Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.32 no.6 Cantabria 2012
https://dx.doi.org/10.3265/Nefrologia.pre2012.Jun.11468
Púrpura de Henoch-Schonlein de novo postrasplante. Discordancia clínico-histológica
Post-transplant Henoch-Schonlein purpura de novo: Clinical/histological discordance
Dirección para correspondencia
Sr. Director:
La aparición de un púrpura de Henoch-Schönlein (PHS) postrasplante es poco frecuente y está descrito como una recidiva1,2. Existen pocos casos descritos de un PSH de novo postrasplante3. La recidiva de la glomerulopatía es la tercera causa de pérdida del injerto después de 10 años de trasplante4. Reportamos el caso de un paciente con antecedentes de macrohematuria y glomerulopatía, que a los 2 años del trasplante presentó púrpura vascular, dolor abdominal y alteraciones urinarias. Se discute la indicación de la biopsia renal, su resultado, la conducta terapéutica y la evolución.
Caso clínico
Hombre de 61 años, de raza blanca. Macrohematuria e hipertensión arterial después de infección orofaríngea a los 21 años. Punción biópsica renal (PBR) a los 31 años, en Australia (desconoce resultado). En diciembre de 2006, a los 57 años, inicia diálisis peritoneal.
En abril de 2008 recibe trasplante renal de donante cadavérico. Creatininemia al alta de 0,8 mg/dl y sin proteinuria. Inmunosupresión: ciclosporina, micofenolato mofetilo (MMF) y prednisona. A los 26 meses del trasplante, aparece tos seca, sensación febril, dolor y distensión abdominal. Previamente al ingreso nota pápulas eritematovioláceas en miembros inferiores y glúteos. Al examen: faringe congestiva. Pápulas de 1 a 3 mm, eritematovioláceas, que no desaparecían a la compresión en muslos, glúteos y plantas (figura 1 A). Dolor a la palpación de epigastrio. Injerto sin dolor ni aumento de su tamaño.
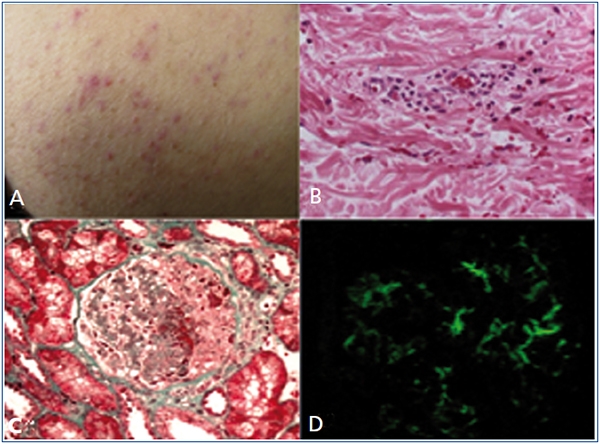
Figura 1. Histología de piel y renal
A) imagen de piel glútea que muestra pápulas eritematovioláceas.
B) Biopsia de piel, dermis superficial con polvillo nuclear, extravasación de glóbulos rojos
y necrosis fibrinoide de pared vascular con infiltrado polimorfonuclear (HyE 20x).
C) Biopsia renal, glomerulonefritis intra y extracapilar con necrosis del flóculo y semiluna celular segmentaria (tricrómico de Mason 200x).
D) Inmunofluorescencia con depósitos mesangiales y pericapilares de IgA.
Los datos de laboratorio se resumen en tabla 1. Negativo para virus de la hepatitis B y C, virus de la inmunodeficiencia humana, anticuerpos antinucleares y anticuerpos anticitoplasma
de neutrófilo. Complemento normal. Sangre oculta en heces por método inmunológico positiva.
Tabla 1. Datos analíticos y del tratamiento realizado 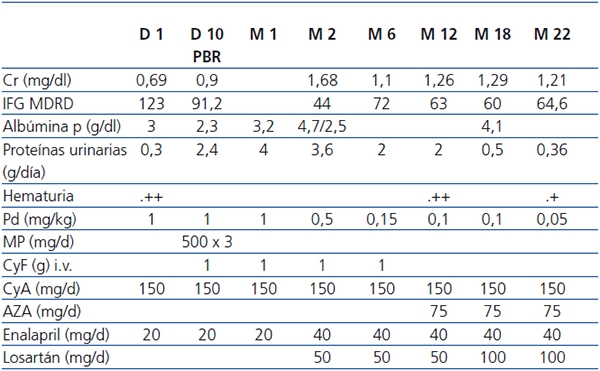
AZA: azatioprina; Cr: creatinina; CyA: ciclosporina; CyF: ciclofosfamida; IFG: índice
de filtrado glomerular; MP: metilprednisolona; PBR: punción biópsica renal; Pd: prednisona.
La presentación clínica sugiere un PHS. Se realiza biopsia de piel (figura 1 B), siendo la inmunofluorescencia negativa. Se produce aumento progresivo de proteinuria, por lo que se realiza PBR que muestra: glomerulonefritis proliferativa intra y extracapilar con semilunas celulares y fibrocelulares, en su mayoría segmentarias (figura 1 C), que afectan 14/25 glomérulos. Focos de necrosis y leucocitoclasia (figura 1 D). Depósitos mesangiales y pericapilares de IgA predominante.
De acuerdo con las pautas nacionales (www.nefroprevencion.org.uy), se inicia tratamiento con bolos de metilprednisolona 1 g/d x 3 y ciclofosfamida 15 mg/k, mensual x 6, continuando con prednisona 1 mg/k. Se mantuvo ciclosporina 2 mg/k/d y se suspendió MMF. La evolución se muestra en la tabla 1.
A los 22 meses de la aparición de PHS, creatininemia de 1,21 mg %, proteinuria 0,32 g/d, hematíes + en orina.
Moroni et al.1 y Han et al.2 describen un riesgo de recurrencia de PHS, que varía entre 0 y 61 %, con mayor recurrencia en donante vivo emparentado.
Thervet et al.5 describen en nefropatía por inmunoglobulina A (NIgA) la recurrencia histológica (depósitos de IgA) al año de trasplante en 69 % de los individuos.
Shimizu et al.3 describen un caso de glomerulonefritis extracapilar IgA postrasplante. La presencia de dolor abdominal les sugirió PHS atípico. Salvo esta referencia de diagnóstico dudoso, no está descrita la aparición de novo de PHS postrasplante. En el caso referido, la ausencia de púrpura previa al trasplante sugiere una aparición de novo del PHS.
Araque et al.6 publicaron en 1995 el primer caso de aparición de PHS en paciente no trasplantado, años después del diagnóstico de NIgA. En nuestro caso, la historia previa es sugestiva de NIgA y actualmente presenta un PHS.
La recurrencia del PHS tiene peor pronóstico: 50 % de pérdida del injerto a los 30 meses con respecto a la recurrencia de la NIgA (11 %)2.
El PHS en adultos es más severo y su pronóstico es peor que en los niños. La serie reportada por Pillebout et al.7 (250 casos) refiere que el 25 % de los adultos alcanzan la insuficiencia renal extrema. La función renal inicial y el grado de proteinuria son marcadores de mal pronóstico, así como la necrosis glomerular, y elementos de cronicidad7. Nuestro caso mostraba intenso componente inflamatorio, semilunas celulares y necrosis en más del 50 % de los glomérulos. Soler et al.8 demuestran que la sobrevida renal fue menor en los pacientes con semilunas en la biopsia renal al momento del diagnóstico.
La discordancia clínica e histológica advierte de la necesidad de contar con PBR en todo paciente adulto que tenga mínimo compromiso renal en el marco del PHS.
En cuanto al tratamiento, la imunosupresión del trasplante no impidió la aparición del PHS. Esto es coincidente con la literatura2,9,10.
Si bien el tratamiento en el PHS es controversial, series pequeñas han mostrado beneficio en el tratamiento agresivo de estos pacientes. Sin embargo, el trabajo de Pillebout publicado en setiembre de 201011, después de que nuestro paciente fuera tratado, plantea que la ciclofosfamida no ofrece un beneficio adicional. En esta serie tenían proliferación extracapilar entre el 37 y el 27 % de los pacientes en cada grupo de tratamiento. Nuestro paciente tenía lesiones activas más severas. El mantenimiento se realizó con azatioprina, dada la escasa utilidad descrita del MMF en la NIgA12,13. Asistimos a una reducción progresiva de la proteinuria, que actualmente es menor de 0,5 g/d, manteniendo una función renal estable.
Los hechos destacables de este caso clínico son:
1. La presentación de novo de un PHS postrasplante a pesar de la medicación inmunosupresora.
2. La necesidad del estudio histológico precoz, dada la discordancia clínico-patológica.
3. La controversia sobre el tratamiento a realizar, conociendo que la evolución del PHS en adultos no es favorable, y que la realización de un tratamiento más agresivo fue recientemente cuestionada por el grupo de Pillebout.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Marcelo Nin1, Rossana Cordero1, Lidice Doufrechou2, Alejandra Larre-Borges2, Virginia Coria1,
Nelson Acosta1, Liliana Gadola1, Sergio Orihuela1, Francisco González1 y Oscar Noboa1
1Centro de Nefrología. Facultad de Medicina, Universidad de la República. Montevideo (Uruguay)
2Servicio de Dermatología. Facultad de Medicina, Universidad de la República. Montevideo (Uruguay)
Referencias Bibliográficas
1. Moroni G, Gallelli B, Diana A, Carminati A, Banfi G, Poli F, et al. Renal transplantation in adults with Henoch-Schonlein purpura: long-term outcome. Nephrol Dial Transplant 2008;23:3010-6. [ Links ]
2. Han SS, Sun HK, Lee JP, Ha JW, Kim SJ, Kim YS. Outcome of renal allograft in patients with Henoch-Schonlein nephritis: single-center experience and systematic review. Transplantation 2010;89:721-6. [ Links ]
3. Shimizu T, Tanabe K, Tokumoto T, Shimmura H, Koga S, Ishikawa N, et al. A case of rapid progressive glomerulonephritis with IgA deposits after renal transplantation. Clin Transplant 2001;15 Suppl 5:11-5. [ Links ]
4. Briganti EM, Russ GR, McNeil JJ, Atkins RC, Chadban SJ. Risk of renal allograft loss from recurrent glomerulonephritis. N Engl J Med 2002;347:103-9. [ Links ]
5. Thervet E, Aouizerate J, Noel LH, Brocheriou I, Martinez F, Mamzer MF, et al. Histologic recurrence of Henoch-Schonlein Purpura nephropathy after renal transplantation on routine allograft biopsy. Transplantation 2011;92:907-12. [ Links ]
6. Araque A, Sánchez R, Alamo C, Torres N, Praga M. Evolution of immunoglobulin A nephropathy into Henoch-Schonlein purpura in an adult patient. Am J Kidney Dis 1995;25:340-2. [ Links ]
7. Pillebout E, Thervet E, Hill G, Alberti C, Vanhille P, Nochy D. Henoch-Schonlein Purpura in adults: outcome and prognostic factors. J Am Soc Nephrol 2002;13:1271-8. [ Links ]
8. Soler MJ, Mir M, Rodriguez E, Orfila A, Munne A, Vázquez S, et al. Recurrence of IgA nephropathy and Henoch-Schonlein purpura after kidney transplantation: risk factors and graft survival. Transplant Proc 2005;37:3705-9. [ Links ]
9. Hasegawa A, Kawamura T, Ito H, Hasegawa O, Ogawa O, Honda M, et al. Fate of renal grafts with recurrent Henoch-Schonlein purpura nephritis in children. Transplant Proc 1989;21:2130-3. [ Links ]
10. Lee J, Clayton F, Shihab F, Goldfarb-Rumyantzev A. Successful treatment of recurrent Henoch-Schonlein purpura in a renal allograft with plasmapheresis. Am J Transplant 2008;8:228-31. [ Links ]
11. Pillebout E, Alberti C, Guillevin L, Ouslimani A, Thervet E. Addition of cyclophosphamide to steroids provides no benefit compared with steroids alone in treating adult patients with severe Henoch Schonlein Purpura. Kidney Int 2010;78:495-502. [ Links ]
12. Maes BD, Oyen R, Claes K, Evenepoel P, Kuypers D, Vanwalleghem J, et al. Mycophenolate mofetil in IgA nephropathy: results of a 3-year prospective placebo-controlled randomized study. Kidney Int 2004;65:1842-9. [ Links ]
13. Frisch G, Lin J, Rosenstock J, Markowitz G, D'Agati V, Radhakrishnan J, et al. Mycophenolate mofetil (MMF) vs placebo in patients with moderately advanced IgA nephropathy: a double-blind randomized controlled trial. Nephrol Dial Transplant 2005;20:2139-45. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Oscar Noboa
Centro de Nefrología,
Facultad de Medicina
Universidad de la República,
Avda Italia s/n
11600, Montevideo, Uruguay
onoboa@hc.edu.uy,
onoboa@gmail.com














