Ficha técnica
Título en español: Fuera de control: El peligroso negocio con la salud.
Título original: Außer Kontrolle - Das gefährliche Geschäft mit der Gesundheit.
Título en inglés: Out of Control - The danger ous health business.
País: Alemania.
Año: 2018.
Director: Elena Kuch, Christian Baars, Britta von der Heide, Antonius Kempmann, Arne Hell.
Música: Insa Rudolph.
Fotografía: Peter Mirecki.
Guion: Britta von der Heide, Monika Wagener, Dirk Neuhoff, Markus Grill.
Intérpretes: Jürgen Thoma, Thomas Woska.
Color: color.
Duración: 42 minutos y 36 segundos.
Género: documental.
Productora: Deutsche Welle.
Sinopsis: Cada vez más personas mueren o sufren lesiones debido a productos médicos inseguros, como prótesis, marcapasos o implantes mamarios. En Alemania, se reportan el triple de incidentes que hace 10 años; en Estados Unidos, cinco veces más. «Fuimos conejillos de indias», resume Jürgen Thoma. Un experimento con un mal resultado. En 2005, Thoma necesitaba una cadera artificial. Se le recomendó un nuevo producto, una «innovación», «lo mejor que existe en el mercado». Sin embargo, esa novedad le causó, probablemente, un enorme sufrimiento a cientos de personas.
Enlace:
https://www.dw.com/es/fuera-de-control-el-peligroso-negocio-con-la-salud/av-48243780
Ficha técnica
Título en español: Salud a la venta.
Título en inglés: The Bleeding Edge.
País: Estados Unidos.
Año: 2018.
Director: Kirby Dick.
Música: Jeff Beal.
Fotografía: Thaddeus Wadleigh.
Guion: Kirby Dick.
Intérpretes:Robert Bridges, Angie Firmalina, Rita Redberg, Stephen Tower.
Color: color.
Duración: 96 minutos.
Género: documental.
Productora: Chain Camera Pictures, Shark Island Productions.
Sinopsis: los cineastas de investigación nominados al Premio de la Academia Kirby Dick y Amy Ziering se centran en la industria de dispositivos médicos de $ 400 mil millones; examinan las regulaciones laxas, los encubrimientos corporativos y los incentivos con fines de lucro que ponen a los pacientes en riesgo diariamente. Tejiendo historias emocionalmente poderosas de personas cuyas vidas han sido irrevocablemente dañadas, el documental pregunta: ¿qué tecnologías que nos pueden salvar la vida realmente nos pueden estar matando? El documental explora el dispositivo anticonceptivo permanente de Bayer Essure, la malla vaginal, el sistema quirúrgico Da Vinci y el reemplazo de cadera de cromo-cobalto.
Enlace:
https://www.imdb.com/title/tt8106576/?ref_=fn_al_tt_1
Fuera de control: El peligroso negocio con la salud (2018) es un documental de la televisión alemana DW que se enfoca en el negocio que se encuentra en los dispositivos médicos lo que plantea un panorama preocupante para los médicos y la sociedad en general. A partir de la revisión de ejemplos concretos, los realizadores muestran cómo los dispositivos médicos pueden producir lesiones o llegan incluso a matar, en parte, por la falta de una regulación rigurosa, con una evaluación insuficiente de la eficacia y la seguridad.
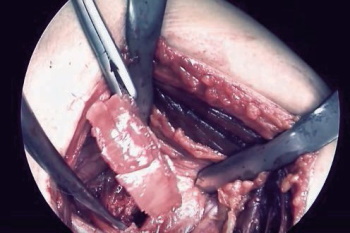
Se trata de una industria que mueve más de 300.000 millones de euros al año, lo que sin duda es un negocio, pero puede acarrear otros costos invaluables, como la calidad de vida, el dolor, el desempeño sexual, la capacidad laboral o bien, «las personas pagan hasta con su vida» el negocio, como dice un afectado por una prótesis de plástico (Foto 1). Y es que el proceso de aprobación de dispositivos parece ser el escenario donde opera la lógica de la ganancia, un campo fértil para la corrupción. La palabra corrupción es un derivado del latín corruptio, que se deriva de la raíz del verbo (co)rumpere que significa quebrar, partir, dañar o estropear1. De esta manera toda acción que estropee o dañe podría ser descrita como corrupta; si tomamos la tradición deontológica de Kant, toda acción que dañe a otros en la búsqueda de un beneficio particular, es corrupción. De ahí, el título acertado del documental de «negocio con la salud», que no es más que la descripción de una serie de acciones corruptas.
Lo primero que conviene recordar es el proceso de aprobación de dispositivos médicos. En la Unión Europea –UE, existen las Agencias de Evaluación de Tecnologías en Salud que evalúan la evidencia sobre la efectividad y seguridad de dispositivos nuevos para que entren al mercado y se comercialicen. Cuando se evalúa un dispositivo totalmente innovador, se estudian los experimentos en animales y ensayos clínicos en voluntarios con el fin de establecer alguna medida de eficacia y seguridad (al menos a corto plazo). Lo que resulta llamativo es que los protocolos de estos ensayos no son de acceso público en la UE2. Ahora, cuando se estudia un dispositivo que representa un cambio en uno ya aprobado, basta con que una agencia certifique que es homólogo de alguno ya probado, con una inferencia abismal de que compartirían la misma efectividad y seguridad. Además, son agencias que pertenecen a la industria privada y que compiten entre sí, de manera que lo que una no certifica, otra lo hará. Y es aquí donde se visualiza el campo fértil porque se han descrito pagos por certificación de manera que un empresario puede tener un dispositivo homologado por media de dádivas.
En Estados Unidos –país que es mostrado equivoca– damente en el documental como un mejor ejemplo de regulación- existen dos vías para la aprobación por la agencia reguladora FDA (Food and Drug Administration)3. Por un lado, la autorización premercadeo (PMA, del inglés Premarket approval), que se indica en los dispositivos que pueden representar un mayor riesgo para la vida, en la que el fabricante debe demostrar evidencia razonable de la efectividad y seguridad; aquí lo que resulta llamativo es que por evidencia razonable se entiende ensayos clínicos controlados, pero también estudios con controles históricos y series de caso, los cuales, dentro de las preguntas sobre tratamientos, son los que podrían sobreestimar los efectos benéficos por los sesgos que acarrean. Por otro lado, la vía 510(k) se utiliza cuando los dispositivos nuevos son sustancialmente equivalentes a uno ya aprobado; el fabricante debe justificar la equivalencia por medio de información sobre su proceso de manufacturación, biocompatibilidad, etc. y rara vez se solicitan evaluaciones clínicas. Este proceso pareciera ser menos riguroso y, si bien es centralizado, es proclive a «estropearse». De los dispositivos ortopédicos que por directriz de la misma FDA se han retirado del mercado, el 98% fueron aprobados por la vía 510(k)4, lo que señala una grave deficiencia en el proceso, que merita mayores estudios.
Con la sola descripción de estos procesos de aprobación, una mente desconfiada puede elucubrar una gran corrupción. Es como si este proceso tan necesario para la salud de las personas albergara a una mafia que no conoce límites geográficos, porque tanto en la UE como en EE. UU. (y, por mucho, Latinoamérica) se presentan casos que la dejan al descubierto. Y apenas previsible que en Latinoamérica la situación sea similar o peor, principalmente por la llegada de la migración de la investigación en salud5, pues el número de ensayos clínicos controlados que se realizan aquí ha aumentado; la participación de habitantes de esta parte del continente viene siendo cada vez mayor; la infraestructura (humana y técnica podríamos decir) ha crecido para poder llevar a cabo los RCT; y tal parece que estos indicadores seguirán en aumento.
En el documental de Netflix, Salud a la venta (2018) se repetía una escena escandalosa. Un dispositivo diseñado para la anticoncepción llamado Essure®, que se ubica por histeroscopia de consultorio en las trompas de Falopio para producir inflamación, fue publicitado como seguro, eficaz y rápido («tardas más tiempo en pintarte las uñas que en esterilizarte»). Sin embargo, un grupo considerable de mujeres comenzó a presentar efectos adversos, como hemorragia uterina anormal, dispareunia, dolor pélvico crónico, entre otros, lo que llevó a una revisión de su seguridad por la FDA6. Aunque el documental puede maximizar la voz de las pacientes que desafortunadamente tuvieron complicaciones (que pueden considerarse hasta esperables en cualquier intervención), lo grotesco es la escena de la aprobación en la FDA. Según la grabación en video de la sesión, quedaron asuntos sobre la seguridad que no fueron resueltos por el fabricante y es posible escuchar a uno de los «expertos» respondiendo a la pregunta de «¿qué haremos si vemos problemas en 10 años?... Pues investigadores privados nos encontrarían y traerían aquí preguntando que por qué aprobamos esto». Uno tendría todo el derecho de sospechar la influencia política que puede ejercer el fabricante, una unión entre la industria y los entes gubernamentales, donde no se sabe en qué espacio habita uno y no tiene influencia el otro. Un ministro de salud en ejercicio que asiste a reuniones de la industria no puede indicar otra cosa que una unión estrecha –y posiblemente corrupta–.
Un elemento que parece hacer honor a la etimología de la corrupción es que la industria y los fabricantes utilizan la argucia argumentativa de la necesidad de que los dispositivos salgan al mercado rápido y fácil por los beneficios para los pacientes. Esto no es más que una falacia porque lo que puede verse como una interpretación certera de la urgencia que puede tener un paciente, no constituye un argumento para someterlo a un dispositivo que no sirve o que es peligroso, aunque muchos entes reguladores multiplican y se convencen de esa idea. Sería un daño consciente o incluso voluntario. La línea argumentativa que debe tomarse, y lo prioritario, es que los dispositivos sean seguros y funcionen, con una evidencia fuerte que deje poco espacio para la tan inevitable incertidumbre. Deberían ser los Estados los que protejan a los ciudadanos y no los intereses de la industria. Por ello, sin dejar de reconocer lo apremiante y necesario de un dispositivo, no se puede pasar por alto la eficacia y la seguridad, con un acto de responsabilidad en la medida en que se piense más allá de las repercusiones inmediatas y sea la industria la que lleve una alta carga de la prueba de sus dispositivos (y no una elevada ganancia económica).
Otro actor fundamental en este fenómeno de los productos sanitarios son los médicos y el personal de salud en general. Han sido varias las denuncias de médicos que aceptan pagos ilegales para los procesos de homologación de dispositivos, o bien, que reciben pagos para implantar los dispositivos en sus pacientes y los publiciten. Se ha descrito que, a la hora de imaginarse en este tipo de situaciones, la mayoría de los médicos –estadounidenses– encuentra apropiado recibir incentivos de la industria en el desarrollo de dispositivos, incluso el 60% ve adecuado reclutar pacientes así no hayan participado del diseño del estudio7. Partiendo de la buena fe de los médicos, uno pudiera interpretar que es como si existiera una confianza ciega en el dispositivo en estudio; pero en el fondo, me parece aquí subyace una lógica centrada en el incentivo y no en la garantía de la seguridad del paciente reclutado. El problema no es participar con la industria, sino hacerlo de forma corrupta, es decir, haciendo daño.
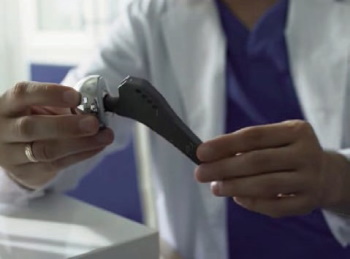
Una acción que puede también indicar corrupción estriba en la vigilancia de la seguridad sobre los efectos adversos de los dispositivos, especialmente una vez se ha dado una aprobación exigua. La corrupción no está en no saber las complicaciones, sino en que, sabiéndolas, no sean informadas y reconocidas. Los pacientes deben saber qué riesgos traen los dispositivos. Un caso impactante es el del ortopedista Stephen Tower, quien recibió una prótesis de cadera metal con metal (unión de la articulación y del fémur cobalto con cobalto), que se venía promocionando para individuos muy activos (Foto 2).
Este médico especialista después del procedimiento comenzó con cambios de comportamiento y alteraciones cognitivas, que finalmente fueron compatibles con cobaltismo (intoxicación por cobalto). Con el cambio de prótesis por una de otro material, los síntomas prácticamente resolvieron y motivó al ortopedista a la búsqueda activa de casos similares y advertir así a sus colegas8.
Con todo este panorama, uno se va formando una idea también de las posibles soluciones. En una sociedad altamente tecnológica, es de esperarse que la medicina también lo sea. ¡Y menos mal! Ha sido la innovación la que nos ha permitido evolucionar como especie. Los dispositivos médicos han mejorado nuestra vida; nos ayudan a vivir más tiempo y a tener mejor calidad de vida. Pero debe tratarse de una innovación responsable, donde lo más nuevo, no tiene por qué necesariamente ser lo mejor; donde la incertidumbre médica se reconoce y se explica; donde se demuestra directamente la ausencia de un alto riesgo (en lugar de partir del supuesto de que son de bajo riesgo). El proceso de aprobación de dispositivos debe ser es campo fértil para la ética de la innovación, que oriente la reflexión sobre la invención de dispositivos para mejorar el proceso de salud y enfermedad de las personas y no los bolsillos de los fabricantes, así como los procesos de relación entre todos los actores del sistema, de manera que se garantice trasparencia. Para llegar a ello hay que fortalecer cada uno de los procesos de vigilancia y control, con castigos justos y reparación basada en verdad. También es importante contar con los medios de comunicación para informar y denunciar con responsabilidad social como lo hacen estos documentales. Pero lo esencial es favorecer a la autocrítica a través de una buena educación para que el individuo sea capaz de reflexionar sobre sus acciones, lo que lleve en un futuro cercano a un espíritu colectivo nuevo: sin corrupción.