Introducción
Un paciente polimedicado es aquel tratado con cinco o más medicamentos de manera simultánea. El aumento de la prevalencia de patologías crónicas con la edad del individuo y la consiguiente prescripción de tratamientos farmacológicos para su control determina un elevado grado de polimedicación. El porcentaje de población española que cumple con esta definición varía con la edad y es notablemente más elevado en mayores de 65 años1,2.
El envejecimiento es un proceso fisiológico que, pese a caracterizarse por gran variabilidad interindividual, va acompañado de una disminución de las capacidades físicas y psicológicas que pueden resultar condicionantes. El porcentaje de mayores es más elevado en el ámbito rural, comunidades especialmente envejecidas a causa de un crecimiento vegetativo negativo y del fenómeno de la despoblación, hasta el punto de constituir un problema de gran relevancia que se ha convertido en una prioridad a distintos niveles administrativos3. Los pacientes de nuestra farmacia comunitaria se engloban en este segmento de población. Su perfil más frecuente es el de una persona mayor de 65 años polimedicada y pluripatológica. Por otra parte, una proporción importante de ellos no cuenta con la suma de recursos adecuada para gestionar de manera autónoma su salud y evitar los riesgos derivados de la polimedicación, por lo que pueden ser considerados polimedicados frágiles4.
La baja adherencia a los tratamientos en esta franja de edad es un problema prioritario: se estima que hasta el 70% de los pacientes no son adherentes a los tratamientos crónicos que tienen prescritos en países de nuestro entorno5. Sin duda, esta situación supone un riesgo evidente para la salud del paciente ya que se trata de un problema relacionado con los medicamentos (PRM) que puede provocar la aparición de resultados negativos asociados a la medicación (RNM). Habida cuenta de que muchos de nuestros pacientes tienen dificultades para seguir su tratamiento farmacológico de manera satisfactoria, creemos necesario implementar medidas orientadas a incrementar la adherencia terapéutica que faciliten su control y seguimiento de manera individualizada.
Los sistemas personalizados de dosificación (SPD) preparados en la farmacia comunitaria ayudan a cubrir estas necesidades ya que son una buena herramienta para mejorar la falta de adherencia terapéutica no intencionada, especialmente en pacientes mayores pluripatológicos y polimedicados. Se trata de un dispositivo desechable de reacondicionamiento donde el farmacéutico, siguiendo un protocolo establecido, dispone la medicación necesaria para un periodo de tiempo determinado (habitualmente siete días). Dichos dispositivos deben cumplir ciertos requerimientos relativos a sus materiales y proceso de fabricación que los haga idóneos para su función6. La manipulación, excluyendo el fraccionamiento previo al reacondicionamiento en algunos casos, se limita a la extracción de la forma farmacéutica (FF) de su acondicionamiento original, e invalida la fecha de caducidad que figura en el mismo. En este sentido, no hay disponibles suficientes datos acerca de la estabilidad de FF y principios activos en las nuevas condiciones. La prestación del servicio de preparación de SPD se basa en procedimientos normalizados de trabajo (PNT) y en documentos de buenas prácticas (BBPP) donde se detallan todas las especificaciones del proceso. Estos documentos proporcionan una base adecuada para la implantación del servicio y pueden ser adaptados a cada caso particular.
Desde nuestra experiencia personal, existen puntos clave del proceso que por su naturaleza se deben realizar de manera individualizada para cada paciente y que deben estar sustentados en el procedimiento. De este modo, se podría aprovechar íntegramente el potencial del servicio y maximizar sus beneficios en salud para los pacientes. En este sentido, el análisis previo de la farmacoterapia de cada paciente que se incorpora al servicio es un punto crítico porque permite la detección de PRM, el análisis de las condiciones en las que es posible el reacondicionamiento y la posibilidad de fraccionamiento de FF, así como la búsqueda de las alternativas que sean necesarias. Estos aspectos son tratados de manera muy breve en algunos de los documentos de apoyo (PNT y BBPP).
Presentamos un estudio descriptivo del proceso de preparación de SPD en nuestra farmacia incluyendo la adaptación del documento procedimental para que contemple en detalle los puntos clave del proceso.
Métodos
1. Población
Parte de los pacientes incluidos en nuestro servicio SPD lo son en virtud de un convenio de colaboración entre el Colegio Oficial de Farmacéuticos y la Excelentísima Diputación de Albacete para pacientes no institucionalizados residentes en zonas rurales despobladas. En el documento que sirve de convenio se mencionan específicamente las siguientes situaciones como criterio de inclusión de los pacientes, las cuales han sido utilizadas para todos los pacientes adscritos:
Mayores de 80 años
Mayores de 65 años con tratamientos complejos y/o baja adherencia
Pacientes con pautas irregulares (PI)
Pacientes polimedicados (5 o más medicamentos)
Pacientes aislados en cuarentena por COVID
Pacientes con ayuda domiciliaria
Además, la elección de los pacientes candidatos puede efectuarse a criterio de la farmacéutica o por derivación de otros profesionales (médica, enfermera, trabajadora social…).
Variables recogidas para cada paciente: edad, sexo, polimedicación (si/no), media de medicamentos (total y dentro del SPD), FF fraccionadas, FF no reacondicionables, FF no reacondicionables con alternativa, número de PI y PRM.
Una vez aceptada la inclusión en el servicio, se facilita al paciente una hoja de información y el consentimiento informado para ser firmado. La preparación de los SPD es un servicio que se realiza con posterioridad a la dispensación. Por este motivo, todos los tratamientos prescritos al paciente son depositados en la farmacia tras su dispensación y custodiados por el farmacéutico. Las FF que no vayan a ser reacondicionadas en los dispositivos son gestionadas tras su dispensación por el paciente según el procedimiento habitual.
2. Procedimiento de trabajo
Se revisaron PNT y documentos técnicos disponibles a nivel autonómico7, estatal8-12 y europeo13 para homogeneizar criterios. Se tomó como base el PNT del Consejo de Colegios Oficiales de Farmacéuticos de Castilla la Mancha (COFCAM)7 que se estructura en 8 secciones: (1) objetivo, (2) ámbito de aplicación, (3) criterios de inclusión, (4) definiciones, (5) responsabilidades, (6) equipamiento, (7) especificaciones del proceso y (8) situaciones especiales. Sobre este documento, además de la utilización de los criterios de inclusión mencionados en el apartado anterior, se realizaron las adaptaciones basadas en la bibliografía consultada y nuestra práctica diaria que se muestran en la Tabla 1.
Tabla 1. Modificaciones y adaptación del PNT del COFCAM7.
| PNT COFCAM | Modificaciones / ampliación |
|---|---|
| 7.4 Entrevista inicial | Revisión del uso de la medicación (RUM) según el protocolo REVISA® SEFAC |
| 7.6 Revisión y control del tratamiento | Elaboración y análisis de un estado de situación inicial completo, según la metodología Foro de Atención Farmacéutica - Farmacia Comunitaria |
| 7.9 Preparación de dispositivos | Estudio de las condiciones de reacondicionamiento, estabilidad y manipulación de las formas farmacéuticas utilizando las bases de datos BotPLUS®, Specialist Pharmacy Service (NHS) y/o literatura adicional |
2.1 Entrevista inicial
La primera entrevista con el paciente incluye la valoración de la adherencia terapéutica utilizando los test de Morisky-Green-Levine y Haynes-Sackett14) y la revisión de las dispensaciones, incluyendo aquellas correspondientes a medicamentos no incluidos en el SPD. La valoración se repite pasados seis meses del ingreso en el servicio. La medicación remanente en los dispositivos retornados a la farmacia se registra semanalmente. Se consideró que un paciente era no adherente cuando recibía menos del 80% de la dosis prescrita para cualquiera de sus tratamientos.
2.2 Revisión y control del tratamiento
El estudio exhaustivo e individualizado de la medicación de cada paciente se lleva a cabo en dos etapas:
a.- El paciente acude a la farmacia con todos los medicamentos que toma habitualmente, incluso aquellos que no precisan prescripción médica. La revisión del uso de la medicación (RUM) se realiza en la zona de atención personalizada en presencia del paciente, puesto que es necesario evaluar su conocimiento acerca de la indicación, posología, pauta, percepción de efectividad y seguridad de su medicación, entre otra información relevante. La RUM se realiza siguiendo el protocolo del Programa REVISA®(15.
b.- La fase de estudio incluye la realización de un estado de situación inicial16, con especial atención a las PI, donde se relaciona cada medicamento con el problema de salud que trata. Incorpora datos analíticos de interés, medidas antropométricas y otra información que pudiera resultar relevante. El análisis de la información obtenida posibilita la detección de PRM y su corrección previa a la preparación de los dispositivos SPD cuando es posible. La fase de estudio se repite siempre que un paciente sufre alguna modificación en su farmacoterapia o un cambio de nivel asistencial (conciliación).
2.3 Preparación de los dispositivos
La preparación de los dispositivos se lleva a cabo con la ayuda de soporte informático (Blistersuite®). La ficha de cada paciente recoge información relativa a tratamientos, dosis, posología y condiciones de reacondicionamiento, a la vez que posibilita el control de stocks, lotes y fechas de caducidad de cada envase y la impresión de la documentación. La preparación se lleva a cabo en un entorno que garantice las condiciones apropiadas de calidad y seguridad. Los dispositivos utilizados para el reacondicionamiento (Venalink® Jumbo) son de tamaño estándar, incluyen cuatro tomas diarias (desayuno, comida, cena, acostar) y se preparan, como máximo, con dos semanas de antelación a su fecha de administración. Una vez finalizada la preparación, se etiquetan con la información del paciente, de la farmacia, del médico prescriptor y de todos los medicamentos reacondicionados (nombre del principio activo, dosis, posología, forma y color del comprimido/cápsula, lotes y fechas de caducidad).
3 Reacondicionamiento de formas farmacéuticas y fraccionamiento
La comprobación de que cada FF prescrita cumple con las condiciones necesarias de estabilidad para su reacondicionamiento fuera de su embalaje primario se realiza por medio de la base de datos de medicamentos BotPLUS®(17, la base de datos del Specialist Pharmacy Service del Reino Unido relativa a la estabilidad de medicamentos reacondicionados en SPD18) y otras bases de datos y fuentes bibliográficas disponibles en caso necesario. Cuando no era posible el reacondicionamiento de una FF, se seleccionaba la alternativa más apropiada según la información disponible, bien por medio de sustitución directa por parte del farmacéutico cuando era posible o bien por sustitución de la prescripción original por parte del médico. La comprobación de la posibilidad de fraccionar las FF reacondicionadas se ha valorado con la información disponible en la ficha técnica de los medicamentos. Como se recomienda en la mayoría de los PNT, se ha tratado de evitar la incorporación al SPD de FF fraccionadas.
Resultados
La información recopilada muestra que nuestro paciente tipo es una mujer, polimedicada y mayor de 75 años. La edad media de la población adscrita supera los 80 años, con valores extremos de 51 y 92, con una media cercana a los 10 principios activos prescritos por paciente. Los datos se encuentran resumidos en la Tabla 2.
Tabla 2. Características de los pacientes del servicio SPD.
| Variable | % (n) o media ± DE |
|---|---|
| Pacientes adscritos al servicio SPD | 39 |
| Sexo Hombre Mujer | 35.9 (14) 64.1 (25) |
| Edad < 60 [60, 75) [75, 90) ≥ 90 | 80.3 ± 8.27 5.1 (2) 15.4 (6) 76.9 (30) 2.6 (1) |
| Estructura del hogar Vive sola Familiar/cuidadora | 30.8 (12) 69.2 (27) |
| Pacientes polimedicados FF prescritas PA prescritos | 97.4 (38) 9.4 ± 3.7 10.6 ± 4.0 |
| Problemas de salud Hipertensión arterial Hipercolesterolemia Diabetes mellitus 1 y 2 | 87.2 (34) .3 (20) 43.6 (17) |
| Pacientes adherentes Inicio del servicio A los 6 meses | 28.2 (11) 79.5 (31) |
DE: desviación estándar; SPD: Sistema Personalizado de Dosificación; FF: Formas farmacéuticas; PA: Principios activos.
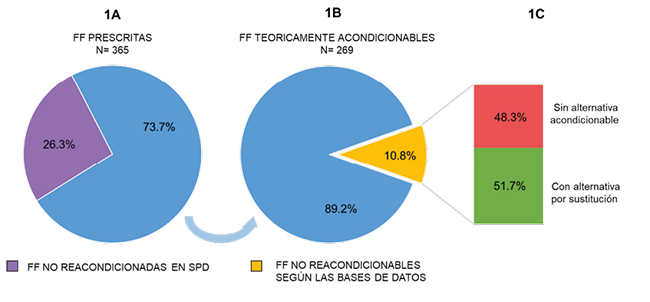
La media de FF prescritas que de entrada no pueden ser reacondicionadas en un dispositivo SPD (inhaladores, parches, colirios, sobres, etc) y son gestionadas por el paciente fue de 2.46 ± 1.85. Esto supone un 26.3% del total de FF prescritas. La media de FF que sí podrían ser reacondicionadas es de 6.9 ± 2.63, con valores extremos de 3 y 13 (ver Figura 1A). Tras el análisis de sus características, resultaron efectivamente reacondicionables cerca del 90% de las mismas (ver Figura 1B). Para el 10.8 % restante (17 FF), fue posible encontrar una alternativa por sustitución del farmacéutico o por modificación de la prescripción en más de mitad de los casos (10 FF) (ver Figura 1C).
La información relativa a las FF implicadas se encuentra detallada en la Tabla 3.
Tabla 3. Alternativas a las FF no reacondicionables.
| FF no acondicionable en SPD | Alternativa FF acondicionable | ||
|---|---|---|---|
| CN | CN | ||
| 727755 | Colecalciferol Rovi® | - | Ninguna |
| 680791 | Tamsulosina Mabo EFG | 651013 | Omnic Ocas® |
| 687704 | Rabeprazol Stada EFG | 665302 | Rabeprazol Normon EFG |
| 669473 | Hydrea® | - | Ninguna |
| 663656 | Carvedilol Ratiopharm EFG | 651585 | Carvedilol Teva EFG |
| 661141 | Zanipress® | 706053 | Enalapril/Lercanidipino Ratiopharm EFG |
| 658953 | Advagraf® | - | Ninguna |
| 689528 | Montelukast Normon EFG | 665728 | Montelukast Stada EFG |
| Eutirox® | Levotiroxina sódica Teva EFG | ||
| 725101 | Trangorex® | - | Ninguna |
| Pradaxa® | - | Ninguna | |
| 700579 | Sinemet plus® | - | Ninguna |
| 798587 | Tenoretic® | 989996 | Blokum-Diu® |
| 706386 | Furosemida combix EFG | 656153 | Furosemida Sandoz EFG |
| 707424 | Metotrexato EFG | - | Ninguna |
| 662056 | Singulair® | 665728 | Montelukast Stada EFG |
| 658394 | Amlodipino Ratiopharm EFG | 658218 | Amlodipino Normon EFG |
CN: código nacional; SPD: Sistema Personalizado de Dosificación; FF: Formas farmacéuticas; EFG: Especialidad Farmacéutica Genérica.
Pautas irregulares. Tres de cada cuatro pacientes (76.9%, n=30) contaban con, al menos, un tratamiento que seguía una PI. El 59% de ellos presentaban 1 PI, el 15.4% presentaban 2 PI y el 2.6% hasta 3 PI. El número total de PI de la población estudiada fue de 38. Atendiendo a su duración, las PI pueden diferenciarse en mensuales (24, por ejemplo, Hidroferol®), días alternos (6, por ejemplo, Tardyferon®), intervalos con meses de descanso (2, por ejemplo, Condrosan®), con días de descanso en la semana (2, por ejemplo, Trangorex®) y pautas semanales (4, por ejemplo, Acfol®). El tratamiento con PI más prescrito en nuestra población de estudio fue Hidroferol®.
Fraccionamiento. En relación con el fraccionamiento, 14 pacientes fraccionaban algún comprimido al inicio de la inclusión al servicio (15 FF fraccionadas). Según la información existente en las bases de datos y ficha técnica, 4 de éstas FF no podían ser fraccionadas al no quedar garantizada la homogeneidad de la dosis en cada fracción resultante, por lo que estamos ante un PRM de administración errónea. Los principios activos que contenían eran metformina, acenocumarol, propranolol y amlodipino.
Problemas relacionados con los medicamentos. En base a las alertas emitidas por la base de datos BotPLUS®, se encontraron 77 PRM, siendo la probabilidad de efectos adversos (54) el más frecuente, seguido de interacciones farmacocinéticas (13), otras interacciones (4), contraindicación (2), espaciar administración (2) y duplicidad (2). Los detalles relativos a todos los PRM detectados están recogidos en las Tabla 4.
Tabla 4. Problemas relacionados con los medicamentos de los pacientes adscritos al servicio.
| PROBLEMA RELACIONADO CON LOS MEDICAMENTOS (PRM) | (N=77) | |
|---|---|---|
| Probabilidad de efectos adversos | 54 | |
| Posible aumento del riesgo de hemorragias gastrointestinales | 23 | |
| Inhibidor selectivo de la recaptación de serotonina (ISRS) + Antiinflamatorio no esteroideo (AINE) | 9 | |
| Vortioxetina + Ácido acetilsalicílico (AAS) | 1 | |
| Paroxetina + AAS | 1 | |
| Amitriptilina + AAS | 1 | |
| Sertralina + AAS | 1 | |
| Sertralina + Metamizol | 1 | |
| Escitalopram + AAS | 2 | |
| Duloxetina + AAS | 1 | |
| Vortioxetina + Metamizol | 1 | |
| Anticoagulantes/Antitrombóticos + ISRS o Inhibidor de la recaptación de serotonina y noradrenalina (IRSN) | 8 | |
| Acenocumarol + Escitalopram | 1 | |
| Acenocumatol + Sertralina | 1 | |
| Clopidogrel + Sertralina | 1 | |
| Clopidogrel + Paroxetina | 1 | |
| Clopidogrel + Trazodona | 1 | |
| AAS + Trazodona | 1 | |
| Dabigatran + Duloxetina | 1 | |
| Rivaroxabán + Fluoxetina | 1 | |
| Anticoagulante oral (ACO) + Estatinas | 3 | |
| Acenocumarol + Simvastatina | 2 | |
| Acenocumarol + Rosuvastatina | 1 | |
| ACO + Ezetimiba | 1 | |
| ACO + Hormonas tiroideas | 1 | |
| ACO + AINE | 1 | |
| Otros | 31 | |
| Tramadol (Trm) + Antidepresivos | 2 | |
| Trm + Trazodona | 1 | |
| Trm + Amitriptilina | 1 | |
| Benzodiazepinas + Opioides | 5 | |
| Lorazepam (Lrz) + Trm | 1 | |
| Lrz + Buprenorfina | 1 | |
| Lrz + Tapentadol | 1 | |
| Lrz + Fentanilo | 1 | |
| Clorazepato + Trm | 1 | |
| Zolpidem + Paroxetina | 1 | |
| Diuréticos + AINE | 3 | |
| Hidroclotiazida + AAS | 1 | |
| Clortalidona + Metamizol | 1 | |
| Furosemida + Metamizol | 1 | |
| Inhibidores de la enzima de conversión de la angiotensina (IECA)/ Antagonistas del receptor de la angiotensina II (ARA-II) + AINE | 3 | |
| Valsartan + AAS | 2 | |
| Enalapril + AAS | 1 | |
| B-Adrenergicos + B-Bloqueantes | 1 | |
| Síndrome serotoninérgico | 4 | |
| Inhibidores de la monoaminooxidasa-B + Antidepresivos | 2 | |
| Fentanilo + Fármacos serotoninérgicos | 1 | |
| IRSN + Fármacos serotoninérgicos | 1 | |
| Antipsicóticos atípicos + Antidiabéticos | 4 | |
| Aripiprazol + Dapaglifozina | 1 | |
| Aripiprazol + Metformina | 1 | |
| Clozapina + Dapaglifozina | 1 | |
| Clozapina + Metformina | 1 | |
| Tiazidas + Antidiabéticos | 1 | |
| Digoxina + Diuréticos eliminadores de potasio | 2 | |
| AINE + Metotrexato | 1 | |
| Corticosteroides + Salicilatos | 1 | |
| Amiodarona + B-Bloqueantes | 1 | |
| IECA/ARA-II + Diuréticos ahorradores de potasio | 1 | |
| B-Adrenérgicos + Diuréticos | 1 | |
| Interacciones farmacocinéticas | 13 | |
| Digoxina + Trazodona | 1 | |
| Paracetamol + Propranolol | 1 | |
| Amlodipino + Simvastatina | 3 | |
| Digoxina + Inhibidores de la bomba de protones (IBP) | 3 | |
| Digoxina + Estatinas | 1 | |
| Benzodiazepinas + IBP | 1 | |
| IBP + Tacrolimus | 1 | |
| Amiodarona + Eplerenona | 1 | |
| Sales de calcio + Tiazidas | 1 | |
| Otras interacciones | 4 | |
| Duloxetina + Fesoterodina | 1 | |
| Furosemida + Amiodarona | 1 | |
| Dabigatran + Amiodarona | 1 | |
| Levodopa + Benzodiazepinas | 1 | |
| Contraindicación | 2 | |
| Acenocumarol + Omeprazol | 2 | |
| Espaciar administración | 2 | |
| Levodopa/carbidopa + Hierro | 1 | |
| Calcio + Hierro | 1 | |
| Duplicidad | 2 | |
| Furosemida + Clortalidona | 1 | |
| Buprenorfina + Trm | 1 | |
ISRS: Inhibidor selectivo de la recaptación de serotonina; AINE: Antiinflamatorio no esteroideo; AAS: Ácido acetilsalicílico; IRSN: Inhibidor de la recaptación de serotonina y noradrenalina; ACO: Anticoagulante oral; Trm: Tramadol; Lrz: Lorazepam; IECA: Inhibidores de la enzima de conversión de la angiotensina; ARA-II: Antagonistas del receptor de la angiotensina II.
IBP: Inhibidores de la bomba de protones
Entre los efectos adversos más frecuentes destaca el incremento de riesgo hemorrágico producto de la asociación de fármacos gastrolesivos de uso crónico, por ejemplo, inhibidores selectivos de la recaptación de serotonina (ISRS) y antiinflamatorios no esteroideos (AINE). A este respecto, y tras consulta con el médico de atención primaria, se resolvieron tres casos de riesgo de RNM antes del inicio del servicio de preparación de SPD por considerarlos prioritarios. Por lo que se refiere a los fármacos más frecuentemente implicados en interacciones destacan ácido acetilsalicílico (AAS), que interacciona en 14 ocasiones, acenocumarol (10), digoxina (6) y trazodona (6).
Discusión
La preparación de SPD no es un proceso meramente mecánico, ni se limita a la distribución ordenada de la medicación de los pacientes en distintos alveolos dentro de un dispositivo atendiendo a su posología. Se trata de una herramienta que ofrece al farmacéutico la posibilidad de garantizar un uso efectivo y seguro de los medicamentos en pacientes especialmente vulnerables y de traducirlo en resultados en salud. Por esta razón, es necesario considerar la preparación de SPD integrada dentro de un proceso más complejo e individualizado para cada paciente que, en muchas ocasiones, se solapa con otros servicios profesionales farmacéuticos tales como la dispensación, la conciliación e incluso el seguimiento farmacoterapéutico19. En este sentido, nuestra adaptación del protocolo de trabajo incorpora dos aspectos que resultan determinantes en el proceso de preparación de SPD: (i) el estudio de la farmacoterapia y una revisión del uso que el paciente hace de su medicación y (ii) el análisis de la compatibilidad de cada FF con el proceso de reacondicionamiento.
La polimedicación es uno de los principales factores asociados al incumplimiento terapéutico no intencionado y, por consiguiente, a la falta de adherencia. Algunas estimaciones sobre la prevalencia de la polimedicación en España realizados en pacientes mayores de 65 años arrojan cifras entre el 35% y el 50%20-22. El porcentaje de polimedicados en nuestra muestra es prácticamente del 100%. De hecho, la polimedicación es el principal criterio de inclusión por el que los pacientes se adscriben al servicio. Es destacable que la media de fármacos prescritos a nuestros pacientes (9.4) es superior a la descrita en la bibliografía, que se cifra en 8.821. Otro dato que puede resultar relevante es que se ha relacionado a las mujeres mayores de 75 años e hipertensas con un menor grado de cumplimiento terapéutico23. Dicho perfil es prácticamente coincidente con el paciente tipo adscrito a nuestro servicio SPD. La edad avanzada es otro de los factores asociados a una baja adherencia. Se ha propuesto el aumento de los olvidos, las confusiones o incluso el miedo a los tratamientos farmacológicos como sus principales causas24.
Existen estudios en nuestro ámbito que ponen de manifiesto la eficacia del uso de dispositivos SPD para mejorar la adherencia terapéutica, habiéndose descrito un incremento en la tasa de adherencia del 12% al 23% en población mayor de 70 años a los dos meses de inclusión en el servicio25. En nuestro caso, tras seis meses de la utilización del SPD hemos observado un aumento de la adherencia al tratamiento del 51.3%.
Formas farmacéuticas reacondicionadas: No es frecuente disponer de datos específicos acerca de la estabilidad de las FF una vez han sido extraídas de su acondicionamiento primario más allá de los que figuran en las bases de datos de productos farmacéuticos. De cualquier modo, conviene tener presente que los dispositivos SPD cubren, como mínimo, los requerimientos de un envase tipo B en cuanto a sus propiedades barrera26 y que las FF van a ser utilizadas, como máximo, tras 14 días de su reacondicionamiento sin más manipulación que su extracción del envase original.
Con estas premisas, es frecuente tener que recurrir a fuentes de información más específicas para obtener datos acerca de la posibilidad de reacondicionar una especialidad o principio activo concreto. Con la información obtenida, y valorando el cociente riesgo/beneficio para cada paciente de manera individual, es posible optar por la inclusión de una especialidad en el SPD a criterio profesional del farmacéutico. Los objetivos prioritarios son la seguridad del paciente y la estabilidad del medicamento.
En nuestro caso, un total de 7 FF prescritas a nuestros pacientes no podían ser reacondicionadas según las bases de datos de productos farmacéuticos y no tenían una posible alternativa para sustituirla (ver Tabla 3). Sin embargo, tras un estudio más profundo, algunas de ellas fueron finalmente reacondicionadas. Dos ejemplos de este procedimiento son amiodarona y dabigatran. Por lo que se refiere a amiodarona, se ha comprobado que una suspensión oral preparada triturando comprimidos comerciales contiene una concentración media de principio activo superior al 90% de la inicial tras 42 días almacenada a 25 ºC27. Además, se sabe que las tabletas expuestas a condiciones tropicales de temperatura y humedad (30ºC y 80%, respectivamente) se conservan de manera adecuada durante varias semanas28. En cuanto a dabigatran, se ha medido la estabilidad de las cápsulas comerciales a temperatura ambiente durante 120 días en distintas condiciones de humedad y temperatura. Las cápsulas se mantuvieron estables en 3 tipos diferentes de recipiente (acondicionamiento primario, envases de dosis unitaria y sistemas de reacondicionamiento utilizados en farmacia comunitaria). En todos los casos, el 98% de la concentración original se mantuvo pasados, al menos, tres meses del inicio del estudio29.
Pautas irregulares: Casi el 80% de nuestros pacientes presentaba alguna PI, lo que complica más si cabe conseguir una adherencia adecuada al tratamiento farmacológico. El dispositivo SPD permite que el paciente se asegure que toma el tratamiento pautado de forma irregular correctamente. Además, también se elimina la posibilidad de administrar dosis mayores a la indicada, lo que podría acarrear efectos tóxicos por acumulación (por ejemplo, vitamina D).
Fraccionamiento: En general, no se pueden fraccionar FF con principios activos de estrecho margen terapéutico, cápsulas blandas, cubiertas entéricas, liberación modificada y comprimidos sublinguales. Se debe valorar de forma individual el motivo por el que se fracciona, ya sea para dividir la dosis o para facilitar la deglución, porque en muchos casos se pueden buscar alternativas más adecuadas. En el caso particular del acenocumarol, todos nuestros pacientes anticoagulados tenían prescrita la dosis de 4 mg. Se trata de una especialidad de estrecho margen terapéutico que requiere de un ajuste posológico según el International Normalized Ratio y que en la mayoría de los casos debe ser fraccionada, pese a que su ficha técnica indique que dicha manipulación no es posible. Tras revisar las pautas posológicas de nuestros pacientes, una de nuestras intervenciones consistió en valorar conjuntamente con el médico de atención primaria la posibilidad de utilizar la dosis de 1 mg, reduciendo así en la medida de lo posible el número de veces que se fraccionaba el comprimido.
Problemas relacionados con los medicamentos: El PRM más frecuentemente encontrado en nuestra muestra fue reacción adversa, en concreto el aumento del riesgo de sangrado gastrointestinal. El motivo es la prescripción conjunta de AAS o anticoagulantes orales, tanto directos como antivitamina K, y otros fármacos con potencial gastrolesivo (AINE o ISRS). La valoración de la prescripción de AAS, tanto para prevención primaria como secundaria, es controvertida30. Por otro lado, las guías de práctica clínica recomiendan asociar un inhibidor de la bomba de protones (IBP) en todos los casos en los que AAS se prescribe como tratamiento crónico a mayores de 65 años. El seguimiento terapéutico de los pacientes tratados con un ISRS podría facilitar un ajuste de dosis o incluso una sustitución del fármaco según la respuesta clínica del paciente buscando una disminución de la gastrolesividad. La relevancia de estar incluido en el servicio de preparación de SPD estriba en que facilita el seguimiento estrecho de los pacientes como medida de control adicional para evitar la aparición de este tipo de RNM.
Una de las interacciones más relevantes encontradas en nuestra muestra es el uso concomitante de opioides y benzodiazepinas. Es una interacción importante que puede provocar sedación, depresión respiratoria, alteraciones cognitivas, aumento en la fragilidad y fracturas óseas por caídas. Se sabe que pacientes que toman benzodiazepinas y opioides simultáneamente requieren con más frecuencia ingresos hospitalarios y presentan un 15% más de riesgo de sobredosis de opiáceos31. Este problema se podría abordar mediante la deprescripción de benzodiazepinas, ya que su uso en población geriátrica se considera inapropiado, la cual podría llevarse a cabo con la ayuda del SPD.
Otras interacciones frecuentes son la de omeprazol con acenocumarol, que se traduce en la disminución del catabolismo y de la eliminación del anticoagulante, con el consiguiente aumento del riesgo de hemorragia, y la de omeprazol con benzodiazepinas, que se traduce en un aumento de la semivida del ansiolítico32. La intervención coordinada con el médico de atención primaria permitió resolver la interacción por sustitución del IBP prescrito (omeprazol por pantoprazol).
A modo de conclusión, la preparación de SPD es un servicio complejo, sistemático, individualizado e interrelacionado con otros servicios farmacéuticos que constituye una herramienta eficaz para mejorar la adherencia terapéutica y obtener resultados en salud. Hemos adaptado un PNT de preparación de dispositivos SPD para nuestra práctica diaria. Esto nos ha permitido abarcar desde el estudio previo de las patologías y la farmacoterapia de los pacientes hasta el conocimiento de estabilidad, posibilidad de fraccionamiento y de reacondicionamiento de cada especialidad farmacéutica prescrita. El análisis de toda la información recopilada permite detectar PRM y RNM existentes y, por medio de intervenciones coordinadas médico-farmacéutico, conseguir un manejo más efectivo y seguro de los tratamientos por parte de los pacientes.