Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.30 no.4 Madrid oct. 2014
https://dx.doi.org/10.3305/nh.2014.30.4.7646
ORIGINAL / Cancer
Impacto del tratamiento antineoplásico en el estado nutricional en pacientes con cáncer de mama
Antineoplastic treatment impact on nutritional status in patients with breast cancer
Karina Monroy Cisneros1, Julián Esparza Romero1, Alfonso Genaro Guevara Torres2, Mauro E. Valencia3, Rosa Olivia Méndez Estrada1, Orlando Tortoledo Ortiz1, Bertha I. Pacheco Moreno1 y Humberto Astiazarán García2
1 Coordinación de nutrición. Centro de Investigación en Alimentación y Desarrollo. Hermosillo. Sonora.
2 Centro Estatal de Oncología. Hermosillo. Sonora.
3 Universidad de Sonora. Hermosillo. Sonora. México.
Consejo Nacional de Ciencia y Tecnología (CONACyT): beca de postgrado que hizo posible la realización del proyecto.
Dirección para correspondencia
RESUMEN
Introducción: El cáncer de mama es la neoplasia más diagnosticada en mujeres en México y también la de mayor mortalidad. Aunque el tratamiento ha mejorado, puede afectar de forma importante el estado nutricio de quienes lo reciben.
Objetivo: Evaluar el impacto del tratamiento antineoplásico sobre el estado nutricio en pacientes con cáncer de mama.
Pacientes y métodos: Se aplicó un diseño cuasiexperimental, antes y después de seis meses del inicio del tratamiento quimioterapéutico. Participaron 40 pacientes con diagnóstico primario de cáncer de mama invasivo. Se tomaron medidas antropométricas, de composición corporal mediante absorciometría dual de rayos X (DEXA) así como análisis de la dieta mediante recordatorio de 24 horas y cuestionario de frecuencia de consumo. Además, se cuantificaron los biomarcadores séricos, retinol y β-caroteno. El efecto del tratamiento se estimó utilizando regresión linear mixta para mediciones repetidas.
Resultados: Se registró una pérdida de tejido magro (p=0.03). Además se encontró interacción del climaterio sobre los parámetros de peso, IMC y grasa corporal; solo en las pacientes preclimatéricas aumentaron estas medidas (p=0.005, 0.006 y 0.001 respectivamente). El retinol sérico disminuyó (p=0.049) pese al incremento en el β-caroteno (p=0.030). También se incrementó el consumo de vegetales y hubo una reducción en el consumo de alimentos de origen animal.
Conclusión: El tratamiento antineoplásico para cáncer de mama afectó negativamente al peso y grasa corporal, principalmente en las mujeres jóvenes. Pese a las modificaciones dietarias, el consumo promedio de vegetales aún es insuficiente, lo cual se reflejó también en los biomarcadores séricos.
Palabras clave: Neoplasias mamarias. Antropometría. Composición corporal. Evaluación de la nutrición. Vitamina A.
ABSTRACT
Background: Breast cancer is the most commonly diagnosis malignancy in women in Mexico and also has the highest mortality. Although treatment has improved significantly, it can affect the nutritional status of the recipients.
Objective: The aim of this study was to assess the impact of the initial phase of antineoplastic therapy on the nutritional status in patients with breast cancer.
Methods: Forty subjects with primary diagnosed of invasive breast cancer were study in a before and after intervention (six months apart) using a quasi-experimental design. Basal and six month after intervention measurements included were anthropometry, body composition by dual X-ray absorptiometry (DEXA), diet by 24-hour recall and food frequency questionnaire, as well as serum β-carotene and retinol. The therapy effect was analyzed using repeated measurements mixed linear regression.
Results: Lean tissue decreased after the studied period (p=0.032).Addicionally, there was an interaction between weight, BMI and body fat parameters with menopausal status, increasing in these variables due to therapy only premenopausal patients (p=0.005, 0.006 and 0.001, respectively). Serum retinol decreased (p=0.049) despite the improvement in β-carotene status (p=0.03). In general there was an increase the consumption of vegetables food products whilst a decrease in animal foods products.
Conclusion: The breast cancer antineoplasic treatment had a negative effect on weight and body fat, especially in young women. Although there were some positive dietary changes, vegetables consumption remained insufficient, which was also reflected in serum biomarkers.
Key words: Breast neoplasms. Anthropometry. Body composition. Nutrition assessment. Vitamin A.
Introducción
En los últimos años, México ha registrado cambios sustanciales en su estructura poblacional, incremento de la esperanza de vida, y, por tanto, de las morbilidades crónico-degenerativas concomitantes al proceso de envejecimiento, entre las cuales destaca el cáncer1.
A nivel mundial, el cáncer es la primera causa de muerte por enfermedades no transmisibles en los países desarrollados y la segunda en los países en desarrollo. Entre las mujeres, el cáncer de mama es el de mayor incidencia y mortalidad: 23% de los nuevos casos (1.38 millones) y 14% del total de muertes (458, 400) por cáncer2. En México, el cáncer ocupa el tercer lugar en la lista de principales causas de muerte en mujeres (15.2% de las defunciones totales), y desde el 2006 el cáncer de mama ocupa el primer lugar en la lista de muertes por neoplasia1.
El tratamiento de cáncer de mama es planificado de acuerdo con el estadio de la enfermedad: habitualmente se utilizan combinaciones de cirugía, radioterapia, quimioterapia adyuvante y hormonoterapia. Dado que los medicamentos utilizados no son selectivos para atacar sólo células neoplásicas, otras estirpes celulares resultan afectadas, como las células sanguíneas, principalmente los neutrófilos, lo cual limita la frecuencia de administración del tratamiento, además de inducir inmunosupresión3. En el caso particular del tratamiento del cáncer de mama, éste se ha asociado con aumento de peso desde finales de los años setenta4. Tal incremento va de 2.5 a 6 kg, se acentúa en las pacientes en premenopausia y se ha asociado al aumento en la proporción de grasa corporal, la cual es una importante fuente extragonadal de estrogenicidad, que promueve el crecimiento tumoral5. Además, en muchos de los casos no sólo se gana grasa, si no que se pierde tejido magro, lo que puede conducir a obesidad sarcopénica6.
La mayoría de las pacientes, en su afán por mejorar su dieta, disminuyen la ingestión de productos de origen animal, lo que puede comprometer el consumo de proteínas, potencialmente asociado a una disminución en la sobrevida7. La enfermedad y la nutrición están íntimamente relacionadas de modo que, mientras la enfermedad puede causar trastornos en la nutrición, ésta a su vez puede influir negativamente en la enfermedad8. Aunque el impacto del tratamiento antineoplásico en las pacientes con cáncer de mama es un hecho bien documentado, las investigaciones publicadas al respecto pertenecen a poblaciones muy distintas a la mexicana por factores genéticos, etnicidad y hábitos alimentarios, los cuales pudieran influir en la susceptibilidad al tratamiento, llevando a un efecto diferencial.
El objetivo fue evaluar el impacto de los primeros seis meses de tratamiento antineoplásico sobre indicadores antropométricos, composición corporal y los biomarcadores séricos retinol y β-caroteno, así como una exploración de los cambios dietarios en pacientes con cáncer de mama.
Pacientes y métodos
El presente estudio fue un diseño cuasiexperimental; se compararon las variables arriba mencionadas, antes y después de recibir el tratamiento antineoplásico por un periodo de 6 meses. Se incluyó a mujeres con cáncer de mama invasivo que acudieron al Centro Estatal de Oncología (CEO) en Hermosillo, Sonora, para iniciar su tratamiento. Se reclutó a quienes no presentaron metástasis ni otras enfermedades que afectaran directamente su composición corporal (hipo e hipertiroidismo, fracturas y/o lesiones incapacitantes, etc) y que no hubieran recibido tratamiento antineoplásico previamente. Se excluyó del estudio a aquellas mujeres que desarrollaron metástasis en el periodo de estudio y/o abandonaron el tratamiento.
Este protocolo fue aprobado por los comités de ética del CEO y del Centro de Investigación en Alimentación y Desarrollo (CIAD), donde se efectuaron las mediciones antropométricas y de composición corporal. A las voluntarias reclutadas se les solicitó firmar una carta de consentimiento informado, así como sus datos generales e información de contacto. De manera adicional, del expediente clínico se tomaron los datos referentes a la etapa de la enfermedad, esquema de tratamiento, estado menopáusico, escolaridad y nivel socioeconómico; éste último determinado por el departamento de trabajo social del hospital en función del ingreso mensual, características de la vivienda y número de habitantes en ella, acceso a servicios básicos, entre otros. La aplicación de los cuestionarios dietarios, así como la extracción de la muestra de sangre se efectuaron en las instalaciones del CEO. La determinación de composición corporal y las mediciones antropométricas se llevaron a cabo en CIAD. Todas las mediciones se realizaron antes y después de 6 meses de recibir tratamiento antineoplásico.
Antropometría
Se midió el peso corporal del individuo con el mínimo de ropa posible, y sin zapatos, utilizando una balanza electrónica (AND FV-150K, Japón) con una capacidad de 150 + 0.5 Kg. La medición de la talla se llevó a cabo con un estadiómetro Holtain, con una capacidad de 201 + 0.1cm posicionando a la paciente en el plano de Frankfurt. El índice de masa corporal (IMC) se calculó utilizando la relación peso/talla2 (kg/m2). La circunferencia de la cintura y cadera se midieron con una cinta métrica flexible. La cintura se tomó de pie a la altura de la cicatriz umbilical y para la cadera se tomó el punto más prominente de la misma9.
Composición Corporal
Se determinó utilizando un equipo de absorciometría dual de rayos X (DXA-MD+ Lunar Co., Madison, WI). Se realizó un barrido de cuerpo completo y se tomaron los datos de grasa, tejido magro y contenido mineral óseo (CMO), todos ellos reportados en kilogramos.
Cuantificación de Biomarcadores Séricos
Se tomaron 10 mL de sangre venosa con el paciente en estado de ayuno. A partir del suero, se extrajo la vitamina A por la técnica publicada por MacCrehan y Schönberger10 y se cuantificó en su forma de retinol y β-caroteno11,12. Para verificar la sensibilidad en la cuantificación de ambos biomarcadores se utilizó un estándar certificado NISTTM (968d) y se obtuvo una variación menor al 5%.
Evaluación Dietaria
Se utilizaron dos instrumentos; el recordatorio de 24 horas y el cuestionario de frecuencia semicuantitativo, diseñado y validado en población mexicana13. Ambos se aplicaron por entrevista directa a las pacientes y por un único entrevistador previamente entrenado y estandarizado.
Análisis Estadístico
El cambio promedio después de 6 meses en cada uno de los parámetros se determinó mediante una prueba de t pareada. La normalidad en la distribución de los datos se valoró mediante métodos gráficos. Para analizar el efecto debido a la terapia antineoplásica se empleó regresión lineal mixta para mediciones repetidas para cada uno de los parámetros estudiados.
Las mediciones antropométricas consideradas como variables respuesta fueron el peso, IMC, circunferencia de cintura y cadera. Para composición corporal se consideró grasa total, tejido magro y CMO. Cada uno de los modelos se ajustó por edad, estado menopáusico (se clasificó como postmenopausia a la ausencia de menstruación por más de un año) y estadio clínico. De igual manera se evaluó la presencia de interacción de dichas variables. En el caso de los biomarcadores séricos retinol y β-caroteno, los modelos se ajustaron adicionalmente por escolaridad y nivel socioeconómico (los seis estratos de esta variable se fusionaron en 2 debido al bajo número de sujetos en algunos de ellos). La significancia estadística de los efectos principales se estableció a una p=0.05. La presencia de de interacción se analizó a una p=0.1. Todos los análisis estadísticos se hicieron con el software NCSS versión 7.03 (2007).
Resultados
Se reclutó un total de 24 mujeres en el periodo de agosto de 2007 a enero de 2008 y 33 en el periodo de febrero a agosto de 2009. Tres mujeres abandonaron el tratamiento y a 14 más se les excluyó del estudio por desarrollo de metástasis en el periodo de seguimiento; por tanto, los resultados presentados corresponden a un total de 40 pacientes. La distribución etaria fue de los 32 a los 61 años; 19 en premenopausia y 21 en postmenopausia. La edad promedio de la menarquia fue 12. Cinco pacientes fueron nulíparas, 28 reportaron haber usado anticonceptivos orales, 6 reconocieron ser fumadoras regulares hasta la fecha del diagnóstico y 7 expresaron haber consumido bebidas alcohólicas ocasionalmente. En lo referente a escolaridad, 11 mujeres cursaron más allá del nivel básico (bachillerato, carrera técnica ó licenciatura). En cuanto al nivel socioeconómico, 25 se encontraron en nivel bajo y 15 en nivel medio o alto.
Cinco mujeres se hallaron en etapa I de la enfermedad, 12 en IIA, 8 en IIB, 9 en IIIA y 6 en IIIB (Clasificación TNM14). Todas las pacientes recibieron tratamiento quimioterapéutico. Los esquemas prescritos FAC (5-Fluorouracilo, Adriamicina, Ciclofosfamida), FEC (5-Fluorouracilo, Epirrubicina, Ciclofosfamida) ó DAC (Docetaxel, Adriamicina, Ciclofosfamida). Adicionalmente se le administró radioterapia a 25 de las pacientes y 8 fueron elegibles para recibir tratamiento con anticuerpos monoclonales (trastuzumab).
En el análisis inicial (Tabla I) se observó un aumento en la circunferencia de cintura (p=0.008) y en la concentración de β-caroteno en suero (p=0.03). Además, un decremento significativo en tejido magro y retinol sérico (p=0.032 y p=0.04 respectivamente).
Al explorar el efecto de otras variables sobre los parámetros de interés (Tabla II), se encontró interacción del estado climatérico (pre y postmenopausia) sobre las variables de peso, IMC y grasa corporal; Las pacientes en premenopausia incrementaron en promedio 2.3 kg de tejido adiposo y 2.1 kg de peso corporal (p<0.001 y p=0.004), mientras que en el grupo de pacientes en postmenopausia no hubo cambio.
En los biomarcadores séricos, pese a la disminución en la concentración de retinol, éste se mantuvo dentro de los límites normales (0.35-1.75μmol/L)15. Se encontró asociación significativa del retinol sérico con el estrato socioeconómico y una asociación inversa con la edad (p=0.014; p=0.011 respectivamente, Tabla I). No se encontró efecto significativo de dichas variables sobre el β-caroteno sérico; pese a su incremento, permaneció muy por debajo del punto de corte de los valores considerados como normales que van de 0.9 a 4.6 μmol/L15.
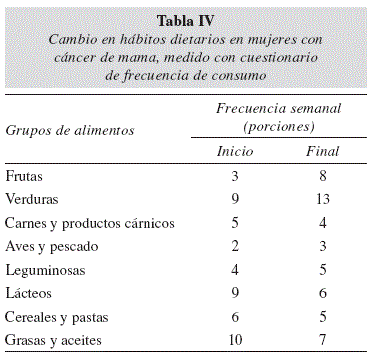
Como resultado de la evaluación dietaria se encontró que después de 6 meses, las mujeres participantes mostraron una disminución en el consumo energético, así como de grasa, hierro, potasio y zinc (p=0.024, p=0.006, p=0.038, p=0.022 y p=0.017 respectivamente, Tabla III). En la encuesta de frecuencia de consumo (Tabla IV) se observó una reducción en la ingestión de productos cárnicos y lácteos, además de un incremento en frutas y verduras.
Discusión
Diversos estudios publicados con relación al tratamiento en pacientes con cáncer de mama han reportado un incremento de peso tanto en pre como postmenopáusicas, como es el caso de Camoriano y col. en 1990, donde las pacientes premenopáusicas aumentaron en promedio 5.9 kg, y las postmenopáusicas 3.6 kg5. Investigaciones posteriores han reportado esta misma tendencia6,7,16. La discrepancia entre esos resultados y los aquí expuestos pudiera deberse a que en la mayoría de ellos el seguimiento fue de al menos un año. Sin embargo, Demark-Wahnefried y col. encontraron un aumento de peso de 2.2 kg en mujeres premenopáusicas6, en un periodo de tiempo similar al nuestro (seis meses). En pacientes premenopáusicas el impacto de la ablación ovárica por efecto del tratamiento es mayor; quienes ya cursaron por la menopausia experimentaron este proceso naturalmente y de forma gradual, por tanto, las secuelas a este respecto en ellas son menores.
Por otra parte, la obesidad androide en pacientes con cáncer de mama se ha asociado con baja sobrevida17. Hay investigaciones que se han enfocado en la obesidad central como factor de riesgo para diabetes y problemas cardiovasculares, lo que aunado al efecto cardiotóxico de algunos fármacos antineoplásicos como la doxorrubicina, adquiere particular relevancia3.
La disminución de tejido magro posterior al tratamiento concuerda con que en los pacientes oncológicos en general el metabolismo proteico se encuentra alterado y en fase catabólica debido a la presencia del tumor, aún en etapas tempranas de la enfermedad; aunque la reducción estrogénica resultante de la administración de quimioterapia también incide en el metabolismo del tejido muscular18. En dos estudios independientes se observaron resultados similares6,19: uno de ellos, sin cambio aparente en las mediciones antropométricas19. Esto podría ser relevante si se considera que la evaluación de la composición corporal no forma parte del esquema habitual de tratamiento que reciben los pacientes con cáncer, y que la disminución de masa magra ha demostrado tener un efecto negativo en la respuesta a los antineoplásicos; de hecho, se resalta la importancia de la valoración de la sarcopenia por el oncólogo y el ajustar las dosis de quimioterapia en función de la misma20. Además, el desgaste muscular impacta de forma directa la independencia, la calidad de vida y la morbilidad en quienes lo presentan.
El incremento de grasa corporal encontrado en las pacientes premenopáusicas confirma que el aumento de peso encontrado en este grupo se debe preponderantemente al aumento de tejido adiposo, como ya otros autores han reportado6,17. No obstante, la elevación en la proporción de grasa puede presentarse aún sin cambio significativo en el peso corporal19. La distribución corporal del tejido adiposo puedes estar influenciada por factores como la etnicidad y carga estrogénica. Sin embargo, dado que algunos de los agentes quimioterapéuticos provocan falla ovárica, esto contribuye a que la ubicación de la grasa sea de tipo androide; lo que se relaciona con riesgo de recidiva y promoción de otras morbilidades17. Resalta de nuevo el hecho de que este fenómeno se presente solo en las pacientes en preclimaterio, ya que las pacientes en postmenopausia no presentan cambios significativos en este parámetro. El aumento de grasa pudiera ser un proceso homeostático para mantener los niveles circulantes de estrógenos, que juegan un rol importante en múltiples funciones en el organismo. Con el climaterio los estrógenos circulantes empiezan a decaer paulatinamente, por lo que el mecanismo compensatorio en las mujeres en postmenopausia no es tan evidente.
Para 1998 la OMS reportó que hasta un 55% de los mexicanos tenía deficiencia de vitamina A21. Sin embargo, otros estudios realizados en mujeres en edad reproductiva en 1999 y 2003 no encontraron tal deficiencia22,23. En este trabajo, solo tres pacientes presentaron valores por debajo del punto de corte establecido como normal. La disminución significativa de la concentración de retinol sérico es consistente con los cambios en la dieta efectuados por las pacientes; se encontró una disminución en la ingestión de energía, grasa, hierro, potasio y zinc (Tabla III); cuyos principales aportadores son los lácteos y productos cárnicos. Su consumo disminuyó según lo encontrado por la encuesta de frecuencia de consumo (Tabla IV).
La reducción de la ingesta calórica es congruente con los estudios publicados al respecto. Aunque el aumento de peso como resultado del tratamiento para cáncer de mama es un hecho documentado desde hace décadas4, no ha podido asociarse a una mayor ingestión de alimentos. Yaw y col. encontraron que aunque la mayoría de las voluntarias en su estudio efectuó cambios en su dieta, no hubo diferencia significativa en la ingesta energética diaria entre quienes bajaron de peso, subieron o lo mantuvieron24.
Algunas investigaciones han reportado que las pacientes bajo tratamiento para cáncer de mama tienden a realizar cambios a su dieta a fin de hacerla más saludable y mejorar su pronóstico, ya sea por indicación del personal médico o por iniciativa propia16,25. Las mujeres incluidas en el presente estudio incrementaron su consumo de frutas y legumbres, esto se reflejó en aumento de la concentración sérica de β-caroteno, aunque permaneció por debajo del punto de corte de valores normales. Por este motivo se considera que la ingestión de frutas y legumbres aun es insuficiente. No obstante, también es de mencionarse que, dado que los adipocitos tienen la capacidad de almacenar β-caroteno, es razonable pensar que aunque las pacientes aumenten su consumo de vegetales, no necesariamente se verá reflejado en la concentración de la vitamina en suero26.
La baja concentración del retinol sérico y su posterior disminución pudieran deberse, aparte de los cambios dietarios, a que la eficiencia en la transformación de β-caroteno a retinol no sea la esperada. El factor de conversión es variable dependiendo del alimento de origen. Estudios al respecto han reportado que la proporción de dicha transformación se encuentra en el rango de 10 a 28:1 por peso. Por tal motivo, la Food and Nutrition Board en 2001 corrigió el factor de conversión de β-caroteno a retinol de 6:1 a 12:1 y se esperan nuevos cambios27,28. Además, la eficiencia de bioconversión puede verse afectada por el elevado estrés oxidativo presente en pacientes con cáncer; potencial detonador del proceso neoplásico29, incrementado por los fármacos quimioterapéuticos30 y favorecido por la pérdida del efecto antioxidante proporcionado por los estrógenos31.
Si bien se reconocen las limitaciones de la evaluación dietaria, se considera que proporcionan valiosa información sobre las modificaciones en los hábitos alimenticios efectuadas por las pacientes como grupo y que incluso ayudan a predecir la ingestión de algunos nutrimentos específicos32, por lo que son herramientas útiles en el diseño y monitorización de programas de apoyo33. Aunque en los países industrializados la atención nutricional en los enfermos de cáncer forma parte del esquema habitual de tratamiento desde hace tiempo, en México esto es incipiente, por lo que es necesario considerar esta iniciativa en los programas de salud. Una buena nutrición mejoraría la tolerancia al tratamiento, disminuiría las complicaciones y sobre todo, incrementaría la calidad de vida en los pacientes.
Limitaciones del Estudio
Aunque en la evaluación del cambio de las variables estudiadas se consideró como covariable al estadio clínico de la enfermedad y se excluyó a quienes desarrollaron metástasis, no se descarta la influencia de la neoplasia sobre los parámetros medidos, por lo que el cambio en ellos no puede explicarse en su totalidad como consecuencia del tratamiento quimioterapéutico. Por otro lado, pese a que las encuestas para la evaluación dietaria están estandarizadas y validadas para estimar la ingesta de alimentos y los hábitos de consumo en la región, su uso en pacientes oncológicos en las instituciones de salud locales aún no. Por lo anterior los resultados obtenidos referentes a la dieta deben considerarse como exploratorios. La información obtenida no puede ser generalizable a todas las pacientes con cáncer de mama.
Conclusión
La fase inicial del tratamiento antineoplásico para cáncer de mama impacta negativamente al peso y grasa corporal, principalmente en las más jóvenes. Aunque la mayoría modificó su dieta, al parecer el consumo promedio de vegetales aún es insuficiente, lo cual se reflejó también en los biomarcadores sanguíneos.
Aunque las causas del incremento de peso en las mujeres con cáncer de mama no son claras, resalta la importancia de realizar una valoración nutricional al inicio del tratamiento; ésto permitiría implementar estrategias que mejoren su tolerancia al mismo, ayuden a prevenir cuadros de deficiencias nutricionales y terminen por impactar positivamente en la calidad y sobrevida de vida de estas mujeres.
Agradecimientos
Primeramente a las pacientes que participaron como voluntarias. Al Centro Estatal de Oncología (CEO) y al Centro de Investigación en Alimentación y Desarrollo (CIAD) por las facilidades otorgadas. A QFB Diana Mendoza Bermúdez y M. en C. Ana Cristina Gallegos Aguilar por el apoyo técnico brindado. Al Dr. Benjamín Arroyo Acosta y al Dr. Ernesto Rivera Claisse por las atenciones y facilidades otorgadas.
Referencias
1. INEGI (Instituto Nacional de Estadística y Geografía). 2011. Estadísticas a propósito del día mundial contra el cáncer. INEGI, serie de estadísticas vitales. México Distrito Federal. [ Links ]
2. Jemal, A., Bray, F., Center, M.M., Ferlay, J., Ward, E., Forman, D. 2011. Global Cancer Stadistics. Cancer J Clin; 61:69-90. [ Links ]
3. Perry, M.C., Anderson, C.M., Doll, D.C., Malhotra, B., Shahab, N., Wooldridge, J.E. 2004. Companion Handbook to The Chemotherapy Soucebook. Second edition. Lippincott Wlliams & Wilkins. United States of America. [ Links ]
4. Dixon, J., Moritz, D., Baker, F. 1978. Breast cancer and weight gain: an unexpected finding. Oncol Nurs Forum 5: 5-7. [ Links ]
5. Camoriano, J., Loprinzi, C., Ingle, J., Therneau, T., Krook, J., Veeder, M. 1990. Weight change in women treated with adjuvant therapy or observed following mastectomy for node-positive breast cancer. Journal of Clinical Oncology 8(8):1327-1334. [ Links ]
6. Demark-Wahnefried, W., Peterson B.L., Winer, E.P., Marks, L., Aziz, N., Marcom, P.K., Blackwell, K., Rimer, B.K. 2001. Changes in weight, body composition, and factors influencing energy balance among premenopausal breast cancer patients receiving adyuvant chemotherapy. Journal of Clinical Oncology. Vol 19, No 9, pp 2381-2389. [ Links ]
7. Goodwin, P.J., Ennis, M., Pritchard, K.I., Koo, J., Trudeau, M.E., Hood, N. 2003. Diet and Breast Cancer: Evidence that extremes in diet are associated with poor survival. Journal of Clinical Oncology. Vol 21, No 13. pp 2500-2507. [ Links ]
8. Ottery, F.D. 1994. Rethinking nutritional support of the cancer patient: The new field of nutritional oncology. Semin Oncol 21:770-778. [ Links ]
9. Tabata S.,Yoshimitsu S., Hamachi T., Abe H., Ohnaka K., Kono S. 2009. Waist circumference and insulin resistance: a cross-sectional study of Japanese men. BMC Endocrine Disorders 9:1. [ Links ]
10. MacCrehan, W.A., Schönberger, E. 1987. Determination of retinol, alpha-tocopherol, and beta-carotene in serum by liquid chromatography with absorbance and electrochemical detection. Clin Chem. Sep; 33(9):1585-92. [ Links ]
11. Bieri, J.G., Tolliver, T.J., Catignani, G.L. 1979. Simultaneous determination of α-tocopherol and retinol in plasma or red cells by high pressure liquid chromatography. The American Journal of Clinical Nutrition 32: 2143-2149. [ Links ]
12. Mejía, L.A., Hudson, E., González de Mejía, E., Vásquez, F. 1988. Carotenoid content and vitamin A activity of some common cultivars of mexican peppers (Capsicum annuum) as determined by HPLC. Journal of Food Science Vol 53 No 5. [ Links ]
13. Ortega, M.I. Quizán, P.T. Morales, G.G., Preciado, M. 1999. Cálculo de ingestión dietaria y coeficientes de adecuación a partir de: registro de 24 horas y frecuencia de consumo de alimentos. Centro de Investigación en Alimentación y Desarrollo A.C. Dirección de nutrición. Hermosillo, Sonora. [ Links ]
14. Sobin L.H., Wittekind C. 2002. TNM Clasification of Malignant Tumors. Union Internationale Contre le Cancer. 6th edition. Editorial Wiley. [ Links ]
15. Laposata M. 1992. SI Unit Conversion Guide. The New England Journal of Medicine. NEJM Books. Boston, Massachusetts. [ Links ]
16. Kroenke, C.H., Chen, W.Y., Rosner, B., Holmes, M.D. 2005. Weight, Weight gain, and survival after breast cancer diagnosis. Journal of Clinical Oncology 23: 1370-1378. [ Links ]
17. Kumar, N.B., Cantor, A., Allen, K. 2000. Android obesity at diagnosis and breast carcinoma survival: Evaluation of the effects of anthropometric variables at diagnosis, including body composition and body fat distribution and weight gain during lifespan, and survival from breast carcinoma. Cancer 88:2751-2757. [ Links ]
18. Tisdale, M.J. 2009. Mechanisms of Cancer Cachexia. Physiological Reviews 89:381-410. [ Links ]
19. Freedman, R.J. Aziz, N., Albanes, D., Hartman, T., Danforth, D., Hill, S., Sebring, N., Reynolds, J.C., Yanovsky, J.A. 2004. Weight and body composition changes during and after adyuvant chemotherapy in women with breast cancer. J Clin Endocrinol Metab 89: 2248-2253. [ Links ]
20. Roubenoff, R. 2008. Excess baggage: sarcopenia, obesity, and cancer outcomes. The Lancet Oncology. Vol 9. [ Links ]
21. WHO. Global prevalence of vitamin A deficiency. MDIS working paper no. 2. Geneva: WHO; 1995. [ Links ]
22. Casanueva, E., Valdés-Ramos, R., Pfeiffer, F., Ricalde-Moreno, A., García-Villegas, E., Meza, C. 1999. Retinol sérico en mujeres mexicanas urbanas durante el periodo perinatal. Salud Publica Mex 41:317-321. [ Links ]
23. Villalpando, S., Montalvo-Velarde, I., Zambrano, N., García-Guerra, A., Ramírez-Silva, C.I., Shamah-Levy, T., Rivera, J.A. 2003. Vitamins A, and C and folate status in mexican children under 12 years and women 12-49 years: a probabilistic national survey. Salud Publica Mex 45:508-519. [ Links ]
24. Yaw, Y.H., Shariff, Z.M., Kandiah, M., Mun, C.Y., Yusof, R.M., Othman, Z., Saibul, N., Weay, Y.H., Hashim, Z. 2011. Weight changes and lifestyle behaviors in women after breast cancer diagnosis: a cross-sectional study. BMC Public Health 11:309. [ Links ]
25. Pekmezi, D.W., Demark-Wahnefried, W. 2011. Updated evidence in support on diet and exercise interventions in cancer survivors. Acta oncologica 50: 167-178. [ Links ]
26. Tang, G., Qin, J., Dolnikowski, G.G., Russell, R.M. 2003. Short-term (intestinal) and long-term (whole-body) conversion of β-carotene to vitamin A in adults as accessed by a stable isotope reference method. Am J Clin Nutr 78:259-66. [ Links ]
27. Tang, G., Qin, J., Dolnikowski, G.G., Russell, R.M., Grusak, M.G. 2005. Spinach or carrot can supply significant amounts of vitamin A as assessed by feeding with intrinsically deuterium labeled vegetables. Am J Clin Nutr 82:821-8. [ Links ]
28. Khan, N.C., West, C.E., De Pee, S., Bosch, D., Phuong, H.D., Hulshof, P.J., Khoi, H.H., Verhoef, H., Hautvast, J.G. 2007. The contribution of plant foods to the vitamin A supply of lactating women in Vietnam: a randomized controlled trial. Am J Clin Nutr 85(4): 1112-20. [ Links ]
29. Karihtala, P., Soini, Y. 2007. Reactive oxygen species and antioxidant mechanisms in human tissues and their relation to malignancies. APMIS. 115:81-103. [ Links ]
30. Perry, M.C. 2008. The Chemotherapy Source Book. Fouth edition. Lippincott Wlliams & Wilkins. United States of America. [ Links ]
31. Pacheco, J. 2010. Estrés oxidativo en el climaterio y menopausia y cancer ginecológico. Rev Per Ginecol Obstet 56:108-119. [ Links ]
32. Pierce, J.P., Natarajan, L., Sun, S. Al-Delaimy, W, Flatt S.W., Kealey, S., Rock, C.L., Thomson, C.A., Newman, V.A., Ritenbaugh, C., Gold, E.B., Caan, B.J. 2006. Increases in plasma carotenoid concentrations in response to a major dietary change in the women's healthy eating and living study. Cancer Epidemiol Biomarkers Prev 15(10). [ Links ]
33. Meyerhardt, J.A., Heseltine, D., Campos, H., Holmes, M.D., Willett, W.C., Winer, E.P., Enzinger, P.C., Bunnell, C.A., Kulke, M.H., Fuchs, C.S. 2005. Assessment of a dietary questionnaire in cancer patients receiving cytotoxic chemotherapy. J Clin Oncol 23:8453-8460. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Humberto Astiazarán García.
Centro de Investigación en Alimentación y Desarrollo.
Carretera a La Victoria km. 0,6.
83304 Hermosillo, Sonora.
E-mail: hastiazaran@ciad.mx
Recibido: 30-V-2014.
Aceptado: 23-VII-2014.