INTRODUCCIÓN
En los pacientes con patologías oncológicas como el cáncer de mama, el cáncer cervicouterino o el cáncer de próstata, el tratamiento sistémico o local condiciona una alteración hormonal que produce con gran frecuencia efectos secundarios, como sofocos, insomnio y astenia, que alteran de forma significativa la calidad de vida.
Los tratamientos actuales para estos síntomas en los pacientes con cáncer tienen sus limitaciones ya que las terapias farmacológicas están contraindicadas en los cánceres hormonodependientes (1), además de estar asociadas a efectos secundarios bastantes molestos. Por otro lado, las terapias alternativas y el abordaje psicoterapéutico carecen de ensayos clínicos controlados.
El mecanismo fisiológico de los sofocos no está del todo claro, aunque existen pruebas que muestran una reducción de los niveles de serotonina (2); de hecho, los inhibidores selectivos de la recaptación de serotonina son útiles para aliviar los síntomas vasomotores (3,4). También se relacionan con cambios en algunos neuroquímicos, como el estrógeno, la norepinefrina, el péptido relacionado con el gen de la calcitonina y la glucosa (5), y con la participación de alteraciones termorreguladoras.
En los pacientes con cáncer, el insomnio no ha recibido mucha atención a pesar de ser uno de los síntomas más comunes (6), que afecta al 40-60 % de los enfermos según varios autores (7). Savard y Morín afirman que más del 50 % de los pacientes oncológicos presentan problemas de sueño que perduran años después de finalizar el tratamiento (8), siendo este un problema crónico para los pacientes y las familias. Existe evidencia de que en la fisiopatología de diversas afecciones neurológicas que incluyen trastornos del sueño se ven involucradas anomalías en las acciones mediadas por la serotonina, la melatonina y el triptófano (9). Silber y Schmitt, en una revisión, sugieren que el triptófano podría mejorar los trastornos del sueño en los adultos, al aumentar la serotonina cerebral (10). Las pacientes con cáncer de mama son las que se asocian a un mayor nivel de insomnio, con una prevalencia entre el 38 % y el 61 % (11). Los síntomas vasomotores de la menopausia, como los sofocos, referidos por el 40-70 % de las supervivientes del cáncer de mama (12), pueden contribuir a la incidencia del insomnio.
Aunque no encontramos estudios donde se use el triptófano como tratamiento del insomnio en pacientes con cáncer, sí los hay para los trastornos del sueño de pacientes no oncológicos, a los que se han administrado dosis de entre 1 y 5 g al día (13-16), observándose un efecto significativo sobre el sueño en el tratamiento crónico del insomnio severo (13,14).
En los pacientes con cáncer, la astenia es uno de los síntomas con mayor prevalencia, de manera que el 95 % de los pacientes oncológicos que reciben tratamiento presentan astenia en mayor o menor grado (17). Al igual que en el caso de los sofocos, los mecanismos fisiopatológicos implicados en la aparición de la astenia relacionada con el cáncer no están completamente aclarados. Probablemente estén relacionados con una alteración de la regulación de varios sistemas y con la asociación de varios factores contribuyentes. Entre los mecanismos descritos se encuentran las alteraciones de la regulación de la serotonina, la disfunción del eje hipotalámico-hipofisario-adrenal, las alteraciones del ritmo circadiano y la alteración de la regulación de las citoquinas (18).
Como hemos comentado previamente, la vía serotoninérgica está involucrada de alguna manera en la aparición de los tres síntomas mencionados. Los bajos niveles de serotonina se han asociado a problemas del sueño, dolor, ansiedad, depresión, sofocos, estados agresivos y migrañas (19,20).
La serotonina ingerida por vía oral no se incorpora a las vías serotoninérgicas del sistema nervioso central ya que no cruza la barrera hematoencefálica. Sin embargo, el triptófano, que es un aminoácido esencial de la síntesis de proteínas y el precursor del neurotransmisor serotonina y de otros metabolitos, como la melatonina, la quinurenina y la niacina, sí puede cruzar la barrera hematoencefálica. Una vez en el sistema nervioso central (SNC) se convierte en 5-hidroxitriptófano (5-HTP) y luego se descarboxila en serotonina (21). Se ha observado que la reducción de los niveles de triptófano se correlaciona con una reducción de los niveles de serotonina (22).
El triptófano se obtiene de la dieta en cantidades suficientes para la síntesis de la serotonina y otros compuestos (23) y, dado que es un componente natural de la dieta, puede usarse sin complicaciones (24,25), teniendo una toxicidad baja, sin efectos adversos asociados (25-27).
El presente estudio se basa en la suplementación dietética con L-triptófano de pacientes con cáncer de próstata, de mama o cervicouterino con el objeto de mejorar la calidad de vida de los mismos al disminuir la frecuencia de los sofocos, el insomnio y la astenia. Después de una búsqueda bibliográfica exhaustiva por parte de nuestro grupo de trabajo, no se han encontrado estudios donde se analice el efecto del triptófano como tratamiento de los síntomas descritos en pacientes con cáncer.
MATERIALES Y MÉTODOS
Ensayo clínico abierto, sin grupo de control, realizado en el Servicio de Oncología Radioterápica del Hospital Universitario Central de Asturias en el período comprendido desde julio de 2018 hasta julio de 2019. Tanto el proyecto de investigación como la hoja de consentimiento informado fueron aprobados por el Comité de Ética de la Investigación del Principado de Asturias.
Se calculó que el tamaño muestral sería de 60 pacientes, considerando un nivel de confianza del 95 %, una potencia del 80 %, una diferencia de medias a detectar de 8 y una desviación estándar, con respecto a la diferencia obtenida de un estudio piloto previo, de 20 pacientes, el número de pares mínimo, considerando un posible ajuste de las pérdidas del 15 %. Este cálculo se llevó a cabo con el programa Epidat, versión 4.2.
Los sujetos fueron entrevistados por primera vez por el autor, quien determinó si cumplían los criterios de selección. Los participantes del estudio se reclutaron de acuerdo con los siguientes criterios de inclusión:
- Mayores de 18 años.
- Con diagnóstico de cáncer de próstata, de mama o cervicouterino.
- Habiendo recibido tratamiento oncológico con radioterapia y/o hormonoterapia.
- Que presentasen sofocos, astenia e insomnio.
- Valores de triptófano en sangre por debajo de la media del rango de referencia.
Los criterios de exclusión fueron:
- Que estuvieran recibiendo tratamiento con antidepresivos que afectaran al metabolismo de la serotonina.
- Que estuviesen tomando algún suplemento o tratamiento para los sofocos, la astenia y el insomnio.
- Que no estuviesen dispuestos a participar y no firmasen el consentimiento informado.
- Que no tuvieran la capacidad de cumplir las pautas.
Como criterios de retirada del estudio se consideraron los valores de triptófano en sangre > 95 ng/ml durante el seguimiento.
Se recogieron los datos de los pacientes (edad, sexo, patología). A todos los sujetos incluidos en el estudio se les administró L-triptófano: 1 sobre de 3 g al día durante 4 meses como mínimo. Debido a que no se han encontrado en la literatura estudios donde se utilice el L-triptófano en pacientes con cáncer, la intervención y su dosis se basaron en los hallazgos de estudios previos acerca de la dosis de triptófano en otros escenarios clínicos, como en el tratamiento de los trastornos del sueño, usando como referencia los estudios con dosis de entre 1 y 5 g/día (14-17). El suplemento fue proporcionado por el laboratorio Nutrición Médica.
Se realizaron las siguientes evaluaciones: analítica de sangre del triptófano libre en el momento basal y, luego, mensualmente durante 3 meses consecutivos. El valor de referencia del triptófano en sangre utilizado fue de 30-95 ng/ml. Las muestras de sangre periférica se obtuvieron mediante técnicas estándar de venopunción, en tubos Vaccutainer que contenían EDTA.K3 como anticoagulante. Después de la centrifugación se desproteinizó una alícuota de 400 µL de las muestras de plasma sanguíneo con ácido sulfosalicílico, después de añadir 100 µL de n-Leu como patrón interno. Se utilizó un analizador de aminoácidos Biochrom (Biochrom Ltd, Cambridge, Reino Unido) en el laboratorio de bioquímica clínica del HUCA para separar los aminoácidos libres presentes en la muestra. El control del plasma ClinCheck para aminoácidos (de Recipe Chemicals + Instruments GmbH, Múnich, Alemania) también se procesó en cada ejecución, como material de control de calidad interno, certificado según la norma ISO 13485, para verificar el rendimiento del análisis.
Se aplicaron cuestionarios para cada síntoma tanto al inicio como al final del estudio. Los sofocos se midieron mediante el cuestionario del estudio ESCAPA. Este cuestionario, que recoge 4 dimensiones -síntomas, temporalidad, estado de ánimo y actividad diaria-analiza además por separado el impacto de los sofocos en la vida diaria (pregunta 19) (28). La astenia se midió mediante el cuestionario Perform, que mide las percepciones de la astenia de los pacientes oncológicos, en su versión adaptada para la población española, que contiene 12 ítems distribuidos en 3 dimensiones: actividades habituales (4 ítems), actitudes y creencias (4 ítems), y limitaciones físicas (4 ítems); en su diseño, las puntuaciones altas conllevan mejores resultados (29). Para el insomnio se empleó el cuestionario ISI 81, que mide el índice de gravedad del insomnio a través de la percepción del propio paciente. Este cuestionario consta de 7 ítems que miden las dificultades para conciliar el sueño, las dificultades para mantener el sueño y despertar por la mañana, la satisfacción con el sueño actual, la interferencia con el funcionamiento diario, la perceptibilidad del deterioro atribuido al problema del sueño y el grado de angustia o cansancio causado por el problema del sueño (30-32). Para evaluar la calidad de vida se aplicó el cuestionario WHOQOL-BREF validado en España, que se centra en la calidad de vida percibida por el paciente y ofrece una puntuación global de la calidad de vida y puntuaciones de las áreas y las facetas que la componen. Consta de 26 ítems que evalúan 4 dimensiones: salud física, salud psicológica, relaciones sociales y ambiente. Las puntuaciones más altas indican una mejor calidad de vida (33-35).
Se evaluaron los posibles efectos adversos haciendo preguntas abiertas a los participantes: por ejemplo, "¿Ha tenido algún problema o efecto secundario desde que toma el suplemento de L-triptófano (como síntomas gastrointestinales o cualquier otro problema)?".
ANÁLISIS ESTADÍSTICO
Se realizó un análisis descriptivo de cada variable recogida, proporcionando medidas de posición y medidas de dispersión para las variables de tipo cuantitativo, y distribuciones de frecuencias absolutas y relativas para las de tipo cualitativo.
Se valoraron los cambios entre el inicio y el final del tratamiento a través del test de la t de Student para muestras relacionadas -previa comprobación de la hipótesis de normalidad- cuando las variables estudiadas eran cuantitativas, y con el test de Madansky cuando eran cualitativas.
Se estudiaron las correlaciones entre variables cuantitativas a través del coeficiente y el test de correlación de Spearman en caso de incumplimiento de la hipótesis de normalidad.
El nivel de significación empleado fue de 0,05.
El análisis estadístico se efectuó mediante el programa R (R DevelopmentCoreTeam), versión 3.4.4 (36).
RESULTADOS
Se incluyen en el estudio 60 pacientes, 37 (61,6 %) hombres y 23 (38,3 %) mujeres. Se obtiene la siguiente distribución de frecuencias por patología: cáncer de próstata 36 (60 %), cáncer de mama 13 (21,6 %), cáncer cervicouterino 11 (18,3 %). La edad media fue en los hombres de 70,8 (8,1) años y en las mujeres de 49,8 (6,8) años.
Se evaluó la elegibilidad de un total de 60 individuos y se excluyeron 3, de los cuales uno abandonó el estudio voluntariamente y 2 presentaron concentraciones de triptófano por encima de los valores normales (> 95 ng/ml) en las analíticas de seguimiento, por lo que fueron retirados del estudio. En total, 57 participantes completaron el estudio.
Al analizar los valores sanguíneos de triptófano observamos que todos los pacientes al inicio del estudio tenían niveles hemáticos de triptófano bajos o en el límite bajo de la normalidad (valor de referencia: 30-95 ng/ml), produciéndose un aumento significativo de estos niveles durante el estudio, con una media final de 67,0 ± 15,4 en comparación con el valor basal 36,5 ± 11,9 (p < 0,001), sin registrarse efectos secundarios asociados a la ingesta de 3 g de L-triptófano.
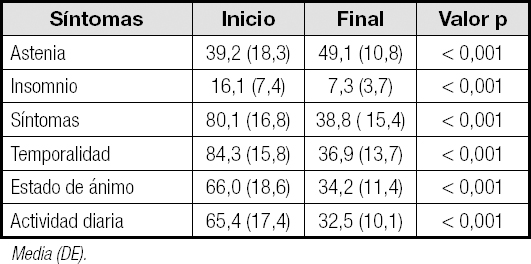
En relación con los sofocos, en el análisis de las cuatro dimensiones del cuestionario ESCAPA se muestra una mejoría significativa de todas ellas, con una disminución de la media final con respecto a la basal (Tabla I).
Analizando la pregunta 19 del cuestionario se objetiva que el 80 % de los pacientes presentaban al inicio una afectación de la vida diaria moderada o muy alta, disminuyendo dicha percepción al 0 %, con un valor de p < 0,001 (Fig. 1).
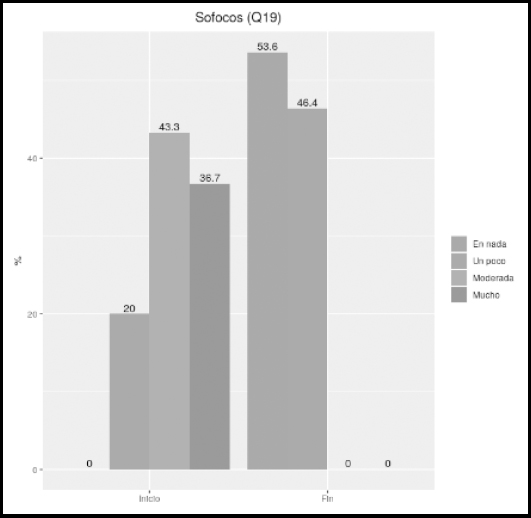
Figura 1. Comparación de las respuestas del cuestionario de sofocos (Q19). ¿Hasta qué punto cree que los sofocos afectan a su vida diaria?
Con respecto al cuestionario ISI81 para el insomnio, se observó una mejoría clínica de este síntoma, objetivándose que, de 60 pacientes, 40 (66,7 %) presentaban insomnio moderado o grave al inicio del estudio y solo un paciente (1,7 %) presentó insomnio moderado al final del mismo, siendo esta diferencia estadísticamente significativa (p < 0,001) (Tabla I).
Del insomnio, en general, se puede decir que la puntuación media disminuyó a 7,3 ± 3,7 con respecto a la media registrada al inicio del estudio (16,1 ± 7,4; p < 0,001) (Tabla II).
Para la astenia, al analizar los resultados del cuestionario PERFOM se objetivó una mejoría de este síntoma cuando se compararon los resultados del cuestionario final con los del inicial, con una variación significativa en el aumento de la media final, de 49,1 ± 10,8, con respecto a la inicial, de 39,2 ± 18,3 (p < 0,001) (Tabla I).
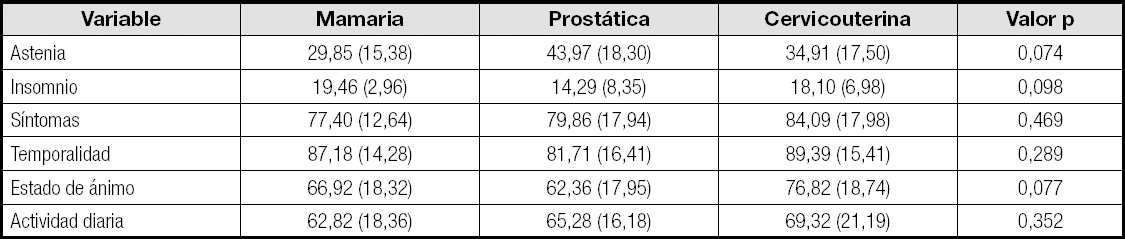
Se comparó la diferencia de cada síntoma entre el momento basal y el final con la diferencia hallada en los valores de triptófano entre la visita final y la basal, no hallándose diferencias significativas (Tabla III).
Al analizar la influencia del comportamiento de los síntomas estudiados al inicio del estudio en relación con la variable patología, no se obtuvo la significación estadística en ninguno de los casos (Tabla IV).
Tabla IV. Relación entre la evolución de los síntomas estudiados (astenia, insomnio y sofocos) y la patología
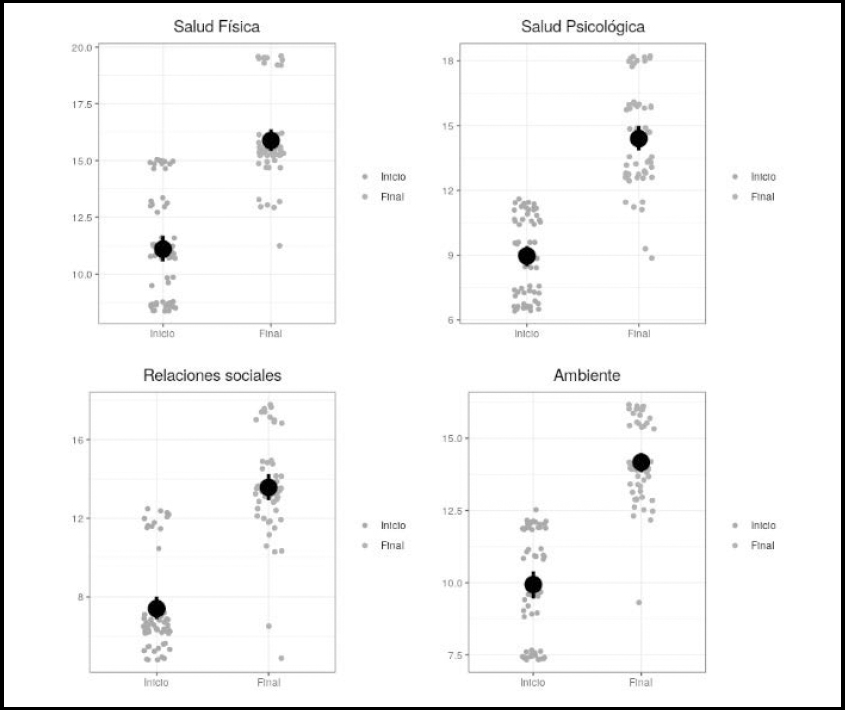
Las puntuaciones brutas obtenidas en la escala WHOQO-BREF se convirtieron a puntaciones transformadas (rango: 0-20), siguiendo las indicaciones del manual del WHOQOL-BREF, con el objetivo de permitir comparaciones entre las subescalas. Tal y como se refleja en la tabla V, el dominio de la salud física es el que registra un mayor nivel de satisfacción con la vida. Por el contrario, el nivel más bajo se obtuvo en el dominio de las relaciones sociales, resultando estas diferencias estadísticamente significativas (p < 0,001).
Tabla V. Comparación entre el inicio y el final del cuestionario de calidad de vida WHOQOL-BREF
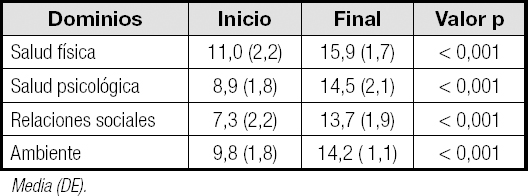
Media (DE).
Respecto a la calidad de vida evaluada con el cuestionario WHOQOL-BREF, esta mejoró durante el desarrollo del estudio, objetivándose que existe una mejoría significativa de la calidad de vida al final del estudio (p < 0,001) (Tabla V, Fig. 2). Este hecho se reflejó en la disminución progresiva de las puntuaciones obtenidas en las 4 dimensiones estudiadas (salud física, salud psicológica, relaciones sociales y ambiente).
DISCUSIÓN
En nuestro estudio se pone de manifiesto que la administración de 3 gramos de L-triptófano como suplemento nutricional a pacientes con cáncer de próstata, de mama o cervicouterino, que habían recibido tratamiento con radioterapia y/o hormonoterapia, se asocia a una elevación del nivel de triptófano en sangre y a una mejoría de los valores de las escalas de sofocos, astenia e insomnio. Aunque no hemos hallado ninguna relación estadísticamente significativa entre la elevación de los niveles de triptófano en sangre y el conjunto de los síntomas estudiados, sí se aprecia una mejoría significativa de cada uno de ellos; esto podría estar relacionado con el pequeño tamaño muestral y con otros posibles factores no recogidos en este estudio.
No encontramos estudios científicos con iguales intereses que los propuestos en esta investigación, dirigida a describir el comportamiento de los síntomas asociados a las neoplasias de mama, de próstata y cervicouterinas (sofocos, astenia, insomnio) en relación con la administración de triptófano a dosis de 1 sobre de 3 g al día durante 4 meses mínimo, siendo difícil para los autores establecer diferencias con otras investigaciones médicas similares. Por ello se amplió el abanico de comparación con otros estudios que habían incluido la administración de L- triptófano a pacientes no afectados de cáncer, pero que sí presentaban alguno de los síntomas que se monitorizaron en el actual estudio.
Nosotros observamos que todos los pacientes tenían inicialmente niveles bajos de triptófano libre en la sangre, lo que podría explicarse por un desequilibrio nutricional causado por la enfermedad de base y por los tratamientos oncológicos recibidos, que conllevarían una ingesta deficiente de triptófano, puesto que este aminoácido no puede ser sintetizado directamente por el ser humano. De forma clara y significativa, observamos que el aporte de 3 g/día de L-triptófano produce un aumento de los niveles de este aminoácido en sangre.
En cuanto a los efectos observados, la mayor modificación se aprecia en los sofocos, seguidos del insomnio y la astenia, demostrándose que el uso de 3 g de L-triptófano podría tener la capacidad de disminuir estos síntomas en los pacientes con cáncer.
La mejoría significativa de los sofocos obtenida en nuestra serie podría explicarse por un aumento del nivel de serotonina a nivel cerebral, ya que la concentración de este neurotransmisor es directamente proporcional a la concentración de triptófano en el plasma. Se ha demostrado que el uso de antidepresivos mejora los síntomas de sofocos en las mujeres con cáncer de mama, pero aumenta el riesgo de cáncer de mama (37-39). La suplementación de L-triptófano tendría la capacidad de aumentar la cantidad de serotonina disponible, produciendo un efecto similar a los ISRS sin los posibles inconvenientes asociados. Aunque Freedman (40) no demostró la mejoría de los sofocos en mujeres posmenopáusicas al administrar 150 mg/día de 5-HTP, esto pudo deberse a que dicha dosis está en el extremo inferior del rango terapéutico, además de no recoger ni los niveles basales ni los finales de triptófano en la sangre.
La utilización del triptófano para los desórdenes del sueño se ha estudiado ampliamente. Spinweber observó que la administración de 3 g de L-triptófano había producido un descenso de la latencia de sueño (13). Hajak G., administrando triptófano en un rango de 1-5 g, reportó una acción significativa sobre el sueño al aumentar los niveles de melatonina en el plasma (14). Por su parte, Huether y cols. se cercioraron de que, tras una infusión de L-triptófano, aparece dependencia en relación con los niveles plasmáticos tanto de triptófano como de melatonina (16). Nuestros resultados también demuestran una mejoría del insomnio con el aporte de 3 g de triptófano pero, a diferencia de otros autores, nuestra muestra solo incluye pacientes con cáncer.
En nuestra serie también obtuvimos una mejoría significativa de la astenia, lo cual puede explicarse por el aumento del triptófano en sangre, ya que uno de los posibles mecanismos responsables de la astenia de los pacientes con cáncer es la alteración de los niveles de serotonina a nivel cerebral, debido a la actividad de citoquinas proinflamatorias como la interleuquina 1β (IL-1β), el interferón alfa (IFN-α), el IFN-γ y el TNF-α, producidas por la propia enfermedad y que alteran el metabolismo del 5-HT (18).
En relación con la calidad de vida evaluada con el cuestionario WHOQOL-BREF, se observa una mejoría significativa al final del estudio tanto de la salud física y psicológica como de las relaciones sociales y ambientales, y esto es de gran importancia en los pacientes oncológicos.
Los resultados de este estudio indicaron que administrar triptófano como suplemento nutricional durante 4 meses no produce ningún efecto adverso, por lo que el triptófano parece ser seguro y tolerarse bien.
La presente investigación está claramente limitada al tratarse de un ensayo clínico abierto, sin grupo de control y con un tamaño muestral pequeño, que se agrava por la heterogeneidad de las tres patologías tumorales estudiadas, que condicionan tres submuestras con un "n" muy bajo para alguna de ellas. Además, la muestra corresponde a un único centro y una única región, por lo que no podemos excluir que existan características locales que hayan influido en los resultados. Esto hace necesaria una investigación multicéntrica para confirmar los hallazgos, que por lo tanto deben considerarse de naturaleza preliminar.
CONCLUSIÓN
El estudio actual sugiere que en los pacientes con cáncer de mama, de próstata o cervicouterino, y síntomas de sofocos, astenia e insomnio, el aporte de triptófano como suplemento nutricional se tolera bien, mejora la calidad de vida y puede asociarse a una mejoría de los valores de las escalas de los síntomas referidos, aunque no demuestra que exista una relación estadísticamente significativa con la elevación del triptófano en la sangre. Por ello, este estudio se debe considerar preliminar y se deberán realizar otros ensayos controlados.