Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.20 no.2 feb. 2003
| Influencia del tratamiento hormonal sustitutivo en el perfil aterogénico de la mujer postmenopáusica C. ALFONSO CANO, M. D. VEZ GARCÍA, P. GARCÍA URRUTICOECHEA, Centro de Salud Docente de San Andrés. Murcia
|
| INFLUENCE OF ESTROGEN REPLACEMENT THERAPY ON ATHEROGENIC PROFILE IN POSTMENOPAUSAL WOMEN
| ||
| RESUMEN Objetivo: El riesgo cardiovascular se eleva en la mujer tras la menopausia. Este estudio pretende comparar el perfil aterogénico de las mujeres postmenopáusicas respecto a las premenopáusicas y valorar la influencia que el tratamiento hormonal sustitutivo ejerce sobre dicho perfil aterogénico. Método: Se seleccionan 76 mujeres climatéricas de 45 a 59 años y 15 mujeres con ciclos menstruales regulares de 40 a 45 años. Concluyen el estudio 63 mujeres con menopausia natural, normotensas, no diabéticas que no habían recibido previamente tratamiento hormonal sustitutivo ni fármacos con efecto sobre el sistema cardiovascular. El grupo control lo forman 15 mujeres sanas con ciclos menstruales regulares, de 40 a 45 años. Reciben durante 6 meses tratamiento hormonal 27 mujeres (50 microgramos de estradiol transdérmico y 100 milígramos de progesterona oral) y no lo reciben 36 de ellas. Se realiza al inicio del estudio y a los 6 meses exploración física (peso, talla, índice cintura/cadera) y determinaciones analíticas (bioquímica general, estrógenos, homocisteína, cobre, fibrinógeno y proteína C reactiva). Al grupo control sólo se le realizan las exploraciones iniciales. Resultados: Los subgrupos de mujeres postmenopáusicas según reciban o no tratamiento hormonal, presentan al inicio del estudio niveles de estradiol inferiores al grupo control (10±3,99; 12±4,56 vs. 83±78,47 mg/l, p<0,0001) mientras que los niveles de colesterol total (236±33,7; 228±32,8 vs. 198±30,2 mg/dl, p<0,002), LDL-colesterol (151±34,2; 144±31,5 vs. 120±25 mg/dl, p<0,02), ácido úrico (4,6±1; 4,8±1 vs. 3,98±0,5mg/dl, p<0,04) y homocisteína (13±3,1; 11±1,7 vs. 9,8±3,3 mmol/l; p<0,02) son más elevados. En el subgrupo que recibe tratamiento hormonal, a los 6 meses del mismo, disminuye significativamente el índice cintura/cadera (0,83±0,05 vs. 0,82±0,06; p<0,03), los niveles de glucemia (85±14,3 vs. 78±15,4 mg/dl, p<0,03), colesterol total (236±33,7 vs. 215±33,2 mg/dl, p<0,03), triglicéridos (106±47 vs. 90±30,1mg/dl, p<0,003) y calcio (9,5±0,4 vs. 9,4±0,4 mg/dl, p<0,0005), y aumentan los de estrógenos (10±3,99 vs. 49±34,43 mg/l, p<0,0001) y de PCR (0,11±0,06 vs. 0,24±0,12 mg/l, p<0,05). Conclusión: El tratamiento hormonal sustitutivo parece mejorar el perfil aterogénico de la mujer postmenopáusica. PALABRAS CLAVE: Menopausia. Riesgo cardiovascular. Tratamiento hormonal sustitutivo. | ABSTRACT Objective: Postmenopausal women have higher risk of cardiovascular events compared with premenopausal. The aim of this clinical study was to evaluate the effect of hormone replacement therapy (HRT) on the atherogenic profile in apparently healthy postmenopausal women. Method: The subjects were 76 healthy postmenopausal women, aged 45 to 59 years, and 15 premenopausal women with regular cycles, aged 40 to 45 years. 63 postmenopausal women completed the study. None of the participating women had a history of hypertension, diabetes mellitus or medications known to affect the cardiovascular system. Twenty seven postmenopausal women received daily 50 micrograms of transdermal estradiol and 100 milligrams of oral progesterone. Thirty six dit not receive HRT. Checkups were preformed at baseline and after six months of treatment, except the group of premenopausal women (only at baseline). Examinations consisted in measurement of body weight, length, waist/hip ratio and plasma levels of biochemical parameters. Results: Estradiol levels were higher among premenopausal women than among treated and non-treated postmenopausal women (83±78.47 versus 10±3.99; 12±4.56 mg/l, p<0.0001). Levels of serum cholesterol (198±30.2 versus 236±33.7; 228±32.8 mg/dl; p<0.002), LDL-cholesterol (120±25 versus 151±34.2; 144±31.5 mg/dl, p<0.02), uric acid (3.98±0.5 versus 4.6±1; 4.8±1 mg/dl, p<0.004) and homocysteine (9.8±3.3 versus 13±3.1; 11±1.7 mmol/l, p<0.02) were higher among postmenopausal women than among premenopausal women. The treated women showed higher levels of serum estradiol (49±34.43 versus 10±3.99, p<0.0001) and CRP (0.11±0.06 vs. 0.24±0.12 mg/l, p<0.05), lower waist/hip ratio (0.82±0.06 versus 0.83±0.05, p<0.03), glucose (78±15.4 versus 85±14.3 mg/dl, p<0.03), cholesterol (215±33.2 versus 236±33.7 mg/dl, p<0.03), triglicerides (90±30.1 versus 106±47 mg/dl, p<0.003) and calcium (9.4±0.4 versus 9.5±0.4 mg/dl, p<0.0005) than postmenopausal women without hormone replacement. Conclusion: That HRT may have a favourable effect on atherogenic profile in apparently healthy postmenopausal women. KEY WORDS: Menopause. Cardiovascular risk. Hormone replacement therapy. |
Alfonso Cano C, Vez García MD, García Urruticoechea P, Tornel Osorio PL, Canteras Jordana M, Abellán Alemán J. Influencia del tratamiento hormonal sustitutivo en el perfil aterogénico de la mujer postmenopáusica. An Med Interna (Madrid) 2003; 20: 70-74.
Trabajo aceptado: 29 de octubre de 2002
Correspondencia: José Abellán Alemán. Centro de Salud Docente de San Andrés. C/ Escultor Sánchez Lozano nº 7, 30005 Murcia. joseabellan@ono.com
INTRODUCCIÓN
En los países industrializados la enfermedad cardiovascular es la primera causa de morbimortalidad en mujeres mayores de 50 años (1). Los cambios hormonales que conducen a la menopausia favorecen la aparición de diversos factores de riesgo cardiovascular: perfil lipídico aterogénico, obesidad, resistencia a la insulina, HTA e hipercoagulabilidad. Las observaciones que permiten fundamentar este hecho son las siguientes: 1) En las mujeres con menopausia precoz (quirúrgica o natural) la enfermedad cardiovascular aparece a edad más temprana. 2) La incidencia y mortalidad por enfermedad coronaria en la mujer es menor que en el hombre por debajo de los 50 años y a partir de esta edad tiende a aumentar hasta aproximarse a la del varón hacia la séptima década de la vida (2). 3) El tratamiento con estrógenos puede reducir el riesgo coronario un 50% (3).
La mejoría en el perfil lipídico producida por los estrógenos explicaría sólo el 25-50% de la disminución de acontecimientos cardiovasculares, lo que sugiere la existencia de otros mecanismos implicados. Se sabe que además de actuar sobre el metabolismo intermediario, los estrógenos ejercen un efecto directo sobre la pared arterial ya que favorecen la inhibición de la formación de la placa de ateroma y además ayudan a controlar el flujo vascular. El efecto antiaterogénico se debe a la disminución del LDL-colesterol, al aumento del HDL-colesterol, a la disminución de la formación de células espumosas ya que previenen la oxidación de las LDL y aumentan la degradación de las LDL oxidadas, a la disminución de la proliferación de células musculares lisas y a la inhibición de la agregación plaquetaria. El efecto vasodilatador lo ejercen por activación o estabilización del óxido nítrico, aumento de prostaciclinas, bloqueo de la acción vasoconstrictora de la endotelina-1, aumento de la conductancia del potasio y por poseer un efecto calcioantagonista.
Los efectos del tratamiento hormonal sustitutivo (THS) van a depender de la dosis, tipo de estrógeno y vía de administración. La vía oral debido al "primer paso hepático" ejerce una acción más beneficiosa sobre los lípidos y los marcadores de riesgo arterial que la vía transdérmica pero también puede estimular la formación de angiotensinógeno y aumentar los marcadores de enfermedad trombótica venosa. La adición de progestágenos, imprescindible en mujeres no histerectomizadas para prevenir el carcinoma de endometrio, no parece modificar los efectos beneficiosos de los estrógenos.
Para contribuir a aclarar estos puntos se diseña el presente trabajo cuyos objetivos son comparar el perfil aterogénico de las mujeres postmenopáusicas respecto a las mujeres premenopáusicas y valorar la influencia del THS sobre el perfil aterogénico de las mujeres postmenopáusicas.
MATERIAL Y MÉTODOS
--Pacientes: se ha diseñado un estudio prospectivo observacional para el que se han seleccionado 76 mujeres con menopausia natural, de 45 a 59 años de edad, con una amenorrea de 1 a 6 años de evolución, normotensas que no habían recibido previamente THS ni fármacos con efecto sobre el sistema cardiovascular y con un IMC<32 kg/m2. Se han excluido las mujeres con diabetes mellitus (DM) y otras enfermedades crónicas. Se ha seleccionado además un grupo de 15 mujeres sanas con ciclos menstruales regulares, de 40 a 45 años como grupo control.
Concluyen el estudio 63 mujeres postmenopáusicas y 15 premenopáusicas (grupo control). Han abandonado el estudio 13 mujeres postmenopáusicas: 9 por iniciativa propia y 4 por enfermedades intercurrentes. Las mujeres postmenopáusicas se dividen en dos grupos según reciban THS (27 mujeres) o no lo reciban THS (36 mujeres). Se incluyen en el grupo de tratamiento las mujeres que así lo deciden tras ser informadas de las características del mismo.
Al grupo postmenopáusico se le realiza al inicio y a los 6 meses una exploración física completa, determinaciones analíticas (bioquímica general, estrógenos, homocisteína, cobre, fibrinógeno y proteína C reactiva). Al grupo de mujeres fértiles sólo se le realizan las exploraciones iniciales.
El THS, si no existen contraindicaciones, se administra en pauta combinada continua: Parches de estradiol tipo "matrix" de 50 mg/día 2 veces por semana y progesterona oral micronizada 100 mg/día.
--Determinaciones de Laboratorio: las determinaciones séricas de glucosa, colesterol, triglicéridos, HDL-colesterol, Apolipoproteína B (Apo B), Lipoproteína a (Lp(a)), calcio, creatinina, ácido úrico y proteína C reactiva (PCR) fueron realizadas en un modular D+P fabricado por Hitachi, con reactivos de Roche Diagnostic. LDL-colesterol fue calculado utilizando la fórmula de Friedelwald. La homocisteína plasmática se determinó en un Imx System, con reactivos de Abbott Diagnostics. El estradiol sérico se midió en un Elecsys 2010 fabricado por Hitachi, con reactivos de Roche Diagnostic. El fibrinógeno plasmático se determinó en un CA-1500 de Sysmex, con reactivos de la casa Dade-Behring. El cobre sérico se midió por absorción atómica en un Perking-Elmer 5100 PC Atomic Absortion Spectrophotometer, fabricado por Perkin-Elmer.
--Análisis estadístico: se ha realizado una estadística descriptiva de cada una de las variables obteniéndose la distribución de frecuencias y los parámetros característicos: media, desviación típica, error de la media y coeficiente de variación. La comparación entre grupos se ha realizado con un análisis de varianza complementado con contrastes de igualdad de pares de medias con el procedimiento LSD (mínima diferencia significativa). La influencia de factores en el efecto del tratamiento se ha probado mediante análisis de varianza de medidas repetidas de acuerdo con un diseño factorial-jerarquizado donde el factor "pacientes" anida sus niveles entre los niveles de los factores sofocos y tratamiento hormonal.
RESULTADOS
Las características de la muestra (edad, el tiempo de amenorrea, índice cintura/ cadera y el índice de masa corporal) quedan reflejadas en la tabla I.
No se observan diferencias significativas (NS) entre los valores basales del índice cintura/cadera (ICC) y del índice de masa corporal (IMC) de las mujeres postmenopáusicas respecto a la premenopausia o grupo control (GC). Después del THS disminuye significativamente el ICC (p<0,03) y no se detectan diferencias en el IMC. En los grupos que no reciben THS no se observan diferencias significativas entre los valores basales y finales del ICC ni del IMC.
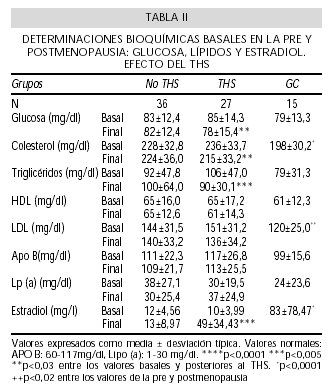
Las tablas II y III reflejan los resultados de las determinaciones de laboratorio. En los valores basales obtenidos en las mujeres postmenopáusicas respecto a las mujeres premenopáusicas se observan niveles de estradiol (p<0,0001), colesterol total (p<0,002), LDL-colesterol (p<0,02), ácido úrico (p<0,04) y homocisteína (p<0,02) significativamente superiores, mientras que no se aprecian diferencias en el resto de variables.
Después del THS se observa que disminuye significativamente la glucemia (p<0,03), el colesterol total (p<0,03), los triglicéridos (p<0,003) y el calcio (p<0,005) y aumentan significativamente los niveles de estrógenos (p<0,0001) y de PCR (p<0,05). En los grupos que no reciben THS no se observan diferencias entre las determinaciones basales y finales.
DISCUSIÓN
Se comprueba un aumento significativo de los estrógenos en el grupo que recibe THS excepto en 4 mujeres que se excluyeron del estudio una vez confirmada la hipoestrogenemia y descartada la falta de cumplimiento terapéutico. La deficiente absorción de los estrógenos transdérmicos en algunas mujeres está avalado por otros estudios: Rohr y cols. (4) y Jarvinen y cols. (5). Se deduce de esto la importancia que tiene la determinación de los niveles estrogénicos, una vez iniciada la terapia, para cerciorarnos de que obtenemos unos niveles hormonales adecuados.
La glucemia se ha reducido significativamente después del THS. Existen estudios que encuentran resultados contradictorios respecto a la insulinemia y la glucemia con THS (6,7). Tras la menopausia se observa una tendencia a incrementar la adiposidad abdominal y visceral unido a un aumento de la resistencia a la insulina que según algunos autores puede revertir con THS (8,9). En este estudio aunque el peso y el IMC se han mantenido estables, el IC/C después del THS se ha reducido significativamente lo que sugiere una favorable redistribución de la grasa corporal (tipo ginoide) con la consiguiente repercusión en la sensibilidad a la insulina y disminución del riesgo cardiovascular. En concordancia con nuestros resultados, en otros estudios como el PEPI y el NHANES III se observan reducciones de glucemia basal con THS transdérmico (10-13), aunque existe un retardo del aclaramiento de la glucosa tras sobrecarga oral.
La mayoría de estudios obtienen con THS una mejoría en el perfil lipídico. Los estrógenos disminuyen el colesterol total y el LDL (aumentan su depuración y posiblemente frenen la síntesis endógena de colesterol), aumentan el HDL, y la acción sobre los triglicéridos depende de la vía de administración ya que por vía oral aumenta sus niveles y por vía transdérmica los pueden disminuir. Los resultados que hemos obtenido en este trabajo sobre los lípidos (descenso no significativo del LDL, descenso significativo de triglicéridos y no modificación del HDL) se explican porque la vía transdérmica ejerce un efecto más suave sobre el LDL, puede aumentar levemente o no modificar el HDL y puede disminuir los triglicéridos ya que al evitar el primer paso hepático no se estimula la síntesis de proteínas incluyendo las lipoproteínas VLDL y HDL. Es probable que la disminución del LDL hubiera alcanzado significación estadística con una muestra más amplia.
La Lp(a) está marcada por factores genéticos y existe una gran dispersión en sus valores. Se han encontrado reducciones en sus niveles con THS en algunos estudios (14-17) así como en los estudios PEPI (18) y HERS (19). Otros autores han obtenido disminuciones en los niveles de Lp(a) de aproximadamente un 50% con el progestágeno noretisterona (20). La vía oral es mas eficaz que la vía transdérmica (21). Existen también trabajos en los que no han observado modificaciones en sus niveles (22,23). El motivo de no haber encontrado reducciones de Lp (a) en el presente estudio puede deberse a la menor influencia que la vía transdérmica y la progesterona natural ejercen sobre esta lipoproteína.
El fibrinógeno es un marcador de riesgo independiente de cardiopatía isquémica y factor de riesgo para accidente cerebrovascular. Aumenta con la edad y se ve influenciado por el estilo de vida ya que disminuye con el ejercicio y la ingesta moderada de alcohol y aumenta con el tabaco y aumento de peso (8-12 mg/dl por cada 5 kg/m2). La mujer tiene valores más elevados que el hombre para la misma edad. Los anticonceptivos orales y la menopausia se asocian con niveles de fibrinógeno más altos y el THS los desciende (estudio PEPI (24)). La vía oral es más eficaz que la vía transdérmica (25-27) aunque hay estudios que detectan descensos de fibrinógeno tanto con terapia oral como transdérmica (28). Los progestágenos pueden amortiguar el efecto de los estrógenos. En este estudio los niveles de fibrinógeno de las mujeres postmenopáusicas son similares entre los distintos grupos a pesar de existir distinta proporción de fumadoras. Probablemente esto se debe a que el tamaño de la muestra no es suficiente para observar la relación existente entre tabaco y fibrinógeno. No haber obtenido reducción de fibrinógeno después de THS puede deberse a haber utilizado la vía transdérmica.
La homocisteína es un factor de riesgo cardiovascular independiente que puede favorecer la aparición de arterioesclerosis y trombosis. Procede del metabolismo de la metionina, aminoácido esencial, en el que intervienen la vitamina B6, B12 y ácido fólico. Deficiencias en estas vitaminas pueden ocasionar acúmulo de homocisteína en las células. La homocisteinemia es menor en la mujer premenopáusica que en el hombre para el mismo rango de edad y después de la menopausia aumenta hasta alcanzar niveles similares al hombre. Aumenta con la edad en ambos sexos. Influyen en su regulación factores genéticos y el estilo de vida ya que el tabaquismo, el sedentarismo y el café aumentan moderadamente sus niveles. Los estrógenos, la tiroxina, la insulina y el cortisol los disminuyen. La disminución de la homocisteinemia por E exógenos se ha demostrado en la cohorte "NHANES III" (29) y en otros trabajos con distintas pautas de THS del 10-15% (30-32) que incluso puede alcanzar el 20-25% (33,34) en mujeres que parten de niveles basales más elevados. El grupo de trabajo PEPI observa reducciones de homocisteína leves y transitorias después de THS (35) y en contraposición a éstos resultados, otros trabajos no obtienen variaciones en los niveles de homocisteína con THS oral o transdérmico (36,37). En nuestro estudio, la homocisteína basal de las mujeres premenopáusicas es significativamente inferior que en las mujeres postmenopáusicas y no haber encontrado disminución después del THS puede deberse a que las concentraciones de homocisteína encontradas están dentro de límites normales, al tamaño de la muestra o a que la vía transdérmica tiene un efecto más discreto que la vía oral.
La proteína C reactiva (PCR) es un FRCV independiente para la aparición de eventos cardiovasculares tanto en pacientes sanos como en los que presentan enfermedad cardiovascular y no hay acuerdo respecto a si el aumento de sus niveles es causa, consecuencia o hallazgo casual de arterioesclerosis. En el estudio CARE se ha observado una disminución de la PCR con estatinas y otros trabajos sugieren que la aspirina ejerce mayor efecto beneficioso en aquellos pacientes con niveles de PCR basal más elevados.
Con la administración de THS se ha evidenciado un rápido aumento de los niveles séricos de PCR, tanto en estudios transversales (38,39) como en estudios de intervención (40,41), aunque existen diferencias dependiendo de la vía de administración. Por vía oral se observa un aumento tanto si se administran los estrógenos solos como si se administran en combinación con progestágenos. Sin embargo, cuando la administración se realiza por vía transdérmica no se observan cambios (42,43).
El rápido incremento de la concentración de PCR se correlaciona con el posible aumento en el riesgo cardiovascular que se observa al inicio del THS en el estudio de prevención secundaria HERS (19). Se ha descrito recientemente que el tratamiento con estatinas atenúa este aumento de PCR (44).
En nuestro estudio, el aumento de PCR observado en el grupo que recibe THS frente al que no es tratado no se corresponde con los resultados de los trabajos publicados. Pensamos que esto puede deberse a que el número de pacientes estudiadas es inferior a los referidos en la bibliografía.
En conclusión se cmprueba que con el climaterio el perfil aterogénico de la mujer empeora. Se advierte una ligera mejoría en dicho perfil con la terapia hormonal sustitutiva, pese debido al escaso tiempo de observación.
Bibliografía
1. Banegas JR, Villar F, Martín JM, Rodríguez-Artalejo F, González J. Relevancia de la mortalidad por enfermedades del aparato cardiocirculatorio en España. Rev Clin Esp 1992; 190: 321-7. [ Links ]
2. Heller RF. Coronary heart disease in relation to age, sex and the menopause. Br Med J 1987; 1: 472-4. [ Links ]
3. Stampfer MJ, Colditz GA. Estrogen replacement therapy and coronary heart disease: a quantitative assessment of the epidemiologic evidence. Prev Med 1991; 20: 47-63. [ Links ]
4. Rohr UD, Nauert C, Stehle B. Beta-estradiol delivered by three different matrix patches 50 microg/day. Maturitas 1999; 33: 45-58. [ Links ]
5. Jarvinen A, Nykanen S, Paasiniemi L. Absorption and bioavilability of oestradiol from a gel, a patch and a tablet. Maturitas 1999; 32: 103-13. [ Links ]
6. Luotola H, Pyorälä T, Loikkannen M. Effects of natural oestrogen/progestogen substitution therapy on carbohidrate metabolism postmenopausal women. Maturitas 1986; 8: 243-53. [ Links ]
7. Brussaard HE, Gevers Leuven JA, Frolich M, Kluft C, Krans HM. Short-term oestrogen replacement therapy improves insulin resistance, lipids and fibrinolysis in postmenopausal women with NIDDM. Diabetologia 1997; 407: 843-9. [ Links ]
8. Chmouliovsky L, Habicht F, James RW, Lehmann T, Campana A, Golay A. Beneficial effect of hormone replacement therapy on weight loss in obese menopausal women. Maturitas 1999; 32: 147-53. [ Links ]
9. Fonseca E, Ochoa R, Galvan R, Hernández M, Mercado M, Zarate A. Increased serum levels of growth hormone and insulin-like grow factor-I associated with simultaneous decrease of circulating insulin of postmenopausal women reiciving hormone replacement therapy. Menopause 1999; 6: 56-60. [ Links ]
10. Stevenson JC, Crook D, Godsland IF, Lees B, Whitehead MI. Oral versus transdermal hormonal replacement therapy. Int J Fertil Menop S 1993; 38: 30-5. [ Links ]
11. Cagnacci A, Tuveri F, Cirilo R, Setteneri AH, Melis GB, Volpe A. The effect of transdermal 17b-estradiol on glucose metabolism of postmenopausal women is evident during the oral but not the intravenous glucose administration. Maturitas 1997; 28: 163-7. [ Links ]
12. Espeland MA, Hogan PE, Fineberg SE, Howard G, Schrott H, Waclawiw MA, et al. Effect of postmenopausal hormone therapy on glucose and insulin concentrations. PEPI investigators. Diabetes Care 1998; 21: 1589-95. [ Links ]
13. Triusu RJ, Cowie CC, Harris MI. Hormone replacement therapy and glucose metabolism. Obstet Gynecol 2000; 96 :665-70. [ Links ]
14. Soma M, Fumagalli R, Paoletti R, Meschia M, Carena Maini M, Crosignani P, et al. Plasma Lp(a) concentration after oestrogen and progestogen in postmenopausal women. Lancet 1991; 337: 612. [ Links ]
15. Nabulsi AA, Folsom AR, White A, Patsch W, Heiss G, Wu KK, et al. Association of hormone replacement therapy with various cardiovascular risk factors in postmenopausal women. N Engl J Med 1993; 328: 1069-75. [ Links ]
16. Van der Mooren MJ, Demacker PNM, Thomas CMG, Rolland R. Beneficial effect on serum lipoproteins by 17-oestradiol-dydrogesterone therapy in postmenopausal women: a prospective study. Eur J Obstet Gynecol Reprod Biol 1992; 47: 143-60. [ Links ]
17. Marsh MS, Crook D, Ellerington MC, Whittecroft SI, Whitehead MI, Stevenson JC. Effect of continuous combined estrogen replacement therapy on serum lipids and lipoproteins. Obstet Gynecol 1994; 83: 19-23. [ Links ]
18. Espeland MA, Marcovina SM, Miller V, Wood PD, Wasilauskas C, Shervin R, et al. Effect of postmenopausal hormone therapy on lipoprotein (a) concentration. PEPI Investigators. Circulation 1998; 97: 979-86. [ Links ]
19. Hulley S, Grady D, Bush T, Furberg C, Herrington D, Riggs B, et al. Randomized trial of estrogen plus progestin for secundary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS). JAMA 1998; 280: 605-13. [ Links ]
20. Farish E, Rolton HA, Barnes JF. Lipoprotein (a) concentrations in postmenopausal women taking norethisterona. Br Med J 1991; 303: 694. [ Links ]
21. Seed M, Sands RH, McLaren M, Kirk G, Darko D. The effect of hormone replacement therapy and route of administration on selected cardiovascular risk factors in postmenopausal women. Fam Pract 2000; 17: 497-507. [ Links ]
22. Owens D, Collins PB, Johnson A, Tomkin GH. Lipoproteins and low-dose estradiol replacement therapy in postmenopausal type 2 diabetic patients: the effect of addition of norethisterone acetate. Diabet Med 2000; 17: 308-15. [ Links ]
23. Cubrillo-Turek M, Stavljenic-Rukavina A, Reiner Z, Zrinski R. Plasma lipids, lipoprotein (a), apolipoproteins and hemostatic risk factors distributions in postmenopausal women. Acta Med Croatica 1999; 53: 61-6. [ Links ]
24. The menopausal Estrogen/Progestin Intervention trial (PEPI). Effects of estrogen/progesteron regimens on heart disease risk factors in postmenopausal women. JAMA 1995; 273: 199-208. [ Links ]
25. Hoibraaten E, Os I, Seljeflot I, Andersen TO, Hofstad A, Sandset PM. The effects of THS on hemostatic variables in women with angiographically coronary artery disease: results from the estrogen in women with artherosclerosis study. Thromb Res 2000; 98: 19-27. [ Links ]
26. Stachowcak G, Owizarak D, Polec I, Pertynski T, Jedrzejczyk S. The influence the hormone replacement therapy containing transdermal 17b-estradiol and medroxyprogesterone acetate on coagulation and fibrinolysis. Ginecol Pol 1999; 70: 527-33. [ Links ]
27. Meilahan EN, Cauley JA, Tracy RP, Macy ED, Gutai JP, Kuller LH. Association of sex hormones and adiposity with plasma levels of fibrinogen and PAI-1 in postmenopausal women. Am J Epidemiol 1996; 143: 159-66. [ Links ]
28. Kroon UB, Tengborn L, Rita H, Backstrom AC. The effects of transdermal oestradiol and oral progestogens on haemostasis variables. Br J Obstet Gynecol 1997; 104 Supl. 16: 32-7. [ Links ]
29. Morris MS, Jacques PF, Selhub J, Rosenberg IH. Total homocysteine and estrogen indicators in the Third National and Nutrition Examination Survey. Am J Epidemiol 2000; 152: 140-8. [ Links ]
30. Mijatovic V, Kenemans P, Jacobs C, Van Baal WM, Peters-Muller ERA, Van der Mooren MJ. A randomised controlled study of the effects of 17b-oestradiol-dydrogesterone on plasma homocysteine in postmenopausal women. Obstet Gynecol 1998; 91: 432-6. [ Links ]
31. Mijatovic N, Netelenbos JC, Van de Mooren MJ, de Valke-de Roo G, Jakobs C, Kenemans P. Randomiced, double-blind, placebo-controlled study of the effects of raloxifene and conjugated equine estrogen on plasma homocysteine in healthy postmenopausal women. Fertil Steril 1998; 70: 1085-9. [ Links ]
32. Van Baal WM, Smolders RG, Van der Mooren MJ, Teerlink T, Kenemans P. Hormone replacement therapy and plasma homocysteine levels. Obstet Gynecol 1999; 94: 485-91. [ Links ]
33. Van der Mooren MJ, Mijatovich V, Van Vaal WM, Stehouver CDA. Hormone replacement therapy in postmenopausal women with specific risk factors for coronary artery disease. Maturitas 1998; 30: 27-36. [ Links ]
34. Van der Mooren MJ, Wouters MG, Blom HJ, Schellekens LA, Eskes TK, Rolland R. Hormone replacement therapy may reduce high serum homocysteine in postmenopausal women. Eur J Clin Invest 1994; 24: 733-6. [ Links ]
35. Barnabei VM, Phillips TM, Hsia J. Plasma homocysteine in women taking hormone replacement therapy: the Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial. J Womens Health Gend Based Med 1999; 8: 1167-72. [ Links ]
36. Evio S, Tiitinen A, Turpeinen U, Ylikorkala O. Failure of the combination of sequential oral and transdermal estradiol plusnorethisterone acetate to affect plasma homocysteine levels. Fertil Steril 2000; 74: 1080-3. [ Links ]
37. Berger PB, Herrmann RR, Dumesic DA. The effect of estrogen replacement therapy on total plasma homocysteine in healthy postmenopausal women. Mayo Clin Proc 2000; 75: 18-23. [ Links ]
38. Cushman M, Meilhan EN,Psaty BM, et al. Hormone replacement therapy, inflammation and hemostasis in elderly women. Arterioscler Thromb Vasc Biol 1999; 19: 893-9. [ Links ]
39. Ridker PM, Hennekens CH, Rifai N, Buring JE, Manson JE. Hormone replacement therapy and increased plasma concentration of C-Reactive Protein. Circulation 1999; 100: 713-6. [ Links ]
40. Cushman M, Legault C, Barret-Connor E, Stefanick M, Kessler C, Judd H, et al. Effect of postmenopausal hormones on inflammation-sensitive proteins. The Postmenopausal Estrogen/Progestin Interventions (PEPI) Study. Circulation 1999; 100: 717-22. [ Links ]
41. Van Baal WM, Kenemans P, Van der Mooren MJ, et al. Increased CReactive Protein levels during short-term hormone replacement therapy in healthy postmenopausal women. Thromb Haemost 1998; 81: 925-8. [ Links ]
42. Vehkavaara S, Silveira A, Hakala-Ala-Pietila T, et al. Effects of oral and transdermal estrogen replacement therapy on markers of coagulation, fibrinilysis, inflammation and serum lipids and lipoproteins in postmenopausal women. Thromb Haemost 2001; 85: 619-25. [ Links ]
43. Lowe GD, Upton MN, Rumley A, et al. Different effects of oral and transdermal hormone replacement therapies on factor IX, APC resistance, t-PA, PAI and C-reactive protein. A cross-sectional population survey. Thomb Haemost 2001; 86: 550-6 [ Links ]
44. Koh KK, Schenke WH, Waclawiw MA, Csako G, Cannon RO 3rd. Statin attenuates increase in C-reactive protein during estrogen replacement therapy in postmenopausal women. Circulation 2002; 105: 1531-3. [ Links ]