Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Medicina Oral, Patología Oral y Cirugía Bucal (Ed. impresa)
versión impresa ISSN 1698-4447
Med. oral patol. oral cir. bucal (Ed.impr.) vol.10 no.4 ago./oct. 2005
Posibilidades diagnósticas de la Tomografía por Emisión de Positrones (PET):
Aplicaciones en la patología oncológica bucal y maxilofacial
The diagnostic possibilities of Positron Emission Tomography (PET)
Daniela Carranza Pelegrina (1), Francisco Lomeña Caballero (2), Marina Soler Peter (3), Leonardo Berini Aytés (4),
Cosme Gay Escoda (5)
(1) Licenciada en Odontología. Residente del Máster de Cirugía e Implantología Bucal. Facultad de Odontología de la Universidad de Barcelona
(2) Consultor del Servicio de Medicina Nuclear, Hospital Clínico y Provincial de Barcelona. Director de la Unidad PET de CETIR, Barcelona
(3) Especialista en Medicina Nuclear. Unidad PET de CETIR, Barcelona.
(4) Profesor Titular de Patología Quirúrgica Bucal y Maxilofacial. Profesor del Máster de Cirugía e Implantología Bucal.
Facultad de Odontología de la Universidad de Barcelona
(5) Catedrático de Patología Quirúrgica Bucal y Maxilofacial. Director del Máster de Cirugía e Implantología Bucal. Facultad de Odontología de la Universidad de Barcelona. Servicio de Cirugía Bucal, Implantología Bucofacial y Cirugía Maxilofacial. Centro Médico Teknon. Barcelona
Correspondencia:
Prof. Dr. Cosme Gay Escoda
Centro Médico Teknon
C/ Vilana,12
08022 Barcelona
e-mail: cgay@ub.edu
Recibido: 24-12-2003 Aceptado: 12-03-2005
| Carranza-Pelegrina D, Lomeña-Caballero F, Soler-Peter M,Berini-Aytés L, Gay-Escoda C. The diagnostic possibilities of positron emissiontomography (PET). Med Oral Patol Oral Cir Bucal 2005;10:331-42. |
| RESUMEN Se describen los principios de la tomografía por emisión de positrones (PET) como procedimiento diagnóstico de reciente introducción en el campo de las Ciencias de la Salud. Las aplicaciones clínicas principales se dan en un grupo concreto de especialidades: la cardiología, neurología, psiquiatría y sobre todo la oncología. Palabras clave: Tomografía por emisión de positrones, neoplasias de cabeza y cuello, diagnóstico por la imagen. | SUMMARY The principles of positron emission tomography (PET), recently introduced as a diagnostic procedure into the health sciences, are described. The principle clinical applications apply to a particular group of specialties: cardiology, neurology, psychiatry, and above all oncology. Key words: Positron emission tomography, head and neck neoplasia, imaging diagnosis. |
INTRODUCCIÓN
En las distintas áreas de las Ciencias de la Salud se han venido desarrollando nuevas estrategias diagnósticas y de seguimiento clínico de los pacientes, entre las que destacan la tomografía computadorizada de alta resolución (TCAR), la tomografía por resonancia magnética (RM) y la tomografía por emisión de positrones (PET). Esta última, ha generado un giro radical en el diagnóstico por la imagen introduciéndonos en el concepto de "imagen molecular"(1).
En España esta técnica fue introducida en 1995 por la Universidad Complutense de Madrid y en 1996 por la Clínica Universitaria de Navarra. En el momento de escribir este trabajo se cuenta con más de 15 unidades PET en funcionamiento en España.
Nuestro objetivo es realizar una revisión de la literatura publicada sobre las posibilidades diagnósticas de la PET en la Oncología Bucal. La elaboración de este trabajo se ha llevado a cabo mediante la búsqueda bibliográfica de lo publicado sobre el tema en libros y revistas de Medicina nuclear y Oncología. Las citas han sido seleccionadas mediante el programa informático de base de datos Medline. Todas las fuentes han sido consultadas en el período comprendido entre los años 1995-2003, a pesar de que en casos puntuales hemos buscado algún artículo más antiguo por si era necesaria la información que contenía.
PRINCIPIOS DE LA TOMOGRAFÍA POR EMISIÓN DE POSITRONES
La PET es una técnica de diagnóstico por la imagen no invasiva basada en la exploración de los órganos y sistemas a través de su metabolismo (mecanismos funcionales, enzimáticos, hormonales o farmacológicos) y que emplea imágenes de alta resolución.
Este método diagnóstico precisa de la administración de un trazador radiactivo al paciente. Este trazador es una sustancia marcada por un isótopo emisor de positrones, que, gracias a sus características físico-químicas, se concentrará en un tejido determinado. Existen actualmente una diversidad de radiofármacos que se utilizan como trazadores, como se puede observar en la tabla 1 (1, 2).
Estos radionúclidos se desintegran emitiendo positrones en un período de tiempo ultracorto (con un rango que va desde unos pocos minutos hasta horas), los cuales después de interaccionar con los electrones de los átomos que componen las moléculas tisulares, sufren posteriormente un proceso de aniquilación. Como consecuencia, se forman dos fotones de 511 Kev de energía de dirección casi coincidente y de sentido opuesto (1, 3, 4). Estos fotones interaccionan con dos detectores opuestos del tomógrafo. La reconstrucción tomográfica de las imágenes PET se consigue gracias a la captación de tal emisión, por medio de técnicas de coincidencia, las cuales son conocidas como colimación electrónica (1, 5).
Mediante las técnicas de retroproyección filtrada o de 3D, se pueden obtener imágenes representativas de la distribución espacial del radiofármaco en el interior del organismo. La resolución alcanzada depende del tomógrafo, pero suele oscilar entre 4-6 mm, obteniéndose imágenes de gran calidad (1). La PET permite por lo tanto detectar y cuantificar la distribución de un radionúclido emisor de positrones en el interior del organismo humano (1,2). (Tabla 1)
APLICACIONES DE LA TOMOGRAFÍA POR EMISIÓN DE POSITRONES
1. Aplicación en investigación
Una de las principales aplicaciones de la tomografía por emisión de positrones es la investigación biomédica en seres humanos, ya que gracias al empleo de trazadores radiactivos específicos, podemos cuantificar, "in vivo" y de forma muy precisa, distintos fenómenos de la fisiología celular. De esta manera, esta técnica de diagnóstico por la imagen puede medir muchas características biológicas de los tumores malignos como el consumo de glucosa, el consumo de diversos aminoácidos, la síntesis de DNA, el metabolismo proteico, el Ph, los receptores de membrana hormonales, la hipoxia, el efecto de la quimioterapia, la transferencia y expresión genéticas, la cinética de los fármacos citostáticos y la permeabilidad de la barrera hematoencefálica en los tumores cerebrales, entre otras (5-7).
La PET permite además, la obtención de imágenes de la farmacocinética y farmacodinamia de distintas drogas y fármacos. Pueden emplearse como radiotrazadores los mismos fármacos marcados con C11o F18, o bien puede medirse su efecto sobre el flujo sanguíneo, el metabolismo de la glucosa o la ocupación de los receptores específicos.
Esta técnica puede ser útil en el diseño y desarrollo de nuevos fármacos, aplicándose en los ensayos clínicos de las fases I y II de experimentación básica e incluso en las fases III y IV, ya en grandes series de seres humanos (5). La investigación completa experimental y clínica, tanto en animales como en humanos, exige la disponiblidad de un ciclotrón, un sistema tomográfico PET multicristal-multianillo y una cámara PET para animales de pequeño tamaño.
2. Aplicaciones clínicas
La neurología, psiquiatría, cardiología y, por último, la oncología son las principales especialidades médicas donde se encuentran las aplicaciones clínicas de la PET descritas en la literatura (1, 5).
En el campo de la Neurología, la PET permite el estudio diagnóstico de diversas patologías, ya que se trata de la forma más exacta de objetivar el metabolismo cerebral. Actualmente su aplicación básica radica en el estudio de la epilepsia refractaria al tratamiento farmacológico y en el diagnóstico de algunas demencias como la enfermedad de Alzheimer (1). En la patología cardíaca, los estudios PET son útiles en la valoración de la viabilidad miocárdica (1).
La aplicación de la tomografía por emisión de positrones en Oncología, se basa en que las células neoplásicas presentan un crecimiento anormal respecto a las células normales. Así, el metabolismo de los tejidos tumorales requiere un aporte de nutrientes superior al normal. (1, 2). La PET dispone de radiotrazadores análogos a las sustancias que participan en estos procesos fisiopatológicos.
Las indicaciones de la PET-FDG aceptadas por la agencia de evaluación norteamericana HCFA (Health Care Financing Agency) en Abril de 2001 se resumen en los siguientes puntos:
Diagnóstico diferencial del nódulo pulmonar solitario.
Diagnóstico de extensión en el cáncer de pulmón no microcítico.
Localización de recidivas con re-estadificación de linfomas.
Localización de recidivas con re-estadificación en cáncer de cabeza y cuello.
Localización de recidivas, con re-estadificación en cáncer colorectal.
Localización de recidivas, con re-estadificación en cáncer de esófago.
Localización de recidivas y re-evaluación de melanomas.
3. Radiotrazadores en Oncología
Existen a nuestra disposición una gran variedad de radiofármacos que basan su utilidad en el estudio de las propiedades biológicas propias de los tumores: C11, N13, O15 y F18. Estos radiotrazadores, al igual que sus análogos naturales, son elementos muy frecuentes en las moléculas orgánicas por lo que pueden sustituirlos (C11, N13, O15) o ser fácilmente intercambiados (átomos de hidrógeno por F18) (2). La mayor parte de los elementos radiactivos emisores de positrones se generan en aceleradores de partículas denominados ciclotrones. Una de las propiedades que poseen, es la de presentar un período de semidesintegración muy corto (O15, 2 minutos; N13, 10 minutos; C11, 20.4 minutos; F18, 110 minutos). Por ello, el empleo de trazadores marcados con O15, N13 y C11estará limitado exclusivamente a aquellas unidades PET con ciclotrón propio (1, 2).
La Fluordesoxiglucosa (18FDG) es el único trazador PET con aplicación clínica establecida. Esto es así debido a que su disponibilidad, estabilidad "in vitro" y período de semidesintegración del F18 (110 minutos), permiten su transporte en forma de monodosis, desde los centros con ciclotrón donde se genera, a otros centros donde disponen de un tomógrafo PET. Estas condiciones no se dan aún con ningún otro radiotrazador. Por tanto, la 18FDG es el único trazador que puede ser utilizado sin disponer de ciclotrón propio (1, 2, 5). La 18FDG permite obtener imágenes y cuantificar uno de los parámetros fisiológicos más interesantes en la célula tumoral como es el metabolismo glucolítico. Los avances de la radiofarmacia favorecerán la incorporación a la práctica clínica de nuevos trazadores con distintas características biológicas, que sean más sensibles y específicos en la detección de los diferentes tumores (2).
La captación de este radiofármaco depende, entre otros factores, de la histología del tumor. Una hipercaptación suele asociarse a una mayor expresión de GLUT-1, a una mayor actividad de las hexoquinasas y a la existencia de un gran número de células viables, características propias de un alto grado de diferenciación histológico (2).
Existen otros radiofármacos que pueden ser útiles en el estudio de los tumores como pueden ser los aminoácidos marcados. Entre ellos destacan la C11-L-metil-metionina y el ácido N-metil-C11-alfa- Metilaminoisobutírico (C11-MeAIB) de reciente introducción (2, 8).
4. Aplicación en Oncología de cabeza y cuello
Los tumores malignos de cabeza y cuello que incluyen los situados en la cavidad bucal constituyen el 5% de todos los cánceres del organismo siendo el carcinoma de células escamosas la neoplasia más frecuente de este territorio (95%). En el 99% de los casos los pacientes presentan tumores primarios visibles o palpables por lo que la técnica de biopsia mediante abordaje directo o endoscópico podría servir para obtener el diagnóstico de certeza (9).
Estas neoplasias pueden propagarse y diseminarse principalmente por vía linfática. La diseminación hacia los ganglios cervicales determinará el tipo de tratamiento y el pronóstico del paciente, por lo que es fundamental la estadificación tumoral. El 60% de los pacientes presentan adenopatías palpables en el momento del diagnóstico, aunque sólo el 40% son adenopatías metastásicas. Además, la supervivencia a los 5 años es mayor del 50% en ausencia de adenopatías metastásicas, pero se reduce al 30% si existe afectación ganglionar (9).
La PET puede utilizarse para hacer el diagnóstico de benignidad o malignidad de un tumor primitivo detectado por otras técnicas, establecer el diagnóstico de extensión previo al planteamiento terapéutico de una neoplasia conocida, diferenciar entre un tumor residual y los cambios producidos tras la cirugía, radio o quimioterapia, guiar una biopsia, localizar una recidiva sospechada clínicamente o por elevación de los marcadores tumorales, hacer un nuevo estudio de extensión o re-estadificación tras el diagnóstico de una recidiva, valorar de forma precoz la respuesta al tratamiento y buscar el tumor primitivo en un paciente con metástasis de origen desconocido (9-12).
En la fase de diagnóstico inicial (figura 1), como ya se ha comentado, la afectación linfática determinará el pronóstico y el plan de tratamiento más oportuno, que generalmente suele basarse en la cirugía de exéresis del tumor primario con o sin vaciamiento ganglionar cervical. En muchas ocasiones esta afectación es subclínica, no pudiéndose confirmar tras la aplicación de otras técnicas de diagnóstico por la imagen. La mayoría de los trabajos publicados demuestran la superioridad de la PET frente a la RM, TC, Ecografía y la palpación. La sensibilidad de la tomografía por emisión de positrones alcanza valores de 80-100% y la especificidad de 85-94% en esta aplicación, mientras que las demás técnicas ofrecen una sensibilidad de 65-88% y una especificidad de 40-85%. La PET-FDG permite detectar adenopatías de hasta 5mm. Se ha establecido que la PET tiene un valor predictivo negativo cercano al 100%, en el caso de que no exista captación ganglionar de FDG, lo cual podría permitir evitar numerosos vaciamientos ganglionares cervicales negativos. Las causas de falsos positivos se deben principalmente a la existencia de ganglios reactivos no tumorales y los falsos negativos se originan cuando existe una afectación parcial o microscópica del ganglio o cuando su tamaño es inferior a los 3mm. Aún así, debido al limitado porcentaje de casos con palpación negativa en que la PET determina la afectación linfática, es muy discutible la aplicación de dicha técnica en esta situación. Por otro lado, pueden darse casos de falsos negativos en pacientes con afectación ganglionar mínima, lo que hace que sea arriesgado obviar el vaciamiento ganglionar ante resultados negativos de la PET. Por ello, esta aplicación quedaría reservada para aquellos casos de alto riesgo de diseminación ganglionar regional o a distancia (12).
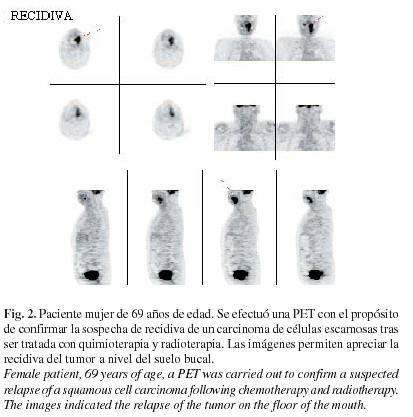
Otra de las indicaciones de la PET es la detección de recidivas (figura 2). Ante un signo de alarma ya sea clínico o analítico, la exploración no resulta fácil debido a la atrofia estructural y la fibrosis cicatricial que se produce tras la cirugía y la radioterapia.
La mayoría de las técnicas convencionales resultan ineficaces a la hora de distinguir entre lesión residual o recurrente y cambios, en cierta medida fisiológicos, observables después del tratamiento. Además, la biopsia, sobre todo cuando se efectúa a ciegas, podría no ser adecuada por no incidir sobre el tejido tumoral o bien por producir complicaciones (como por ejemplo la necrosis tisular) en un tejido, ya de por sí muy deteriorado. La PET-FDG detecta de manera muy precoz los focos de enfermedad cancerosa residual al demostrar un aumento del metabolismo glucolítico del tejido tumoral y diferenciarlo del tejido cicatricial, cuyo consumo de glucosa está disminuido (9). En estos casos la PET ofrece una sensibilidad de 85-100% y una especificidad de 82-100%, datos que demuestran su superioridad frente a las técnicas convencionales. También permite dirigir la biopsia eliminando los falsos negativos de la misma (12).
Como última indicación cabe destacar la capacidad de esta técnica de diagnóstico por la imagen para detectar el tumor primario en lesiones metastásicas de origen desconocido (figura 3). Muchas veces el primer signo de alarma procede de la aparición de una adenopatía cervical. Los distintos estudios de imagen (TC, RM) o la endoscopia no llegan a descubrir ni el 20% de los tumores primitivos que generalmente se localizan en la base lingual, el cavum o el pulmón.
El informe final de un proyecto de investigación subvencionado por la Agencia de Evaluación de Tecnología Sanitaria del Instituto de Salud Carlos III (Expediente 00/10028) expone una revisión sistemática y un metaanálisis sobre esta situación, dando como resultado que cuando todas las demás técnicas han fracasado, la PET es capaz todavía de detectar un 43% de los tumores primarios, lo que permite iniciar el tratamiento en ese momento (20). En la tabla 2 se presentan los valores de sensibilidad y especificidad de la PET-FDG aplicada en carcinomas de cabeza y cuello encontrados en la literatura.
VENTAJAS DE LA TOMOGRAFÍA POR EMISIÓN DE POSITRONES
La PET es una técnica de diagnóstico por la imagen que nos facilita información funcional sobre la perfusión y bioquímica tisular, a diferencia de otras técnicas como la TC o la RM que son modalidades diagnósticas basadas en el estudio de la morfología o la anatomía de los órganos (1, 5, 13-15).
Así, tanto la TC como la RM presentan un criterio para determinar la malignización de un tejido, que depende exclusivamente del análisis morfométrico. Por ello, presentan importantes limitaciones en cuanto al diagnóstico oncológico.
Las células neoplásicas presentan un consumo elevado de glucosa. De este modo, la masa tumoral presenta un aumento del metabolismo de glucosa comparativamente superior respecto al tejido sano (5, 13, 16, 17). El incremento de la actividad glucolítica de las células tumorales, se relaciona también con la proliferación celular y con el grado de malignidad. Este dato hace que las neoplasias sean candidatas ideales para la obtención de una imagen metabólica específica (1, 5, 18).
Dos características hacen posible que la PET sea una excelente herramienta diagnóstica en oncología: tiene una gran sensibilidad para detectar la hipercaptación de FDG en las lesiones tumorales, con un alto valor predictivo negativo y la segunda característica es que es posible explorar todo el cuerpo humano en el mismo acto exploratorio (2, 12). Esta última característica, permite diagnosticar metástasis a distancia que permanecen a menudo inadvertidas, como demuestran Teknos y cols.(14) en su trabajo, donde confirman la utilidad de la FDG-PET a la hora de estudiar los carcinomas de cabeza y cuello en estadios III y IV detectando metástasis ocultas, principalmente en los ganglios linfáticos mediastínicos.
También es posible la valoración precoz de la capacidad de la respuesta de un paciente a un tratamiento o bien contrariamente, si será necesario sustituir o complementar la terapéutica aplicada.
Las técnicas de diagnóstico por la imagen basadas en el análisis morfométrico de los tejidos, como puede ser el caso de la TCAR, presentan una especificidad y sensibilidad reducida para diferenciar entre la aparición de las habituales alteraciones tisulares postratamiento y las posibles recidivas, dando lugar a resultados falsos positivos o falsos negativos (4, 16, 18). Schechter y cols. (19) resaltan en su publicación el valor de la PET a la hora de contribuir a la diferenciación entre lesiones residuales o recidivas y los cambios tisulares propios del tratamiento antineoplásico.
Por su parte, los tejidos cicatriciales y necróticos no captan la FDG. La captación de FDG en los tejidos inflamados (neumonía, bronquitis, vasculitis, etc.) es inferior a la de las lesiones neoplásicas malignas. No obstante, se han descrito falsos positivos en inflamaciones, infecciones y granulomas (sarcoidosis, tuberculosis, histoplasmosis, aspergilosis, etc.) (2). En estos casos podría ser interesante la utilización de la C11-metionina como radiotrazador (2).
En general, se cree que la PET presenta un grado de especificidad y sensibilidad superior con respecto a otras técnicas de diagnóstico por imagen como la RM o la TC (20). Sin embargo, otros autores como McGuirt y cols.(21) consideran la PET, la RM y la TC, equivalentes en cuanto a su capacidad diagnóstica, aunque resaltan la superioridad de la PET frente al examen clínico.
De esta manera, la PET, utilizada apropiadamente durante el período postoperatorio, permitiría además, valorar la evolución y la posible curación tras el tratamiento radioterápico de los carcinomas de cabeza y cuello (22).
Numerosos autores (4, 16, 22) coinciden en la dificultad diagnóstica que existe para la detección de nódulos linfáticos metastásicos cervicales de carcinomas de células escamosas de las vías aerodigestivas superiores. La PET es una modalidad diagnóstica que podría ser de gran utilidad en la localización de actividad tumoral en zonas donde clínicamente esta actividad es aparentemente negativa. Muy frecuentemente estas metástasis permanecen ocultas e inaccesibles a la detección clínica. El riesgo de error en la detección de las mismas mediante diferentes técnicas diagnósticas ha sido evaluado por algunos autores (16); en concreto para la palpación sería de 20-28%, mientras que, para la TCAR se indican rangos entre 7,5-28% y para la RM del 16%.
INCONVENIENTES DE LA TOMOGRAFÍA POR EMISIÓN DE POSITRONES
Entre los inconvenientes de la PET deben destacarse dos muy importantes. Uno es la escasa disponibilidad de unidades PET en el territorio español. Por otra parte, resaltar su elevado coste económico; no obstante la relación coste/beneficio justifica este desembolso económico.
El poder de resolución es de aproximadamente 6mm en la visualización de la imagen, lo cual impide detectar la existencia de micrometástasis, lo que no deja de ser un cierto inconveniente.
Otra desventaja de la FDG-PET, es que al igual que la FDG se acumula en áreas tumorales de actividad metabólica intensa, también podría hacerlo en otras regiones del organismo que presentan la misma característica pero de manera fisiológica. Entre ellos podríamos nombrar: el tracto digestivo, la glándula tiroides, el músculo estriado, el miocardio, la médula ósea, el cerebro y el tracto genitourinario. El escáner PET/TCAR ha demostrado ser útil para diferenciar los acúmulos fisiológicos del radiofármaco frente a las hipercaptaciones que se producen como consecuencia de la existencia de lesiones malignas. En cabeza y cuello los acúmulos elevados de FDG pueden deberse a la hipercaptación normal de un músculo estriado como por ejemplo el músculo esternocleidomastoideo. Además debe instruirse al paciente para que no hable tras la administración del radiotrazador ya que esto favorecería su captación por los músculos laríngeos y podría confundirnos en la interpretación de la PET (23).
Goerres y cols. (24) valoran los artefactos que pueden aparecer en pacientes con sospecha de patología neoplásica o inflamatoria que son portadores de implantes dentarios, tras ser sometidos a la PET o a los sistemas híbridos PET/TCAR. El objetivo del estudio era evaluar la influencia de los implantes dentarios en la calidad de las imágenes PET comparando las imágenes no corregidas, las imágenes corregidas con atenuación mediante Germanio 68 (PET (Ge68)) y la PET/TCAR. Apreciaron una diferencia significativa en cuanto a la calidad de la imagen de los labios y la punta nasal, que aparecían más oscuras en las imágenes no corregidas respecto a las corregidas. En 33 pacientes se vieron artefactos en la TCAR y en 28 de ellos estos artefactos también eran valorables en las imágenes PET. La comparación directa entre PET (Ge68) y PET/TCAR demostró una diferencia en la aparición de artefactos en 3 de los 17 pacientes. Las lesiones malignas fueron igualmente visibles en cualquiera de los dos métodos de corrección. Su conclusión es que los implantes dentarios, prótesis fijas etc., pueden causar artefactos en las imágenes corregidas con atenuación tanto en la PET(Ge68) como en la PET/TCAR, por lo que recomiendan que estos pacientes sean evaluados mediante imágenes PET (24).
PERSPECTIVAS DE FUTURO
Las perspectivas de futuro nos llevan a los sistemas híbridos que combinan la PET y la TCAR. La fusión PET + TCAR ó PET + RM se realizaba hasta ahora de manera retrospectiva mediante un sistema de corregistro por software. La fusión de imágenes PET + TCAR es sumamente útil en oncología, ya que permite comprobar que el depósito patológico de un trazador, como la FDG, coincide con la masa o adenopatía aumentada de tamaño detectada por la TCAR. Esto facilitaría la toma de muestras y la guía de biopsias o, incluso, la planificación de la radioterapia. Los sistemas híbridos permiten someter al paciente a las dos pruebas durante la misma sesión exploratoria (2, 23).
BIBLIOGRAFÍA
1. Martí J. Tomógrafo emisor de positrones. En: Richter J, Martí J. PET Tomografía Molecular: fundamentos y aplicaciones. Madrid: Ediciones Eseuve; 1993. p. 15-38. [ Links ]
2. Gámez Cerezano C, Cabrera Villegas A, Sopena Monforte R, García Velloso M. La tomografía por emisión de positrones (PET) en oncología (Parte I). Rev Esp Med Nucl 2002;21:41-60. [ Links ]
3. Hemingway R, Wong W, Chevretton E, McGurk M. The use of positron emission tomography in the evaluation of orofacial malignancy disease. Br Dent J 1996;181:250-3. [ Links ]
4. Stuckensen T, Kóvacs A, Adams S, Baum R. Staging of the neck in patients with oral cavity squamous cell carcinoma: a prospective comparison of PET, ultrasound, CT and MRI. J Cranio Maxillofac Surg 2000;28:319-24. [ Links ]
5. Phelps M. PET: The merging of biology and imaging into molecular imaging. J Nucl Med 2000;41:661-81. [ Links ]
6. Fowler J, Volkow N, Wang G, Ding Y, Dewey S. PET and drug research development. J Nucl Med 1999;40:1154-63. [ Links ]
7. Hustinx R, Eck S, Alavi A. Potencial applications of PET imaging in developing. Novel cancer therapies. J Nucl Med 1999: 995-1002. [ Links ]
8. Sutinen E, Jyrkkio S, Alanen K, Nagren K, Minn H. Uptake of [ N-methyl -(11)C]alpha-methylaminoisobutyric acid in untreated head and neck cancer studied by PET. Eur J Nucl Med Mol Imaging 2003;30:72-7. [ Links ]
9. Cabrera Villegas A, García Velloso M, Gámez Cerezano C. Tomografía por emisión de positrones (PET) en oncología clínica (Parte III). Rev Esp Med Nuclear 2002;21:304-23. [ Links ]
10. Perie S, Montravers F, Kerrou K, Angelard B, Tassart M, Talbot JN et al. Fluorodeoxyglucose imaging using a coincidence gamma camera to detect head and neck squamous cell carcinoma and response to chemotherapy. Ann Otol Rhinol Laryngol 2002;111:763-71. [ Links ]
11. Kresnik E, Mikosch P, Gallowitsch HJ, Kogler D, Wiesser S, Heinisch M, et al. Evaluation of head and neck cancer with 18F-FDG PET: a comparison with conventional methods. Eur J Nucl Med 2001;28:816-21. [ Links ]
12. Gómez Muñoz J, López Martín J, Borrego Dorado I, Vázquez Albertino, Oliveras Moreno, García Perla A. Indicaciones de la Tomografía por emisión de positrones (PET) en cirugía maxilofacial. Rev Esp Cirug Oral y Maxilofac 2002;24:70-4. [ Links ]
13. Braams J, Pruim J, Kole A, Nikkels P, Vaalburg W, Vermey A. Detection of unknown primary head and neck tumors by positron emission tomography. Int J Oral Maxillofac Surg 1997;26:112-5. [ Links ]
14. Teknos TN, Rosenthal EL, Lee D, Taylor R, Marn CS. Positron emission tomography in the evaluation of stage III and IV head and neck cancer. Head Neck 2001;23:1056-60. [ Links ]
15. Klabbers BM, de Munck JC, Slotman BJ, Langendijk HA, de Bree R, Hoekstra OS, et al. Matching PET and CT scans of the head and neck area: development of method and validation. Med Phys 2002;29:2230-8. [ Links ]
16. Braams J, Pruim J, Freling N, Nikkels P, Roodenburg J. Detection of lymph node metastases of squamous-cell cancer of the head and neck with FDG-PET and MRI. J Nucl Med 1995;36:211-6. [ Links ]
17. Lowe V, Boyd J, Dunphy F, Kim H, Dunleavy T, Collins B, et al. Surveillance for recurrent head and neck cancer using positron emission tomography. J Clin Oncol 2000;18:651-8. [ Links ]
18. Kao C, ChangLai S, Chieng P, Yen R, Yen T. Detection of recurrent or persitent nasopharyngeal carcinomas after radiotherapy 18- fluoro-2-deoxyglucose positron emission tomography and comparison with computed tomography. J Clin Oncol 1998;16:3550-5. [ Links ]
19. Schechter NR, Gillenwater AM, Byers RM, Garden AS, Morrison WH, Nguyen LN, et al. Can positron emission tomography improve the quality of care for head-and-neck cancer patients? Int J Radiat Oncol Biol Phys 2001;51:4-9. [ Links ]
20. Anzai Y, Carroll W, Quint D, Bradford C, Minoshima S, Wolf G, et al. Recurrence of head and neck cancer after surgery or irradiation: prospective comparison of 2- deoxy-2 (F-18) fluoro-D- glucose PET and MRI imaging diagnoses. Radiol 1996;200:135-41. [ Links ]
21. Mc Guirt W, Greven K, Williams D, Keyes J, Watson N, Capellari J, et al. PET scanning in head and neck oncology: a review. Head Neck 1998;20:208-15. [ Links ]
22. Lapela M, Eigtved A, Jyrkiö S, Grénman R, Kurki T, Lindholm P. Experience in qualitative and quantitative FDG-PET in follow-up of patients with suspected recurrence from head and neck cancer. Eur J Cancer 2000; 6:858-67. [ Links ]
23. Kluetz P, Meltzer C, Villemagne V, Kinahan P, Chander S. Combined PET/CT imaging in Oncology: Impact on patient management. Clin Positron Imag 2000;3:223-30. [ Links ]
24. Goerres GW, Hany TF, Kamel E, von Schulthess GK, Buck A. Head and neck imaging with PET and PET/CT: artefacts from dental metallic implants. Eur J Nucl Med Mol Imaging 2002;29:367-70. [ Links ]
25. Farber LA, Benard F, Machtay M, Smith RJ, Weber RS, Weinstein GS, et al. Detection of recurrent head and neck squamous cell carcinomas after radiation therapy with 2-18F-fluoro-2-deoxy-D-glucose positron emission tomography. Laryngoscope 1999;109:970-5. [ Links ]
26. Stokkel MP, Terhaard CH, Hordijk GJ, van Rijk PP. The detection of unknown primary tumors in patients with cervical metastases by dual-head positron emission tomography. Oral Oncol 1999;35:390-4. [ Links ]
27. Wong RJ, Lin DT, Schoder H, Patel SG, Gonen M, Wolden S, et al. Diagnostic and prognostic value of [(18)F]fluorodeoxyglucose positron emission tomography for recurrent head and neck squamous cell carcinoma. J Clin Oncol 2002;20:4199-208. [ Links ]
28. Regelink G, Brouwer J, de Bree R, Pruim J, van der Laan BF, Vaalburg W, et al. Detection of unknown primary tumours and distant metastases in patients with cervical metastases: value of FDG-PET versus conventional modalities. Eur J Nucl Med Mol Imaging 2002;29:1024-30. [ Links ]
29. Wax MK, Myers LL, Gabalski EC, Husain S, Gona JM, Nabi H. Positron emission tomography in the evaluation of synchronous lung lesions in patients with untreated head and neck cancer. Arch Otolaryngol Head Neck Surg 2002;128:703-7. [ Links ]
30. Hannah A, Scott AM, Tochon-Danguy H, Chan JG, Akhurst T, Berlangieri S, et al. Evaluation of 18 F-fluorodeoxyglucose positron emission tomography and computed tomography with histopathologic correlation in the initial staging of head and neck cancer. Ann Surg 2002;236:208-17. [ Links ]











 texto en
texto en