My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.19 n.2 Madrid Mar./Apr. 2004
Original
Influencia de la formulación de la glutamina en sus efectos sobre los
sistemas antioxidantes y de destoxificación hepática en la rata
J. J. Ortiz de Urbina*, F. Jorquera**, J. Culebras***, C. Villares*, J. González-Gallego**** y M. J. Tuñón****
* Servicio de Farmacia. ** Servicio Digestivo y *** Servicio de Cirugía "Hospital de León". **** Departamento de
Fisiología, Universidad de León.
| Resumen Objetivos: El objeto de este estudio es valorar el efecto que la suplementación de dietas parenterales con L-glutamina o con L-alanil-L-glutamina ejerce sobre el equilibrio oxidante/antioxidante hepático y sobre los sistemas de destoxificación mediados por el citocromo P-450 en ratas. Material y métodos: Los animales (n = 60) se cateterizaron centralmente y se asignaron aleatoriamente a uno de los siguientes grupos: grupo control con alimentación oral e infusión i.v. de solución salina (C), grupo de nutrición parenteral total sin glutamina (NPT sin GLN), grupo de nutrición parenteral suplementada con glutamina (NPT GLN) y grupo de nutrición parenteral total suplementada con dipéptido alanina-glutamina (20 g/L) (NPT ALA-GLN). Las nutriciones parenterales eran isocalóricas e isonitrogenadas y las infusiones se administraron a una velocidad de infusión de 2 ml/h durante 5 días. Resultados: En los animales del grupo sin GLN disminuyó la concentración hepática de glutatión y los niveles de los productos de reacción del ácido tiobarbitúrico (TBARS) se incrementaron. Tanto la suplementación con glutamina como con alanina-glutamina normalizaron los niveles de glutatión pero sólo en el grupo del dipéptido disminuyeron los niveles de TBARS. Este efecto era paralelo a la recuperación parcial de las actividades enzimáticas antioxidantes analizadas. La concentración hepática del citocromo P-450, de las monooxigenasas dependientes del citocromo P-450 y el aclaramiento de antipirina no se modificaron por la suplementación de glutamina o de alanina-glutamina. Conclusiones: Nuestros datos sugieren una mayor protección de la suplementación con alanina-glutamina contra el daño producido por radicales libres durante la NPT y una ausencia de efectos tanto de la suplementación con glutamina como con alanina-glutamina sobre el metabolismo oxidativo hepático. (Nutr Hosp 2004, 19:73-82) Palabras clave: Nutrición parenteral. Alanina-glutamina. Glutamina. Estrés oxidativo. Antioxidantes y sistemas de destoxificación. Ratas.
| EFFECTS OF GLUTAMINE ON Abstract Goals: The goal of this study is to assess the effect that supplementing parenteral diets with L-glutamine or with L-alanyl-L-glutamine has on the balance of oxidants/antioxidants in the liver and on detoxification systems mediated by P-450 cytochrome in rats. Material and methods: Central catheters were inserted in the animals (n = 60) and they were randomly assigned to one of the following groups: a control group (C) with oral feeding and I.V. infusion of saline solution, a total parenteral nutrition group without glutamine (TPN without GLN), a parenteral nutrition group with glutamine supplement (TPN GLN), and a total parenteral nutrition group with a supplement of alanine-gluta-mine dipeptide (20 g/L) (TPN ALA-GLN). The parenteral nutrition provided was all isocaloric and isonitrogenated, and the infusions were administered at a speed of 2 ml/h over 5 days.Results: In the animals of the group without GLN, the liver concentration of glutathione was reduced while the levels of thiobarbituric acid reaction products (TBARS) increased. Supplementing with either glutamine or ala-nine-glutamine normalized the levels of glutathione but the TBARS levels only fell in the group with the dipeptide. This effect was parallel to the partial recovery of the antioxidant enzyme activities analyzed. The liver concentrations of P-450 cytochrome, P-450 cytochrome dependent mono-oxygenases and the clearance of antipyrine were not modified by the supplements of glutamine or alanine-glutamine. Conclusions: Our data suggest a greater protection by alanine-glutamine supplements against the injury produced by free radicals during TPN and the absence of any effect with either glutamine or alanine-gluta-mine supplements on the oxidative metabolism of the liver. (Nutr Hosp 2004, 19:73-82) Key words: Parenteral nutrition. Alanine-glutamine. Glutamine. Oxidative stress. Antioxidants and detoxification systems. Rats. |
Correspondencia: Juan José Ortiz de Urbina González.
Servicio de Farmacia. - Hospital de León.
Altos de Nava, s/n. - 24008 León.
e-mail: jortizu@medynet.com
Recibido: 15-V-2003.
Aceptado: 30-VII-2003.
Introducción
La glutamina aunque es un aminoácido considerado como no esencial, juega un papel fundamental en múltiples funciones metabólicas, actuando no sólo como precursor en la síntesis proteica, sino también como importante intermediario en numerosas vías metabólicas. Tanto en estudios experimentales como clínicos se ha demostrado que en situaciones de hipercatabolismo tales como la cirugía, el ayuno prolongado, las quemaduras e infecciones, se produce una deficiencia intracelular de glutamina junto con una elevada pérdida muscular y pulmonar del aminoácido y además lesiones del epitelio intestinal, comprobándose la existencia de una relación directa entre el contenido muscular de glutamina y la síntesis proteica. La suplementación con glutamina mejora el balance nitrogenado, aumenta la velocidad de síntesis proteica y preserva la integridad de la mucosa1. Por todo ello, parece lógico considerar que la utilización de este aminoácido en la nutrición clínica sea fundamental ya que el mantenimiento de sus concentraciones intracelulares promueve la conservación de la proteína muscular y mejora la regulación de la homeostasis amino-acídica2.
Además, se han puesto de manifiesto diversos efectos negativos cuando se produce una deficiencia en glutamina, por lo que parece adecuada la suplementación con glutamina en el marco de la nutrición clínica en pacientes malnutridos y estresados. La relación existente entre metabolismo oxidativo y la dieta o la reserva proteica corporal explica el interés del estudio de los efectos de la adición de glutamina a las dietas parenterales. Se ha demostrado que la nutrición parenteral total, tanto en animales de experimentación como en estudios clínicos, produce estrés oxidativo, con disminución en la actividad de diversas enzimas antioxidantes3.
Las enfermedades críticas se asocian con depleción hepática, muscular y plasmática de glutatión, lo que reduce la capacidad antioxidante y produce daño oxidativo 4. La glutamina al ser un eficaz precursor del glutatión puede contribuir a la protección de la función hepática. Además, dado que la reserva proteica corporal y los niveles de aminoácidos de la dieta juegan un importante papel en los sistemas de destoxificación hepática 5,6 es interesante estudiar los efectos de la suplementación con glutamina sobre el metabolismo oxidativo hepático y sobre las actividades monooxigenasas citocromo P-450 dependientes.
La utilización de la glutamina como sustrato nutricional está limitada por su pobre solubilidad acuosa y su inestabilidad térmica, lo que impide que pueda ser esterilizada por calor. Estas características obligan a su preparación extemporánea. El desarrollo del dipéptido L-alanina-L-glutamina ha supuesto un avance en la terapéutica nutricional al permitir suministrar glutamina de una manera eficaz y segura por ser estable (se puede esterilizar por calor) y muy soluble. Diferentes estudios muestran que este dipéptido se hidroliza y libera glutamina por medio de las peptidasas libres7,8.
El objetivo de nuestro trabajo es estudiar los efectos de la suplementación de las nutriciones parenterales con glutamina y con el dipéptido alanina-glutamina sobre la capacidad antioxidante hepática y sobre el sistema de destoxificación mediado por el citocromo P-450 en la rata. Además compararemos de ambos sustratos sus efectos positivos y/o negativos sobre el funcionalismo hepático, fundamentales para decidir su utilización.
Material y métodos
Animales y proceso experimental
Para la realización de este trabajo se han utilizado ratas macho de raza Wistar (Charles River, Barcelona), de pesos comprendidos entre 220-260 g. Las condiciones de fotoperíodo (12 horas de luz/12 horas de oscuridad), de temperatura (22 ºC) y humedad (45-55%) se mantuvieron constantes durante todo el período que duró el proceso experimental. Todos los procedimientos experimentales con los animales se realizaron de acuerdo con las normativas Europea (EUCD 86/609/EEC)9 y Española (RD 223/1998)10 y siguiendo las indicaciones de la Guide for Care and Use of Laboratory Animals11, utilizadas de forma rutinaria en nuestro laboratorio.
Antes de iniciar el procedimiento experimental, todos los animales fueron aclimatados durante 24 horas en jaulas metabólicas con libre acceso al agua y al pienso comercial (Purina Chow A03, Panlab Ltd, Barcelona). Transcurrido este período se inició el procedimiento quirúrgico.
El proceso se iniciaba con la anestesia del animal con pentobarbital sódico (50 mg/kg i.p.). Se disecaba la vena yugular derecha donde se introducía un catéter central de silicona (Silastic DE 1,19 mm; DI 0,64 mm: Dow Corning, Midland, USA) para la administración de las diferentes soluciones a infundir. El catéter se tunelizaba subcutáneamente hasta la región subescapular para su exteriorización. Se introducia en un muelle protector que se fijaba próximamente a la piel interescapular por medio de un botón de acero inoxidable y se conectaba distalmente a un aparato giratorio ("swivel") que permitía la conexión con la bomba de perfusión continua de la solución a infundir así como el libre movimiento del animal dentro de la jaula metabólica. Una vez concluida la operación quirúrgica se colocaba a los animales en las jaulas de metabolismo, fijando el aparato giratorio en la parte superior de las mismas y conectándolo a una bomba de infusión continua (B. Braum, perfusor secura P), a través de la que se infundieron las diferentes soluciones de nutrición parenteral.
Los animales se distribuyeron de forma aleatoria en cuatro grupos experimentales (n = 15 animales por grupo):
Grupo C: grupo de animales control que recibían por vía central y en perfusión continua suero salino isotónico y con libre disposición al pienso comercial (valor calórico 2.660 Kcal/Kg).
Grupo NPT sin GLN: animales que recibían por vía central y en perfusión continua NPT sin glutamina.
Grupo NPT GLN: animales que recibían por vía central y en perfusión continua NPT suplementada con L-glutamina.
Grupo NPT ALA-GLN: animales que recibían por vía central y en perfusión continua NPT con suplemento del dipéptido alanina-glutamina.
La velocidad inicial de perfusión durante el primer día después de la operación fue de 1 ml/h para evitar la subida brusca de la glucemia y permitir la adaptación del animal a las condiciones experimentales, pasando posteriormente a una velocidad de infusión de 2,0 ml/h12,13. Las condiciones indicadas se mantenían durante 5 días. Transcurrido este tiempo se sacrificaban los animales. Con objeto de evitar la posible influencia de las variaciones circadianas14 todos los animales fueron sacrificados a la misma hora del día.
Utilizando la misma técnica quirúrgica descrita anteriormente se disecaba la carótida, introduciendo en ella un catéter por el que se recogían las muestras de sangre que posteriormente se centrifugaban a 3.500 rpm, 4 ºC durante 15 minutos y el plasma se congelaba a -20 ºC. El hígado se fraccionaba en porciones de un 1 g y se congelaban a -80 ºC.
Nutriciones parenterales totales
Las nutriciones parenterales fueron preparadas en el día de la cateterización en campanas de flujo laminar horizontal para mantener una esterilidad total y eran almacenadas posteriormente hasta el inicio de la perfusión a 4 ºC. Las NPT eran isocalóricas e isonitrogenadas y sólo se diferenciaban en la composición de aminoácidos no esenciales proporcionando una cantidad similar de calorías/día a la dieta con pienso estándar (tabla I).
Métodos analíticos
Las muestras de hígado se homogeneizaron, sobre hielo, en una solución de 250 mM de manitol, 70 mM de sacarosa y 2 mM de ácido etilen-diaminotetra acético (pH 7,4). El homogeneizado se centrifugó a 4 ºC y 750 g durante 15 min separando el pellet del núcleo, eritrocitos y restos celulares. El sobrenadante resultante de centrifugar el homogenado hepático a 12.000g se centrifugó de nuevo a 105.000g durante 60 min, el pellet microsomal se resuspendió en Tris-HCI (100 mM, pH 7,4), ácido etilen-diaminotetraacético (10 mM) y glicerol 20% (w/v); constituyendo el sobrenadante la fracción citosólica. Las fracciones microsomal y citosólica se congelaban a -80 ºC hasta el momento del análisis.
La concentración de citocromo P-450 se determinó midiendo las diferencias de absorbancia entre la muestra de microsomas hepáticos reducida con ditionita sódica burbujeando con monóxido de carbono15. La actividad anilina hidroxilasa microsomal era determinada mediante la formación de p-aminofenol a partir de la anilina16. La aminopirina desmetilasa microsomal se analizó por la determinación de formal-dehído formado17.
La superóxido dismutasa se determinó según el método de Misra y Fridovich18. La actividad catalasa fue medida por el método de Chance y Machley19. El análisis de la glutatión peroxidasa se realizó según el método de Flohe y Guntzler20 usando el hidroperóxido de cumeno como sustrato. El glutatión hepático se determinó por fluorimetría según el método de Hissin y Hill21 Los productos de reacción del ácido tiobarbitúrico (TBARS) fueron determinados en homogeneizado hepático según el método de Buege y Aust22. La concentración de proteínas se calculó según el método de Lowry y cols.23 usando albúmina bovina como patrón.
Tratamiento estadístico
Para la expresión de los resultados se calculó la media y el error estándar de la media (EEM). La significación de la diferencia entre las medias de los diferentes grupos se calculó por aplicación del test ANOVA y seguidamente por el test de Newman-Keuls. La diferencia fue considerada significativa cuando p < 0,05.
Resultados
El primer parámetro determinado fue el peso corporal. Se puede destacar como resultado más significativo la disminución significativa del peso corporal en los animales de los tres grupos con NPT (sin GLN, GLN y ALA-GLN) respecto al grupo control (C) (tabla II).
La concentración hepática del glutatión, antioxidante endógeno fundamental, fue significativamente más baja en el grupo NPT sin GLN tanto frente al grupo control (p < 0,05) como frente a los grupos con suplementación con glutamina (NPT GLN y NPT ALAGLN, p < 0,05) (tabla III, fig. 1). Estos resultados se acompañaron de una mayor concentración de los productos de reacción del ácido tiobarbitúrico (TBARS), indicativa de la existencia de peroxidación lipídica, en los animales que recibían la NPT sin GLN (+25,66%) y en los que recibían la NPT con GLN (+21,86) siendo en ambos casos la diferencia estadísticamente significativa (p < 0,05). Sólo el grupo de NPT con ALAGLN mantuvo unos niveles semejantes al grupo control (tabla III, fig. 2).
Los animales que recibieron las NPT sin GLN, GLN y ALA-GLN mostraron una disminución en la actividad de la enzima superóxido dismutasa (-49,4%, -50,3% y -45,6%, respectivamente) con una diferencia frente al grupo control estadísticamente significativa pero sin mostrar diferencias entre los distintos grupos experimentales de NPT. La actividad catalasa disminuyó significativamente en los grupos de NPT sin GLN y GLN (-38,67% y -36,79%, respectivamente); sin embargo, en el grupo NPT con ALA-GLN se mantuvo en los niveles del grupo control mostrando un incremento significativo respecto al grupo NPT sin GLN (tabla III, fig. 3). La actividad de la enzima glutatión peroxidasa permanecía sin cambios en los grupos de NPT respecto al grupo control (tabla III).
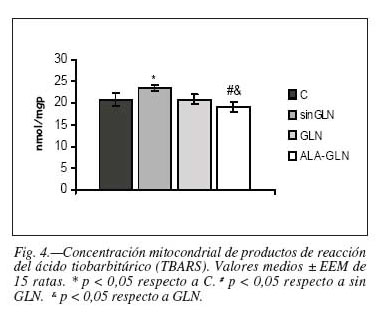
En cuanto a los resultados obtenidos a nivel mitocondrial observamos un aumento significativo en la actividad enzimática GPx en el grupo sin GLN, sin que existieran diferencias significativas en la actividad SOD entre los diferentes grupos (tabla IV). Igualmente puede observarse que la concentración mitocondrial de los productos de reacción del ácido tiobarbitúrico (TBARS) aumentaron significativamente en el grupo sin GLN frente al grupo control y frente al grupo ALA-GLN (+12,44% y +20,04% respectivamente; p < 0,05) y lo hicieron asimismo en el grupo GLN frente al grupo ALA-GLN; p < 0,05) (tabla IV, fig. 4).
En el presente estudio se han considerado, como parámetros orientativos del estado del sistema antioxidante y de su adaptación a una situación de daño oxidativo, las relaciones entre diversas actividades antioxidantes citosólicas y la concentración de los productos de reacción del ácido tiobarbitúrico (TBARS) (tabla V). Las relaciones entre las correlaciones de las tres enzimas antioxidantes frente a los TBARS disminuyeron significativamente respecto al grupo C y al grupo de NPT con ALA-GLN tanto en el grupo NPT sin GLN como en el grupo NPT con GLN (tabla V).
Respecto al efecto de las diferentes nutriciones sobre el sistema de monooxigenasas dependientes del citocromo P-450, que es representativo de las reacciones destoxificadoras de fase I, nuestros resultados muestran la existencia de una disminución significativa de las concentraciones del citocromo P-450 respecto al grupo control tan sólo en el grupo sin GLN (-22,58%; p < 0,05). También podemos observar que no existieron diferencias significativas en las actividades de las monooxigenasas dependientes del citocromo P-450 determinadas (anilina hidroxilasa y aminopirina desmetilasa) (tabla VI).
Tampoco detectamos la existencia de diferencias significativas en el aclaramiento de antipirina entre los 4 grupos experimentales. Sin embargo, en el grupo de NPT sin GLN puede observarse una tendencia hacia la disminución en dicho aclaramiento (tabla VI).
Discusión
Estrés oxidativo y sistemas antioxidantes
El glutatión es uno de los más importantes antioxidantes del organismo por lo que su disminución origina una menor capacidad antioxidante de los tejidos. La disminución en la capacidad antioxidante se asocia con el desarrollo de enfermedades graves y otras situaciones tales como intoxicaciones, diabetes, sepsis, procesos inflamatorios del pulmón, enfermedades coronarias, cáncer y estados de inmunodeficiencia24; por ello, los precursores del glutatión se están convirtiendo en una alternativa farmacológica importante en el tratamiento de muchas enfermedades 25. El principal inconveniente del glutatión, como molécula terapéutica, es la necesidad de administrarlo en forma de precursores asimilables. La glutamina se considera el más importante y eficaz precursor dado que es transportada fácilmente dentro de la célula donde está disponible para la síntesis del glutatión26-28.
Se ha demostrado previamente que la administración de una nutrición parenteral suplementada con glutamina protege al organismo del daño originado por radicales libres, efecto que probablemente sea debido al mantenimiento de los niveles de glutatión en los diversos órganos26-30.
La suplementación con el dipéptido de glutamina protege la función hepática y mejora la supervivencia durante la lesión hepática inducida por dosis normales e incluso tóxicas de fármacos como el paracetamol o agentes citostáticos como el 5-fluoracilo31. Igualmente se ha demostrado que la suplementación con glutamina protege la función hepática, actuando cómo profiláctico de la enfermedad veno-oclusiva hepática (complicación de la terapia con altas dosis de citostáticos para el trasplante de médula) y cuyo origen es al parecer la producción de radicales libres que ocluyen el flujo hepático como consecuencia de un descenso de determinados antioxidantes, incluyendo el glutatión32,33. También se ha demostrado este efecto protector a nivel gastro-intestinal, dado que el mantenimiento de los niveles de glutatión, gracias a la suplementación con glutamina, evita el daño gástrico inducido por el pH ácido del estómago34; también protege frente a lesiones que se producen durante la revascularización de un tejido previamente isquémico en procesos quirúrgicos, revascularización coronaria como el bypass aorto-coronario, trasplante de órganos, etc.35.
Nuestros resultados indican que la NPT en la rata produce estrés oxidativo. Muestra de ello es el incremento en la producción de radicales libres, como se confirma por el aumento en la concentración de TBARS y la disminución del glutatión hepático, con un desplazamiento en el equilibrio oxidante/antioxidante a favor del primero y por lo tanto estrés oxidativo y peroxidación lipídica. La suplementación con dipéptido de glutamina recupera los valores de glutatión y disminuye la concentración de TBARS.
Entre las defensas antioxidantes que tienen las células de los mamíferos frente a los radicales libres, además del glutatión, podemos destacar las actividades enzimáticas superóxido dismutasa (SOD), catalasa (CAT) y glutatión peroxidasa (GPx)36. Esta serie de actividades enzimáticas realizan su función conjunta y escalonadamente para eliminar los intermediarios reactivos de oxígeno. Según los datos de nuestros experimentos, la actividad SOD citosólica disminuyó en los tres grupos con NPT, lo que indica una disminución de la capacidad de inactivación del anión super-óxido que permite a este anión reaccionar con el peróxido de hidrógeno generando el radical hidroxilo (reacción de Haber Weis), principal responsable de la peroxidación lipídica. Estos datos junto al aumento de los niveles de TBARS en los grupos con NPT sin GLN y GLN indicarían la existencia de estrés oxidativo en dichos grupos. Sin embargo, la actividad SOD mitocondrial no experimentó modificaciones en ninguno de los tres grupos experimentales respecto al grupo control.
En nuestros resultados observamos cómo no hay variación de la actividad GPx citosólica en ninguno de los tres grupos experimentales frente al grupo control y, por lo tanto, no parece existir una disminución de la capacidad para degradar el peróxido de hidrogeno y otros hidroperóxidos orgánicos por lo que no parece existir potenciación de los efectos del estrés oxidativo. Sin embargo, nuestros datos indican que la NPT en la rata origina una disminución significativa de la actividad CAT que se recupera al suplementar la nutrición con el dipéptido de glutamina sin que tenga lugar tal recuperación en los animales de los grupos con NPT sin GLN y GLN donde se observó una marcada disminución de la actividad catalasa. El incremento producido por la GLN sobre la actividad CAT tiene trascendencia ya que esta enzima es parte del sistema primario de defensa contra los radicales libres y aunque se considera que es el ciclo redox del glutatión la mayor fuente de protección para los niveles moderados-altos de estrés oxidativo, la catalasa pare-ce ser más importante a la hora de proteger contra el estrés oxidativo grave. En este sentido, comparando las tres actividades enzimáticas antioxidantes estudiadas, se ha indicado que cuando existe una inhibición de la GPx o de la CAT se produce una gran toxicidad por daño oxidativo, mientras que si sólo se inhibe la actividad SOD este daño es mucho menor37.
En nuestros resultados observamos una falta de uniformidad en las variaciones que experimentan las actividades enzimáticas analizadas; dichas alteraciones pueden deberse a diferentes mecanismos, aunque las situaciones de estrés oxidativo y el incremento en los radicales libres puede explicar dichos cambios. Así, se ha indicado que la actividad SOD se inhibe por el peróxido de hidrógeno38 o por la sobreproducción del anión superóxido que conduciría a la inactivación enzimática39; a su vez la CAT y la GPx se inhiben por iones superóxido40.
La mitocondria es una fuente importante de intermediarios reactivos de oxígeno promoviendo el desarrollo de estrés oxidativo. En nuestro trabajo los resultados a nivel mitocondrial muestran una actividad GPx muy activada en el grupo con NPT sin GLN lo que podría indicar una mayor producción de peróxido de hidrógeno y, por lo tanto, un mayor daño por radicales libres. En el grupo ALA-GLN la actividad GPx presenta valores similares al grupo control. Este presumible menor daño oxidativo podría confirmarse por el menor aumento de los TBARS detectado en el grupo suplementado con el dipéptido respecto a los otros grupos de NPT.
Se han utilizado diversas correlaciones como índices de estrés oxidativo. Éstas pueden orientar no sólo sobre el estado de las enzimas antioxidantes sino también sobre sus posibles mecanismos adaptativos en una situación de daño oxidativo41. En nuestro trabajo hemos relacionado diversas actividades enzimáticas frente a los TBARS42 y observamos unas correlaciones inversas y significativas bastante claras entre la peroxidación lipídica y la disminución de las actividades enzimáticas, manteniéndose los resultados CAT/TBARS y GPx/TBARS del grupo ALA-GLN con valores muy similares al grupo control y con valores significativamente diferentes de los obtenidos en los grupos con NPT sin GLN y GLN. Otros autores encuentran correlaciones similares en patologías hepáticas en las que se encuentra involucrado el daño originado por radicales libres42.
En resumen, nuestros resultados indican la existencia de un daño oxidativo causado por la nutrición parenteral total como se deduce de los valores de las diferentes correlaciones entre las actividades enzimáticas y las concentraciones de TBARS, así como de la disminución significativa de las actividades SOD citosólicas en los tres grupos con NPT respecto al grupo control. Sin embargo, observamos menor daño oxidativo en el grupo con NPT ALA-GLN como lo refleja el hecho de que los animales de este grupo presentaron concentraciones hepáticas significativamente superiores de glutatión (GSH) respecto a los animales que recibieron las otras nutriciones. Dado que el glutatión es el principal antioxidante no enzimático del organismo43, cabría esperar un índice de peroxidación lipídica menor, lo que se confirmó por el hecho de que las concentraciones hepáticas de TBARS fueron significativamente menores en el grupo suplementado con el dipéptido que en los otros dos grupos con nutrición parenteral (sin GLN y GLN). Estos datos se confirman también a nivel mitocondrial ya que las actividades SOD, GPx y TBARS del grupo con NPT ALA-GLN se mantienen en valores similares al grupo control.
Nuestros datos coinciden en gran medida con los resultados obtenidos por otros autores que investigan terapias con sustancias antioxidantes (tales como ácido ascórbico, melatonina, catequina y quercitina) como protectores del estrés oxidativo. En dichos estudios se indica que la eficacia de un tratamiento antioxidante se comprueba por el incremento de los niveles de glutatión unido a una disminución de los TBARS así como por el incremento en mayor o menor medida de las tres principales actividades enzimáticas CAT, GPx y SOD44,45; si bien no existe una uniformidad de opiniones en lo que respecta a qué criterios deben ser necesarios para hablar de estrés oxidativo. Así, en otros estudios no se detectan aumentos de la SOD pero si de CAT y GPx, explicando estos resultados como un aumento compensador ante la excesiva producción de EROs 46; mientras que en otros trabajos sólo valoran el incremento de la actividad CAT como principal factor para evitar el daño oxidativo47.
Nuestros datos parecen demostrar la importancia que tiene la suplementación con glutamina al mantener, al menos parcialmente, la capacidad antioxidante enzimática ya que en otros trabajos con modelos similares con nutrición parenteral total de composición estándar se detectan unas disminuciones marcadas de las tres actividades enzimáticas citosólicas SOD, GPx y CAT48.
En conjunto, los resultados del presente estudio sugieren que los cambios producidos en los niveles de glutatión, actividad catalasa y los valores de TBARS, significativamente alterados por la nutrición parenteral total, no se diferencian significativamente respecto a los valores normales tras la suplementación con dipéptido de glutamina, por lo que actúa como un agente antioxidante y debería por tanto incorporarse al arsenal terapéutico. De hecho, se ha demostrado la eficacia de sustancias antioxidantes, como es el caso de N-acetílcisteína, en el tratamiento de enfermedades originadas por radicales libres ya que aumenta las concentraciones hepáticas de glutatión y disminuye la peroxidación lipídica, como se ha comprobado en el tratamiento del síndrome de distrés respiratorio agudo, la intoxicación por paracetamol y el tratamiento de la obstrucción biliar49. Otros ejemplos de capacidad antioxidante son el tratamiento preventivo con alfa-tocoferol y vitamina C previo a los trasplantes hepáticos y renales50.
Citocromo P-450 y aclaramiento de antipirina
Diferentes estudios experimentales han demostrado que la oxidación microsomal de xenobióticos está disminuida en animales con deficiencia de proteínas y que esta reducción de la actividad oxidativa se recupera después de una dieta hiperproteica3. El metabolismo de la antipirina puede ser modificado por dietas ricas en carbohidratos y proteínas 51; experimentos realizados en humanos han demostrado que los niveles de aminoácidos administrados parenteralmente, sin cambiar la cantidad de calorías recibidas, pueden modificar el metabolismo de la antipirina6.
La composición de la NPT es uno de los principales factores que pueden influir en el metabolismo oxidativo hepático. Así, los estudios clínicos en humanos coinciden, en general, en detectar una capacidad oxidativa hepática menor cuando las infusiones se realizan exclusivamente a base de glucosa. Uno de los primeros autores en describirlo fue Burgess y cols., pues en sus resultados comprobaron cómo los pacientes que recibían exclusivamente carbohidratos como fuente calórica tenían un aclaramiento de antipirina más bajo, independientemente de la cantidad de calorías proporcionadas. Sin embargo, el grupo que recibía una NPT compuesta por carbohidratos y lípidos mostró un aclaramiento de antipirina similar al control52.
Otro estudio importante en este sentido es el realizado por Jorquera y cols. con una variedad de NPT, la nutrición periférica hipocalórica (compuesta por aminoácidos y glucosa) en el que se ha comprobado un incremento del aclaramiento de antipirina en los pacientes que la recibían con respecto a los pacientes control que se mantenían con sueroterapia convencional5. Ambos estudios demuestran la sensibilidad del metabolismo microsomal hepático a regímenes de NPT diferentes con lo que esto supone para la eficacia y/o toxicidad de muchos agentes terapéuticos.
En nuestro estudio, se determinaron las actividades monooxigenasas representativas de las principales familias de citocromo P-450. Se detectó una disminución significativa en el contenido total de citocromo P-450 hepático en el grupo con NPT sin GLN, no encontrándose diferencias de los grupos suplementados con glutamina respecto al grupo control. Estos resultados sugirieren que la influencia sobre el metabolismo oxidativo hepático de la NPT se relaciona no solamente con las concentraciones totales de los aminoácidos administrados sino también con la clase específica de los mismos. La medición de la capacidad oxidativa hepática mediante una técnica in vivo como es el aclaramiento de la antipirina del plasma parecen apuntar en la misma dirección ya que se observó una disminución del aclaramiento en el grupo con NPT sin GLN, aunque posiblemente debido al tamaño muestral no se alcanzó la significación estadística.
Otros autores han evaluado el efecto que tiene la nutrición parenteral sobre el metabolismo de fase I en ratas, encontrando una reducción en el contenido hepático del citocromo P-45048. Dichos autores explican este efecto en base a una alteración en la composición lipídica de la membrana del retículo endoplasmático hepático. Igualmente se ha demostrado que las concentraciones de citocromo P-450 tienden a recuperar sus valores normales tras el tratamiento con glutatión, restaurándose el daño lipídico de dichas membranas53.
Como comentamos previamente, en nuestro estudio encontramos una reducción significativa de la concentración del citocromo P-450 en el grupo con NPT sin GLN respecto al grupo control, algo que no se produjo en los otros grupos experimentales. Este resultado podría deberse a que la glutamina es el mejor precursor del glutatión. La disminución del contenido hepático del citocromo P-450 junto con el aumento de la actividad anilina hidroxilasa son utilizados por algunos autores como marcadores de hepatotoxicidad y de disminución en la capacidad metabolizadora hepática54, resultados que se asemejan a los datos obtenidos en el grupo con NPT sin GLN en nuestro estudio.
Muy recientemente se ha descrito que la NPT durante 6 a 7 días de tratamiento, puede afectar al citocromo P-450 disminuyendo su actividad, afectando sobre todo a la isoenzima CYP3A, actividad muy importante ya que es la encargada de la metabolización del mayor número de fármacos. La suplementación de la NPT con glutamina era capaz de prevenir dicha disminución 55. Una posible explicación para que nuestros resultados no sean tan significativos podría ser que la duración del tratamiento fue menor.
Los datos recogidos en el presente estudio parecen indicar que el efecto de la nutrición parenteral total sobre las enzimas metabolizadoras de fármacos puede alterar la capacidad del hígado de biotransformar fármacos y otros xenobióticos dependiendo de los aminoácidos aportados. Los pacientes sometidos a nutrición parenteral están con frecuencia críticamente enfermos, precisando de polifarmacoterapia para sus procesos de base. En estas circunstancias, una nutrición parenteral que no altere el metabolismo oxidativo evitaría posibles efectos adversos no previstos al no modificar los niveles plasmáticos de los fármacos, lo que incidiría en menores interacciones medicamentosas.
Así pues, en el presente estudio la disminución del contenido total de citocromo P-450 en el grupo de NPT sin GLN parece indicar una disminución parcial de la capacidad oxidativa hepática que puede ser revertida suplementando la NPT con glutamina y, por tanto, alterar en menor medida el metabolismo oxidativo hepático.
L-glutamina en comparación con el dipéptido
El hecho de que en nuestro estudio la suplementación con glutamina, ya sea como tal o como dipéptido, haya originado una pérdida de peso similar en los dos grupos parece confirmar los datos obtenidos por otros autores en el sentido de no encontrar diferencias en el estado nutricional al suplementar las NPT con uno u otro producto56,57.
En cuanto a los efectos sobre el metabolismo oxidativo hepático observamos que ambas sustancias se comportan de modo similar al no interferir en el mismo. Sin embargo, en lo que respecta al sistema antioxidante, nuestros datos indican que aunque tanto la L-alanina-L-glutamina como la glutamina normalizan la concentración de glutatión, sólo el dipéptido redujo los niveles de TBARS. Igualmente, tanto la suplementación con el dipéptido como con la glutamina incrementaron diferentes enzimas antioxidantes pero sólo el primero incrementó de una manera significativa la actividad catalasa lo que le permitiría ser más eficaz en la eliminación de EROs.
Nuestros datos sugieren que las formulaciones parenterales que contienen el dipéptido L-alanina-L-glutamina protegen mejor contra los radicales libres que las que contienen únicamente glutamina y, por lo tanto, todas estas características le convierten en la primera elección para la preparación de nutriciones suplementadas con glutamina.
Agradecimientos
La realización de este trabajo ha sido posible gracias a la financiación del Plan Nacional de Salud Español.
Referencias
1. Fürst P, Pogan K y Stehle P: Glutamine dipeptides in clinical nutrition. Nutrition, 1997, 13:731. [ Links ]
2. Fürst P: Old and new substrates in clinical nutrition. J Nutr, 1998, 128:789. [ Links ]
3. Jorquera F, Culebras JM y González-Gallego J: Influence of nutrition on liver oxidative metabolism. Nutrition, 1996, 12: 442-447. [ Links ]
4. Fürst P: The role of antioxidants in nutricional support. Clin Nutr, 1998, 17:S4-S5. [ Links ]
5. Jorquera F, Almar M, Martínez C, González-Sastre M, Culebras JM y González-Gallego J: Antipyrine clearance in surgical patients maintained on hypocaloric peripheral parenteral nutrition. J Parenter Enteral Nutr, 1994, 18:544-548. [ Links ]
6. Pantuck EJ, Pantuck CB, Weissman Ch, Askanazi J y Conney AH: Effects of parenteral nutritional regimens on oxidative drug metabolism. Anesthesiology, 1984, 60:534-540. [ Links ]
7. Herzog B, Stehle P y Fürst P: In vitro peptidase activity of basolateral membranas vesicles (BLMV) of rat mucosa against glutamine contaning dipeptides. Clin Nutr, 1992, 11:S31-S37. [ Links ]
8. Fürst P y Stehle P: The potential use of parenteral dipeptides in clinical nutrition. Nutr Clin Pract, 1993, 8:106-114. [ Links ]
9. EU: Council Directive 86/609/EEC of november 24, 1986 on the approximation of law, regulations and administrative provisions of the member states regarding the protection of animals used for experimental and other scientific purposes. Official J Eur Communities, 1986, L358:18.12. [ Links ]
10. Real Decreto 223/1998, de 14 de marzo sobre protección de los animales utilizados para la experimentación y otros fines científicos: Boletín Oficial del Estado español, 1988, 67:8509. [ Links ]
11. Institute of laboratory animals resources (ILAR): Guide for care and use of laboratory animals. National Academy Press. Washington, DC. 1996. [ Links ]
12. Helton WS, Jacobs DO, Bonner-Weir S, Bueno R, Smith RJ y Wilmore DW: Effects of glutamine-enriched parenteral nutrition on the exocrine pancreas. J Parenter Enteral Nutr, 1990, 14:344-352. [ Links ]
13. Denno R, Rounds J, Faris R, Holejko L y Wilmore D: The enhanced effect of parenteral nutrition on hepatotoxicity. Nutrition, 1996, 12:30-35. [ Links ]
14. Tuñón MJ, González P, López P, Salido GM y Madrid JA: Circadian rhythms in glutathione and glutathione-S tranferase activity of rat liver. Arch Int Physiol Biophys, 1992, 100:83-97. [ Links ]
15. Omura T y Sato RJ: The carbon monoxide-binding pigment of liver microsomes. J Biol Chem, 1964, 239:2379-2385. [ Links ]
16. Imai Y, Ito A y Sato R: Evidence for biochemically different types of vesicles in the hepatic fraction. J Biochem, 1966, 60: 417-428. [ Links ]
17. Nash T: The colorimetric stimation of formaldehyde by means of the Hautzsch reaction. J Biol Chem, 1953, 239:416-421. [ Links ]
18. Mirsa HP y Fridovich I: The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase. J Biol Chem, 1972, 247:3170-3175. [ Links ]
19. Chance B y MacHley AL: Assays of catalases and peroxidases. Methods Enzymol, 1955, 2:764-775. [ Links ]
20. Flohe L y Guntzler WW: Glutathione peroxidase. Methods Enzymol, 1974, 105:115. [ Links ]
21. Hissin PJ y Hilf R: A fluorimetric method for determination of oxidized and reduced glutathione in tissues. Anal Biochem, 1976, 74:214-226. [ Links ]
22. Buege JA y Aust SD: Microsomal lipid peroxidation. Methods Enzymol, 1978, 52:302. [ Links ]
23. Lowry OH, Rosebrough NJ, Farr AL y Randall NJ: Protein measurement with the phenol reagent. J Biol Chem, 1951, 193:265-275. [ Links ]
24. Exner R, Wessner B, Manhart N y Roth E: Therapeutic potential of glutathione. Wien Klin Wochenschr, 2000, 28:610-616. [ Links ]
25. Wernerman J y Hammarqvist F: Modulation of endogenous glutathione availability. Curr Opin Clin Nutr Metab Care, 1999, 2:487-92. [ Links ]
26. Amores-Sánchez MI y Medina MA: Glutamine, as a precursor of glutathione, and oxidative stress. Mol Genet Metab, 1999, 67:100-105. [ Links ]
27. Ziegler TR, Bazargan N y Galloway JR: Glutamine-enriched parenteral nutrition; saving nitrogen and saving money? Clin Nutr, 2000, 19:375-377. [ Links ]
28. Ziegler TR: Glutamine supplementation in cancer patients receiving bone marrow transplantation and high dose chemotherapy. J Nutr, 2001, 131:S2578-S2584. [ Links ]
29. Babu R, Eaton S, Drake DP, Spitz L y Pierro A: Glutamine and glutathione counteract the inhibitory effects of mediators of sepsis in neonatal hepatocytes. J Pediatr Surg, 2001, 36: 282-286. [ Links ]
30. Ziegler TR: Glutamine supplementation in bone marrow transplantation. Br J Nutr, 2002, 87:S9-S15. [ Links ]
31. Demling RH: Enteral glutamine administration prevents the decrease in cell energy charge potential produced in ileum after a skin burn in the rat. J Burn Care Rehabil, 2000, 21:275-279. [ Links ]
32. Brown SA, Goringe A, Fegan C y Davies SV: Parenteral glutamine protects hepatic function during bone marrow transplantation. Bone Marrow Transplant, 1998, 22:281-284. [ Links ]
33. Goringe A, Brown SA, O'Callaghan U y Rees J: Glutamine and vitamin E in the treatment of hepatic veno-occlusive disease following high-dose chemotherapy. Bone Marrow Transplant, 1998, 21:829-832. [ Links ]
34. Hung CR y Neu SL: Acid-induced gastric damage in rats is aggravated by starvation and prevented by several nutrients. J Nutr, 1997, 127:630-636. [ Links ]
35. Yasuhara M: L-glutamine-induced heme oxygenase-1 protects small intestine from warm ischemia and reperfusion injury in the rat. Hokkaido Igaku Zasshi, 2001, 76:21-34. [ Links ]
36. Halliwell B: Free radical and oxidative damage in biology and medicine: An introduction. En: Oxidative stress in skeletal muscle. Ed. AZ Reznick. Birkhäuser Verlag, pp. 1-27, Basel, 1998. [ Links ]
37. Michiels C, Raes M, Toussaint O y Remacle J: Importance of SE-glutathione peroxidase, catalase and Cu/Zn-SOD for cell survival against oxidative stress. Free Rad Biol Med, 1994, 17:235-248. [ Links ]
38. Hodgson EK y Fridovich I: The interaction of bovine erythrocyte superoxide dismutase with hydrogen peroxide: inactivation of the enzyme. Biochemistry, 1975, 14:5294-5299. [ Links ]
39. Santiard D, Ribiere C, Nordmann R y Houee-Levin C: Inactivation of Cu, Zn-superoxide dismutase by free radicals derived from ethanol metabolism: a gamma radiolysis study. Free Rad Biol Med, 1995, 19:121-127. [ Links ]
40. Blum J y Fridovich I: Inactivation of glutathione peroxidase by superoxide radical. Arch Bochem Biophys, 1985, 240:500-508. [ Links ]
41. Somani SM, Husain K, Díaz-Phillips L, Lanzotti DJ, Kareti KR y Trammell GJ: Interaction of exercise and ethanol on antioxidant enzymes in brain regions of rat. Alcohol, 1997, 13: 603-610. [ Links ]
42. Peres W, Tuñón MJ, Collado P, Herman S, Marroni N y González-Gallego J: The flavonoid quercetin ameliorates liver damage in rats with biliary obstruction. J Hepatol, 2000, 33: 742-750. [ Links ]
43. Fernández-Checa JC, Shelly L, Ookhtens M y cols.: Regulation of hepatic glutathione. En: Hepatic Transport and Bile Secretion. Physiology and Pathophysiology. Ed. N. Tavoloni y PD Berk. Raven Press, pp. 363-395, Nueva York, 1993. [ Links ]
44. Batcioglu K, Karagozler AA, Genc M y Celik S: Comparison of the chemopreventive potentials of melatonin and vitamin E plus selenium on 7,12-dimethylbenz(a)anthracene-induced inhibition of mouse liver antioxidant enzymes. Eur J Cancer Prev, 2002, 11:57-61. [ Links ]
45. Karamanlioglu B, Yuksel M, Temiz E, Salihoglu YS y Ciftci S: Hepatobiliary scintigraphy for evaluating the hepatotoxic effect of halothane and the protective effect of catechin in comparison with histo-chemical analysis of liver tissue. Nucl Med Commun, 2002, 23:53-59. [ Links ]
46. Selman M, McLaren JS, Himanka MJ y Speakman JR: Effect of long-term cold exposure on antioxidant enzyme activities in a small mammal. Free Radic Biol Med, 2000, 15:1279-1285. [ Links ]
47. Brown-Borg HM, Rakoczy SG, Romanick MA y Kennedy MA: Effects of growth hormone and insulin-like growth factor-1 on hepatocyte antioxidative enzymes. Exp Biol Med, 2002, 227:94-104. [ Links ]
48. Lespine A, Fernández Y, Periquet B y cols.: Total parenteral nutrition decreases liver oxidative metabolism and antioxidant defenses in healthy rats: comparative effect of dietary olive and soybean oil. J Parenter Enteral Nutr, 2001, 25:52-59. [ Links ]
49. Elejalde JI: Estrés oxidativo, enfermedades y tratamientos antioxidantes. An Med Interna, 2001, 18:50-59. [ Links ]
50. Rabl H, Khoschsorur G y Colombo T: A multivitamin infusion prevents lipid peroxidation and improves transplantation performance. Kid Int, 1993, 43:912-917. [ Links ]
51. Alvares AP, Anderson KE, Conney AH y Kappas A: Interactions between nutritional factors and drug biotransformations in man. Proc Natl Acad Sci USA, 1976, 73:2501-2504. [ Links ]
52. Burgess P, Hall RI, Bateman DN y Johnston IDA: The effect of total parenteral nutrition on hepatic drug oxidation. J Parenter Enteral Nutr, 1987, 11:540-542. [ Links ]
53. Facino RM, Carini M, Aldini G y cols.: Efficacy of glutathione for treatment of fasciolosis. An investigation in the experimentally infested rat. Arzneim-Forsch/Drug Res, 1993, 43: 455-460. [ Links ]
54. Jodynis-Liebert J, Murias M y Bloszyk E: Effect of sesquiterpene lactones on antioxidant enzymes and some drug-metabolizing enzymes in rat liver and kidney. Planta Med, 2000, 66: 199-205. [ Links ]
55. Shaw AA, Hall SD, Franklin MR y Galinsky RE: The influence of L-Glutamine on the depression of hepatic cytochrome P-450 activity in male rats caused by total parenteral nutrition. Drug Metab Dispos, 2002, 30:177-182. [ Links ]
56. Jian ZM, Cao JD, Zhu XG y cols.: The impact of alanyl-gluta-mine on clinical safety, nitrogen balance, intestinal permeability, and clinical outcome in postoperative patients: a randomized, double-blind, controlled study of 120 patients. J Parenter Enteral Nutr, 1999, 23:S62-S66. [ Links ]
57. Waitzberg DL, Cukier C, Mucerino DR, Logulo AF, Torrinhas RSM y De Castro I: Small bowel adaptation with growth hormone and glutamine after massive resection of rat's small bowel. Nutr Hosp, 1999, 14:81-90. [ Links ]