Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.59 no.4 may. 2006
ECOGRAFÍA UROLÓGICA
Cáncer de prostata y ecografía transrectal
Prostate cancer and transrectal ultrasound
Felipe Herranz Amo, Fernando Verdú Tartajo y Juan Ignacio Martínez Salamanca.
Servicio de Urología. Hospital General Universitario Gregorio Marañón. Madrid. España.
Dirección para correspondencia
RESUMEN
En este artículo describimos las alteraciones ecográficas patológicas que puede producir el cáncer de próstata y analizamos su utilidad en el estudio de esta patología. La ecografía transrectal no tiene la suficiente sensibilidad y especificidad en el diagnóstico, estudio de extensión y diagnostico de las recidivas postprostatectomía radical. Sin embargo el estudio ecográfico de la morfología del ápex prostático puede ser de utilidad para la planificación y ejecución de la disección apical durante la prostatectomía radical.
Palabras clave: Cáncer de próstata. Ecografía transrectal. Diagnóstico. Estudio de extensión. Recidiva. Ápex prostático. Ecografía Urológica.
SUMMARY
We describe the ultrasonographic changes prostate cancer can produce, and analyze the usefulness of ultrasonography in the study of this disease. Transrectal ultrasound does not have enough sensitivity and specificity for the diagnosis, metastasic study, and diagnosis of recurrences after radical prostatectomy. Nevertheless the ultrasound study of the morphology of the prostatic apex may be useful for the planning and performance of the apex dissection during radical prostatectomy.
Key words: Prostate cancer. Transrectal ultrasound. Diagnosis. Extension study. Recurrence. Prostatic apex. Urological ultrasound.
Introducción
El cáncer de próstata (CP) es la neoplasia no cutánea más frecuentemente diagnosticada en USA y la segunda causa de muerte por enfermedad oncológica después del cáncer de pulmón. Se estima que en el año 2.005 se diagnosticaran en USA 232.900 nuevos casos y morirán por esta enfermedad 30.350 varones (1). En un estudio sobre la estimación de la incidencia del cáncer en Europa en 1995 (2), el CP se situó en el 3º lugar en frecuencia (11%) en el varón después de las neoplasias de pulmón (22%) y colo-rectal (12%). En los países de la Unión Europea el CP ocupó el segundo puesto en incidencia después del cáncer de pulmón y por delante del colo-rectal.
En España la incidencia real del CP es desconocida. En un estudio multicéntrico retrospectivo sobre la incidencia del CP realizado en la Comunidad de Madrid de los pacientes diagnosticados en el año 2000, tanto en la Sanidad Pública como en la Privada, la incidencia obtenida fue de 100,4 casos x 100.000 hombres, con una media de edad al diagnóstico de 70 años. Al ajustar la incidencia obtenida a la población española, europea y mundial se obtuvieron unas cifras de 120,1, 103,5 y 68,6 x 100.000 hombres respectivamente (3).
La primera aplicación de los ultrasonidos a la próstata utilizando la vía transrectal la realizaron Takahasu y Ouchi en 1964, aunque debido a la mala calidad de las imágenes no tuvieron ninguna aplicación clínica. En 1971, fue Watanabe quien obtuvo las primeras imágenes ecográficas transrectales de la próstata con aplicación clínica (4).
Desde entonces la ecografía transrectal (ETR) se ha utilizado ampliamente para el estudio de la glándula prostática y como guía - control en la aplicación de diversos tratamientos (5). En el cáncer de próstata las indicaciones para la utilización de la ETR reflejadas en la literatura se detallan en la Tabla I.
Diagnóstico ecográfico del cáncer de próstata.
En el modelo anatómico zonal de McNeal (15), la zona periférica forma la parte posterior, lateral y apical de la glándula prostática extendiéndose por la parte anterior hasta fusionarse con el estroma muscular anterior. Ecográficamente presenta una reflectividad media que se ha definido convencionalmente como isoecoica y que se utiliza como patrón de referencia ecográfico en la exploración de la próstata. La zona central presenta una reflectividad ecográfica similar a la zona periférica siendo prácticamente imposible la diferenciación ecográfica de ambas. En estas dos zonas se van a desarrollar entre el 70% y el 80% de los tumores de la próstata.
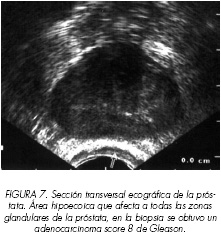
La lesión que con más frecuencia se encuentra en la exploración ecográfica es el nódulo hipoecoico. Según Shinohara (16) esto es debido a que la arquitectura glandular normal es sustituida por masas de células sin estructura reconocida, disminuyendo las interfases glándula – estroma y por lo tanto la cantidad de ecos reflejados. El nódulo hipoecoico suele ser único (Figura 1), pero también pueden encontrase múltiples nódulos localizados en la zona periférica (Figura 2) o diseminados por toda la glándula (Figura 3). En algunos pacientes debido a la extensión del cáncer se observa un área hipoecoica (Figura 4) más que un nódulo, que afecta a una parte importante de la zona periférica pudiendo extenderse también a la zona transicional (Figura 5). En ocasiones el tumor afectará a toda la zona periférica produciéndose un fenómeno de inversión de la reflectividad ecogénica entre la zona periférica y la transicional (Figura 6). Cuando el tumor invada todas las zonas de la próstata se observarán como una glándula totalmente hipoecoica (Figura 7).
Aunque la patología que con más frecuencia se asocia al nódulo hipoecoico es el cáncer de próstata, existen otras patologías benignas: áreas de hiperplasia benigna (17), infartos (Figura 8), procesos inflamatorios (Figuras 9 y 10), atrofia glandular y estructuras anatómicas normales (vasos sanguíneos, tejido muscular liso del ápex prostático o la entrada de las vesículas seminales) que pueden producir un área hipoecoica (18).
La incidencia de los nódulos hipoecoicos en la literatura está en función de la frecuencia del transductor utilizado, los criterios que se hayan seguido para la selección de los pacientes y la experiencia del médico que realice la exploración. Esta frecuencia varía entre el 9% y el 90% (19-25). Al igual que otros autores (26) hemos observado una disminución de la incidencia de nódulos hipoecoicos en la última década en los pacientes sometidos a ecografía transrectal. En nuestra serie de 3.078 pacientes sometidos a una primera biopsia con un 37,8% de cáncer de próstata, el 60% presentaron un nódulo hipoecoico en el periodo 1994-1997 frente al 30% en el periodo 2001-2003 (p=0,0001), el 82% de los pacientes diagnosticados de cáncer de próstata presentaban un nódulo hipoecoico en la primera fase frente al 57% en la última (p=0,0001) (27).
La incidencia de cáncer de próstata en los nódulos hipoecoicos también es muy variable oscilando entre el 11% y el 69% (19-25), estando en función de los hallazgos al tacto rectal y de los niveles de PSA. Cuando al nódulo hipoecoico se le asocia un tacto rectal patológico la incidencia de cáncer es del 36%-76% frente al 4,8%-36% cuando el tacto es normal (19,23,24,28,29), si se asocia a una elevación del PSA la incidencia será del 35%-55% frente al 4%-12% cuando el PSA es normal (19,28) y cuando al nódulo hipoecoico se añade la positividad de los otros dos test la incidencia de cáncer es del 60%-78,5% frente al 2%-5% cuando ambos test son negativos (19,28,29).
No se ha logrado esclarecer una hipotética asociación entre la morfología del nódulo hipoecoico y la existencia o no de cáncer. Harper y cols. (30) defienden que en los nódulos hipoecoicos de la zona periférica que presentaron una definición muy clara y lineal con el resto de la zona periférica, no se encontró ninguna alteración patológica en la biopsia. Observaron que estos nódulos desaparecían al pasar el paciente de la postura de decúbito lateral izquierdo a la contralateral o a la de litotomía, interpretándolos como artefactos posturales o seudolesiones. Sperandeo y cols. (31) mediante presión con el transductor transrectal clasificaron los nódulos hipoecoicos en deformables (cambios en la longitud del eje perpendicular) y no deformables; encontraron cáncer de próstata en el 92,6% de los nódulos no deformables y solo 20,5% en los deformables, consideran que esta sencilla maniobra tiene una elevada sensibilidad y especificidad pero sigue siendo necesaria la biopsia de todos los nódulos hipoecoicos.
A pesar de las expectativas iniciales sobre el papel de la ecografía transrectal en el diagnóstico del cáncer de próstata, la experiencia acumulada en la literatura ha demostrado que la sensibilidad de esta exploración es del 70%-92% con una especificidad del 40%-79% y un valor predictivo positivo del 15%-35% (18,32). Esta baja especificidad condiciona su utilidad de forma aislada en el diagnóstico del cáncer de próstata, teniéndose que integrar en el seno de algoritmos diagnósticos con otros test.
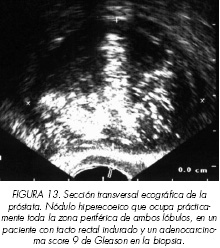
En ocasiones el nódulo hipoecoico presenta en su interior grandes áreas de ecogenicidad elevada, justificando el término de lesión ecogénica mixta (Figura 11) descrita por Rifkin y cols. (33). A veces el área de ecogenicidad elevada es tan grande 366 que ocupa todo el nódulo teniendo la apariencia de nódulo hiperecoico (Figura 12) que, en ocasiones, puede ocupar prácticamente casi toda la zona periférica (Figura 13). La presentación del cáncer de próstata como nódulo hiperecoico es muy baja alrededor del 1-2% (16-30,32-34). Esto es debido a que tumores generalmente de alto grado y volumen sufren una necrosis central (comedonecrosis) originándose una cavidad llena de detritus eosinofílicos que posteriormente sufrirán un proceso de calcificación distrófica (34-35). Este fenómeno es muy frecuente en los carcinomas ductales que suponen el 1,3% de los adenocarcinomas de próstata en su forma pura y el 4,8% en su forma mixta (asociado a cáncer acinar) (36) y en los carcinomas de patrón cribiforme (37). Cuando el nódulo hiperecogénico no está rodeado de un área de ecogenicidad disminuida, está bien delimitado y presenta un patrón más uniforme (Figura 14), respetando el límite entre la zona periférica y la transicional, suele tener una etiología benigna.
Clásicamente se consideraba que un 25%-30% de los tumores de próstata eran isoecoicos, no diferenciándose ecográficamente del resto de la zona periférica (38,39). Aunque se ha comprobado que los tumores isoecoicos tiene generalmente menor volumen (tumor en menos cilindros), no se ha observado diferencia en otros parámetros como score de Gleason, afectación extracapsular, invasión de vesículas seminales, etc. En nuestra serie (27), hemos observado un aumento de los tumores isoecoicos en un periodo de 10 años. En el periodo 1994-1997 la media de tumores isoecoicos fue del 18% aumentando al 43% (p=0,0001) en el periodo 2001-2003, este aumento se ha asociado a una disminución de los niveles de PSA y de las alteraciones al tacto rectal al diagnóstico de forma significativa.
En algunas ocasiones el cáncer de próstata se puede sospechar por lo que algunos autores han denominado como signos indirectos (34), o signos de alarma (40-42) como: asimetría de la zona periférica, deformidades del contorno, ecograma abigarrado y distorsión o desaparición de la anatomía interna de la glándula.
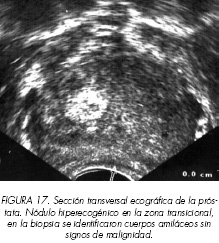
Aproximadamente el 20% de los tumores de próstata se desarrollan en la zona transicional. Esta zona va experimentando modificaciones ecogénicas durante el desarrollo de la hiperplasia benigna de la próstata, pudiéndose observan desde nódulos hipoecoicos (Figura 15), nódulos mixtos (Figura 16) y nódulos hiperecoicos (Figura 17) sin que se haya podido establecer una relación entre la imagen ecográfica y los hallazgos histológicos.
Determinación del estadio local en el cáncer de próstata.
El conocimiento lo más exacto posible de la extensión en patología tumoral es esencial para indicar el tratamiento más apropiado para cada paciente. Cuando no existen signos de enfermedad diseminada (N0,M0) la invasión de las vesículas seminales es aceptada como un signo de enfermedad de mal pronóstico, mientras que la sospecha de extensión tumoral a la grasa periprostática nos obligaría a reconsiderar la indicación de cirugía radical o a modificar la técnica quirúrgica a emplear.
1 – Determinación de la invasión periprostática.
La cápsula prostática se considera como una expansión del estroma fibromuscular con una composición variable de fibras de músculo liso según el área anatómica evaluada. Esta cápsula es incompleta, está ausente en el ápex prostático y en la base de la próstata, siendo inseparable de la porción glandular. Su espesor oscila entre los 0,5 y los 2 mm. Debido a su ausencia de glándulas, ecográficamente se debería de identificar como una estructura hipoecoica que rodeara de forma parcial la próstata, pero por su pequeño grosor es muy difícil de identificar en la ecografía. Lo que se observa en la ecografía es la diferencia de ecogenicidad existente ente la próstata y el tejido graso que la rodea, lo que se denomina ecograma capsular (43).
La mayoría de los autores coinciden en considerar a las alteraciones que se observan en la banda hiperecoica que rodea a la glándula, en continuidad con un nódulo hipoecoico, como un signo de invasión extracapsular (44-48). La invasión de la grasa periprostática por el tumor se sospechará si existe: a) deformación del ecograma capsular por la protrusión de un nódulo hipoecoico (Figura 2); b) emisión de prolongaciones digitiformes hipoecoicas sin solución de continuidad con el nódulo hipoecoico (Figura 18); y c) desaparición del ecograma capsular entre la próstata y las estructuras vecinas, generalmente con el recto (Figura 19).
Con los transductores ecográficos de 7-7,5 Mhz de frecuencia utilizados en la actualidad la sensibilidad para detectar la invasión del espacio periprostático es del 38%-63% con una especificidad del 76%-90% y un valor predictivo positivo del 55%-94% (44-50). Esta baja rentabilidad de la ecografía en la detección de la extensión extracapsular es debido a varias razones: a) la enfermedad extracapsular microscópica o focal es indetectable mediante ETR; b) las alteraciones del ecograma capsular no siempre son debidos al tumor, pudiendo deberse a tractos fibrosos o neurovasculares (43); y c) un porcentaje de pacientes no despreciable sometidos a prostatectomía radical no presentaban nódulo hipoecoico identificable, no cumpliéndose el requisito previo para la identificación de la afectación extracapsular.
2 – Determinación de la invasión de las vesículas seminales.
La invasión de las vesículas seminales en el cáncer de próstata se puede realizar a través de 3 rutas (51): Tipo I – de forma retrógrada a través de los conductos eyaculadores y el espacio extraprostático invaginado (40%); Tipo II – invasión directa desde la base de la próstata con afectación del tejido periprostático y perivesicular o no (30%); y, Tipo III – focos aislados (micrometástasis) en el seno de las vesículas seminales sin contacto con el tumor primario (30%). En la serie de Villers (52) el 91% de las vesículas invadidas lo fueron según el tipo I. En la de Ohori (53) el 84% lo fueron según el tipo I o II y solo el 16% según el tipo III.
No existe una unanimidad de criterio para definir cuál o cuáles son los signos ecográficos de sospecha de invasión de las vesículas seminales. Se han descrito los siguientes: asimetría (48,49,54,55), dilatación (48,54,55), signo de la adhesión (43,54) (obliteración del ángulo prostato-seminal) parcial (Figura 20) o total (Figura 21 ), desplazamiento anterior de la vesícula en relación con la pared rectal mayor de 1 cm (44,46,47,54,55), hiperecogenicidad en alguna zona de la vesícula (47,48,55) (Figura 22) y existencia de una zona hipoecoica en la base de la próstata adyacente a la vesícula seminal (44,46,54). La combinación de 2 o más signos aumenta la probabilidad de que exista la invasión.
La sensibilidad de la ecografía para la detección de la invasión de las vesículas seminales es del 14%-90%, la especificidad del 76%-100% y el valor predictivo positivo del 24%-100% (44,46,47,49,50,53). Las grandes diferencias observadas entre las distintas series publicadas pueden deberse a: a) la variabilidad en la anatomía normal de las vesículas seminales (55), b) los cambios inducidos por el desarrollo de la hiperplasia benigna concomitante; c) la gran disparidad de criterios ecográficos existentes para definir la invasión de las vesículas seminales; y, d) la ecografía generalmente no detecta la invasión microscópica o focal tipo III (54).
Evaluación de la morfología del ápex prostático.
Myers y cols. (56) en un estudio anatómico con próstatas procedentes de autopsias y de prostatectomía radical estudiaron la morfología del ápex prostático. Agruparon las próstatas según la existencia o no de comisura anterior, demostrando que existía una estrecha relación entre la morfología del esfínter externo y la morfología del ápex (Figura 23).
La prostatectomía radical es una técnica quirúrgica de difícil realización que exige unos sólidos conocimiento anatómicos, una planificación previa y una cierta destreza manual para su ejecución. El tiempo quirúrgico conocido como disección apical es especialmente difícil o delicado, ya que de su ejecución dependerán la continencia urinaria, la conservación de la erección y, en gran medida, la existencia o no de márgenes quirúrgicos positivos. Por lo tanto el conocimiento previo a la cirugía de la morfología del ápex prostático sería de gran ayuda para la planificación de dicho tiempo quirúrgico.
La ecografía puede ayudarnos a identificar a los pacientes con escotadura anterior en el ápex prostático antes de la prostatectomía (57). En los pacientes sin escotadura anterior, la morfología del ápex se modifica en función del crecimiento de la hiperplasia benigna concomitante (abombamiento del labio anterior del ápex), pero en los cortes ecográficos longitudinales centrados sobre el ápex se observa que el labio posterior del mismo no se prolonga más distalmente que el labio anterior (Figura 24). En cambio, cuando existe escotadura anterior ecográficamente se observa que el labio posterior del ápex se prolonga más distalmente que el anterior (Figura 25), existiendo un plano graso entre la cara posterior de la uretra y dicho labio posterior; cuando es mucho más prominente, en los cortes transversales parece abrazar la cara posterior y laterales de la uretra (Figura 26).
Evaluación de la anastomosis vesico uretral prostprostatectomía.
La anastomosis vesico-uretral en las secciones ecográficas longitudinales tiene generalmente forma cónica con vértice distal. El plano graso retroanastomótico, que se observa como una línea hiperecoica entre la pared vesical y la rectal, tiene que ser homogéneo y bien delimitado para considerarse normal (Figura 27). Entre el 40% y el 80% de las veces se identifica un nódulo, generalmente hipoecoico, en la cara anterior de la anastomosis que protruye en su interior que se cree debido a tejido vesical o de la propia anastomosis empujado por el complejo venoso dorsal ligado (Figura 28).
La ecografía transrectal postprostatectomía se ha utilizado fundamentalmente para la detección de la recidiva local y la detección de calcificaciones intranastomóticas debido a migración de suturas (Figura 29). La recidiva local puede manifestarse como un nódulo hipoecoico situado posteriormente a la anastomosis (Figura 30) o como una irregularidad del plano graso retroanastomótico (Figura 31). La baja especificidad obtenida por la ecografía en la detección de la recidiva local es debido a: a) el tejido fibroso maduro es hipocelular con un gran contenido de colágeno presentando muy pocas interfases acústicas y comportándose ecográficamente como hipoecoico (58,59) b) la existencia, en ocasiones, de restos de tejido prostático normal o hiperplásico puede producir nódulos hipoecoicos (60-62); y c) la recidiva mínima no tiene el suficiente volumen tumoral para que se modifique la imagen normal de la anastomosis vesico-uretral (59,63).
Conclusiones
Actualmente las imágenes obtenidas mediante ecografía transrectal de la próstata no tienen la suficiente sensibilidad y especificidad en el cáncer de próstata para su utilización de forma aislada. En el diagnostico del cáncer de próstata el papel de la ecografía transrectal se limita, sobre todo, a la localización de las zonas que se quieren biopsiar. En el estudio de extensión tumoral el rendimiento es inferior al demostrado por la asociación de otros parámetros como: PSA, tacto rectal y score de Gleason integrados en estudios multivariantes o nomogramas.
También en el diagnóstico de la recidiva local ha sido desplazada por la evaluación de otros factores como: el tiempo desde la prostatectomía hasta la elevación del PSA, el tiempo de duplicación del PSA, etc. Sin embargo el estudio ecográfico de la morfología del ápex prostático puede ser de utilidad para la planificación y ejecución de la disección apical durante la prostatectomía radical.
A pesar de ello creemos que el estudio y conocimiento de la morfología normal con sus posibles variantes anatómicas y las alteraciones ecográficas que producen las distintas patologías prostáticas es básico para todo Urólogo, sobre todo si realiza biopsias de próstata ecodirigidas. Recomendamos dos atlas de ecografía transrectal de la próstata (64-65) para aquellos que quieran profundizar más en su estudio.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
1. JEMAL, A.; MURRAY, T.; WARD, E.: Cancer Statistics, 2005. Ca Cancer J. Clin., 55: 10, 2005. [ Links ]
2. BRAY, F.; FERLAY, R.S.; PARKIN, D.M.: Estimates of cancer incidence and mortality in Europe in 1995. Eur. J. Cancer, 38: 99, 2002. [ Links ]
3. HERRANZ AMO, F.; ARIAS FUNEZ, F.; ARRIZABALAGA MORENO, M. y cols.: El cáncer de próstata en la Comunidad de Madrid en el año 2000. I – Incidencia. Actas Urol. Esp., 27: 323, 2003. [ Links ]
4. WATANABE, H.; KAIHO, H.; TANAKA, M. y cols.: Diagnostic application of ultrasonotomography to the prostate. Invest. Urol., 8: 548, 1971. [ Links ]
**5. HERRANZ AMO, F.: Ecografía transrectal de próstata. Doyma SA. Barcelona, 1998. [ Links ]
*6. COONER,W.H.; MOSLEY, B.R. ; RUTHERFORD, C.L. y cols.: Prostate cancer detection in a clinical urological practice by ultrasonography, digital rectal examination and prostate specific antigen. J. Urol., 143: 1146, 1990. [ Links ]
*7. LEE, F.; TORP-PEDERSEN, S.T.; SIDERS, D.B.: Use of transrectal ultrasound in diagnosis, guided biopsy, staging, and screening of prostate cancer. Urology, 33: 7, 1989. [ Links ]
8. HAMPER, U.M.; SHETH, S.: Prostate ultrasonography. Semin. Roentgenol., 28: 57, 1993. [ Links ]
9. KABALIN, J.N.; HODGE, K.K.; McNEAL, J.E. y cols.: Identification of residual cancer in the prostate following radiation therapy: role of transrectal ultrasound guided biopsy and prostate specific antigen. J. Urol., 142: 326, 1989. [ Links ]
10. TERRIS, M.K.; McNEAL, J.E.; STAMEY, T.A.: Transrectal ultrasound imaging and ultrasound guided prostate biopsies in the detection of residual carcinoma in clinical stage A carcinoma of the prostate. J. Urol., 147: 864, 1992. [ Links ]
11. PARRA, R.O.; WOLF, R.M.; HUBEN, R.P.: The use of transrectal ultrasound in the detection and evaluation of local pelvis recurrences after a radical urological pelvic operation. J. Urol., 144: 707, 1990. [ Links ]
12. BLASKO, J.C.; RAGDE, H.; GRIMM, P.D.: Transperineal ultrasound-guided implantation of the prostate: morbidity and complications. Scand. J. Urol. Nephrol., 137: 113, 1991. [ Links ]
13. WIEDER, J.; SCHMIDT, J.D.; CASOLA, G. y cols.: Transrectal ultrasound-guided transperineal cryoablation in the treatment of prostate carcinoma: preliminary results. J. Urol., 154: 435, 1995. [ Links ]
14. GELET, A.; CHAPELON, J.Y.; BOUVIER, R. y cols.: Treatment of prostate cancer with transrectal focused ultrasound: early clinical experience. Eur. Urol., 29: 174, 1996. [ Links ]
15. McNEAL, J.E.: Regional morphology and pathology of the prostate. Am. J. Clin. Pathol., 49: 347, 1968. [ Links ]
*16. SHINOHARA, K.; WHEELER, T.M.; SCARDINO, P.T.: The appearance of prostate cancer on transrectal ultrasonography: correlation of imaging and pathological examinations. J. Urol., 142: 76, 1989. [ Links ]
17. LEE, F.; GRAY, J.M.; McLEARY, R.D. y cols.: Prostatic evaluation by transrectal sonography: criteria for diagnosis of early carcinoma. Radiology, 158: 91, 1986. [ Links ]
18. WATERHOUSE, R.L.; RESNICK, M.I.: The use of transrectal prostatic ultrasonography in the evaluation of patients with prostatic carcinoma. J. Urol., 141: 233, 1989. [ Links ]
19. COONER, W.H.; MOSLEY, B.R.; RUTHERFORD, C.L. y cols.: Prostate cancer detection in a clinical urological practice by ultrasonography, digital rectal examination and prostate specific antigen. J. Urol., 143: 1146, 1990. [ Links ]
20. RIFKINM, D.; CHOI, H.: Implications of small, peripheral hypoecoic lesions in endorectal US of the prostate. Radiology, 166: 619, 1988. [ Links ]
21. VALLANCIEN, G.; PRAPOTNICH, D.; VEILLON, B. y cols.: Systematic prostatic biopsies in 100 men with no suspicion of cancer on digital rectal examination. J. Urol., 146: 1308, 1991. [ Links ]
22. HODGE, K.H.; McNEAL, J.E.; STAMEY, T.A.: Ultrasound guided transrectal core biopsies of the palpably abnormal prostate. J. Urol., 142: 66, 1989. [ Links ]
23. FERNÁNDEZ GONZÁLEZ, I.; RUIZ RUBIO, J.L.; LLORENTE ABARCA, C. y cols.: Rendimiento de la biopsia transrectal ecodirigida en el diagnóstico del cáncer de próstata. Arch. Esp. Urol., 48: 587, 1995. [ Links ]
24. DEVONEC, M.; FENDLER, J.P.; MONSAILLIER, M. y cols.: The significance of the prostatic hypoecoic area: results in 226 ultrasonically guided prostatic biopsies. J. Urol., 143: 316, 1990. [ Links ]
*25. HERRANZ AMO, F.; VERDÚ TARTAJO, F.; DÍEZ CORDERO, J.Mª. y cols.: Relación entre los nódulos hipoecoicos periféricos de la glándula prostática y el cáncer de próstata. Actas Urol. Esp., 20: 725, 1996. [ Links ]
26. ROBERTS, R.O.; BERGSTRALH, E.J.; LIEBER, M.M. y cols.: Digital rectal examination and prostate-specific antigen abnormalities at the time of prostate biopsy and biopsy outcomes, 1980 to 1997. Urology, 56: 817, 2000. [ Links ]
*27. HERRANZ AMO, F.; DÍEZ CORDERO, J.Mª.; VERDÚ TARTAJO, F. y cols.: Evolución de las características clínicas, ecográficas y patológicas de los pacientes con indicación de ecografía transrectal y biopsia de próstata entre 1994 y 2003. Actas Urol. Esp., 29: 55, 2005. [ Links ]
28. LEE, F.; TORP-PEDERSEN, S.; LITTRUP, P.J. y cols.: Hypoechoic lesions of the prostate: clinical relevance of tumor size, digital rectal examination, and prostate-specific antigen. Radiology, 170: 29, 1989. [ Links ]
29. OYEN, R.H.; VAN DE VOORDE, W.M.; VAN POPPEL, H.P. y cols.: Bening hyperplastic nodules that originate in the peripheral zone of the prostate gland. Radiology, 189: 707, 1993. [ Links ]
30. HAMPER,U.M.; SHETH, S.; SAVADER, B.L.: Positional hypoechoic lesions on transrectal sonography of the prostate. AJR, 155: 1138, 1990. [ Links ]
31. SPERANDEO, G.; SPERANDEO, M.; MORCALDI, M. y cols.: Transrectal ultrasonography for the early diagnosis of adenocarcinoma of the prostate: A new maneuver designed to improve the differentiation of malignant and benign lesions. J. Urol., 169: 607, 2003. [ Links ]
32. CHODAK, G.W.: Screening for prostate cancer: Role of ultrasonography. Urol. Clin. North Am., 16: 657, 1989. [ Links ]
33. RIFKIN, M.D.; McGLYNN, E.T.; CHOI, H.: Echogenicity of prostate cancer correlated with histologic grade and stromal fibrosis: Endorectal US studies. Radiology, 170: 549, 1989. [ Links ]
34. EGAWA, S.; WHEELER,T.M.; SCARDINO, T.: Unusual hyperechoic appearance of prostate cancer on transrectal ultrasonography. Br. J. Urol., 69: 169, 1992. [ Links ]
35. HAMPER, U.M.; SHETH, S.; WALSH, P.C. y cols.: Bright echogenic foci in early prostatic carcinoma: sonographic and pathologic correlation. Radiology, 176: 339, 1990. [ Links ]
36. DUBE, V.; FARROW, G.M.; GREENE, L.F.: Prostatic adenocarcinoma of ductal origin. Cancer, 32: 402, 1973. [ Links ]
37. DÄHNERT,W.F.; HAMPER,U.M.; EGGLESTON, J.C. y cols.: Prostatic evaluation by transrectal sonography with histopathologic correlation: The echogenic appearance of early carcinoma. Radiology, 158: 97, 1986. [ Links ]
*38. MAYAYO DEHESA,T.: Ecografía transrectal y cáncer de próstata. Visión personal. Arch. Esp. Urol., 46: 755, 1993. [ Links ]
39. ELLIS,W.J.; BRAWER, M.K.: The significance of isoechoic prostatic carcinoma. J. Urol., 152: 2304, 1994. [ Links ]
40. ESPUELA ORGAZ, R.; NOGUERAS GIMENO, M.A.; ABAD MENOR, F. y cols.: Ecografía transrectal de próstata: Técnica e indicaciones. Actas Urol. Esp., 9: 317, 1985. [ Links ]
41. NOGUERAS GIMENO, M.A.; MARTÍNEZ PÉREZ, E.; PÉREZ ARBEJ, J.A. y cols.: Ecografía transrectal y cáncer de próstata. Urol. Integr. Invest., 1: 277, 1996. [ Links ]
42. ESPUELA ORGAZ, R.; NOGUERAS GIMENO, M.A.; ABAD MENOR, F. y cols.: Ecografía transrectal de próstata: evaluación actual. Arch. Esp. Urol., 43: 65, 1990. [ Links ]
43. HASEGAWA, Y.; SAKAMOTO, N.: Correlation between ultrasonic appearance and histology of periprostatic tissue. Eur. Urol., 24: 66, 1993. [ Links ]
44. WOLF, J.S. Jr.; SHINOHARA, K.; NARAYAN, P.: Staging of prostate cancer. Accuracy of transrectal ultrasound enhanced by prostate-specific antigen. Br. J. Urol., 70: 534, 1992. [ Links ]
45. HAMPER, U.M.; SHETH, S.; WALSH, P.C. y cols.: Capsular transgresion of prostatic carcinoma: evaluation with transrectal US with pathologic correlation. Radiology, 178: 791, 1991. [ Links ]
46. WOLF, J.S. Jr.; SHINOHARA, K.; CARROLL, P.R. y cols.: Combined role of transrectal ultrasonography, Gleason score, and prostate-specific antigen in predicting organ-confined prostate cancer. Urology, 42: 131, 1993. [ Links ]
47. GOHJI, K.; MORISUE, K.; KIZAKI, T. y cols.: Correlation of transrectal ultrasound imaging and the results of systematic biopsy with pathological examination of radical prostatectomy specimens. Br. J. Urol., 75: 758, 1995. [ Links ]
48. ORVIK, J.; HALVORSEN, O.J.; SERVOLL, E. y cols.: Transrectal ultrasonography to asses local extent of prostatic cancer before radical prostatectomy. Br. J. Urol., 73: 65, 1994. [ Links ]
49. ANDRIOLE, G.L.; COPLEN, D.E; MIKKELSEN, D.J. y cols.: Sonographic and pathological staging of patients with clinically localized prostate cancer. J. Urol., 142: 1259, 1989. [ Links ]
50. HERRANZ AMO, F.; DÍEZ CORDERO, J.M.ª.; VERDÚ TARTAJO, F. y cols.: Eficacia de la ecografía transrectal en el estadiaje local del cáncer de próstata. Actas Urol. Esp., 21: 565, 1997. [ Links ]
51. WHEELER, T.M.: Anatomic considerations in carcinoma of the prostate. Urol. Clin. North Am., 16: 623, 1989. [ Links ]
52. VILLERS, A.A.; McNEAL, J.E.; REDWINE, E.A. y cols.: Pathogenesis and biological significance of seminal vesicle invasion in prostatic adenocarcinoma. J. Urol., 143: 1183, 1990. [ Links ]
53. OHORI, M.; SHINOHARA, K.; WHEELER, T.M. y cols.: Ultrasonic detection of non-palpable seminal vesicle invasion: A clinicopathological study. Br. J. Urol., 72: 799, 1993. [ Links ]
54. HARDEMAN, S.W.; CAUSEY, J.Q.; HICKEY, D.P. y cols.: Transrectal ultrasound for staging prior to radical prostatatectomy. Urology, 34: 175, 1989. [ Links ]
55. TERRIS, M.K.; McNEAL, J.E.; STAMEY, T.A.: Invasion of the seminal vesicles by prostatic cancer: detection with transrectal sonography. AJR, 155: 811, 1990. [ Links ]
56. MYERS, R.P.; GOELLNER, J.R.; CAHILL, D.R.: Prostate shape, external striated urethral sphincter and radical prostatectomy: The apical dissection. J. Urol., 138: 543, 1987. [ Links ]
*57. HERRANZ AMO, F.: Morfología ecográfica del ápex prostático: implicaciones en su disección durante la prostatectomía. Actas Urol. Esp., 28: 413, 2004. [ Links ]
58. WASSERMAN, N.F.; KAPOOR, D.A.; HILDEBRANDT, W.C. y cols.: Transrectal US in evaluation of patients after radical prostatectomy. Part II. Transrectal US and biopsy findings in the presence of residual and early recurrent prostatic cancer. Radiology, 185: 367, 1992. [ Links ]
59. ABI-AAD, A.S.; MACFARLANE, M.T.; STEIN, A. y cols.: Detection of local recurrence after radical prostatectomy by prostate specific antigen and transrectal ultrasound. J. Urol., 147: 952, 1992. [ Links ]
60. GOLDENBERG, S.L.; CARTER, M.; DASHEFSKY, S. y cols.: Sonographic characteristics of the urethrovesical anastomosis in the early post-radical prostatectomy patient. J. Urol., 147: 1307, 1992. [ Links ]
61. FOSTER, L.S.; JAJODIA, P.; FOURNIER, G. Jr. y cols.: The value of prostate specific antigen and transrectal ultrasound guided biopsy in detecting prostatic fossa recurrences following radical prostatectomy. J. Urol., 149: 1024, 1993. [ Links ]
62. FOWLER, J.E. Jr.; BROOKS, J.; PANDEY, P. y cols.: Variable histology of anastomotic biopsies with detectable prostate specific antigen after radical prostatectomy. J. Urol., 153: 1011, 1995. [ Links ]
63. KAPOOR, D.A.; WASSERMAN, N.F.; ZHANG, G. y cols.: Value of transrectal ultrasound in identifying local disease after radical prostatectomy. Urology, 41: 594, 1993. [ Links ]
**64. MAYAYO DEHESA, T.: Atlas de ecografía transrectal de próstata. Abbot laboratories S.A. Madrid, 1996. [ Links ]
**65. HERRANZ AMO, F.: Atlas de ecografía transrectal de próstata. Doyma, Barcelona, 2000. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Felipe Herranz Amo
C/ Lira, 4 8º B
Madrid 28007. (España)
felipeherranz@telefonica.net