Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.39 supl.1 Madrid dic. 2013
https://dx.doi.org/10.4321/S0376-78922013000500010
De la biología al injerto de tejido adiposo: cómo mejorar el lipoinjerto
From biology to fat grafting: how to improve lipofilling
Girard, A.C.*; Mirbeau, S.*; Atlan, M.**; Festy, F.*; Roche, R.* y Hoareau, L.*
*ADIP'sculpt, Plataforma CYROI, Sainte Clotilde, Isla de la Reunión, Francia
**Jefe del Departamento de Cirugía Plástica y Reconstructiva, Centro hospitalario General de Pontoise/René Dubos, Inserm, Francia
Agradecimiento al grupo Clinifutur, y al Ministerio de Educación Nacional y de Investigación por el apoyo financiero.
Dirección para correspondencia
RESUMEN
A pesar de que el uso del injerto de grasa ha ganado popularidad, no hay consenso sobre la mejor manera de manejar el tejido adiposo. Los protocolos difieren y los resultados son a menudo variables. Diversos factores influyen en la calidad de la grasa inyectada, entre los que encontramos las moléculas tóxicas provenientes de la infiltración, procedimiento previo a la liposucción. En este trabajo, hemos confirmado el efecto nocivo de los anestésicos sobre las células madre derivadas del tejido adiposo, determinando el efecto del lavado y la centrifugación en el tejido graso con el fin de proponer un protocolo simple y optimizado para mejorar la supervivencia del injerto.
Evaluamos la citotoxicidad de la lidocaína sobre las células madre derivadas de tejido adiposo (ADSC) mediante ensayo de LDH. Sometimos el tejido adiposo conjunto a varios tipos de centrifugación (de 1 segundo a 10 minutos y desde 0 g a 1800 g), y el volumen de líquido y el aceite liberado se midió inmediatamente después de la centrifugación. Tras la determinación de las condiciones óptimas para la manipulación de tejidos (400 g/1 minuto), inyectamos el tejido adiposo de liposucción sin o con lidocaína en ratones inmunodeficientes. Un mes después de la inyección, evaluamos la calidad de los injertos mediante histología, y en comparación con los injertos obtenidos a partir de un protocolo convencional: una simple sedimentación.
La lidocaína ejerce un efecto citotóxico sobre las ADSC, y este efecto depende del tiempo de incubación y de las concentraciones. En cuanto al tejido adiposo, una centrifugación intensa (900 g, 1800 g) es perjudicial en comparación con una centrifugación suave (100 g, 400 g). Además, las secciones histológicas de los injertos de tejido adiposo no centrifugados mostraron la presencia de grandes vacuolas de aceite mientras que los injertos resultantes de lavado con protocolo de centrifugación suave (400g/1minuto) no lo hacen.
En conclusión, creemos que se debe emplear un manejo adecuado del tejido adiposo, incluyendo lavado y centrifugación, con el fin de eliminar el líquido de infiltración y las moléculas tóxicas asociadas que son perjudiciales para los injertos. Sin embargo, no recomendamos una centrifugación intensa ya que conduce muy rápidamente a una mayor muerte celular. Por lo tanto, una centrifugación suave (400 g/1 minuto) precedida de lavados, parece ser el protocolo más apropiado para la reinyección del tejido adiposo.
Palabras clave: Injerto de grasa autóloga, Lidocaina, Centrifugacion, Células madre derivadas de tejido adiposo.
Código numérico: 19-104-15841.
ABSTRACT
While fat grafting for soft tissue filling has gained popularity, there is no consensus on the best way how to handle adipose tissue. Protocols differ and results are often highly variable. Various factors influence the quality of injected fat, among which the toxic molecules coming from infiltration procedure prior to liposuction. In this work, we have confirmed the deleterious effect of anesthetics on adipose-derived stem cells, and determined the effect of washing and centrifugation on adipose tissue, in order to propose a simple and optimized protocol to improve graft survival.
Lidocaine cytotoxicity on adipose-derived stem cells (ADSCs) was evaluated by LDH assay. Then, whole adipose tissue was subjected to various centrifugation types (from 1 sec to 10 min and from 0 g to 1800 g), and volume of liquid and oil released were measured immediately after centrifugation. After determination of the optimal conditions for tissue handling (400 g/1 min), adipose tissue from liposuction made without or with lidocaine was injected into immunodeficient mice. One month after injection, quality of the grafts was evaluated by histology, and compared with grafts obtained from one conventional protocol: a simple settling.
Lidocaine exerts a cytotoxic effect on ADSCs, and this effect is dependent on the incubation time and concentrations. Concerning adipose tissue, strong centrifugation (900 g, 1800 g) is deleterious compared to the low centrifugation (100 g, 400 g). In addition, histological sections of the non-centrifuged adipose tissue grafts shows the presence of extensive oil vacuoles, whereas the grafts resulting from washing with soft centrifugation protocol (400 g/1 min) do not.
To conclude that appropriate handling of adipose tissue, including washing and centrifugation, should be done in order to remove infiltration liquid and associated toxic molecules, which are deleterious for the grafts. However, strong centrifugation is not recommended since it leads very quickly to greater cell death. Thus, soft centrifugation (400 g/1 min), preceded by washings, seems to be the most appropriate protocol for the re-injection of adipose tissue.
Key words: Autolougous fat grafting, Lidocaine, Centrifugation, Adipose-derived stem cells.
Numeral Code: 19-104-15841.
Introducción
El tejido adiposo se ha utilizado durante más de un siglo para el relleno de tejidos blandos y está considerado como uno de los mejores materiales para restaurar las deficiencias de volumen tanto con fines estéticos como reconstructivos. En la actualidad, el injerto de grasa ha ganado popularidad y ha extendido sus campos de aplicación.
Mientras que las ideas y las técnicas han evolucionado considerablemente con el fin de diseñar el mejor protocolo posible para su uso, la principal desventaja de la técnica continúa siendo la reabsorción del injerto graso (1), que provoca resultados impredecibles y hace necesaria la sobrecorrección, lo cual puede conducir a postoperatorios indeseados, hematomas y edema. La técnica de Coleman, llamada lipoestructura (2), se ha utilizado en todo el mundo y se ha convertido en un referente internacional. Proporciona un elemento esencial que es la manipulación atraumática del tejido adiposo antes de su reinyección. Pero a pesar de los grandes avances realizados por Coleman, la técnica todavía no es perfecta ya que el mantenimiento del injerto no es óptimo. Por lo tanto, con el tiempo, los cirujanos siguen tratando de perfeccionar el protocolo para optimizar aún más la supervivencia celular y mejorar aún más los resultados estéticos.
Por otra parte, en los últimos años ha aumentado el conocimiento sobre la biología del tejido adiposo, especialmente en esta última década con el descubrimiento de las células madre derivadas de tejido adiposo (ADSC) (3). Por supuesto, estas células son de gran importancia para la medicina regenerativa, pero también han adquirido gran interés en el campo de la estética y en la cirugía de reconstrucción. De hecho, estas células deben jugar un papel clave en la supervivencia de los injertos de grasa que nos conducirá a lograr mejores resultados con un posible proceso de regeneración de la zona tratada (4-7).
Existen muchos parámetros que pueden influir en la calidad del injerto: duración y calidad de la infiltración (efectos de los anestésicos como la lidocaína y la adrenalina), técnica de liposucción y cánula utilizados, preparación de la grasa (decantación, lavado, centrifugación...), inyección de la grasa, etc. (8). Entre los parámetros de tesis, analizamos en este estudio los efectos de la lidocaína en el tejido adiposo y en las ADSC. También centramos nuestra atención en dos técnicas que se emplean con el fin de mejorar la calidad de los injertos: la centrifugación y el lavado.
Material y Método
Origen del tejido adiposo
Obtuvimos muestras de tejido subcutáneo de grasa blanca humana de mujeres con peso normal o con ligero sobrepeso; edad media de 45 años y un índice de masa corporal medio de 23,6 kg/m2. Las pacientes se habían sometido a liposucción por razones estéticas. Excepto anticonceptivos orales, las pacientes no estaban recibiendo ninguna otra medicación en el momento de la liposucción. La cirugía se realizó bajo anestesia general y en 1 caso, bajo anestesia local.
El estudio fue aprobado por el comité de ética de la Isla de la Reunión para la protección de las personas que participan en investigación biomédica.
Protocolo de recolección del tejido adiposo
Para el ensayo de citotoxicidad (3 pacientes), obtuvimos el tejido graso con jeringas de 10 ml, manualmente, y por un mismo cirujano, después de la infiltración de una solución tumescente que contenía adrenalina 1 mg / L para 1 L de Ringer lactato (RL), pero sin lidocaína. Para la medición de líquido y aceite (3 pacientes), utilizamos lidocaína para la anestesia local (40 ml de lidocaína al 2 % + adrenalina 1 mg / L para 1 L de RL). Para el experimento in vivo de inyección de grasa en ratones, obtuvimos el tejido adiposo de 2 pacientes y mediante 2 métodos: antes de la liposucción, infiltramos primero un lado del abdomen con la misma solución tumescente sin lidocaína para prevenir sus posibles efectos y, a continuación, infiltramos el otro lado con 0,8 mg / ml de lidocaína (40 ml de lidocaína al 2 % + adrenalina 1 mg / L para 1 L de RL).
Purificación de la fracción vascular estromal y cultivo celular
Aislamos la Fracción del estroma vascular (SVF) del tejido adiposo por el procesamiento ya descrito previamente (9). Después de su digestión con colagenasa, lavado y centrifugaciones, resuspendimos el sedimento celular (SVF) en medio 199 (PAN Biotech, Francia). Previamente realizamos análisis de citometría para evaluar las características fenotípicas de las células madre derivadas de tejido adiposo (10). Sembramos 300.000 células/ cm2 en placas de 24 pocillos con M199 que contiene L-glutamina, glucosa (2 g / L), anfotericina B (10 mg / ml), estreptomicina (0,4 mg / ml) y penicilina (400 U / ml) (PAN Biotech, Francia), con 20 % de suero fetal bovino (FBS) (PAN Biotech, Francia). A continuación, cultivamos las células para la proliferación en medio con 10 % de SFB a 37 oC en 5 % de CO2 antes de los experimentos.
Tratamiento con medicamentos
Las células madre derivadas de tejido adiposo (ADSC) se mantuvieron sólo en cultivo primario, sin pasaje. Cuando llegaron a confluencia del 80 % (después de 4 días de cultivo), fueron tratadas con diferentes concentraciones clínicas de lidocaína junto con el mismo medio de cultivo: 1,7 mM (0,4 mg / ml), 3,4 mM (0,8 mg / ml), 6,8 mM (1,6 mg / ml) y para diferentes tiempos de exposición (2 horas, 4 horas y 24 horas). Las células no tratadas se utilizaron como control para cada tiempo de exposición. No detectamos ninguna variación de pH (~ 8) para cada medio de tratamiento.
Detección de citotoxicidad por ensayo de LDH
La lactato deshidrogenasa citosólica (LDH) se libera en el medio de cultivo cuando la membrana de la célula está dañada y es por lo tanto un buen indicador de citotoxicidad. Medimos la liberación de LDH en los medios utilizando un set de ensayo de citotoxicidad LDH de Sciencell (Cliniscience, Montrouge, Francia), de acuerdo con las instrucciones del fabricante. Realizamos mediciones enzimáticas de LDH liberado espectrofotométricamente a 490 nm. Empleamos Triton X-100 (1 % , Sigma) como control positivo de la muerte. Para cuantificar la citotoxicidad, correlacionamos los valores de absorbancia con el número de células viables.
Líquido y medición de aceite después de la centrifugación de la grasa recolectada
Después de la recolección, centrifugamos 50 ml de tejido adiposo (centrifuga LMC-3000, Biosan, Letonia) a diferentes velocidades y tiempos de centrifugación: no, 100 g/1 segundo, 100 g/1 minuto, 400 g/1 minuto, 900 g/1 minuto, 900 g/3 minutos, 1.800 g/10 minutos. El volumen infranadante de líquido y el sobrenadante de aceite se midieron después de la centrifugación y se expresaron como un porcentaje del volumen de tejido inicial.
Protocolos de manipulación del tejido adiposo
Realizamos los procedimientos completos, desde la infiltración y la liposucción a la manipulación de la grasa, de forma que se permitiera que el tejido adiposo estuviera 2 horas en contacto con la solución infiltrada, con o sin lidocaína. A continuación, colocamos verticalmente las jeringas de 10 ml y las dejamos reposar durante 5 minutos para eliminar la mezcla de infiltración. Para el protocolo de decantación, dejamos reposar las jeringas durante 5 minutos. Para el lavado y protocolo de centrifugación suave, transferimos 25 ml de la grasa del tejido cosechado a un tubo de 50 ml, y se enjuagaron / centrifugaron con 25 ml de Ringer lactato (100 g durante 1 segundo), seguido de un último lavado con una centrifugación suave (400 g durante 1 minuto).
Inyección del tejido adiposo preparado en ratones Beige con inmunodeficiencia combinada grave
Utilizamos ratones Beige con inmunodeficiencia combinada grave (SCID) (Charles River Laboratories, Lyon, Francia) en el experimento in vivo de los injertos de grasa. Para ambos protocolos de prueba, eliminamos el líquido infranadante y el aceite sobrenadante y a continuación, transferimos el tejido a jeringas de 1 ml para luego inyectarlo en ratones hembra SCID beige de 8 semanas de edad. El protocolo se llevó a cabo en el laboratorio de animales de CYROI, Isla de la Reunión con aprobación n o 974001 emitida por los Servicios Veterinarios de la Isla de La Reunión y aprobación del Comité de Ética CYROI para el Bienestar Animal. Para cada muestra de tejido adiposo, inyectamos 8 ratones (4 por condición) con 1 ml por lado dorso-lateral (2 ml de tejido por ratón), mediante retrotrazado con cánula de 1,6 mm de diámetro. Utilizamos el tejido adiposo de 2 pacientes para la inyección de un total de 16 ratones de los que se tomaron los lipoinjertos (x 32).
Cortes histológicos y tinción de los lipoinjertos
Sacrificamos y diseccionamos a los ratones 1 mes después de la inyección. Los injertos se conservaron en formol para posteriormente ser embebidos en parafina. Preparamos 5 secciones a micrómetro de tejido que se tiñeron con hematoxilina / eritrosina / azafrán (HES). Las fotografías fueron tomadas con un microscopio invertido, aumento x 100. Hicimos observaciones ciegas de injertos y secciones.
Análisis estadístico
Los datos se analizaron mediante ANOVA seguido de un post-test de Dunnett para las comparaciones de múltiples dosis o tiempos (JMP , SAS Institute Inc., Cary, NC). La significación estadística se estableció en p < 0,05. Los datos se expresan como media ± SEM.
RESULTADOS
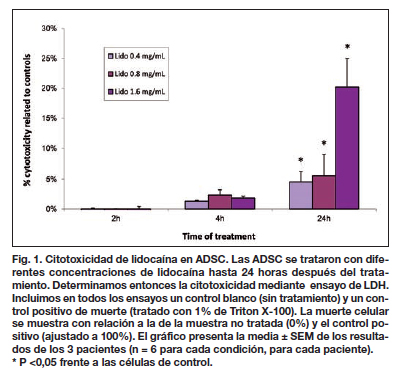
Efecto de la lidocaína sobre la viabilidad de las células madre derivadas del tejido adiposo (ADSC)
Realizamos los ensayos LDH después del tratamiento con lidocaína con el fin de medir la citotoxicidad en ADSC. La lidocaína no afectó a la viabilidad ADSC hasta las 2 horas de tratamiento (Fig. 1). La citotoxicidad comenzó a aumentar a partir de las 4 horas de tratamiento, pero los resultados no fueron significativos (Fig. 1). A las 24 horas de tratamiento, la citotoxicidad aumentó con el incremento de las dosis de lidocaína, hasta un 25 % para la dosis más alta (1,6 mg / ml). Por lo tanto, la citotoxicidad inducida por lidocaína es dependiente de la dosis y del tiempo, pero no para exposiciones cortas (< 2 horas). Sin embargo, aunque las células se incubaron sólo 2 horas con el fármaco, se podría revelar hasta un 10 % de citotoxicidad mucho tiempo después (24 horas de la exposición al fármaco; (datos no mostrados).
Llevamos a cabo los mismos experimentos en presencia de adrenalina 1:1.000.000 (solo o combinada con lidocaína) y los resultados no mostraron efecto de la adrenalina en viabilidad de las ADSC (datos no mostrados).
Efecto de la centrifugación sobre el tejido adiposo después de la cosecha
Uno de los métodos para deshacerse del efecto de la lidocaína es centrifugar el tejido adiposo. Por lo tanto, decidimos analizar el grado de muerte celular en función del tipo de centrifugación.
Sabiendo que los adipocitos que mueren liberan el aceite que contienen en sus gotas lipídicas, utilizamos esta propiedad para evaluar la viabilidad de los adipocitos en el tejido adiposo después de diferentes tipos de centrifugación midiendo el volumen de aceite liberado. Por la misma razón, medimos el volumen de líquido intersticial infranadante, que corresponde a la solución tumescente infiltrada en el sitio donante de grasa antes de la liposucción. La figura 2 muestra que tanto el porcentaje de aceite como de líquido aumentan con el aumento de la velocidad (100 g hasta 1800 g) y del tiempo (1 segundo a 10 minutos) de centrifugación. El aceite liberado después de una centrifugación suave (hasta 400 g) fue equivalente al del tejido adiposo no centrifugado(< 3 % ), por lo que no afecta a la viabilidad de los adipocitos (condiciones 2, 3 y 4). Por el contrario, se liberó más aceite (hasta un 10 % ) después de la centrifugación intensa (de 900 g), lo que corresponde a la muerte de más adipocitos (condiciones 5, 6 y 7). En cuanto al líquido intersticial, la centrifugación intensa (1800 g / 10 minutos, condición 7) permitíó extraer la mayor parte del líquido presente en el tejido adiposo (25 % del volumen total). La centrifugación más baja (100 g / 1 segundo, condición 2) podría permitir extraer menos líquido (5 % ) pero parece mejor que el protocolo de decantación (condición 1). Para las condiciones intermedias (4, 5 y 6), no detectamos diferencias estadísticas entre centrifugaciones de 400 g y de 900 g. (Fig. 2).
Estudio comparativo de la manipulación del tejido adiposo
Después de cada liposucción sin o con lidocaína, comparamos dos protocolos diferentes de manipulación del tejido adiposo en un estudio in vivo de inyección de grasa en ratones: 1. Protocolo de decantación y 2. Lavado con protocolo de centrifugación suave.
Sabiendo que la centrifugación a 100 g no afectó el tejido pero permitió extraer más líquido en comparación con la decantación (Fig. 2), decidimos seleccionar este procedimiento de centrifugación (100 g / 1 segundo) después del primer lavado, lo que fue seguido por un segundo lavado y una centrifugación suave a 400 g durante 1 minuto con el fin de extraer más líquido y para compactar la grasa antes de su inyección.
En general, el análisis histológico de los lipoinjertos reveló que la decantación conduce a peores resultados en comparación con el protocolo de lavado con centrifugaciones suaves (Fig. 3).
El protocolo de decantación conduce a la formación de vacuolas de aceite dentro de los injertos (Fig. 3, panel superior) y en condiciones de uso de lidocaína era incluso peor (Fig. 3, panel derecho superior). Por el contrario, el lavado suave y las centrifugaciones mejoraban la calidad del injerto, ya que observamos menos vacuolas de aceite, adipocitos más homogéneos (en forma y tamaño), aumento de la celularidad y más tejido conectivo (Fig. 3, panel inferior). Pero en condiciones de uso de lidocaína también fue peor para este protocolo, provocando vacuolas de aceite mayores y más heterogeneidad (Fig. 3, panel inferior derecho).
Discusión
La forma de recoger y preparar el tejido adiposo es de gran importancia para mejorar la calidad y la eficiencia de injerto adiposo. En primer lugar, es importante estudiar el efecto de los fármacos asociados al procedimiento de infiltración del tejido graso. Mientras la adrenalina (utilizada como vasoconstrictor) no afecta a las células madre derivadas de tejido adiposo (ADSC) ( datos no mostrados ), la lidocaína comúnmente utilizada para la anestesia local, induce la muerte de las ADSC cuando las células están fuertemente expuestas a este medicamento. Estos datos son consistentes con otros estudios previos (11). Sin embargo, la lidocaína no afecta directamente a la viabilidad de las ADSC a baja concentración y a tiempo de exposición corto (menos de 2 horas). Como hemos mostrado anteriormente, aunque las células permanezcan en contacto con el fármaco menos de 2 horas, la lidocaína todavía ejerce efectos citotóxicos que pueden ser visibles después de 24 horas (9) .
Las ADSC han cobrado gran interés en el campo de la transferencia de grasa autóloga. La idea es que, gracias a las propiedades de las células madre de tejido adiposo, la preservación de ADSC vivas podrían favorecer la neovascularización y la regeneración del tejido adiposo (mediante la sustitución de los adipocitos muertos), mejorando así la supervivencia del injerto de grasa y su eficiencia (5 , 12 , 13) .
Con el fin de deshacernos del efecto perjudicial de la lidocaína, hemos probado los efectos de dos técnicas, la centrifugación y el lavado, del tejido adiposo. En cuanto a la centrifugación, la muerte celular se correlaciona con la velocidad y el tiempo de la misma, pero se mantiene baja por debajo de 400 g. El líquido liberado también se correlaciona con la velocidad y el tiempo de centrifugación, pero no hay diferencia estadística entre 400 g y 900 g. Por lo tanto, sabiendo que la centrifugación intensa ya ha sido señalada como una causa de daño del tejido adiposo y de las ADSC (14-16), la centrifugación suave a 400 g (1 minuto) representa un buen compromiso de cara al objetivo de nuestro estudio (17, 18).
Acerca del lavado, Alexander describe su efecto sobre el tejido adiposo (18) mediante la medición de los restos de lidocaína. Obtiene la conclusión de que el lavado permite eliminar una parte de la lidocaína infiltrada en el tejido adiposo, y aconseja al menos 2 lavados con el fin de eliminar la mayor parte de la droga. Pero los pasos de lavado por sí solos no son suficientes ya que todavía se pueden observar algunos restos de la droga. Por lo tanto, nuestro estudio sobre el efecto de centrifugación permite definir un protocolo de combinación de lavados (al menos 2) y de centrifugaciones suaves que mejoran claramente la extracción de líquidos remanentes tal y como se muestra en la figura 2.
Por último, ya que no hay consenso sobre el mejor protocolo a emplear para la transferencia de grasa autóloga, proponemos aquí un método sencillo que permite preservar las ADSC, lo que podría a su vez permitir una reducción de la isquemia y la malnutrición de las células dentro del injerto, que a su vez mejoraría la calidad del injerto de grasa. Este método es un procedimiento no traumático que implica centrifugaciones y lavados suaves que eliminan los elementos nocivos (anestésicos, eventuales citocinas inflamatorias). Por otra parte, en comparación con el procedimiento de simple decantación, mostramos que este método es eficaz en un modelo de inyección de grasa en ratones, ya que pudimos mejorar la calidad de los injertos. Sin embargo, la lidocaína sigue siendo perjudicial para el tejido adiposo incluso para exposiciones de 2 horas. Este método se puede mejorar mediante la adición de un tercer lavado del tejido adiposo antes de su inyección.
Conclusiones
De acuerdo con todos estos resultados, sugerimos que durante la anestesia general sea de elección la infiltración sin anestesia y con adrenalina. Por otra parte, se debe evitar el anestésico en el lugar de la infiltración debido a la muy alta concentración que habitualmente se emplea. Cuando se usa anestesia local, la infiltración debe ser la menor posible con bajas dosis de lidocaína y, con el fin de eliminar totalmente las moléculas tóxicas, el tejido adiposo debe ser lavado y centrifugado al menos dos veces.
Declaración
Los autores declaran no tener asociaciones comerciales o financieras que pudieran crear un conflicto de intereses con alguno de los productos mencionados en este artículo. Este trabajo ha sido financiado por el Ministère de l'Enseignement Supérieur et de la Recherche y la compañía Adi-sculpt.
Agradecimientos
Agradecemos su colaboración a los cirujanos plásticos P. Delarue y O. Hulard que participaron en este estudio y permitieron la recolección de muestras de tejido adiposo subcutáneo. Por último, nos gustaría dar las gracias a todos los pacientes que hicieron posible este estudio al consentir la recogida de muestras de tejido.
Bibliografía
1. Coleman, S.: Structural fat grafting. St. Louis, Mo.: Quality Medical Pub., 2004. Pp: 75-102. [ Links ]
2. Coleman, S. R.: Facial recontouring with lipostructure. Clin Plast Surg 1997,24: 347-367. [ Links ]
3. Zuk, P. A., Zhu, M., Ashjian, P., et al.: Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell 2002, 13: 4279-4295. [ Links ]
4. Coleman, S. R.: Structural fat grafting: more than a permanent filler. Plast Reconstr Surg 2006, 118: 108S-120S. [ Links ]
5. Matsumoto, D., Sato, K., Gonda, K., et al.: Cell-assisted lipotransfer: supportive use of human adipose-derived cells for soft tissue augmentation with lipoinjection. Tissue Eng 2006, 12: 3375-3382. [ Links ]
6. Philips, B. J., Marra, K. G., Rubin, J. P.:Adipose stem cell-based soft tissue regeneration. Expert Opin Biol Ther 2012, 12: 155-163. [ Links ]
7. Weyand, B., Vogt, P. M.: Potential of Mesenchymal Stem Cell Applications in Plastic and Reconstructive Surgery. Adv Biochem Eng Biotechnol, 2012. DOI: 10.1007/10_2012_162. [ Links ]
8. Shiffman, M. A.: History of Autologous Fat Transplant Survival. Autologous Fat Transfer. In M. A. Shiffman (Ed.): Springer Berlin Heidelberg, 2010. Pp. 5-10. [ Links ]
9. Girard, A. C., Atlan, M., Bencharif, K., et al.: New insights into lidocaine and adrenaline effects on human adipose stem cells. Aesth Plast Surg 2013, 37: 144-152. [ Links ]
10. Festy, F., Hoareau, L., Bes-Houtmann, S., et al.: Surface protein expression between human adipose tissuederived stromal cells and mature adipocytes. Histochem Cell Biol 2005, 124: 113-121. [ Links ]
11. Keck, M., Zeyda, M., Gollinger, K., et al.: Local anesthetics have a major impact on viability of preadipocytes and their differentiation into adipocytes. Plast Reconstr Surg 2010, 126: 1500-1505. [ Links ]
12. Yoshimura, K., Suga, H., Eto, H.: Adipose-derived stem/progenitor cells: roles in adipose tissue remodeling and potential use for soft tissue augmentation. Regen Med 2009, 4: 265-273. [ Links ]
13. Yoshimura, K., Eto, H., Kato, H., et al.: In vivo manipulation of stem cells for adipose tissue repair/reconstruction. Regen Med 2001, 6: 33-41. [ Links ]
14. Kurita, M., Matsumoto, D., Shigeura, T., et al.: Influences of centrifugation on cells and tissues in liposuction aspirates: optimized centrifugation for lipotransfer and cell isolation. Plast Reconstr Surg 2008, 121: 1033-1041; discussion 1042-1033. [ Links ]
15. Conde-Green, A., Baptista, L. S., de Amorin, N. F., et al.: Effects of centrifugation on cell composition and viability of aspirated adipose tissue processed for transplantation. Aesthet Surg J 2010, 30: 249-255. [ Links ]
16. Xie, Y., Zheng, D., Li, Q., et al.: The effect of centrifugation on viability of fat grafts: an evaluation with the glucose transport test. J Plast Reconstr Aesthet Surg 2010, 63: 482-487. [ Links ]
17. Hoareau, L., Bencharif, K., Girard, A. C., et al.: Effect of centrifugation and washing on adipose graft viability: A new method to improve graft efficiency. J Plast Reconstr Aesthet Surg, 2013, XX: 1-8. [ Links ]
18. Alexander, R.W. Autologous fat grafting: a study of residual intracellular adipocyte lidocaine. Autologous Fat Transfer. In M. A. Shiffman (Ed.): Springer Berlin Heidelberg, 2010. Pp. 445-450. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dra. Anne-Claire Girard
2 rue Maxime Rivière
97490 Sainte Clotilde, Reunion Island, France
e-mail: ac.girard@adipsculpt.com