Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.26 supl.1 Pamplona 2003
Intoxicaciones medicamentosas (I). Psicofármacos y antiarrítmicos
Acute pharmacologic poisoning (I). Psychotropic and antiarrhythmic drugs
I. Osés1, G. Burillo-Putze2, P. Munné3, S. Nogué4, M.A. Pinillos5
| RESUMEN En la valoración de la Intoxicación Medicamentosa Aguda (IMA) en pacientes graves con dosis potencialmente no tóxicas del teórico fármaco responsable es importante insistir en la anamnesis en la coingesta de otros fármacos o tóxicos. Inicialmente se prestará atención a las medidas de soporte vital, oxigenando, protegiendo la vía aérea y expandiendo la volemia. El ECG es una herramienta diagnóstica de primer orden en las IMA, sobre todo por antidepresivos tricíclicos (ADT) y medicación cardiovascular. Su monitorización continua durante las primeras 12-24 horas suele ser necesaria en la mayoría de los casos. | ABSTRACT In the evaluation of Acute Drug Poisoning (ADP) in patients seriously ill with a potentially non-toxic dose of the drug that is theoretically responsible, it is important to insist on anamnesis in the coingestion of other drugs or toxics. Initially attention is given to life support measures, oxygenation, protection of the airway and expanding the volemia. The ECG is a diagnostic tool of the first order in ADPs, above all for tricyclic antidepressants (TAD) and cardio-vascular drugs. In the majority of cases continuous monitoring is usually necessary during the first 12-24 hours. |
| 1. Servicio de Medina Intensiva. Hospital de Navarra. Pamplona. 2. Servicio de Urgencias. Hospital Universitario de Canarias. Tenerife. 3. Unidad de Toxicología Clínica. Hospital Clínic. Barcelona. 4. Área de Vigilancia Intensiva y Unidad de Toxicología Clínica. Hospital Clinic. Barcelona. 5. Servicio de Urgencias. Hospital de Navarra. Pamplona. | Correspondencia: Inés Osés Munarriz Servicio de Medicina Intensiva Hospital de Navarra Irunlarrea, 3 31008 Pamplona Tfno. 948 422100 Fax 948 422303 |
INTRODUCCIÓN
La IMA es la primera causa de consulta por intoxicación en los servicios de urgencias españoles, tanto en la población adulta como pediátrica1,2. Debido a que las posibilidades etiológicas de la IMA son extensas, se han seleccionado aquellos medicamentos que son usados con más frecuencia en los intentos de autolisis, por su fácil accesibilidad, y aquellos que aunque presentan una incidencia menor, poseen importancia clínica por su potencial gravedad.
De esta manera, exponemos en este trabajo la intoxicación debida a: medicación de uso en psiquiatría (benzodiacepinas, antidepresivos tricíclicos y litio), y medicación cardiovascular (digital, betabloqueantes y antagonistas del calcio). La medicación analgésica-antiinflamatoria y antiepiléptica se presenta en otro capítulo de este número.
Los servicios de urgencias tanto de atención primaria como hospitalarios junto con los servicios de emergencias extrahospitalarios, son el primer escalón en la atención al paciente intoxicado, y generalmente el lugar donde se diagnostican, tratan y resuelven la mayoría de los casos3. No obstante, determinados fármacos precisan de una vigilancia clínica estrecha, lo que implica su transferencia a Unidades de Observación de Urgencias, o al Servicio de Cuidados Intensivos, donde poder realizar técnicas de monitorización invasiva, depuración extrarrenal, etc.
BENZODIACEPINAS
Las benzodiacepinas son los psicofármacos más prescritos y, en el conjunto de los agentes tóxicos, sólo son superados en uso por el alcohol etílico. La mayoría de las intoxicaciones son gestos suicidas de escasa gravedad y con frecuencia participan en intoxicaciones mixtas tanto con otros medicamentos, especialmente de acción antidepresiva, como con drogas de abuso. Es muy difícil que una intoxicación únicamente con benzodiacepinas ponga al paciente en una situación grave. Si se da esta situación habrá que sospechar de ingesta de alcohol u otros fármacos. La mortalidad por benzodiacepinas es de 5,9 por millón de prescripciones, cifra muy baja en comparación con la de 118 por millón atribuida a los barbitúricos4.
Según su vida media las benzodiacepinas se clasifican en:
Acción ultracorta (vida media < 5 horas): triazolam (HalcionR) midazolam (DormicumR) ketazolam (SedotimeR, MarcenR).
Acción corta (vida media 5-20 horas): alprazolam (TrankimacinR) bromacepam (LexatinR) loracepam (OrfidalR, IdalpremR).
Intermedia (vida media 20-40 horas): clonacepam (RivotrilR) cloracepato (TranxiliumR, DorkenR) lormetacepam (NoctamidR, LorametR), loprazolam (SomnovitR)
Acción larga (vida media > 40horas): diazepam (ValiumR) flunitrazepam (RohipnolR).
Mecanismo de acción
Las benzodiacepinas facilitan la actuación del neurotrasmisor GABA potenciando la entrada de cloro en la neurona postsináptica, produciendo una hiperpolarización, de efectos inhibidores: ansiolítico, miorrelajante, hipnótico y anticonvulsivante. A dosis altas llegan a producir amnesia, sedación intensa, depresión respiratoria y cardiovascular.
Cinética
Tienen una absorción completa vía oral y alcanzan el pico plasmático en función del tóxico. Presenta una elevada unión a proteínas (70-99%) y atraviesan la barrera hematoencefalica (BHE). Su metabolización es hepática y extrahepática, con metabolitos activos, lo que origina efectos prolongados. Su eliminación es renal y presentan una vida media variable que oscila entre 2 y 48 horas.
Manifestaciones clínicas
La intoxicación aguda por benzodiacepinas se caracteriza por una alteración fundamentalmente del SNC. Producen disminución del nivel de conciencia con hiporreflexia e hipotonía. Puede haber ataxia, disartria y nistagmus. En ocasiones producen excitación paradójica. Habitualmente no son graves salvo que exista patología previa o se asocie con otros depresores del SNC. La depresión respiratoria aparece en intoxicaciones graves, pudiendo complicarse con broncoaspiración. En estos casos también puede presentarse hipotensión.
Diagnóstico
Como en todas las intoxicaciones es importante la anamnesis. Las benzodiacepinas pueden detectarse en sangre y orina pero su cuantificación no es de relevancia. Se debe medir la saturación de oxígeno por oximetría de pulso y gasometría arterial si existe depresión respiratoria. La radiología de tórax está indicada siempre que se sospecha broncoaspiración. Si hay o se sospecha coingesta de otros fármacos se debe realizar ECG y analítica básica.
Tratamiento
Tras una valoración inicial del nivel de conciencia (escala de Glasgow), así como hemodinámica y respiratoria (frecuencia cardiaca, presión arterial y saturación de oxígeno), se debe monitorizar al paciente y realizar vigilancia neurológica.
Se debe asegurar una correcta oxigenación con mascarilla Venturi y, si el nivel de conciencia es bajo y/o existe depresión respiratoria severa, será preciso la intubación orotraqueal. También debe obtenerse una vía periférica para infundir cristaloides en función de su situación hemodinámica.
La descontaminación digestiva para disminuir la absorción del fármaco tiene un intervalo máximo 1-2 horas y debe realizarse con carbón activado a dosis de 1g/Kg. Con esta técnica existe riesgo de broncoaspiración, que puede ser más grave que la propia intoxicación. Sólo puede utilizarse en caso de intoxicaciones graves, mixtas y con intervalos asistenciales breves.
No es útil la diuresis forzada ni las técnicas de depuración extrarrenal para aumentar la eliminación del tóxico.
Flumazenilo
El antídoto específico es el flumazenilo. Es un antagonista competitivo de las benzodiacepinas, que también parece que revierte parcialmente la acción de otras drogas no benzodiacepínicas como baclofén, carbamacepina, etanol, meprobamato, tetrahidrocannabinol, zolpidem, etc5. El objetivo del tratamiento no es conseguir 15 puntos en la escla de Glasgow (GCS), sino mejorar el nivel de conciencia si existe caída de lengua, riesgo de broncoaspiración o depresión respiratoria. Está indicado en caso de coma profundo y/o hipoventilación, si es necesario hacer un diagnóstico diferencial en intoxicaciones mixtas y en situaciones de coma no filiado. Se utiliza también si es necesario revertir una sedación.
Inicialmente se administra un bolus de 0,1-0,25 mg en un minuto; se espera un minuto a la respuesta deseada, y en caso negativo, se repite el bolo hasta un máximo de 1-2 mg. Revierte los síntomas en 1-5 minutos pero tiene vida media corta (50 minutos) por lo que puede haber recaída en la depresión del nivel de conciencia. En caso de ingesta de benzodiacepinas de vida media larga, insuficiencia hepatocelular o ancianos está indicada la perfusión a dosis de 2 mg/6h. Se aconseja iniciar la perfusión antes de que pase por completo el efecto de los bolus. Las convulsiones son la única contraindicación absoluta y se debe utilizar si es necesario con precaución en caso de antecedentes de epilepsia o ingesta de fármacos proconvulsivantes. Si por cualquier razón se determinase el nivel de benzodiacepinas en sangre con las técnicas habituales en clínica, éste estará falsamente aumentado tras la administración de flumazenilo, por su similitud estructural química.
Se ha demostrado que el uso de flumazenilo puede dar lugar a síndrome de abstinencia, en pacientes con administración crónica de benzodiacepinas6.
Para valorar la evolución de los pacientes con intoxicación por benzodiacepinas es fundamental respetar un periodo de observación, siempre que el paciente esté sintomático (GCS < 15). En caso de que se encuentre asintomático dependerá del pico plasmático del fármaco (velocidad de absorción) y de la facilidad para penetrar el SNC (liposolubilidad): 3 horas tras diazepam y 9 horas post-temazepam. Si se hubiese administrado flumazenilo en bolus este periodo será de 3 horas como mínimo y de 6 horas en caso de tratamiento en perfusión continua.
ANTIDEPRESIVOS TRICÍCLICOS
Los antidepresivos tricíclicos (ADT) tienen una enorme trascendencia terapéutica y sobre todo toxicológica. Según los datos del Toxic Expossure Surveillance System, en el año 2000, los ADT fueron responsable del 3,9% de las intoxicaciones agudas en EE.UU., y del 69% de los casos de muertes por antidepresivos7. La introducción a principios de los 90 de los Inhibidores Selectivos de la Recaptación de Serotonina (ISRS) ha supuesto un cambio en el tratamiento de la depresión y por tanto del número de intoxicados por ADT. Pese a ello, el número de pacientes tratados con ADT no deja de crecer año tras año, debido probablemente al mayor diagnóstico y tratamiento de esta enfermedad8.
Los ADT inhiben la recaptación de noradrenalina, dopamina y serotonina, mejorando con ello la depresión, pero originando como efectos secundarios taquicardia, temblor, ansiedad, agitación y náuseas. El bloqueo de los receptores muscarínicos produce sequedad de boca, estreñimiento, retención urinaria, impotencia, midriasis y visión borrosa, pudiendo llegar a presentarse como efectos secundarios graves agitación, alucinaciones, ataxia, convulsiones y coma. También actúan bloqueando los receptores de histamina, dando lugar a somnolencia, y los receptores alfa-1 adrenérgicos, produciendo uno de sus efectos tóxicos más importantes, la vasodilatación e hipotensión ortostática. Otro de sus efectos más temidos es el bloqueo de los canales de sodio y potasio miocárdicos, con un efecto quinidina-like, produciendo depresión de la conducción miocárdica, disminución de la pendiente de la fase 0, con alargamiento del QRS, inotropismo negativo (mayor hipotensión) y prolongación del QT. Finalmente, actúan como antagonistas de receptores GABA, pudiendo producir convulsiones.
En caso de intoxicación, sus complicaciones principales son la hipotensión (14-51%), el coma (17-52%), las convulsiones (6,2%) y las arritmias (2,6%), todas ellas indicadoras de gravedad9. Aunque los efectos secundarios graves aparecen en general dentro de las 6 primeras horas postingesta, la mitad de los pacientes que fallecen lo harán en las dos primeras horas10,11.
Cinética
Los ADT presentan una absorción gastrointestinal rápida y circulación enterohepática, la cual además se verá acentuada en caso de intoxicación por el enlentecimento digestivo por efecto anticolinérgico. Una vez absorbidos presentan una alta unión a proteínas plasmáticas y un alto volumen de distribución, lo cual les proporciona una vida media larga. Poseen excreción activa de metabolitos por bilis, orina y estómago.
Diagnóstico
Se considera ingesta tóxica a aquella superior a 20 mg/Kg, y de carácter grave la superior a 40 mg/Kg. Aunque el nivel plasmático considerado tóxico corresponde a 1.000 µg/ml, el valor de la determinación plasmática es bastante limitado debido a que la concentración de ADT libre se modifica con el pH, a su alto volumen de distribución y a la enorme variabilidad individual existente en cuanto a vida media.
Junto con la clínica del paciente, el elemento diagnóstico con más valor es el electrocardiograma. El análisis del QRS en derivaciones de miembros es el mejor predictor de toxicidad por ADT. Cuando el QRS es menor de 0,1 segundos, no implica riesgo tóxico. Por el contrario cuando supera esta cifra, aparecerán convulsiones en el 34% de los intoxicados y arritmias ventriculares en el 14%. Éstas suben al 50% en caso de QRS mayor de 0,16 segundos12,13. Otro parámetro a estudiar es la presencia de la onda R en la derivación AVR. Si ésta es mayor de 3 mm, es un buen predictor de arritmias y convulsiones, con un valor predictivo positivo del 46% y una sensibilidad del 81%14 (Fig. 1).
Recientemente se ha comunicado una relación entre la aparición de Síndrome de Brugada y la concentración plasmática de ADT. Este patrón electrocardiográfico se relaciona con mayor gravedad y mayores estancias en cuidados intensivos, desapareciendo cuando los niveles de ADT disminuyen15.
Tratamiento
Todo paciente con sospecha de gravedad debe ser monitorizado electrocardiográficamente y vigilado estrechamente. En cuanto a la descontaminación, está contraindicado el jarabe de ipecacuana. No hay evidencia de que el uso de lavado gástrico más carbón sea superior a éste último solo, pudiendo recuperarse hasta un 9% de producto. Aunque la descontaminación debe realizarse dentro de la 1ª hora, puede ser eficaz con posterioridad, debido al enlentecimeinto del vaciado gástrico. En enfermos asintomáticos y con riesgo leve será la única terapéutica a emplear.
El siguiente esfuerzo terapéutico debe ir encaminado a prevenir la acidosis, por su efecto en el aumento de ADT plasmático libre. La acidosis además se verá agravada por la hipotensión, las convulsiones y la depresión respiratoria, entrando en el consiguiente círculo vicioso. Junto con las medidas de soporte general, el uso de bicarbonato sódico se considera el tratamiento de elección. Éste mejora la hipotensión en un 96% de los casos, disminuye el ensanchamiento del QRS (80%), y la aparición de convulsiones. Debe recibir bicarbonato sódico todo intoxicado que presente hipotensión, convulsiones, arritmias ventriculares o supraventriculares, un QRS > 160 mseg, o mayor de 120 mseg junto con una frecuencia cardiaca superior a 110 latidos/minuto. Parece que es preferible la administración del bicarbonato en bolos hasta conseguir un pH de 7,55, con una paCO2 normal.
En caso de arritmias, se debe utilizar además del bicarbonato, lidocaína y magnesio. Están contraindicados los antiarrítmicos clase IA y IC (quinidina, procainamida, flecainamida y propafenona). Si el paciente entra en PCR, hay varios casos en la literatura con supervivencia tras 60 minutos de RCP.
Para la hipotensión se emplea suero salino (de elección) o Ringer Lactato, noradrenalina o dobutamina. En algunos casos se ha llegado a utilizar el balón de contrapulsación intraaórtico con buen resultado.
Si el paciente presentase convulsiones, hay que tratarlas cuanto antes con benzodiacepinas y bicarbonato. El uso de fisostigmina como antídoto está en discusión por el riesgo de asistolia y convulsiones, aceptándose su uso en manos expertas y bajo estricto control hemodinámico. Está absolutamente contraindicado el uso de flumacenilo en caso de intoxicación mixta con benzodiacepinas, por el riesgo de convulsiones.
Control evolutivo
Debido a la potencial gravedad de la intoxicación por ADT, todo paciente debe estar un mínimo de 6-12 horas en observación, con vigilancia de constantes vitales y ECG. Podría valorarse el alta si pasadas seis horas no presentase ninguna alteración ECG (QRS < 100mseg), ni tampoco clínica ni analítica.
Deberá seguir en observación mientras existan alteraciones del ECG o clínicas, y entre 12-24 horas tras la suspensión del tratamiento instaurado para tratar la intoxicación.
INHIBIDORES DE LA MONOAMINO OXIDASA
Los Inhibidores de la Monoamino Oxidasa (IMAO) siguen en gravedad toxicológica a los ADT, aunque no en cuanto a incidencia. Producen un aumento de aminas biogénicas a nivel cerebral, con un inicio de los síntomas entre 6 y 12 horas tras la ingesta. La dosis tóxica es de 2-3 mg/kg.
Pueden ocasionar una amplia gama de síntomas, entre otros hipertensión, taquicardia y agitación. En casos graves llegan a producir fallo cardiovascular y neurológico, siendo las complicaciones más temidas el Síndrome Serotonínico y la Hipertermia Maligna16.
Existen varias sustancias que interactúan con los IMAO potenciando sus efectos tóxicos: agonistas serotonínicos (ISRS, meperidina, ADT), simpático-miméticos (anfetaminas, fenilpropanolamina, fenilefrina) y alimentos ricos en tiramina (quesos o embutidos muy curados, salsa de soja, habas, higos y pasas secas, vinos tinto y jerez, etc). También existen sujetos más susceptibles como los acetiladores lentos.
En cuanto al tratamiento, es efectivo el carbón activado dentro de las primeras 4 horas. El paciente deberá estar bajo control cardiovascular y neurológico las primeras 12 horas. En caso de hipertensión se usarán nitroprusiato o fentolamina. (3-5 mg e.v.), siendo también efectivo el nifedipino sublingual. Si aparece hipotensión y no revierte con expansores, se debe administrar noradrenalina. Para la hipertermia se aconseja medidas físicas y se pauta benzodiacepinas, pudiendo necesitar dantroleno y parálisis muscular. Si existiese agitación no usar fenotiazinas u otros neurolépticos. Las medidas de depuración renal y extrarrenal no parecen efectivas17.
INHIBIDORES SELECTIVOS DE LA RECAPTACIÓN DE SEROTONINA
Los inhibidores selectivos de la recaptación de serotonina (ISRS) son los antidepresivos más seguros desde el punto de vista toxicológico. La intoxicación produce síntomas leves, que generalmente no conllevan riesgo vital. Los efectos más usuales son disminución leve del nivel de conciencia, taquicardia, náuseas, vómitos y temblor. En algunos casos puede verse cefalea, agitación, arritmias y convulsiones (algunas hasta 6 horas tras la ingesta). La dosis tóxica es de 1,5 g, aunque a partir de 500-600 mg pueden aparecer síntomas.
Su mayor toxicidad ocurre cuando se ingieren junto con otros fármacos, sobre todo antidepresivos de otros grupos farmacológicos y sedantes, pues aumentan la probabilidad de desarrollar un Síndrome Serotonínico18.
En cuanto al tratamiento, el vaciado gástrico puede ser efectivo incluso varias horas postingesta. Las medidas de eliminación no parece que tengan utilidad. Aquellos pacientes que ingieran una dosis superior a 1,5 g deben estar en observación al menos 24 horas, incluso cuando estén asintomáticos, con monitorización de constantes y ECG. Cuando aparezcan síntomas graves o exista coingestión de fármacos potencialmente peligrosos, se valorará el ingreso en la Unidad de Cuidados Intensivos.
LITIO
El 75-90% de los pacientes tratados con litio presentan algún signo de toxicidad. En el año 2001, se comunicaron a los Posion Centers de EE.UU. 4.607 intoxicaciones por litio, con 8 fallecimientos19. Su margen terapéutico es muy estrecho, debido a que los niveles terapéuticos están muy cerca de los tóxicos20.
Cinética
La absorción del fármaco se produce entre 1-2 horas postingesta, con un pico máximo a las 2-4 horas, retrasándose en preparados retard entre 6 y 12 horas. El fármaco no se une a proteínas plasmáticas. El 95% se elimina por la orina, y el resto por el sudor, saliva y leche materna. A nivel renal existe una reabsorción del 80%. El nivel terapéutico está entre 0,7 y 1,2 mEq/l, a partir del cual ya aparecen síntomas de toxicidad, y sobre todo por encima de 1,6 mEq/l.
Manifestaciones clínicas
La intoxicación más grave suele ocurrir en enfermos que lo toman de forma crónica, frente a los que realizan un intento autolítico aislado. La correlación entre niveles plasmáticos y toxicidad no es directa en las intoxicaciones agudas, pudiendo haber niveles altos con escasos síntomas. En el enfermo tratado con litio habrá más sintomatología con dosis menores.
La intoxicación leve se manifiesta con apatía, letargia, debilidad, temblor fino y síntomas gastrointestinales (náuseas, vómitos y diarreas). En los casos moderados aparecen temblor grueso, ataxia, lenguaje lento, confusión, hiperreflexia, clonus y cambios electrocardiográficos inespecíficos. En la intoxicación grave aparecen convulsiones, coma, shock, fasciculaciones generalizadas, alteraciones del ECG de todo tipo, arritmias, y muerte21.
Existen además ciertos factores precipitantes de intoxicación en consumidores crónicos como la deshidratación, hiponatremia, insuficiencia renal y fármacos como los antiinflamatorios no esteroideos, IECA, antipsicóticos, ISRS y carbamacepina.
Diagnóstico
Deberá considerarse intoxicado aquel paciente con sintomatología y cifras superiores a 1,2 mEq/l, o cuando existan unos niveles superiores a 1,6 mEq/l. Tras la primera determinación, deberá realizarse una segunda a las 6 horas y en algunos casos de preparados retard hasta 12 horas postingesta. Así mismo hay que tener cuidado de no usar para la extracción de la muestra sanguínea tubos con heparina de litio, que alterarían la litemia resultante.
Tratamiento
En los preparados retard, habrá que realizar lavado intestinal total, mediante catártico o solución evacuante de Bohn, incluso a las 12 horas postingesta. El carbón activado es ineficaz, por lo que su uso no está indicado.
Habrá que hidratar adecuadamente al paciente, para corregir tanto la deshidratación como la hiponatremia.
Se solicitará una bioquímica básica (electrolitos y función renal), y se controlará frecuentemente el estado neurológico del paciente.
La hemodiálisis es el tratamiento de elección en los casos graves: litemia superior a 3,5-4 mEq/l sin sintomatología, o presencia de síntomas fundamentalmente neurológicos con litemia mayor de 2 mEq/l. También se indicará en los casos de insuficiencia renal (por imposibilidad para eliminar el litio por su vía fisiológica), o cuando exista algún problema médico (insuficiencia cardiaca) que impida la reposición de volumen y sodio.
Tras la diálisis, habrá que esperar un efecto rebote por salida del litio intracelular, que probablemente requerirá una segunda sesión a las seis horas (medir nueva litemia inmediatamente tras la diálisis y en ese intervalo). La reaparición de síntomas también indicaría la repetición de la depuración extrarrenal.
Existe una relación entre el tiempo de litemia elevada y secuelas neurológicas a largo plazo, de tipo cerebeloso (ataxia, incoordinación motora, etc.), por lo que no debe retrasarse la hemodiálisis cuando esté indicada.
ß-BLOQUEANTES
En los últimos años se han diversificado las indicaciones de los ß-bloqueantes, pues además de sus indicaciones cardiológicas se utilizan en migrañas, temblor esencial, ansiedad, prevención de hemorragias digestivas, etc. Son intoxicaciones poco frecuentes, pero pueden ser especialmente severas, con una mortalidad 4-5%22. Ocurren más en menores de 50 años, con el propanolol como fármaco principal y con arritmias del tipo de las bradicardias y asistolia23.
Mecanismo de acción
Cuando un simpático-mimético se fija sobre un ß-receptor se activa la adenilciclasa, que por medio del ATP sintetiza el AMPc. Éste activa las proteínas quinasas responsables de la fosforilación de las proteínas.
Los ß-bloqueantes antagonizan estos receptores de forma competitiva entre los ß-bloqueantes intrínsecos y los ß-bloqueantes. Esto nos permite comprender por qué las dosis habituales de ß-adrenérgicos son habitualmente ineficaces en caso de intoxicación, pues la mayoría de los receptores están bloqueados y se precisan dosis elevadas de aminas vasoactivas y otras moléculas como el glucagón que estimulan a los miocitos por vías diferentes (Tabla 1).
Efectos del ß-bloqueante
Los más usados son cardioselectivos, ocasionando disminución de la contractilidad y de la frecuencia cardiaca, con resultado de disminución del gasto cardiaco, de las resistencias periféricas, lo que conduce a hipotensión arterial y shock (Fig. 1). Bloquean el sistema renina-angiotensina, produciendo hiperpotasemia. A escala hepática inhiben la glucogenolisis y la secreción de glucagón por lo que ocasionan hipoglucemia. Dan lugar a broncoconstricción (bloqueo de receptores ß-2) y además pueden penetran en SNC y ocasionar disminución del nivel de conciencia con bradipnea y convulsiones.
Cinética
Los más lipofílicos (propanolol, timolol, metoprolol) se absorben con rapidez y los síntomas ya están presentes a los 60 minutos. Atraviesan con facilidad la barrera hematoencefálica y se metabolizan en el hígado.
En los más hidrosolubles (esmolol, labetalol, bisoprolol) la absorción puede retrasarse 3-4 horas, especialmente si el paciente está hipotenso. Tienen una alta fijación a las proteínas (especialmente los lipofílicos) y su volumen de distribución es elevado en los muy liposolubles. No hay buena correlación entre los niveles plasmáticos y las manifestaciones clínicas.
Manifestaciones clínicas
A nivel cardiovascular producen bradicardia e hipotensión. La hipotensión suele reflejar bajo gasto e indica mal pronóstico. Algunos como el propanolol pueden producir bloqueo cardiaco por estabilización de membranas, en lugar de por bloqueo beta24.
Un grado más severo es el shock cardiogénico agravado por una vasoplejia periférica si el ß-bloqueante tiene efecto alfa como labetalol o carvedilol o se asocia con un antagonista del calcio. El edema agudo de pulmón no es frecuente salvo que exista insuficiencia cardiaca previa o sea secundaria a reanimación agresiva. La parada cardiaca puede ser por disociación electromecánica, bloqueo auriculoventricular de 3er grado, asistolia, Torsades de Pointes en caso de sotalol, flutter y fibrilación.
También pueden actuar a nivel neurológico originando desde somnolencia, obnubilación agitación y alucinaciones, hasta convulsiones, depresión del nivel de conciencia y coma25.
En el ECG pueden aparecer signos de intoxicación entre 20 minutos y 3 horas tras la ingestión, con alargamiento del QRS > 0,12 segundos o del intervalo QT, ambos signos de gravedad. En la analítica los datos a valorar son la acidosis láctica, la hiperkaliemia por insuficiencia renal aguda, hipocalcemia y citolisis hepática hipóxica. En la radiología de tórax se buscarán signos de edema pulmonar. En intoxicaciones graves puede ser necesario la colocación de un catéter de Swan-Ganz para el estudio y la evolución hemodinámica.
Debemos sospechar una intoxicación por ß-bloqueantes en caso de bradicardia e hipotensión. Hay que tener en cuenta qué otras intoxicaciones pueden presentarse de manera similar. El diagnóstico diferencial si el intervalo QT es normal lo haremos con hipotermia, intoxicación por opiáceos u organofosforados. En caso de intervalo QT corto deberemos pensar en digitálicos y cianuro. La intoxicación por amiodarona puede cursar con un cuadro similar y habitualmente presenta un intervalo QT alargado. La intoxicación por cloroquina, clonidina y los antagonistas del calcio, pueden presentar también bloqueos auriculoventriculares.
Tratamiento
Existen dos prioridades en la intoxicación por ß-bloqueantes: mejorar la perfusión inicialmente aumentando la volemia y mejorar la ventilación y la oxigenación.
La descontaminación digestiva puede estar indicada si es de forma precoz (< 2 h) o en fórmulas retard hasta 12 horas, usando carbón activado siempre que defienda la vía aérea. Si no es así, será preciso previamente la intubación orotraqueal. Las medidas terapéuticas para aumentar la eliminación, depuración renal o extrarrenal no están indicadas.
En todas las intoxicaciones se debe prever un período mínimo de observación de 12 horas con control clínico y ECG. El tratamiento de la bradicardia aislada inicialmente es observación. Si el intervalo QT es largo se recomienda isoprenalina a dosis elevadas (2-4 µg/Kg/min) como primera droga de elección. En casos refractarios está indicada la colocación de un marcapasos. En situación de shock cardiogénico, además de isoprenalina, podemos utilizar adrenalina y control de electrolitos y acidosis láctica, si es preciso administrando bicarbonato.
En la intoxicación aguda por ß-bloqueantes la respuesta a las aminas vasoactivas puede ser escasa y la depresión cardiovascular puede ser refractaria a atropina, isoproterenol y marcapasos.
El antídoto a utilizar es el glucagón, el cual activa la membrana permitiendo la entrada de calcio por un receptor diferente. Está indicado en caso de hipotensión y bradicardia sintomática. No es efectivo para abolir la conducción AV prolongada, ni en caso de manifestaciones neurológicas. Su presentación es en forma de polvo (1mg), debiendo sustituirse el diluyente comercial (contiene fenol para su administración IM) por suero salino o agua estéril para su administración endovenosa. Se pauta inicialmente aproximadamente 3 mg (0,05 mg/Kg) en 1 minuto, luego si es necesario 5 mg y perfusión continua a 5 mg/h. Exige controlar glucemias, potasio y equilibrio ácido-base.
DIGOXINA
La intoxicación por glucósidos cardiacos, especialmente la digoxina es frecuente por su amplia utilización y su estrecho rango terapéutico. Se ha estimado que más del 15% de los pacientes admitidos en el hospital recibirán digoxina como tratamiento y casi el 35% de los mismos puede presentar signos de toxicidad26,27.
Se describen dos situaciones clínicas toxicológicas distintas: la sobredosificación de pacientes en tratamiento con digoxina (intoxicación crónica más frecuente), y la ingesta aguda masiva, mucho menos frecuente.
Mecanismo de acción
La digoxina inhibe la ATPasa de la membrana, impidiendo el transporte de iones. A dosis terapéuticas disminuye el automatismo, prolonga el período refractario y disminuye la conducción nodal. A dosis tóxicas aumenta la actividad simpática y genera arritmias.
Cinética
La digoxina presenta una absorción oral eficaz y se ve disminuida por alimentos y antiácidos. Tiene una baja unión a proteínas (25%) y su eliminación es renal en un 80% (semivida de eliminación de 36-48 h). La causa más frecuente de intoxicación crónica es la insuficiencia renal.
Por otro lado, debemos de tener en cuenta que la hipopotasemia (< 2,5 mEq/l) inhibe la actividad de la Na-K-ATPasa, potenciando el efecto de la digital. También algunos fármacos modifican la farmacocinética por reducción de la excreción renal (propafenona, quinidina, verapamilo, amiodarona) y otros aumentan la toxicidad por modificaciones en la farmacodinámica (ß-bloqueantes, kaliuréticos, antagonistas del calcio). La dosis tóxica se estima en una ingesta superior a 0,05 mg/Kg, siendo tóxica la digoxinemia > 2,5mg/dl.
Manifestaciones clínicas
En la intoxicación aguda tras una fase inicial asintomática, aparecen síntomas digestivos (náuseas, vómitos y diarreas), neurológicos (mareos, cefalea, síncope, convulsiones, alucinaciones o visión alterada con borde de color amarillo de los objetos). En las intoxicaciones agudas son más frecuentes los síntomas digestivos mientras que en la crónica son más frecuentes los neurológicos. Las manifestaciones cardiacas son las más graves, con alteraciones en el ECG, generalmente bradicardias (sinusal, bloqueo AV, bloqueos fasciculares), pero también pueden producir arritmias rápidas y ventriculares, cubeta digitálica, etc.
Debemos tener en cuenta algunos factores que incrementan la toxicidad de digoxina como: hipokalemia, hipomagnesemia, hipercalcemia, hipoxia, cardiopatía isquémica, hipotiroidismo y los fármacos ya mencionados. La intoxicación28 es menos probable en el hipertiroidismo, en fibrilación auricular y en niños.
Diagnóstico
Ante la sospecha clínica de intoxicación por digoxina se solicitará una analítica básica que incluirá ionograma y función renal. En el ECG lo más frecuente que se observa es extrasistolia ventricular, aunque puede haber múltiples arritmias. Se solicita los niveles de digoxina en sangre, sabiendo que una digoxinemia elevada no siempre indica toxicidad. Deberemos esperar de 6 a 12 horas para valorar las concentraciones séricas que es el periodo de tiempo necesario para que la digoxina tenga una distribución completa en el organismo. Tras la administración de anticuerpos los niveles también están falsamente elevados. En la gasometría detectaremos acidosis, la cual aumenta la toxicidad y, en función de la clínica neurológica, puede ser necesario la realización de TC craneal para descartar patología neurológica.
Tratamiento
En el 95% de las intoxicaciones no se necesita tratamiento salvo la optimización de la función renal, pH y potasio, suspender la toma de digoxina y/o corregir el factor desencadenante. Sólo un 5% precisa de tratamiento activo por bajo gasto cardiaco. Se puede realizar lavado gástrico antes de 3 horas seguido de carbón activado. No es preciso repetir la dosis de carbón, ya que la digoxina no tiene circulación enterohepática. Las medidas renal y extrarrenal son inefectivas por el alto volumen de distribución.
Para el tratamiento de bradicardias o el bloqueo AV completo administrar atropina y colocar un marcapasos. El miocardio puede ser refractario a la electroestimulación y puede producir arritmias malignas. La cardioversión puede inducir FV por lo que se recomienda utilizar la menor energía posible.
En caso de arritmias ventriculares se emplea:
– Fenitoína : 100 mg i.v. cada 5 minutos (máximo 1g) si coexiste con bloqueo AV completo.
– Lidocaína: 1-2 mg/Kg i.v. en bolo y a continuación perfusión a 1-4 mg/min (evitar la desfibrilación eléctrica por el riesgo de inducir arritmias ventriculares malignas). Es de primera elección en arritmias ventriculares si no hay bloqueo AV.
– Magnesio: 2g i.v. de sulfato de magnesio en 20 minutos e infusión 1g/hora si la función renal es normal. Es de 2ª elección.
Los anticuerpos antidigital (Fab) son fragmentos purificados de anticuerpos generados por las ovejas contra la digoxina. La unión de la digoxina-Fab es muy rápida y también lo es la disociación digoxina-Na-K ATPasa (< 30 minutos).
Las indicaciones de uso son:
– Taquicardia/fibrilación ventricular.
– Bradicardia sinusal/bloqeo AV refractario a atropina y marcapasos.
– Parada cardiaca.
– Refuerza la indicación un K > 5,5 mEq/l y/o digoxinemia > 10 ng/ml.
La administración de Fab se lleva a cabo en perfusión continua i.v. de 30 minutos. Una vez reconstituidos deben ser administrados inmediatamente, o refrigerarlos, administrándolos antes de 4 horas. En cuanto a posología, se tendrá en cuenta que se deben pautar:
– 48 mg de anticuerpos por cada mg de digoxina ingerido, o
– 80 mg por cada 1ng/ml de digoxinemia que se quiera neutralizar o
– si se desconoce este dato se inicia con 480 mg (6 viales) en 500 ml de SF en 30 minutos.
La mejoría es esperable al cabo de 1-2 horas. La misma dosis puede repetirse en 4-8 horas en caso de ineficacia o recidiva de la sintomatología. El éxito de tratamiento nos lo dará la mejoría del ECG, no los niveles que estarán falsamente elevados.
Los efectos adversos son en general son raros. Las reacciones de hipersensibilidad ocurren en el 0,8% de los casos (única contraindicación). También puede haber fallo cardiaco por abolición del efecto terapéutico de la digoxina. El control rápido de la hiperpotasemia puede producir una hipopotasemia en las primeras 24 h. Finalmente puede aparecer recurrencia de los signos de toxicidad, causados por la digoxina remanente, en intoxicaciones masivas con una menor dosis de neutralización de la estimada29.
ANTAGONISTAS DEL CALCIO
La incidencia de intoxicación por fármacos antagonistas del calcio, accidental o intencionada ha ido en aumento los últimos años asociado a su mayor uso1,30.Los fármacos más frecuentemente involucrados son verapamilo, nifedipina y diltiazem.
Mecanismo de acción
Los antagonistas del calcio bloquean la entrada de calcio hacia el interior de las células a través de los canales lentos, por lo que disminuye el Ca libre intracelular.
Las repercusiones sólo tienen lugar en las células cuyo potencial de acción y/o activación de proteínas contráctiles sea calcio dependiente, esto es miocardiocitos, células del automatismo y conducción cardiaca, y célula muscular lisa de las paredes vasculares. Los efectos son: inotrópico y cronotrópico negativo, prolongación de la conducción AV, disminución de la tendencia a arritmias, vasodilatación y broncodilatación.
Manifestaciones clínicas
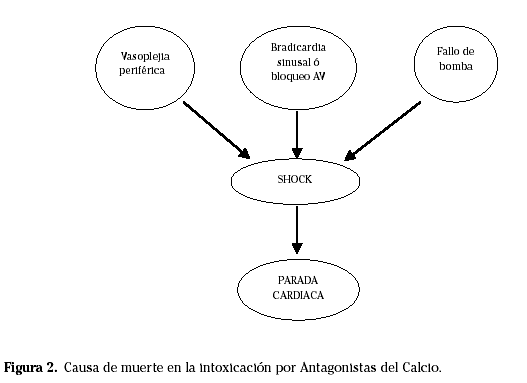
La toxicidad por antagonistas del calcio puede dar sintomatología cardiovascular (hipotensión, shock, bradicardia, ritmos nodales rápidos, paro sinusal, asistolia) (Fig. 2), neurológica (alteración del habla, letargia, confusión, convulsiones, parada respiratoria, coma), gastrointestinales (náuseas, vómitos, íleo, isquemia intestinal), y metabólicas (hiperglucemia, acidosis láctica). Se han descrito alteraciones cutáneas graves como necrolisis epidérmica tóxica, síndrome de Stevens-Johson y vasculitis cutáneas secundarias a los antagonistas del calcio31.
Existen algunas diferencias toxicológicas entre los calcioantagonistas más utilizados:
– Verapamilo: hipotensión y prolongación de conducción AV. Vasodilatador débil e hipotensión por bajo gasto sin vasoconstricción compensadora.
– Nifedipino: vasodilatador importante (es frecuente la taquicardia sinusal).
– Diltiazem: similar a verapamilo pero con menor depresión cardiaca.
Diagnóstico
Tendremos un alto índice de sospecha de intoxicación por antagonistas del calcio si se presentan los siguientes signos: hipotensión con bradicardia, alteración del estado mental, acidosis láctica, hiperglucemia, paro sinusal y shock refractario.
Dentro de los procedimientos diagnósticos realizaremos una analítica básica (incluyendo calcio), donde puede observarse hipoglucemia en caso de intoxicación por verapamilo. En casos excepcionales se ha descrito hipocalcemia. Obviamente, será necesario un ECG. En caso de sintomatología de insuficiencia cardiaca, realizar radiología de tórax y en caso de hipotensión severa gasometría para valorar acidosis.
Tratamiento
Todo paciente con sospecha de intoxicación por antagonistas del calcio debe ser ingresado para observación y monitorización. Si a las 6-8 horas está asintomático, estable y con ECG normal puede ser dado de alta. Si presenta bradiarritmias graves o hipotensión refractaria a sueroterapia deberá ser ingresado en una unidad de cuidados intensivos. Además de monitorizar el ECG, en ocasiones puede ser necesario colocar catéter de Swan-Ganz.
La primera medida para mejorar la perfusión es expandir la volemia. Respecto a la descontaminación digestiva, aunque estos fármacos se absorben en menos de 2 horas, las dosis tóxicas pueden provocar hipotensión e íleo paralítico por lo que se retrasa la absorción. Además en las formas retard, ésta puede demorarse hasta 14 horas. Administrar carbón activado (1g/Kg). Está contraindicado el jarabe de ipecacuana por el riesgo de shock y convulsiones.
La depuración renal o extrarrenal son ineficaces por su alta unión a proteínas y el elevado índice de distribución. La eliminación es por metabolismo hepático.
En caso de hipotensión y bradicardia se procederá a expandir la volemia utilizando 1.000-2.000 ml de salino 0,9% en una hora. Se pauta calcio. Una ampolla de cloruro cálcico al 10% tiene 3 veces más calcio (13,6 mEq) que una de gluconato cálcico (4,6 mEq). La respuesta al calcio dura 10-15 minutos por lo que luego es necesaria una perfusión a 0,3-0,7 mEq/Kg/h.
En caso de bradiarritmia grave sintomática está indicado isoproterenol a 2-10 mg/minuto. La atropina ejerce mínima respuesta. Considerar también la colocación de marcapasos.
Cuando exista hipotensión severa con predominio de vasoplejia utilizar dopamina, noradrenalina y si predomina el cuadro de cardioplejia, dobutamina y adrenalina. Considerar la colocación de un balón de contrapulsación intraaórtico.
En los casos graves con pobre respuesta a las terapéuticas anteriores puede usarse insulina a altas dosis con normoglucemia32. Esta combinación posee efectos inotrópicos positivos, probablemente por mejora en la utilización de la glucosa a nivel miocárdico. Comenzaremos con un bolo de insulina de 0,1 UI/Kg, seguido de una perfusión de 0,2-0,3 UI/Kg/h. Para mantener la normoglucemia, la pauta inicial será de 0,5-1 g/Kg de glucosado 5% en bolo, seguidos de 0,5 g/Kg/h, orientándonos luego con controles glucémicos periódicos. La respuesta hemodinámica se producirá entre 30 y 60 minutos post inicio de la administración.
Otra alternativa terapéutica es la administración de glucagón endovenoso. Aunque con menos evidencia clínica que la anterior, puede usarse en caso de hipotensión refractaria. Se administrarán 2-5 mg en un minuto, seguido de una segunda dosis a los 5 minutos de 4-10 mg. Una vez obtenida respuesta, se mantendrá esa dosis/hora como perfusión33.
BIBLIOGRAFÍA
1. Burillo-Putze G, Munne P, Dueñas A, Pinillos MA, Naviero JM, Cobo J et al. National multicenter study of acute intoxication in Emergency Departments of Spain. Eur J Emerg Med 2003 (en prensa). [ Links ]
2. Mintegui S, Benito J, Vázquez MA, Fernández A, Gortázar P, Grau G. Intoxicaciones en urgencias: cambios epidemiológicos en los últimos 10 años. Rev Esp Pediatr 2002; 56: 23-29. [ Links ]
3. Riquelme A, Burillo-Putze G, Jiménez A, Hardisson A. Epidemiología global de la Intoxicación Aguda en un Área de Salud. Aten Primaria 2001; 28: 506. [ Links ]
4. Fraser AD. Use and abuse of the benzodiazepines. Ther Drug Monit 1998; 20: 481-489. [ Links ]
5. Roberge RJ, Lin E, Krenzelok EP. Flumazenil reversal of carisoprodol (Soma) intoxication. J Emerg Med 2000; 18: 61-64. [ Links ]
6. Mintzer MZ, Stoller KB, Griffiths RR. A controlled study of flumazenil-precipitated withdrawal in chronic low-dose benzodiacepine users. Psychopharmacology (Berl) 1999; 147: 200-209. [ Links ]
7. Litovitz TL, Klein-Schwartz W, White S, Cobaugh DJ, Youniss J, Omslaer JC et al. 2000 Annual report of the American Association of Poison Control Centers Toxic Exposure Surveillance System. Am J Emerg Med 2001; 19: 337-395. [ Links ]
8. Alonso MP, De abajo FJ, Martínez JJ, Montero D, Martín-Serrano G, Madurga M. Evolución del consumo de antidepresivos en España. Impacto de los inhibidores selectivos de la recaptación de serotonina. Med Clin (Barc) 1997; 108: 161-166. [ Links ]
9. Frommer DA, Kulig KW, Marx JA, Rumack B. Tricyclic antidepressant overdose. JAMA 1987; 257: 521-526. [ Links ]
10. Boehnert MT, Lovejoy FH. Value of the QRS duration versus the serum drug level in predicting seizures and ventricular arrhythmias after an acute overdose of tricyclic antidepressants. N Engl J Med 1985; 313: 474-479. [ Links ]
11. Foulke GE, Albertson TE, Walby WF. Tricyclic antidepressant overdose: emergency department findings as predictors of clinical course. Am J Emerg Med 1986; 4: 496-500. [ Links ]
12. Foulke GE, Albertson TE. QRS interval in tricyclic antidepressant overdosage: inaccuracy as a toxicity indicator in emergency settings. Ann Emerg Med 1987; 16: 160-163. [ Links ]
13. Niemann JT, Bessen HA, Rothstein RJ, Laks MM. Electrocardiographic criteria for tricyclic antidepressant cardiotoxicity. Am J Cardiol 1986; 57: 1154-1159. [ Links ]
14. Liebelt EL, Francis PD, Wolf AD. ECG lead a VR versus QRS interval in predicting seizures and arrhythmias in acute tricyclic antidepressant toxicity. Ann Emerg Med 1995; 26: 195-201. [ Links ]
15. Goldgran-Toledano D, Sideris G, Kevorkian JP. Overdose of cyclic antidepressants and the Brugada syndrome. N Engl J Med 2002; 346: 1591-1592. [ Links ]
16. Schonwald S. Medical Toxicology. A sinopsis and study guide. Philadelphia, Lippincott Williams & Wilkins, 2001. [ Links ]
17. Linden CH, Rumack BH, Strehlke C. Monoamine oxidase inhibitor overdose. Ann Emerg Med 1984; 13: 1137-1144. [ Links ]
18. Brown T, Skop B, Mareth T. Pathophysiology and management of the serotonin syndrome. Ann Pharmacother 1996; 30: 527-533. [ Links ]
19. Litovitz TL, Klein-Schwartz W, Rodgers GC, Cobaugh DJ, Youniss J, Osmales JC et al. 2001 Annual report of the American Association of Poison Control Centers Toxic Exposure Surveillance System. Am J Emerg Med. 2002; 20: 391-452. [ Links ]
20. Dueñas A, Aparicio M. Litio. En: Dueñas laita A (Ed). Intoxicaciones agudas en medicina de urgencia y cuidados críticos. Barcelona, Masson 1999: 293-296. [ Links ]
21. Barrueto F. Antimaniac agents: Lithium and Valproic Acid. En: An intensive review course in clinical toxiclogy. New York City Poison Control Center. New York, 2002; 41-43. [ Links ]
22. Joye F. Beta-blocker intoxication. Presse Med 2000; 29: 1027-1033. [ Links ]
23. Love JN, Litovitz TL, Howell JM, Clancy C. Characterization of fatal beta blocker ingestion: a review of the American Association of Poison Control Centers data from 1985 to 1995. J Toxicol Clin Toxicol 1997; 35: 353-359. [ Links ]
24. Love JN, Enlow B, Howell JM, Klein-Schwartz W, Litovitz TL. Electrocardiographic changes associated with beta-blocker toxicity. Ann Emerg Med 2002; 40: 603-610. [ Links ]
25. Taboulet P, Cariou A, Berdeaux A, Bismuth C. Pathophysiology and management of self-poisoning with beta-blockers. J Toxicol Clin Toxicol 1993; 31: 531-551. [ Links ]
26. Borron SW, Bismuth C, Muszynski J. Advances in the management of digoxin toxicity in the older patient. Drugs Aging 1997; 10: 18-33. [ Links ]
27. Mahdyoon H, Battilana G, Rosman H, Goldstein S, Gheorghiade M. The evolving pattern of digoxin intoxication: observations at a large urban hospital from 1980 to 1988. Am Heart J 1990; 120: 1189-1194. [ Links ]
28. Abad Santos F, Carcas AJ, Ibáñez C, Frías J. Digoxin level and clinic manifestations as determinants in the diagnosis of digoxin toxicity. Ther Drug Monit 2000; 22: 163-168. [ Links ]
29. González Andrés VL. Revisión sistemática sobre la efectividad e indicaciones de losanticuerpos antidigoxina en la intoxicación digitálica. Rev Esp Cardiol 2000; 53: 49-58. [ Links ]
30. Amorim S, Dias P, Rocha G, Gama G, de Campos M, Pires S. Poisoning with calcium channel blockers-a case report and review of the literature. Rev Port Cardiol 2001; 20: 1249-1257. [ Links ]
31. Odeh M. Exfoliative dermatitis associated with diltiazem. J Toxicol Clin Toxicol 1997; 35: 101-104. [ Links ]
32. Boyer E, Duic P, Evans A. Hyperinsulinemia/ euglycecmia therapy for calcium channel blocker poisoning. Ped Emerg Care 2002; 18: 36-37. [ Links ]
33. De Roos F. Calcium Channel Blockers. En: Goldfrank L, Flommenbaum N. Lewin N, Howland MA, Hoffman RS, Nelson L (Eds). Goldfrak´s Toxicologic Emergencias, 7 th Ed. New York, McGraw-Hill, 2002: 762-774. [ Links ]