Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.34 supl.4 Madrid 2017
https://dx.doi.org/10.20960/nh.1564
Nuevos ingredientes en fórmulas infantiles. Beneficios sanitarios y funcionales
New ingredients in infant formula. Health and functional benefits
M. Cristina de Almagro García, José Antonio Moreno Muñoz, Jesús Jiménez López y María Rodríguez-Palmero Seuma
Departamento de Investigación Básica. Laboratorios Ordesa. Barcelona
Dirección para correspondencia
RESUMEN
Existe cada vez mayor evidencia científica de que la nutrición temprana y el estilo de vida tienen un efecto de programación sobre la salud y el riesgo de enfermedad futura. Las fórmulas infantiles deben cubrir los requerimientos nutricionales y promover un crecimiento y desarrollo correcto de los lactantes. Actualmente, un ámbito de innovación importante consiste en el aporte de componentes bioactivos capaces de aportar beneficios funcionales al lactante. Uno de los nuevos ingredientes es la membrana del glóbulo graso lácteo, que aporta componentes como fosfolípidos y gangliósidos, así como proteínas bioactivas. Además, ingredientes como probióticos y prebióticos actúan como moduladores de la microbiota intestinal y contribuyen a mejorar la salud gastrointestinal. Otros componentes relevantes en fórmulas infantiles son los ácidos grasos poliinsaturados de cadena larga, la α-lactoalbúmina y los nucleótidos. Estudios recientes demuestran que la adición de estos ingredientes a las fórmulas infantiles mejora el desarrollo cognitivo y reduce la incidencia de infecciones y alergias en los lactantes. Nuevos estudios de seguimiento a largo plazo son necesarios para valorar si los efectos observados son duraderos y se mantienen en etapas posteriores de la vida.
Palabras clave: Fórmula infantil. Lactante. Ingredientes bioactivos. Sistema immune. Desarrollo cognitivo.
ABSTRACT
There is an increasing body of evidence about the effect that early nutrition and lifestyle could have on the programming of later health and disease. Infant formula must cover all the nutritional needs to promote adequate infant growth and development. Currently, important research efforts have been made to supplement infant formulae with new bioactive ingredients with health benefits for the infant. The milk fat globule membrane is one of the new ingredients, which provides phospholipids and gangliosides, as well as bioactive proteins. In addition, ingredients such as probiotics and prebiotics modulate intestinal microbiota and contribute to improve gastrointestinal health. Other ingredients relevant in infant formulas are long chain polyunsaturated fatty acids, α-lactalbumin and nucleotides. Recent research studies have demonstrated that adding these ingredients to infant formulas improves cognitive development and decreases the number of infections and allergies in infants. However, more studies are needed to find if these effects are long lasting and can be seen in childhood and adulthood.
Key words: Infant formula. Infant. Bioactive compounds. Immune system. Cognitive development.
IMPORTANCIA DE LA NUTRICIÓN EN EL DESARROLLO DEL LACTANTE
Los dos primeros años de vida representan, junto con la adolescencia, el periodo de crecimiento y desarrollo más importante en la vida de una persona. Al cumplir 1 año, el niño habrá multiplicado su peso al nacer por 3 y su talla por 1,5 aproximadamente. Los órganos vitales también incrementan su tamaño proporcionalmente. El cerebro, por ejemplo, en el momento del nacimiento presenta un peso del 25% respecto al del cerebro adulto, mientras que al año de vida será del 75%. En esta época de crecimiento tan importante, la alimentación se convierte en un factor clave que debe aportar las cantidades de nutrientes suficientes para la formación de todos los órganos y estructuras.
Además del crecimiento a nivel físico, los primeros años de vida representan también un periodo de desarrollo funcional de muchos sistemas, tanto a nivel inmunitario, metabólico, como a nivel neurocognitivo y psicomotor.
En relación al sistema inmune, los primeros años de vida representan una etapa de maduración a nivel funcional muy importante, que debe asegurar por un lado una adecuada respuesta a las infecciones, pero por otro lado evitar también una respuesta excesiva frente a elementos externos como pueden ser la alimentación u otro tipo de alérgenos (1).
El desarrollo del sistema nervioso central (SNC) continúa tras el nacimiento a lo largo de los primeros años de vida, con procesos como la proliferación neuronal, la mielinización y la formación de sinapsis (2). La formación de estas estructuras cerebrales es importante para lograr una óptima función cognitiva y visual, lo que permite al lactante un correcto aprendizaje y la capacidad de procesar mejor y entender todo lo que sucede en el entorno.
Los primeros años de vida son también determinantes para el correcto desarrollo de los procesos metabólicos, lo que va a condicionar la aparición potencial de obesidad en edades posteriores (3).
PROGRAMACIÓN METABÓLICA
Existe cada vez mayor evidencia científica de que la nutrición temprana y el estilo de vida, cuando actúan durante periodos de la vida sensibles de mayor plasticidad como es la primera infancia, tienen un efecto de programación duradera sobre etapas posteriores y capacidad de influir en la salud y el riesgo de enfermedad futura (3). Los mecanismos para este efecto modulador de los nutrientes pueden ser de tipo genético, epigenético o metabólico, y son objeto de numerosos estudios a nivel internacional.
Se conoce que el crecimiento en las primeras etapas de la vida está estrechamente vinculado con la salud en etapas posteriores. La mayor evidencia del efecto de la modulación temprana del crecimiento sobre los riesgos posteriores se ha encontrado para enfermedades como la obesidad, adiposidad y enfermedades asociadas tales como diabetes tipo 2, hipertensión, enfermedades cardiovasculares y asma. Hoy día se considera que los 1.000 primeros días de vida constituyen una ventana de oportunidad para la prevención de enfermedades en la edad adulta. Por tanto, la nutrición mejorada ofrece importantes oportunidades preventivas.
NUEVOS COMPONENTES DE LAS FÓRMULAS INFANTILES
La composición de las fórmulas infantiles ha evolucionado considerablemente a lo largo de los años para conseguir un contenido nutricional similar al de la leche materna, un ámbito en el que se han realizado avances sustanciales de forma progresiva desde mitad del siglo pasado.
Recientemente, otro de los ámbitos importantes de mejora en las fórmulas infantiles persigue acercar la funcionalidad de las fórmulas infantiles a la leche materna, pues es bien reconocido que, incluso en las sociedades occidentales, la alimentación con leche materna da lugar a índices de morbilidad en los lactantes inferiores a la alimentación con fórmula infantil.
Con el objetivo de velar por la seguridad y eficacia de las fórmulas infantiles de inicio y de continuación, el nuevo Reglamento UE 2016/127, aprobado en febrero de 2016, acorde con la opinión de EFSA (Autoridad Europea de Seguridad Alimentaria) publicada en el año 2014 (4), regula en Europa su composición nutricional especificando el contenido mínimo y máximo para cada macro y micronutriente.
AVANCES EN LA CALIDAD DE LA FRACCIÓN LIPÍDICA
Ácidos grasos poliinsaturados de cadena larga: ácido araquidónico (ARA) y el ácido docosahexaenoico (DHA)
Los ácidos grasos poliinsaturados (AGPI), docosahexaenoico (DHA) de la serie omega-3 y araquidónico (ARA) de la serie omega-6 forman parte de los fosfolípidos de las membranas celulares, y son los ácidos grasos poliinsaturados mayoritarios en tejido nervioso y retina (5). Sin embargo, sus precursores, los ácidos grasos esenciales linoleico y α-linolénico, se encuentran en bajas proporciones a nivel cerebral. Asimismo, también se han atribuido funciones inmunomoduladoras a los ácidos grasos poliinsaturados de cadena larga (6).
Estos se depositan en el cerebro del feto a partir de la semana 20 de gestación, y esto continúa hasta los 2 años de vida, siendo sus niveles más elevados en niños alimentados con leche materna que en niños alimentados con fórmulas infantiles no suplementadas con estos nutrientes (5). Diferentes estudios clínicos han demostrado que la suplementación con estos nutrientes en la etapa perinatal tiene un impacto positivo en la función cognitiva y visual del lactante. Por ejemplo, el estudio DIAMOND, en el cual la ingesta de una fórmula infantil con un 0,32% de ácido docosahexaenoico mejoró la capacidad visual medida a través de los potenciales visuales evocados frente a una fórmula control (7).
Como resultado de estos estudios, en 2014, EFSA estableció que las fórmulas infantiles para lactantes y de continuación debían considerar el ácido docosahexaenoico como un nutriente esencial para el lactante, y estableció la obligatoriedad de su inclusión en las fórmulas infantiles en un mínimo de 20 mg/100 kcal y máximo de 50 mg/100 kcal (4). Respecto al ácido araquidónico, EFSA no ha establecido una cantidad mínima en las fórmulas infantiles. Sin embargo, debido a su presencia en leche materna y que el ácido araquidónico puede tener un papel en el crecimiento, varios expertos han recomendado su adición a las fórmulas infantiles en concentración similar a la del ácido docosahexaenoico (8).
La membrana del glóbulo graso lácteo (MFGM)
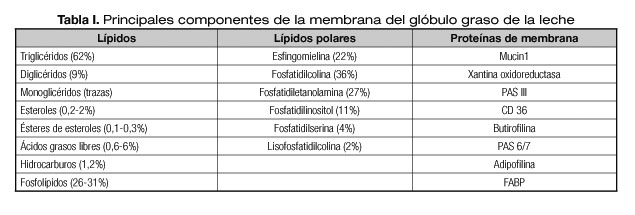
Los lípidos presentes en la leche se encuentran en forma de glóbulos de grasa. El interior de estos liposomas está constituido mayoritariamente por triglicéridos, mientras que la membrana que forma estos glóbulos se constituye de una tricapa de lípidos polares, fosfolípidos y esfingolípidos, con proteínas (mucinas y lactadherina) intercaladas (9) (Tabla I).
Durante el desarrollo perinatal, los componentes de la membrana del glóbulo graso lácteo tienen las siguientes funcionalidades relevantes para el desarrollo del lactante (10):
-A nivel intestinal: poseen efecto protector frente a infecciones, modulan la microbiota intestinal e intervienen en el desarrollo de la función inmune.
-A nivel cerebral: los gangliósidos están involucrados en numerosos procesos del desarrollo neuronal, como la mielinización y mantenimiento de la integridad axonal, en el desarrollo, diferenciación y maduración neuronal, en la transmisión de impulsos nerviosos, y en los procesos de formación de la memoria.
El enriquecimiento de fórmulas infantiles con componentes de la membrana del glóbulo graso de la leche (MFGM) se asocia a una mejora en la función cognitiva del lactante, tal como ha sido evidenciado en diversos estudios clínicos (10). Este efecto beneficioso ya se había observado en animales, en los que una dieta suplementada con sueros ricos en componentes de la membrana del glóbulo graso lácteo, lactoferrina y prebióticos originaba diferencias significativas a nivel de maduración cerebral, medida con técnicas de imagen así como con test de comportamiento.
Moduladores de la microbiota intestinal: probióticos y prebióticos
En el tejido linfoide asociado al intestino (GALT) se encuentra el 80% de las células inmunitarias del cuerpo humano, por lo que juega un papel importantísimo en la correcta maduración del sistema inmunitario del bebé. Una microbiota intestinal adecuada en el bebé y la exposición a los microorganismos adecuados en las primeras etapas de la vida ayudan a una correcta maduración del tracto gastrointestinal (TGI) inmaduro en el momento del nacimiento, potenciando el efecto barrera y ayudando a madurar de forma correcta el sistema inmunitario (11), disminuyendo el riesgo de reacciones de hipersensibilidad frente a antígenos alimentarios (12).
Asimismo, la microbiota intestinal asociada a las células epiteliales potencia el efecto barrera del epitelio, compitiendo por los nutrientes y lugares de unión al epitelio con los microorganismos patógenos. Al mismo tiempo, la microbiota intestinal es capaz de regular la expresión de las proteínas (ocludinas y claudinas) involucradas en regular el espacio intercelular (tight-junctions), así como de estimular la producción de péptidos antibacterianos conocidos como defensinas, y citoquinas que ayudan a proteger al huésped de microorganismos patógenos (13).
En los primeros meses de vida, la microbiota del bebé alimentado con leche materna está fundamentalmente dominada por bacterias del género Bifidobacterium, en comparación con los niños alimentados con fórmula infantil. Una de las especies más representativas es Bifidobacterium longum subsp. infantis. Se asocia la presencia de niveles elevados de bifidobacterias en las heces de niños con una menor incidencia de infecciones y una mayor maduración de su sistema inmunitario y gastrointestinal (14).
La microbiota intestinal puede ser modulada con la ingesta de probióticos y prebióticos o con simbióticos (combinaciones de probióticos y prebióticos). La adición de estos ingredientes en fórmulas infantiles puede ayudar a corregir las alteraciones de la microbiota que se producen en los niños alimentados exclusivamente con fórmulas infantiles que no los contienen, o en niños que nacen por cesárea y no están expuestos a la microbiota del canal vaginal (15).
Se denomina simbiótico a toda aquella combinación sinérgica de prebióticos y probióticos, definiéndose como probiótico a todo aquel "microorganismo vivo que administrado en la cantidad adecuada proporciona beneficios saludables al hospedador", y al mismo tiempo se define como prebióticos a aquellos "ingredientes alimentarios que al ser fermentados selectivamente producen cambios específicos en la composición y/o actividad de la microbiota gastrointestinal confiriendo beneficios en la salud del individuo" (16). En un simbiótico es clave probar el efecto prebiótico sobre el probiótico de la mezcla simbiótica, ya que no todos los prebióticos ejercen el mismo efecto estimulador del crecimiento selectivo en todos los probióticos, por lo que la combinación prebiótico/probiótico ha de ser testada para garantizar que es la mejor de las combinaciones posibles.
Las especies probióticas más utilizadas en fórmulas infantiles son: Bifidobacterium longum subsp. infantis, B. animalis subsp. lactis, B. longum subsp. longum, , L. casei subsp. rhamnosus y L. reuteri. Nuestro grupo de investigación ha trabajado durante más de 10 años en el desarrollo y evaluación clínica de varios probióticos, entre ellos de la especie Bifidobacterium longum subsp. infantis CECT7210 (Bifidobacterium infantis IM-1®). Este probiótico posee propiedades antirotavirales demostradas en estudios in vitro y en ratón BALB/c, en los que se observó un retraso del inicio de la infección y una disminución significativa del antígeno detectado en heces a los 7 días. Además, posee las características fisicoquímicas que la avalan como probiótico, como la resistencia a los jugos gástricos, sales biliares y a pH bajo, y capacidad de adhesión al mucus intestinal. Su seguridad se ha evaluado mediante estudios de ingesta aguda en modelo murino inmunocompetente e inmunodeprimido (17). También se han llevado a cabo estudios clínicos en lactantes que demuestran su seguridad y eficacia.
Las Sociedades Pediátricas Europea y Americana han revisado recientemente la seguridad de los probióticos en lactantes, así como la evidencia científica en relación a sus posibles efectos beneficiosos avalando su seguridad, si bien especificando que se deben de aportar pruebas de ello para cada cepa probiótica y no generalizar (18,19).
Algunos de los compuestos prebióticos más utilizados en alimentación infantil son fructooligosacáridos, galactooligosacáridos e inulina.
La leche materna también contiene oligosacáridos complejos formados por ácido siálico, N-acetilglucosamina, L-fucosa, D-glucosa y D-galactosa. Los oligosacáridos de la leche materna se encuentran en una concentración de hasta 12-14 g/L, constituyendo una de las principales fracciones sólidas de este alimento. Esta fracción es en parte responsable de que en los lactantes alimentados al pecho predomine en su microbiota el género Bifidobacterium, dado su efecto bifidogénico; mientras que en los lactantes alimentados con fórmulas infantiles estándar, las bifidobacterias conviven con otras especies bacterianas fundamentalmente gramnegativas como las enterobacterias (20).
La adición de prebióticos a las fórmulas infantiles tiene por objeto la modulación de la microbiota intestinal hacia un predominio de las bifidobacterias, lo que se ha postulado como mecanismo protector frente a infecciones gastrointestinales y alergias frecuentes en el lactante (21).
CONCLUSIONES
La investigación y la innovación en el ámbito de las fórmulas infantiles pretende no solo aproximar la composición nutricional a la de la leche materna, el patrón de oro, sino también aportar los beneficios a nivel funcional, especialmente en la protección que confiere frente a enfermedades infecciosas o de tipo metabólico, así como la estimulación del desarrollo inmunológico o neurocognitivo. Algunos de los ingredientes que se han adicionado recientemente a las fórmulas infantiles con esta finalidad son las membranas del glóbulo graso lácteo, ricas en lípidos complejos como fosfolípidos y gangliósidos, y componentes moduladores de la microbiota intestinal, como los prebióticos y los probióticos. Estos ingredientes se suman a otros ingredientes funcionales, como los ácidos grasos poliinsaturados, proteínas bioactivas como la α-lactoalbúmina, nucleótidos, colina, etc. A través de la investigación podremos lograr nuevos avances y disponer de fórmulas infantiles con una composición cada vez más avanzada que aporten beneficios a la salud futura del lactante.
BIBLIOGRAFÍA
1. Calder PC, Krauss-Etschmann S, de Jong EC, Dupont C, Frick JS, Frokiaer H, et al. Early nutrition and immunity -progress and perspectives. Br J Nutr 2006;96(4):774-90.
2. de Graaf-Peters VB, Hadders-Algra M. Ontogeny of the human central nervous system: what is happening when? Early Hum Dev 2006;82(4):257-6.
3. Koletzko B, Brands B, Poston L, Godfrey K, Demmelmair H; Early Nutrition Project. Early nutrition programming of long-term health. Proc Nutr Soc 2012;71(3):371-8.
4. EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies), 2014. Scientific Opinion on the essential composition of infant and follow-on formulae. EFSA Journal 2014;12(7):3760.
5. Rodriguez-Palmero M, Koletzko B, Kunz C, Jensen R. Nutritional and biochemical properties of human milk: II. Lipids, micronutrients, and bioactive factors. Clin Perinatol 1999;26(2):335-59.
6. Foiles AM, Kerling EH, Wick JA, Scalabrin DM, Colombo J, Carlson Se. Formula with long chain polyunsaturated fatty acids reduces incidence of allergy in early childhood. Pediatr Allergy Immunol 2016;27(2):156-61.
7. Birch EE, Carlson SE, Hoffman DR, Fitzgerald-Gustafson KM, Fu VL, Drover JR. The DIAMOND (DHA Intake And Measurement Of Neural Development) Study: a double-masked, randomized controlled clinical trial of the maturation of infant visual acuity as a function of the dietary level of docosahexaenoic acid. Am J Clin Nutr 2010;91(4):848-59.
8. Koletzko B, Carlson SE, van Goudoever JB. Should Infant Formula Provide Both Omega-3 DHA and Omega-6 Arachidonic Acid? Ann Nutr Metab 2015;66(2-3):137-8.
9. Garcia C, Innis S. Structure of the human milk fat globule. Lipid Technology 2013;25(10):223-6.
10. Hernell O, Timby N, Domellöf M, Lönnerdal B. Clinical benefits of milk fat globule membranes for infants and children. J Pediatr 2016;173 Suppl:S60-5.
11. Spahn TW, Kucharzik T. Modulating the intestinal immune system: the role of lymphotoxin and GALT organs. Gut 2004;53:456-65.
12. Ouwehand AC. Antiallergic effects of probiotics. J Nutr 2007;137(3 Suppl 2):794S-7S.
13. Yu LC, Wang JT, Wei SC, Ni YH. Host-microbial interactions and regulation of intestinal epithelial barrier function: From physiology to pathology. World J Gastrointest Pathophysiol 2012;3(1):27-43.
14. Schack-Nielsen L, Michaelsen KF. Advances in our understanding of the biology of human milk and its effects on the offspring. J Nutr 2007;137(2):503S-510S.
15. Sanders ME. Impact of probiotics on colonizing microbiota of the gut. J Clin Gastroenterol 2011;45(Suppl. 3):S115-9.
16. International Scientific Association for Probiotics and Prebiotics (ISAPP). 6th Meeting of the International Scientific Association of Probiotics and Prebiotics: London, Ontario; 2008.
17. Muñoz JA, Chenoll E, Casinos B, Bataller E, Ramón D, Genovés S, et al. Novel probiotic Bifidobacterium longum subsp. infantis CECT 7210 strain active against rotavirus infections. Appl Environ Microbiol 2011;77(24): 8775-83.
18. Braegger C, Chmielewska A, Decsi T, Kolacek S, Mihatsch W, Moreno L, et al.; ESPGHAN Committee on Nutrition. Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr 2011;52(2):238-50.
19. Thomas DW, Greer FR; American Academy of Pediatrics Committee on Nutrition; American Academy of Pediatrics Section on Gastroenterology, Hepatology, and Nutrition. Probiotics and prebiotics in pediatrics. Pediatrics 2010;126(6):1217-31.
20. Rivero-Urgell M, Santamaria-Orleans A. Oligosaccharides: application in infant food. Early Hum Dev 2001;65 Suppl:S43-52.
21. Roberfroid M, Gibson GR, Hoyles L, McCartney AL, Rastall R, Rowland I, et al. Prebiotic effects: metabolic and health benefits. Br J Nutr 2010;104 Suppl 2:S1-63.
 Dirección para correspondencia:
Dirección para correspondencia:
María Rodríguez-Palmero Seuma.
Laboratorios Ordesa.
Ctra. del Prat, 9-11.
08830 Sant Boi de Llobregat, Barcelona
e-mail: maria.rodriguez@ordesa.es