Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.78 no.8 ago. 2003
REVISIÓN
ORBITOPATÍA TIROIDEA
(FISIOPATOLOGÍA, DIAGNÓSTICO Y TRATAMIENTO)
THYROID ORBITOPATHY
(PATHOGENESIS, DIAGNOSIS AND TREATMENT)
PÉREZ MOREIRAS JV1, COLOMA BOCKOS JE2, PRADA SÁNCHEZ MC2
| RESUMEN Objetivo: Realizar una revisión y actualización acerca de los actuales enfoques diagnósticos, terapéuticos y fisiopatológicos de la orbitopatía tiroidea y plantear un abordaje clínico sencillo, precoz y práctico, basado en el conocimiento de la enfermedad. Palabras clave: Orbita, Tiroides, Enfermedad de Graves, Oftalmopatía, Orbitopatía.
| SUMMARY Purpose: To review and to update the current diagnostic and therapeutic approaches and the pathogenesis of thyroid orbitopathy. To propose a practical, basic and precocious approach based in the knowledge of the disorder. Key words: Orbit, Thyroid, Graves’ Disease, Ophthalmopathy, Orbitopathy.
|
Recibido: 2/7/03. Aceptado: 20/8/03.
Instituto Internacional de Órbita y Oculoplástica.
1 Doctor en Medicina.
2 Licenciado en Medicina.
Los autores no tienen interés comercial ni han recibido apoyo económico alguno.
Correspondencia:
J. V. Pérez Moreiras
Cl. Eduardo Pondal, 30 - 2.ª planta
15702 Santiago de Compostela (A Coruña)
España
E-mail: orbita@clinicamoreiras.com
INTRODUCCIÓN
La orbitopatia tiroidea es una enfermedad debilitante del sistema visual, caracterizada por presentar cambios de los tejidos blandos orbitarios y periorbitarios debidos a un proceso inflamatorio, o a la consecuencia del mismo, y que generalmente se relaciona con alteraciones endocrinas sistémicas de la glándula tiroides, causando una alteración significativa en la calidad de vida de los afectados.
La orbitopatia tiroidea (OT) es la primera causa de patología orbitaria, con una incidencia que oscila entre el 50 y 60% en la consulta de un cirujano de órbita (1). Es conocida también con el nombre de oftalmopatia de Graves por su asociación con la enfermedad de Graves, considerándose la manifestación extratiroidea más frecuente de esta enfermedad, aunque puede presentarse en pacientes sin historia pasada o presente de hipertiroidismo (eutiroideos), en pacientes hipotiroideos y en la tiroiditis de Hashimoto (2). Debido a que la enfermedad afecta la órbita en su conjunto, preferimos el termino de orbitopatia al de oftalmopatia ya que refleja mejor la concepción actual de la patología.
La incidencia de la enfermedad de Graves (independiente de las manifestaciones orbitarias) es de 13,9 casos por 100.000 habitantes por año en Estados Unidos (3), con predominio del sexo femenino, siendo su incidencia en mujeres de una mujer por cada 5.000 habitantes/año y en varones de 1 por 25.000 habitantes/año, según algunos autores. La edad de presentación de la orbitopatia tiroidea presenta aparentemente un pico bimodal de incidencia, tanto en hombres como en mujeres, con grupos de edades de 40-44 años y 60-64 años en mujeres y 45-49 años y 65-69 años en hombres, pero el rango de edad puede oscilar entre los 25 a 65 años (4). La edad media de presentación es ligeramente mayor en hombres que en mujeres. El 10-12% de los pacientes con enfermedad de Graves van a presentar signos y síntomas clínicos de OT, mientras que la gran mayoría solo presentará formas subclínicas.
La OT es identificada aproximadamente en un 20% de pacientes con enfermedad de Graves durante el examen físico inicial, pero la gran mayoría de pacientes presentan una forma subclínica o autolimitada de orbitopatia tiroidea. La prevalencia de estas formas leves de OT se estima que puede ser tan alta como un 80% (5). La enfermedad es por lo general bilateral (85-95%) pero puede manifestarse de manera unilateral (5-15%), aunque esto puede ser el reflejo de la asimetría con la que generalmente se presenta la orbitopatia. Solo el 5% de los pacientes presentan reactivación de la enfermedad inflamatoria orbitaria una vez que ha remitido el episodio inicial. El 33% de los pacientes con OT reportan antecedentes familiares positivos de enfermedad tiroidea, y aproximadamente un 9% se acompañan de dermatopatia.
En la gran mayoría de pacientes el hipertiroidismo y la orbitopatia se presentan con un margen de tiempo de 18 meses entre ellas (6), aún así, la aparición de una de ellas puede separarse de la otra en 20 años en algunos casos (7). Bartley no encuentra variaciones estacionales y comenta que la orbitopatía aparece 6 meses antes del hipertiroidismo en el 18,5%, coinciden ambas en el 20% y se presenta en los 6 meses después del hipertiroidismo en el 35% (8).
Las formas graves de orbitopatía aparecen sólo en un 4-5% de pacientes, siendo más común su aparición en pacientes de mayor edad, diabéticos y en hombres (en los que se observa mayor incidencia de neuropatía optica compresiva). Un apartado especial debe considerarse para el habito de fumar, ya que el cigarrillo esta fuertemente asociado a la enfermedad de Graves y a la orbitopatia, siendo un factor de riesgo para ambas, pero con mayor influencia sobre la OT. La proporción de pacientes fumadores se incrementa de manera significativa cuando se estudian los pacientes con enfermedad orbitaria severa, relacionándose el cigarrillo no solo con formas más agresivas de la enfermedad sino con menor respuesta al tratamiento y mayor tiempo de duración. Algunos autores, pero no todos, han establecido una relación dosis-respuesta entre el número de cigarrillos por día y la enfermedad orbitaria (9). La relación cigarrillo-OT esta claramente identificada en la literatura (1,2,4-6,9,10), existiendo evidencia que demuestra la desaparición del riesgo excesivo de padecer enfermedad severa en grandes fumadores al dejar de fumar. Como concomitante, en el caso de la enfermedad de Graves, existen suficientes evidencias para afirmar que el cigarrillo disminuye posibilidad de remisión del hipertiroidismo al tratamiento con drogas antitiroideas, y además, incrementa el riesgo de recurrencia del hipertiroidismo (2).
Para el control del hipertiroidismo, reciben tratamiento en la Comunidad Europea con radioiodo (RI) el 85%, tiroidectomía el 14% y terapia médica el 55%, aunque en España el tratamiento más utilizado es la tiroidectomía subtotal por considerar que influye menos sobre la progresión de la orbitopatía
En el centro de órbita de Santiago estudiamos en los últimos 30 años 1632 pacientes con patología tiroidea, con una media de 110 casos/años en los últimos años. En el apartado de cirugía hemos descomprimido 604 órbitas con una media en los últimos años de 85 órbitas/año al ser centro de referencia nacional e internacional. En nuestros pacientes nos hemos encontrado con un estado sistémico de hipertiroidismo en el 88%, eutiroidismo el 6%, hipotiroidismo el 4% y tiroiditis de Hashimoto el 2%. En el esquema I observamos las variantes sistémicas que podemos encontrar durante el examen de los pacientes con enfermedad tiroidea.
FISIOPATOLOGÍA
En los últimos años se conoce mejor la patogenia, pero es una enfermedad de carácter autoinmune con etiología desconocida y con un tratamiento poco satisfactorio, por lo que sigue siendo un enigma fisiopatológico y un dilema terapéutico. Esta ampliamente sostenido que se trata de una enfermedad autoinmune sin relación directa con las alteraciones metabólicas causadas por la sobreproducción de la hormona tiroidea; esto explicaría la no mejoría de la enfermedad orbitaria luego de un satisfactorio control metabólico, así como la presencia de OT en pacientes eutiroideos o con tiroiditis de Hashimoto. Aún así la evidencia del carácter inmunológico no esta totalmente confirmada, y los niveles de anticuerpos relacionados con el agrandamiento de la glándula tiroidea y la sobreproducción hormonal (inmunoglobulinas estimulantes del tiroides o T.S.I) no se relacionan de manera contrastada con la presencia, severidad o actividad de la orbitopatia tiroidea. La OT puede acompañarse de otras enfermedades de etiología autoinmune como son la Miastenia Gravis, el Vitíligo y la Diabetes, entre otras (tabla I).
Contrariamente a la mayoría de enfermedades autoinmunes, las cuales tienden a la cronicidad y presentan episodios frecuentes e inesperados de recaídas, la mayoría de enfermos con OT tienden a estabilizarse y tener una remisión espontánea de la enfermedad dentro de los 18 meses del inicio de la misma (5). Es nuestra apreciación, y la de otros autores, que el control hormonal sistémico influye en el desarrollo clínico de la orbitopatia tiroidea, Kazim, Goldberg y Smith (5) sugieren que el comportamiento clínico de la actividad inflamatoria de la orbita es particularmente sensible a los cambios de los valores séricos de tiroxina y tirotropina en pacientes jóvenes. Estos mismos autores han detectado que los casos de recurrencia de la enfermedad orbitaria están relacionados con el inicio de distiroidemia, coincidiendo con nuestras observaciones clínicas.
En la orbitopatía se produce aumento de volumen de los músculos extraoculares, de la grasa y del tejido conectivo. Los músculos y la grasa están edematosos por aumento en la deposición de glucosaminoglucanos (GAG) y de la celularidad: linfocitos T CD4+, macrófagos y linfocitos B. La hipótesis patogenética actual se basa en la actividad de linfocitos T autorreactivos que reconocen a un antígeno que comparten la glándula tiroides y la órbita. Los linfocitos T CD4+ al reconocer el antígeno segregan citoquinas para amplificar la reacción inmunológica activando los linfocitos T CD8+. Las citoquinas estimulan a los fibroblastos para sintetizar y segregar GAG que atraen líquido en el espacio retroorbitario para producir edema periorbitario y muscular, lo que origina proptosis. Se ha demostrado, in vitro, que la Interleukina 6 (IL-6), que se encuentra elevada en el suero de pacientes con enfermedad de Graves, es capaz de aumentar la expresion de receptores de TSH en los fibroblastos preadipociticos (11), siendo este receptor el autoantigeno responsable del hipertiroidismo en la enfermedad de Graves y el posible autoantigeno común entre la órbita y la glándula tiroides. Esta sobre expresión del receptor de TSH ayudaría a perpetuar el mecanismo inflamatorio en la orbita. La reacción inmunológica de la orbitopatia tiroidea es una reacción de tipo II y tiene la característica de ser una respuesta de tipo celular en sus fases iniciales, la cual desaparece para dar paso a una reacción de tipo humoral en los estadios más avanzados de la enfermedad.
La célula diana de la respuesta autoinmune en la OT permanece aún desconocida, pero estudios recientes se orientan hacia el fibroblasto preadipocitico que puede diferenciarse en adipocito bajo estimulación, lo que aumenta el volumen del tejido graso de la órbita observado en la OT. Se ha observado que esta célula no solo muestra receptores de TSH sino que además es capaz, ante estimulación, de incrementar el número de estos receptores. Sabemos que las células afectadas son los fibroblastos, adipocitos y miocitos, aunque hoy en día esta prácticamente descartado que el miocito sea la célula diana. En los músculos extraoculares existen estructuras análogas al tejido conectivo o septos fibrosos que sostienen el tejido adiposo orbitario, este tejido en forma de endomisio, perimisio y epimisio parecen ser los sitios involucrados en la fibrosis y cicatrización que se produce en la OT y que es responsable del estrabismo restrictivo (fig. 1). Debido a que las fibras musculares están relativamente respetadas en la OT, se sugiere que es el tejido conectivo del músculo (de las mismas características del tejido conectivo graso orbitario) y no las fibras del músculo extraocular, el tejido diana de la enfermedad (5) con afectación múscular. La inflamación que se produce en los tejidos orbitarios (grasa y músculo) aumenta el edema y se traduce de manera clínica generando malestar, sensación de presión en la órbita, lagrimeo, escozor, inyección palpebral y conjuntival. La evolución de todo este proceso produce exoftalmos, alteración de la motilidad, fibrosis, congestión venosa, compresión en el ápex, e inclusive, neuropatía.

Fig. 1. Fibrosis endomisial (-) en músculo recto inferior. Tricrómico de Masson x 300.
La producción de GAG y de colágeno se ve incrementada cuando los fibroblastos son sometidos a un medio con baja tensión de oxigeno según estudios realizados en cultivos celulares. La expansión del tejido orbitario que causa disminución del flujo venoso, así como las condiciones inflamatorias conllevan a crear un medio isquémico, con baja tensión de oxigeno, que perpetua la inflamación. Se ha sugerido, aunque no demostrado, que la influencia negativa del cigarrillo sobre la orbitopatia tiroidea pueda deberse, entre otras cosas, a la disminución de la tensión de oxigeno en los tejidos orbitarios de los pacientes fumadores. Cultivos de fibroblastos orbitarios provenientes de pacientes con enfermedad de Graves, han demostrado que la nicotina y el alquitrán que forman parte de los componentes de los cigarrillos, en combinación con interferón gamma, son capaces de aumentar la expresión de antigenos de histocompatibilidad (HLA-DR) en los fibroblastos, lo cual permite a estas células cumplir un rol como células presentadoras de antigenos, lo que podria ser uno de los mecanismos moleculares que relacionan el consumo de cigarrillos con una mayor gravedad de los pacientes con OT (12).
A diferencia de otras regiones del cuerpo, el tejido conectivo de la orbita contiene fibroblastos derivados de la cresta neural, aunque este dato aún no esta del todo comprendido, es importante recalcar que las células derivadas de la cresta neural poseen la particularidad de tener un alto grado de plasticidad fenotípica (13). La expansión del tejido graso orbitario y periorbitario que se observa en los pacientes afectados con OT puede deberse a la diferenciación de los fibroblastos orbitarios con potencial adipogénico después de su exposición a un entorno alterado de citoquinas y agentes inflamatorios durante el desarrollo de la enfermedad. Se ha sugerido que la perdida del potencial adipogénico con la edad puede ser la explicación a la diferencia entre la presentación clínica de la OT en pacientes jóvenes y los de mayor edad. En pacientes más jóvenes existe una mayor expansión del tejido graso, mientras que en individuos mayores, donde predominarían los fibroblastos sin potencial adipogénico, la enfermedad estará marcada por una mayor fibrosis de los tejidos, en vez de la expansión grasa observada en los más jóvenes (5). Con el paso del tiempo se observa la aparición de atrofia y la presencia de tejido graso entre las fibras musculares.
En resumen, la OT es un desorden autoinmune desconocido, en el que el hipertiroidismo de la enfermedad de Graves está producido por la interacción de las inmunoglobulinas estimulantes del tiroides (TSI) con los receptores de TSH, en donde se sugiere que la presencia de un autoantígeno común a la glándula tiroidea y a los tejidos orbitarios sería el causante de los cambios inflamatorios producidos en la orbita. Existen factores que favorecen su aparición y evolución: genéticos, tabaquismo, tratamiento con iodo radiactivo, etc. Bajo un mecanismo fisiopatológico complejo, aparece edema en las áreas peribulbares y retrobulbares, afectando a los tejidos conjuntivo, adiposo y muscular. Existe infiltración de linfocitos T, B, macrófagos y mastocitos que producen alteraciones en la arquitectura muscular con su consiguiente desestructuración progresiva que evoluciona hacia la atrofia. La infiltración linfomonocitaria en el tejido conectivo da lugar a que los fibroblastos activados segreguen GAG, favoreciendo así el edema. Como resultado final se produce una expansión del tejido graso y una restricción en los músculos que limita y reduce la motilidad. Se aumenta la presión retrobulbar induciendo exoftalmos, alteración del drenaje venoso, presión sobre le nervio óptico con posible neuropatía (defectos en el campo visual y alteración de visión de colores), edema periorbitario, congestión conjuntival (quemosis), alteración en los músculos extraoculares con diplopía y limitación del movimiento. La fibrosis actúa también sobre los párpados limitando la motilidad y causando retracción, que junto con el exoftalmos puede llevar a producir queratopatía por exposición. Los linfocitos T infiltran los tejidos orbitarios en la fase incipiente y en la fase activa de la enfermedad produciendo los cambios inflamatorios iniciales, para luego dar paso a una reacción de tipo humoral, por lo que se reconocen dos fases inmunológicas en la enfermedad.
HISTOPATOLOGÍA
En la fase inicial, los tejidos orbitarios, especialmente el músculo y el tejido adiposo, presentan marcado edema (fig. 2). Las fibras de colágeno se encuentran separadas por un fluido que muestra metacromasia con el azul de toluidina y leve positividad al ácido periódico de Schiff (PAS+). En estudios experimentales de orbitopatias y mixedema se ha comprobado la existencia de ácido hialurónico, el cual aumenta la presión osmótica, lo que da lugar a una acumulación de agua en los tejidos.

Fig. 2. Músculo recto medio con edema intersticial (-) y leve infiltrado
linfoplasmocitario. H & E x 300.
El infiltrado inflamatorio existente en los tejidos extraoculares consiste principalmente en linfocitos, células plasmáticas y macrófagos. Indudablemente, el infiltrado de linfocitos establece y perpetúa el proceso autoinmune. Los linfocitos predominantes son «linfocitos T», incluyendo subpoblaciones CD4+ y CD8+, aunque pueden observarse también «linfocitos B». El infiltrado rodea preferentemente las fibras musculares estriadas, dispuestas a veces en cúmulos (fig. 3) pero no suelen formar folículos linfoides con centros claros germinales, como sucede en pacientes con enfermedad inflamatoria idiopatica. La glándula lagrimal muestra moderada infiltración de linfocitos y células plasmáticas, con edema intersticial pero no con fibrosis. Los tendones de los músculos y las meninges del nervio óptico no suelen estar afectados.

Fig. 3. Infiltrado inflamatorio en músculo recto inferior dispuesto en cúmulos (-) y de
manera difusa. H & E x 60.
En la observación macroscópica, los músculos extraoculares pueden aumentar de 2 a 8 veces su tamaño, son de color rojo oscuro, están edematosos y su consistencia es más dura. Después de estudios ópticos y ultraestructurales, la mayoría de las fibras musculares muestran apariencia normal con una intensa proliferación de fibroblastos perimisiales e infiltración inflamatoria. Sin embargo, en algunos casos se han podido demostrar cambios degenerativos o regenerativos.
Los tabiques conjuntivos que rodean los lóbulos de tejido adiposo se encuentran engrosados, pudiéndose observar a este nivel focos de células inflamatorias (linfocitos, células plasmáticas y ocasionales neutrofilos polinucleares), aunque esto suele ser más evidente en los músculos extraoculares.
En el material quirúrgico orbitario estudiado bajo microscopía de luz se puede observar infiltración grasa y fibrosis en el músculo de Müller, así como también infiltración de mastocitos. Estudios recientes demuestran, contrariamente a otros reportes, que el músculo de Müller se ve envuelto en el proceso de inflamación y fibrosis que caracteriza a la OT (14), por lo que la retracción palpebral no sería solamente producto de la estimulación simpática. Cockerham no hayó infiltración linfocítica ni edema intersticial en 23 especimenes de pacientes con OT, encontrando a la inmunohistoquimica antígeno común de leucocitos (lo que evidencia inflamación) y a la microscopia electrónica demostró fibrosis, mastocitos, y abundantes células de Müller en estado contráctil.
SIGNOS CLÍNICOS, CLASIFICACIÓN Y DIAGNÓSTICO PRECOZ
En la OT la clínica del paciente es fiel reflejo de la fisiopatología de la enfermedad. Un adecuado conocimiento de esta nos orientará acerca de los signos y síntomas que debemos observar, pero más importante aún, nos hará reconocerlos de la manera más precoz posible, permitiendo un rápido abordaje terapéutico en el momento preciso en que la enfermedad responde bien a la medicación, e incluso, nos permite la prevención de la misma. El diagnóstico precoz, tanto oftalmológico como endocrino, y la prevención de la enfermedad son la clave para el satisfactorio tratamiento del paciente y para evitar las secuelas físicas y psicológicas que de ella se derivan. Debemos de considerar la cirugía rehabilitadora como un fracaso en el diagnostico precoz y en el tratamiento de la orbitopatia tiroidea.
Signos y síntomas palpebrales
La retracción es el signo cardinal de afectación palpebral, característicamente es más acentuada en el 1/3 externo o temporal del párpado superior, es uno de los signos más precoces en aparecer en la OT y es causa frecuente de la primera consulta o de preocupación del paciente. Se presenta tanto en el párpado superior como en el inferior, pero es en el primero donde suele llamar más la atención del paciente. En el párpado superior, la zona de limbo corneal superior (hora 12) que normalmente esta cubierta 1 mm por el párpado, queda al descubierto dejando expuesta la esclera. El mecanismo es mixto: por un lado existe hipertonía simpática del músculo de Müller, y por otro, fibrosis y adherencias en los retractores palpebrales. La fibrosis del elevador da lugar a una excursión palpebral en resorte y una asinergia en la mirada inferior (conocido en inglés como lid lag) (fig. 4). En la retracción palpebral superior debe tenerse en cuenta la hiperfunción del complejo recto superior-músculo elevador secundaria a la fibrosis del recto inferior, ya que en algunas ocasiones existirá una aparente retracción en posición primaria de mirada que se resolverá al realizar la retroinserción quirúrgica del músculo recto inferior (fig. 5). Lo anterior se explica debido a que la fibrosis del recto inferior desvía la mirada hacia abajo obligando al paciente a elevar los ojos para mantenerlos en posición primaria con lo que el complejo elevador del párpado superior (EPS) se contrae, produciendo la retracción del párpado superior. La retracción palpebral suele persistir durante años, estabilizándose o en algunos casos mejorar lentamente, desapareciendo, o incluso, en muy raras ocasiones evolucionando hacia la ptosis palpebral (por atrofia de las fibras) después de 10-15 años, como es el caso de algunos de nuestros pacientes. La retracción pequeña (1-2 mm) puede desaparecer a los 2-3 años en el 50% de los pacientes tratados de hipertiroidismo. En casos de severa proptosis, puede producirse la desinserción de la aponeurosis del elevador, apareciendo ptosis del párpado. Esto plantea un interesante diagnóstico diferencial con la ptosis de la miastenia grave, proceso autoinmune no pocas veces asociado a la enfermedad de Graves.
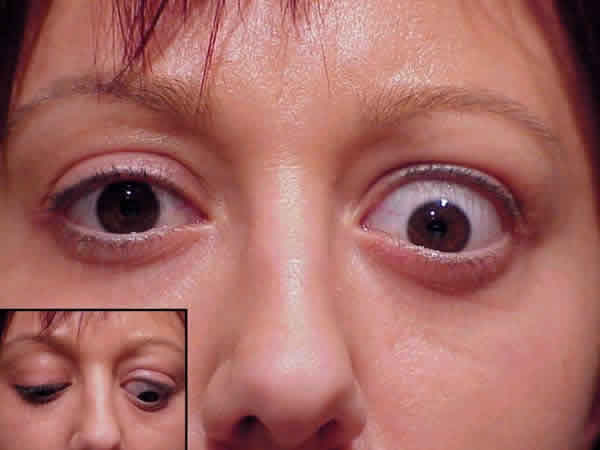
Fig. 4. Retracción palpebral superior en OI. Coexiste fibrosis del recto inferior
con una retracción palpebral verdadera, que se comprueba en mirada inferior, ya
que el párpado no desciende con la mirada produciendo el llamado "lid lag".

Fig. 5. Retracción palpebral superior secundaria a fibrosis de los rectos inferiores.
En la mirada inferior los párpados tienen una excursión normal, lo que significa que
la retracción superior no es causada por el complejo elevador del párpado superior.
La retracción palpebral inferior es un signo que es notado con menor frecuencia por el paciente. Se producen las mismas alteraciones del párpado superior, pero los cambios son menos intensos por las características anatómicas del mismo. La retracción palpebral inferior esta principalmente producida por un mecanismo mecánico, debido al exoftalmos y al aumento del volumen graso, el párpado por gravedad tiende a retraerse (fig. 6), lo que explica la disminución del mismo luego de cirugía de descompresión y lipectomia. En casos de retracciones importantes se puede observar entropión del párpado inferior, lo que sumado a la exposición causada por la proptosis y la retracción palpebral superior puede empeorar la integridad de la superficie ocular.

Fig. 6. Retracción palpebral inferior con exposición escleral. Se observa el
factor mecánico ejercido por el exoftalmos sobre el párpado inferior, siendo
mayor en OD que en OI, lo que origina una retracción de 6 mm en OD y de
4 mm en OI.Orbitopatía con signos de actividad inflamatoria.
Los cambios inflamatorios que se producen en los párpados son indicadores muy importantes de la actividad de la enfermedad (y por ende del diagnostico precoz). Los pacientes suelen presentar edema palpebral periorbitario que es más acentuado en horas de la mañana, lo que algunas veces puede ser confundido con una reacción alérgica por el oftalmólogo inexperto, aunque el paciente tiroideo no presenta reacción folicular conjuntival y además tiene otros signos asociados como molestias en la lectura, astenopia, e incluso manifestaciones sistémicas de hipertiroidismo. El grado de edema puede no corresponder con el grado de exoftalmos ni con la retracción palpebral, pudiendo aparecer todos estos signos o solo uno de ellos, generalmente están presentes todos ellos pero con diferente grado de afectación. Durante la fase inflamatoria activa se observa hiperemia palpebral, la cual debe buscarse en la zona preseptal para ser representativa de enfermedad tiroidea, ya que es común encontrar hiperemia en el borde palpebral y la zona pretarsal (cerca del margen) en pacientes normales o con blefaritis.
El aumento del tejido graso que se produce en la órbita también se evidencia en la región periorbitaria y palpebral, según algunos autores como Rootman no solo existe un aumento del volumen graso sino también una redistribución de la misma. De esta manera no sólo apreciamos un aumento de la grasa preseptal de los párpados inferiores y superiores sino que es muy característico de los pacientes con OT una hipertrofia de la grasa suborbicular de la región subciliar del párpado superior, en especial en el área temporal (fig. 7), lo que debe ser tenido muy en cuenta a la hora de la rehabilitación quirúrgica de estos pacientes. Más allá de los cambios grasos periorbitarios, es nuestra impresión clínica, y la de otros autores como Rootman y Goldberg, que el aumento de tejido graso también se produce en los paquetes grasos premalares, lo que produce ese discreto cambio morfológico que se observa en la fascie de los pacientes con OT, y que ha sido atribuido al uso prolongado de cortisona.

Fig. 7. Marcado engrosamiento de la grasa suborbicular (SOOF) de la
región subciliar temporal superior. Orbitopatía sin actividad inflamatoria
evidente.
Exoftalmos
Es el signo más universalmente conocido en la orbitopatía de Graves y utilizado incluso por algunos autores para la evaluación de los resultados quirúrgicos (15). Sin embargo, con frecuencia es poco o nada aparente (sólo el 40-65% de los enfermos presentan exoftalmía). En la medición de la proptosis influyen muchas variables, como son las diferencias anatómicas y raciales (el exoftalmos es mayor en pacientes negros) el sistema de medición (nosotros utilizamos el exoftalmómetro de Hertel) y la variabilidad según el examinador. Estadísticamente se considera normal una medición igual o inferior a 18-19 mm (pacientes caucásicos) y clínicamente significativa una diferencia entre ambos ojos mayor de 2 mm. En algunos casos puede observarse seudoexoftalmos como en las craneosinostosis, ptisis bulbi del ojo adelfo, miopía magna anisometrópica, etc. El exoftalmos suele ser axial y bilateral (85-90% de los casos), aunque generalmente asimétrico. No son raros los desplazamientos del globo en el eje vertical u horizontal cuando existe engrosamiento particularmente intenso de algún músculo extraocular, con el consiguiente efecto masa. La asimetría es mucho más marcada si existe una asimetría también en la retracción palpebral, simulando más exoftalmos el ojo con mayor retracción.
La proptosis se produce por un conflicto de espacio en la cavidad orbitaria, que al ser un espacio cerrado sólo permite el desplazamiento de sus contenidos hacia la pared anterior (septum y párpados) que es la pared más débil (fig. 8). El conflicto de espacio se produce por el aumento de volumen del tejido graso, de los músculos extraoculares y de la glándula lagrimal por la infiltración de células inflamatorias (linfocitos, células plasmáticas y mucopolisacáridos, que son muy hidrófilos), así como por el trastorno mecánico de retorno venoso, con el consiguiente edema en el territorio de las venas oftálmicas por un doble mecanismo: aumento de la presión hidrostática por el efecto masa de todas estas estructuras hipertrofiadas, e hidrofilia de los mucopolisacáridos y proteínas del infiltrado, y en caso de la vena oftalmica inferior también puede existir una compresión de esta contra el canal infraorbitario por el músculo orbitario de Müller (5). La maniobra de retropulsión ocular varia dependiendo más del engrosamiento muscular del tercio posterior del cono que del grado de exoftalmía (indica aumento de volumen en los músculos cuando es difícil la retropulsión), si la exoftalmía es por aumento de grasa, al presionar sobre el globo ésta ultima se hernia hacia los septos palpebrales permitiendo un fácil desplazamiento posterior del globo. El aumento de volumen de la órbita crea la sensación de presión que tienen algunos pacientes y en caso de afectación de los músculos puede existir dolor, generalmente al movimiento. La exoftalmia tiende a permanecer sin cambios durante muchos años.

Fig. 8. Exoftalmos de 29 mm, presentaba luxación espontánea en mirada
superior al quedar el ecuador del globo por detrás del párpado inferior.
Actividad inflamatoria evidente.
Clásicamente la afectación de los músculos extraoculares se caracteriza por un marcado engrosamiento del vientre muscular que respeta la inserción tendinosa escleral (fig. 9), lo que diferencia la miopatia de origen tiroideo de la segunda causa más frecuente de engrosamiento muscular orbitario (16) que es la miositis idiopática, en donde la porción tendinosa esta claramente afectada.
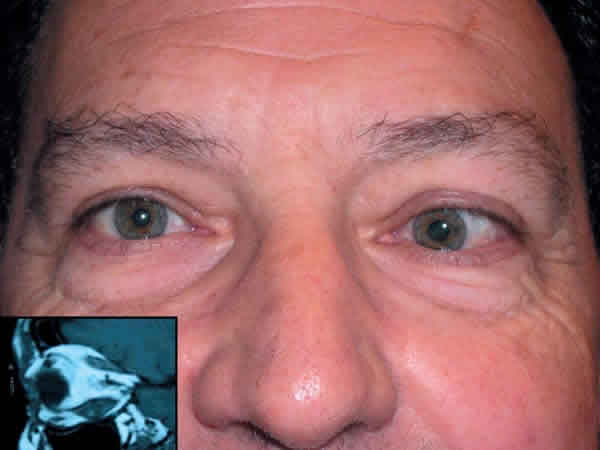
Fig. 9. Endotropía e hipotropía en OI por fibrosis de los músculos rectos inferior
y medio, en un paciente con orbitopatía no activa. RM, T1 donde se evidencia
engrosamiento del vientre muscular sin alteración del tendón de inserción
(cuadro inferior).
El proceso inmunológico inflamatorio, donde aparentemente juega un rol fundamental el tejido conectivo muscular (endomisio, perimisio y epimisio), produce una infiltración celular, incremento de la permeabilida vascular y producción de glicosaminoglicanos que conllevan a la aparición de edema con separación de las fibras musculares (las cuales aparecen normales al examen microscópico) y la consecuente alteración del normal funcionamiento del músculo. Cuando la miositis originada por este proceso inflamatorio se hace crónica, puede desembocar en un cuadro de fibrosis con proliferación de tejido conjuntivo, e incluso reemplazo del tejido muscular por tejido graso, produciéndose zonas de atrofia entro del músculo, este proceso conlleva al establecimiento de una miopatia restrictiva que caracteriza las fases tardías de algunos pacientes con OT.
Una vez más el entendimiento del proceso fisiopatológico de la enfermedad nos lleva a hacer hincapié en el diagnostico precoz de la OT. Los pacientes que presentan un estadio inflamatorio temprano en el que no se han producido cambios cicatriciales ni fibróticos responden adecuadamente al tratamiento médico, lo que permite mantener el normal funcionamiento del músculo extraocular; contrariamente a los pacientes en fases crónicas o tardías de la enfermedad, en los cuales solo nos queda la difícil y muchas veces frustrante labor de realizar cirugía rehabilitadora para conseguir la binocularidad en las principales posiciones de mirada, trabajando sobre unos músculos con función anormal.
Cuando el engrosamiento es especialmente marcado en la región posterior muscular, cerca del anillo de Zinn, la retropulsión del globo es más patológica y existe un mayor riesgo de presentar neuropatía óptica (por compresión sobre el nervio óptico), que suele manifestarse con exoftalmos de grado moderado, lo que también se conoce como síndrome compresivo del ápex, que causa neuropatía en un 6-7% de los pacientes. Los pacientes con neuropatía óptica presentan alteraciones en el campo visual, las cuales pueden ser muy variables, además presentan alteraciones en la percepción de los colores, reflejo pupilar aferente, cambios en los potenciales visuales evocados y al examen del fondo de ojo el nervio óptico puede verse normal o presentar hiperemia o discreto borramiento de los bordes de la papila. La presencia de neuropatía óptica es indicativa de una rápida intervención terapéutica que incluye la descompresión quirúrgica del tercio posterior de la órbita (apex).
Clínicamente el síntoma más precoz de alteración muscular es la incapacidad, por parte del paciente, de mantener la lectura por tiempos prolongados, con fatiga y disconfort. Los pacientes reportan visión borrosa y dificultad de «enfocar» al realizar los movimientos oculares, no siendo concientes de la presencia de diplopía, interpretándola como visión difusa. Los síntomas tempranos se acentúan de mayor manera en momentos del día cuando el edema es mayor (por las mañanas) y cuando el individuo tiende a usar los músculos verticales (que suelen estar más afectados), como es el caso de estar acostado en cama, dicha sintomatología va mejorando a lo largo del día. Al ir progresando la enfermedad, el cuadro clínico tiende a empeorar, la restricción de la motilidad aumenta y se acompaña de dolor en los movimientos o sensación de presión. El individuo es conciente de la diplopía, la cual inicialmente es en las primeras horas del día y en posiciones extremas de mirada, hasta que progresa y se hace permanente al ser los músculos son menos distensibles (fig. 10). Los cuadros extremos pueden producir oftalmoplegia o marcadas restricciones de la motilidad con el consiguiente incremento de la posibilidad de presentar neuropatía óptica.

Fig. 10. Estrabismo restrictivo. Marcada restricción de la mirada superior,
OD es incapaz de elevarse y OI alcanza menos de 5º. En el recuadro inferior
se observa la posición compensadora de la cabeza para evitar la diplopía.
Al examen físico el paciente presenta hiperemia subconjuntival en la zona de inserción de los músculos rectos. A medida que la enfermedad progresa y los músculos pierden su elasticidad se produce rigidez de los mismos durante los test de ducción forzada. El grado en que se eleva la presión intraocular (PIO) durante el movimiento de los músculos se correlaciona con el grado de afectación, considerándose una elevación de más de 4 mmHg en la PIO como positiva para una restricción asociada a enfermedad tiroidea. En los sujetos normales este incremento raramente supera los 2 mmHg. En un estudio sobre 88 pacientes con patología tiroidea, hemos encontrado una correlación positiva entre el gradiente de presión intraocular (test de Braley) y el grado de afectación orbitaria, lo que nos demuestra que a mayor severidad de la orbitopatia hay mayor restricción muscular que origina mayores incrementos tensionales en las ducciones opuestas al músculo afecto. Consideramos, al igual que otros autores, que aumentos mayores de 9 mmHg se correlacionan con neuropatía óptica. La primera persona que publicó esta relación entre la PIO y la motilidad ocular en pacientes con orbitopatia tiroidea fue Alson Braley en 1953.
Una manera práctica de medir la motilidad ocular en el paciente es a través del reflejo de una linterna sobre la superficie anterior del ojo, utilizando los principios del test de Hirschberg se miden los grados de movimiento durante las ducciones oculares: 15º de movimientos en el borde pupilar, 30º en la mitad del iris y 45º en el limbo corneal. El uso de prismas para determinar el grado de estrabismo tiene un valor fundamental tanto diagnostico como terapéutico. Los test de pantalla de Hess son también de utilidad para documentar el progreso de la binocularidad del paciente, en especial, durante el tratamiento quirúrgico.
Los músculos más afectados clínicamente son el recto inferior (60%), sobre todo en pacientes de edad, y el recto medio (50%), por lo que en la clínica es frecuente la desviación hacia abajo y hacia adentro del globo ocular así como la dificultad en la mirada hacia arriba y hacia fuera. El recto superior (25%) y el recto lateral son músculos poco afectados y aún con menor frecuencia los oblicuos. Autores como Cabanis y cols y Nugent y cols (17,18) demuestran en estudios de imágenes, que radiológicamente el músculo más afectado en frecuencia es el recto superior.
La OT produce un engrosamiento de las glándulas lagrimales, las cuales se hacen palpables en su región palpebral, no siendo infrecuente que durante las blefaroplastias superiores para la rehabilitación quirúrgica de estos pacientes nos encontremos con una ptosis o hernia glandular la cual tengamos que reparar y recolocar la misma en su posición original sujetada al arcus marginalis. La glándula aparece móvil, de consistencia firme y no dolorosa a la presión. La infiltración celular de la glándula lagrimal, puede en algunos casos, producir destrucción de los acinos con fibrosis y disminución de la secreción lagrimal, lo que puede llevar a un empeoramiento de las alteraciones de la superficie ocular, cursando en primer lugar con epifora y posteriormente evolucionar hacia un síndrome de ojo seco.
Cambios en la superficie ocular
La exoftalmia, la disminución del parpadeo espontáneo, la retracción palpebral, la quemosis y el lagoftalmos, producen una exposición aumentada de la superficie ocular que conlleva a una desecación de la misma que puede derivar en una queratopatía por exposición de gravedad variable, siendo inicialmente leve, cuando es una de las claves del diagnostico precoz. En las formas leves, apenas existe una fina epiteliopatía puntiforme en la hemicórnea inferior (más expuesta por el lagoftalmos nocturno) que se puede extender a la conjuntiva adyacente. Si la exposición es mayor, la desepitelización corneoconjuntival se amplía al área de la hendidura palpebral, pudiendo, en los casos más desafortunados, ulcerarse el estroma corneal, e incluso perforarlo. La situación se agrava cuando existe fibrosis de la glándula lagrimal con la consiguiente disminución de la producción del componente acuoso de la película lagrimal. La queratopatia por exposición con riesgo de perforación ocular es uno de los motivos, junto a la neuropatía óptica por compresión, para realizar una descompresión quirúrgica de urgencia, ya que corre grave peligor la integridad visual del paciente.
En las fases de actividad de la OT es característico una hiperemia difusa de la conjuntiva, observándose además un aumento de la vasculatura subconjuntival en el área de inserción de los músculos extraoculares. La dificultad del retorno venoso en los territorios de las venas oftálmicas producen una acumulación de líquido que se evidencia en forma de quemosis conjuntival, la cual puede variar en intensidad desde ser muy discreta hasta prolapsarse más allá del borde libre palpebral (fig. 11).

Fig. 11. Quemosis marcada que sobrepasa el borde palpebral en la región
temporal. Orbitopatía activa en paciente con vitíligo y neuropatía óptica
asociada.
Clínicamente el paciente se quejan de picor, sensación de cuerpo extraño (refiere arenillas en los ojos), epífora y fotofobia. Esto se produce por evaporación acelerada del componente acuoso de la lágrima debido al agrandamiento de la hendidura palpebral, que puede alcanzar hasta 15-16 mm en vertical. A la orbitopatía tiroidea se asocia la queratoconjuntivitis límbica superior de Theodore, no estando clara la relación entre ambas entidades (casual o por un mecanismo de la orbitopatía aún no descubierto que ocasiona alteración local del tono vasomotor de la conjuntiva).
Cambios intraoculares
Como hemos mencionado anteriormente, la presión intraocular, en los casos de compromiso muscular, sufre una elevación tanto en posición primaria como en los movimientos de la mirada. Este aumento de la PIO es tratada y abordada por la gran mayoría de oftalmólogos como si se tratara de un glaucoma simple de ángulo abierto. Este concepto no solo es erróneo clínicamente sino también desde el punto de vista fisiológico. Primero tenemos que tener en cuenta que al ser el músculo recto inferior el más afectado clínicamente, al pedir al paciente sentado en la lámpara de hendidura que mire en posición primaria, realmente estamos obligándolo a mirar hacia arriba, ya que al haber compromiso del recto inferior el ojo suele descender y es por eso que muchos pacientes con OT inclinan la barbilla o mentón hacia arriba para evitar la diplopía, lo que quiere decir, que realmente no estamos tomando la PIO en posición primaria sino haciendo un test de Braley, esa medida elevada de la PIO no es la que el paciente tiene en el transcurso del día en posición primaria. En segundo lugar, el mecanismo de elevación de la PIO no es el del Glaucoma de ángulo abierto, y la causa de la elevación de la PIO es por aumento de presión en la órbita y la congestión del retorno venoso en la misma. El uso de fármacos antiglaucomatosos no produce el descenso esperado de la PIO en estos pacientes, a los cuales, muchas veces, en su ya difícil entorno psicológico se les agrega la errónea idea de que tienen un problema adicional como es el glaucoma, teniendo que poner gotas que generalmente son irritantes de la superficie ocular y que son mal toleradas por unos ojos que ya tienen esta ultima alterada. Por estos motivos el uso de medicación antiglaucomatosa es mas bien una tranquilidad para el oftalmólogo, y no una solución para el paciente. En la actualidad existen mecanismos de control temprano del daño de fibras nerviosas que pueden ser utilizados en estos pacientes, que deben ser observados para evitar el uso de agentes irritantes de la superficie ocular y también para detectar los posibles casos en que en realidad se trate de pacientes con OT y Glaucoma, y que no sea una hipertensión ocular causada por la enfermedad. Es de hacer notar que la descompresión orbitaria y la cirugía del estrabismo restrictivo disminuyen la PIO de estos pacientes. Estos cambios en la presión orbitaria deben también tenerse en cuenta en el momento de realizar cirugía de catarata en pacientes con OT, ya que aún en fases no activas pueden presentar complicaciones intraoperatoiras por este fenómeno, y en caso de usar anestesia peribulbar o tópica, hay que tener en cuenta que no son orbitas normales y que poseen una presión aumentada. Es aconsejable el uso de diuréticos durante la cirugía de cataratas.
Alteraciones del nervio óptico
La neuropatía óptica que se produce en la orbitopatía tiroidea es de tipo compresivo, aparece en el 5-7% de los pacientes con orbitopatía y en los casos de mayor presión en el vértice de la órbita. Curiosamente, no suele tratarse de pacientes con gran exoftalmia. Además de la compresión directa del nervio en su porción apical, contribuyen al daño del mismo el trastorno del retorno venoso, el estiramiento que sufre el nervio en la órbita al perder su trayectoria sinuosa y la hipertensión ocular. Cuando predomina la compresión apical del nervio, la papila puede presentar aspecto normal, edematosa, hiperemica o ligeramente isquémica. Las alteraciones más precoces se producen en la esfera de la percepción cromática, por ser los axones que proceden de la mácula los más sensibles al daño, clínicamente se evidencia alteración en el reflejo pupilar aferente. La progresión de la neuropatía, escotomas, atrofia-excavación y estasis dependerá de la propia OT y de la situación circulatoria previa del nervio (mayor sensibilidad a la isquemia-compresión en pacientes con antecedentes de patología vascular).
El que la neuropatía óptica sea más frecuente en pacientes con exoftalmias menores se explica por ser la proptosis una forma «espontánea» de descompresión orbitaria, pacientes con septos grasos mas distensibles permiten el movimiento axial del contenido orbitario, con lo que se libera la presión en la región orbitaria y particularmente en el apex donde se produce la compresión del nervio. Contrario a lo anterior, orbitas pequeñas con septos rígidos, o con un apex pequeño con aumento importante del tamaño muscular, desarrollan el llamado síndrome de hacinamiento el apex orbitario, con la consiguiente compresión y afectación del nervio óptico. La neuropatía óptica y los cambios campimétricos que esta produce son reversibles, siempre que se actué de manera rápida para evitar un daño permanente del nervio. La recuperación de la función normal del nervio óptico, la percepción cromática, los cambios en los potenciales visuales evocados (PVE), el defecto pupilar aferente y las alteraciones campimétricas suele restablecerse en el transcurso de varios meses.
En los estudios de imagen se puede observar, en casos de exoftalmias muy marcadas, un estiramiento del nervio óptico, con una deformidad en forma en «V» del polo posterior del globo con el vértice en la inserción del nervio, lo cual evidencia también sufrimiento del nervio, en este caso, por un mecanismo distinto a la compresión, siendo también un criterio para una rápida intervención terapéutica. Otros cambio que pueden afectar al globo ocular, son la aparición de hipermetropía o la presencia de pliegues retinocoroideos por compresión del polo posterior por parte de los tejidos orbitarios.
Como ya hemos recalcado antes, lo más importante de la clínica de la OT es reconocer los signos y síntomas que nos llevarán al diagnostico precoz de la enfermedad y evitara así el innecesario retraso del tratamiento médico que será la causa de las alteraciones irreversibles que se pueden presentar en esta enfermedad. Los signos y síntomas más frecuentes y útiles para realizar el diagnostico precoz son:
Signos: Edema palpebral, edema periorbitario, quemosis, hiperemia, queratopatía, conjuntivitis crónica.
Síntomas: Dolor o «sensación» orbitaria, lagrimeo, fotofobia, sensación de cuerpo extraño, visión borrosa, dificultad de enfoque (diplopía) e incomodidad (dolor) al mover los ojos.
Clasificación
Existen muchas clasificaciones de la OT, entre ellas, la más utilizada desde 1969 fue la de la Asociación Americana de Tiroides (ATA), dirigida por Werner, también llamada NOSPECS, que actualmente tiene un interés histórico por tener poco valor en el aspecto clínico, terapéutico y de pronóstico. Nosotros, al igual que otros autores como Rootman, Dolman, (19) o Mourits (20) con su propuesta de clasificación clínica de actividad (clinical activity score o CAS), preferimos clasificar la enfermedad orbitaria tiroidea en términos de su espectro de presentación clínica, basándonos en la presencia o no de factores inflamatorios que nos revelen la actividad de la enfermedad.
Existe una amplia difusión del termino de orbitopatia infiltrativa o no infiltrativa, también llamada por algunos autores enfermedad tipo 1 o tipo 2, que se basa en las diferentes formas clínicas de la enfermedad según su mayor afectación muscular (restricción) o grasa. Esta forma de analizar la OT no es incorrecta, pero preferimos no utilizarla, ya que sugiere una dicotomía patogénica, que no esta comprobada. Esta definición además presenta la OT como dos tipos de enfermedad o dos tipos rígidos de presentación, lo que clínicamente no es correcto por el amplio abanico de presentaciones clínicas que desarrollan estos pacientes, entendiendo nosotros, que la expresión clínica de la enfermedad es producto de las características propias de cada individuo (edad, sexo, raza, etc), así como de los factores concomitantes de la enfermedad (cigarrillo, control del estado metabólico, enfermedades asociadas como diabetes, etc) según hemos descrito en la fisiopatología de la OT.
La clasificación que utilizamos es de tipo práctico, sin tratar de explicar conceptualmente la enfermedad, sino más bien buscando la aplicación clínica, para una decisión terapéutica en el momento de ver al paciente en la consulta. El objetivo es establecer si la enfermedad esta en una fase activa o no activa, definiendo la actividad de la enfermedad en términos de inflamación. Una vez determinado esto, evaluamos la severidad de la afectación (leve, media, grave). La enfermedad no activa, no muestra signos ni síntomas de inflamación en el momento de presentación, es una enfermedad que ha tenido una forma larvada en su comienzo o es la evolución de una forma activa que ha respondido al tratamiento o que ha frenado espontáneamente su actividad (fig. 12).

Fig. 12. Los recuadros superiores evidencian pacientes con marcados cambios
por la orbitopatía tiroidea (estrabismo, exoftalmos, retracción palpebral y
redistribución grasa) pero sin signos de actividad inflamatoria. Los recuadros
inferiores muestran dos pacientes con actividad inflamatoria evidente
(quemosis, hiperemia palpebral-conjuntival, edema palpebral) además de
presentar exoftalmos, retracción y estrabismo.
Los determinantes clínicos de actividad que utilizamos son:
— Inicio reciente de la OT.
— Inicio agudo de la enfermedad.
— Progresión de la enfermedad (percepción del paciente de estar peor).
— Dolor o sensación retrobulbar.
— Dolor a los movimientos oculares.
— Grado de variabilidad de los síntomas (empeoramiento matutino).
— Inflamación palpebral (hiperemia, edema).
— Inflamación conjuntival (hiperemia, quemosis).
— Progresión del exoftalmos, la retracción y de la visión doble.
Como vemos, los signos y síntomas de actividad, son en buena parte subjetivos (también objetivos), por lo que además de evidenciarse clínicamente (edema, hiperemia, quemosis, exoftalmos, etc.) son percibidos por los pacientes (dolor, presión, lagrimeo, visión borrosa, diplopía, etc.), lo que nos da un arma muy valiosa para realizar el diagnostico precoz de la orbitopatia, que es el mejor determinante para la respuesta terapéutica y la evolución de la enfermedad. El endocrino, elaborando un simple cuestionario al paciente puede detectar la presencia de actividad clínica de OT en sus pacientes con enfermedad de Graves, mucho antes de que exista evidencia clínica de ella. En un estudio realizado en la unidad de orbita del Hospital General de Vancouver (6) donde se entregó un cuestionario, con preguntas basadas en exposición ocular, proptosis, visión y estrabismo en las consultas de endocrinología, se evidenció que se detectaban pacientes con signos clínicos de enfermedad orbitaria 8 meses antes, de lo que hubiesen sido referidos por los canales regulares. Esta experiencia demuestra que a través de sencillos métodos podemos hacer un diagnostico precoz eficiente y evitar las grandes deformidades y consecuencias, que aún hoy, vemos en algunos pacientes con OT.
Se han descrito signos paraclínicos de actividad de la enfermedad, como son:
— Variación en la reflectividad de los músculos extraoculares en la ecografía modo A.
— Tiempo de relajación mayor en T2 en RMN.
— Concentración de glicosaminglicanos en orina o suero.
— Scintillografia orbitaria positiva con octreotido.
— Scinitllografia orbitaria positiva con Galium-67-citrato (21).
Es importante la documentación en la historia de todos estos datos, subjetivos y objetivos para de este modo establecer una base para el estudio de la progresión (mejoramiento o no) de la enfermedad, ya que es posible, aunque raro, que una enfermedad no activa se convierta en activa, de igual modo la disminución o detención de la actividad nos evidenciará la correcta respuesta al tratamiento del paciente. Hay que recalcar, que si bien los signos y síntomas de la OT son característicos, pueden también semejar otra afectación orbitaria que debemos descartar, e incluso, puede aparecer una orbitopatia inflamatoria muy semejante a la OT como signo paraneoplásico en pacientes con tumores neuroendocrinos, como fue nuestra experiencia en un caso de un paciente con un tumor retroperitoneal, cuya clínica desapareció al ser resecado el tumor, casos similares han sido descritos en la literatura (22).
Una vez establecida la actividad de la enfermedad, buscamos los signos que nos hablen de severidad o grado de afectación, en estos damos gran importancia a la función visual (para determinar la presencia o no de neuopatia óptica o inducción de hipermetropia), el estado de la motilidad ocular (mayor restricción, mayor posibilidad de neuropatía óptica y peor calidad de vida del paciente), la retropulsión que será un indicador de la afección muscular posterior, cambios en la superficie ocular (estado corneal, evidencia de ulceración o epiteliopatia), grado de proptosis, grado de congestión orbitaria (la quemosis es un reflejo de la incapacidad del retorno venoso) y el test de Braley.
Una vez realizado un completo examen oftalmológico, debemos tener claro el grado de afectación orbitaria y la presencia o no de actividad de la OT, con lo que plantearemos nuestra decisión terapéutica según los hallazgos clínicos. Aún así es necesario el estudio paraclínico del paciente para confirmar el diagnostico y descartar otras patologías. Es importante también tener un adecuado conocimiento del estado metabólico del paciente por lo que tenemos que tener un estrecho contacto y colaboración con el endocrino tratante, de igual manera debemos saber las decisiones terapéuticas que se van a realizar al paciente para el control de su hipertiroidismo (drogas antitiroideas, yodo radiactivo o cirugía).
Es necesario recalcar que la orbitopatía, en algún momento de su evolución, siempre presenta una fase inflamatoria o de actividad (más o menos evidente), que puede ser subclínica o no visible para el explorador (simulando un estadio no inflamatorio). En algunos casos, estas formas subclínicas persisten, esto explicaría los pacientes aparentemente sin actividad y estables, pero que presentan una lenta y constante progresión en el tiempo.
En nuestra experiencia de los últimos 150 pacientes revisados, hemos encontrado que el 51,2% de ellos presentan una orbitopatía no activa en el momento de la consulta, mientras que el 48,8% presenta signos de actividad, de este último grupo, el 28,6% son de tipo leve, el 40,5% moderadas y el 26,2% severas. Hemos observados que en el grupo de mujeres el promedio de edad en las formas no activas es de 38 años mientras que el grupo activo tiene un promedio de edad de 47,3 años, y si bien esta diferencia no se da en el grupo de varones y los promedios de edad son muy similares, nos encontramos con que el promedio general de edad es mayor en hombres que en mujeres, evidenciando al factor edad como un elemento de peor pronóstico. Es interesante hacer notar que en las OT, el porcentaje de incidencia en mujeres es de el 89% en las no activas, 75% en las activas leves y 76,5% de las activas moderadas, por el contrario al llegar a las formas activas severas nos encontramos que la incidencia de mujeres es de solo el 36,5%, pasando los hombres a ocupar un 63,5% en esta categoría, luego de haber tenido una incidencia de 19% en la no activas, 25% en las activas leves y 23,5% en las activas moderadas, por lo que, al igual que otros autores, vemos que el sexo masculino es también un indicador negativo de la enfermedad. Los signos y síntomas de consulta más frecuentes en este estudio por orden de frecuencia, fueron: exoftalmos, retracción palpebral, algún tipo de diplopía y lagrimeo para los pacientes con enfermedad no activa y edema (hinchazón), fotofobia, lagrimeo y diplopía para los casos activos.
DIAGNÓSTICO POR IMAGEN
Ecografía
La ultrasonografía es una exploración de bajo coste económico, sin radiación ionizante y muy accesible al oftalmólogo, siendo un examen que practicamos de rutina a todos nuestros pacientes con OT durante el primer examen clínico. Tiene las desventajas de que requiere experiencia (es mucho más fácil visualizar el engrosamiento muscular en TC o RMN) y de que no aporta buenas imágenes del tercio posterior de la órbita, por la pérdida de respuesta ecogénica que se va produciendo a través de los tejidos (atenuación). Permite una rápida exploración de la órbita para descartar la presencia de otro tipo de afectación orbitaria (miositis, tumor, etc) mostrando los cambios producidos en la grasa y músculos orbitarios. A nivel muscular se observa engrosamiento del músculo en su vientre mientras la inserción aparece normal (fig. 13). En el modo A se observan ecos de reflectividad baja, que indican inflamación en el músculo (es un signo de actividad), esta imagen es el resultado de interfases en el músculo originadas por el edema y células inflamatorias al separar las fibras musculares. En los casos no activos aparecen ecos de media-alta reflectividad en el vientre muscular con una estructura irregular del músculo.

Fig. 13. Ecografía modo A y B (corte sagital). Engrosamiento del vientre muscular con
tendón de inserción normal. Baja reflectividad interna en modo A (sugiere inflamación).
Además del engrosamiento muscular también se puede apreciar el incremento del volumen de grasa, que se traduce en una imagen ecográfica orbitaria mayor de lo normal. Cuando hay aumento de grasa, se incrementa el volumen de los espacios extracónico, intraconico y preseptal, que puede manifiestarse en los modos A y B. La infiltración celular en los tabiques conectivos de la grasa refuerza las interfases acústicas del tejido adiposo, que aparece más heterogéneo y con media-alta reflectividad.
No es infrecuente encontrarnos con una glándula lagrimal de mayor tamaño, o con una vena oftálmica superior más dilatada en casos de compresión posterior (síndrome de hacinamiento del apex orbitario), en donde también se puede observar el ensanchamiento de las vainas del nervio (mayor presencia de líquido cefalorraquídeo) que sugiere neuropatía por compresión. Se ha llegado a detectar aumento del tamaño muscular en el 63% de pacientes con OT sin clínica oftalmológica, y con mucha frecuencia, bilateralidad en las formas clínicamente unilaterales. Mc Nutt y cols. han establecido el diámetro a partir del cual deben ser considerados patológicos cada uno de los músculos rectos: 5,2 mm para el medio, 5,1 mm para el lateral, 4,8 mm para el superior y 4,4 mm para el inferior, pero hay que tener en cuenta que estas mediciones pueden variar fácilmente con pequeños cambios en el ángulo del transductor. También se considera patológica una diferencia superior a 0,5 mm en el diámetro del mismo músculo en cada órbita.
La tomografía computarizada (TC) revela las estructuras anatómicas de la órbita a través del análisis de las diferentes densidades de los tejidos orbitarios. La grasa orbitaria tiene densidad negativa (–80 a –100 NHU), mientras que los músculos y el nervio óptico tienen densidad positiva (+20 a +45 NHU). Debido a esto, no es necesario utilizar habitualmente inyecciones de contraste en la exploración del exoftalmos endocrino, ya que la grasa sirve de contraste natural de fondo a los músculos, siendo estos dos los principales tejidos afectados en la OT. La inyección de contraste solo nos aporta la evidencia de mayor captación muscular por el incremento del flujo sanguíneo producto de la inflamación en los casos activos. El estudio de TC en la orbitopatía tiroidea se efectúa en cortes axiales cada 3-5 mm y coronales cada 5 mm, desde el párpado hasta el seno esfenoidal utilizando el plano de centrado de Salvolini-Cabanis.
Los hallazgos que aparecen en la TC son característicos: exoftalmos, engrosamiento del vientre muscular con inserción tendinosa normal, incremento de volumen de grasa y rectificación del nervio óptico. En algunos casos de OT aparece una imagen de efecto de masa difusa en el espacio intracónico (+20 +50 NHU) por la inflamación subaguda en la grasa orbitaria, lo que a veces no es fácil de diferenciar con imágenes de inflamaciones inespecíficas o linfomas. Los cortes axiales y coronales del apex muestran muy claramente la compresión del nervio óptico a nivel del vértice orbitario por el engrosamiento muscular cuando existe un síndrome de hacinamiento. La TC es también de gran valor ya que nos proporciona el detalle óseo y de los senos paranasales, imágenes de gran valor para la realización de los procedimientos quirúrgicos de descompresión. En algunos casos, en OT de larga evolución puede observarse el abombamiento óseo de las paredes etmoidales, produciendo la llamada imagen o signo de la botella de coca-cola. Si el retorno venoso está comprometido, la vena oftálmica superior muestra un diámetro superior al normal en cortes axiales y coronales, en algunos casos, en nuestra experiencia, luego de varios años de evolución, el cuadro de engrosamiento de los músculos puede conducir a la atrofia de los mismos. Cuando la musculatura presenta cambios de tipo fibróticos y atróficos, generalmente en casos crónicos, es posible ver imágenes hipodensas (oscuras) dentro de la masa muscular, lo que indica la presencia de tejido graso dentro del músculo. Cuando el estudio de la órbita no está bien centrado puede aparecer una imagen de masa en el tercio posterior del músculo recto inferior que puede simular un tumor en el suelo y vértice (fig. 14), de ahí la importancia que tiene hacer sistemáticamente un buen centrado utilizando el plano neuro-ocular de Cabanis.

Fig. 14. TC sin contraste. A: corte coronal, engrosamiento de los músculos rectos y
oblicuos, en especial de los rectos medios e inferiores que parecen fusionarse en
OI. B: corte axial, moldeamiento de la pared etmoidal OD (signo de coca-cola) por
engrosamiento del recto medio, tendón normal. C: corte axial con mala técnica, recto
inferior de OD semeja una masa en el suelo de la órbita. D: corte coronal, zonas
hipodensas dentro del tejido muscular, en especial en los rectos superiores de AO y
el recto inferior de OI.
En nuestra experiencia, casi el 90% de los pacientes tiroideos estudiados en la TC muestran anormalidades. El 75% tienen afectación muscular, con mayor incidencia en el recto inferior y después en el recto interno. No es infrecuente el engrosamiento del bloque que corresponde al músculo recto superior y elevador del párpado (17-18). En un estudio efectuado por Enzmann (1979) en 116 pacientes, el músculo recto inferior aparecía afectado en el 80% de los casos, el recto interno en el 75% y los rectos superior y lateral en el 50%. En menor proporción y más difícil de observar está el músculo oblicuo. En los exoftalmos clínicamente unilaterales, la TC mostraba signos de bilateralidad en el 50% de los casos, mientras que Trokel y Hilal (1979) encontraban un 95% de bilateralidad en pacientes con clínica unilateral.
En el estudio de Van der Gaag (1996), la TC demuestra que el aumento de volumen en la órbita se debe en un 45% de los casos a los músculos, tejido conjuntivo y grasa intraorbitaria; sólo a los músculos en un 20%, a la grasa en un 28% y refleja como normales un 4%. En algunos estudios coronales de TC aparece una banda blanquecina curva hiperintensa en la proximidad de la inserción de los músculos superiores, que va desde el músculo oblicuo mayor, pasa por el elevador y se extiende hacia el recto lateral que corresponde al músculo tensor intermuscular.
Es un estudio radiológico que no utilizamos de rutina, ya que presenta un elevado coste económico y aporta pocas ventajas respecto a la TC en cuanto al diagnóstico de la orbitopatía tiroidea. Se observan los mismos hallazgos morfológicos que en la TC, evidenciándose exoftalmos, engrosamiento de los músculos con aumento de su porción ventral, aumento del tejido graso, dilatación de la vena oftálmica superior, aumento difuso del tamaño de la glándula lagrimal y muestra las alteraciones en los diámetros de nervio óptico como dilatación de sus vaina cuando este presenta compresión o rectificación del mismo (fig. 15).

Fig. 15. RM. A: protónico axial, engrosamiento del vientre de ambos rectos medios.
B: T2 coronal, engrosamiento muscular asimétrico con mayor afección de recto
medio e inferior de OI. C: T1 coronal, discreto engrosamiento muscular con
aumento del tejido graso. D: T2 axial, gran exoftalmos con rectificación del nervio
óptico AO.
Recientemente se ha descrito la utilidad de practicar RM en imágenes ponderadas de T2 para medir la actividad inflamatoria (el tiempo de relajación en T2 es más largo, lo que sugiere el tratamiento con esteroides a dosis altas), pero su uso es más académico que práctico. Con la RM se puede valorar la actividad de la enfermedad porque está relacionada con la presencia de edema o de fibrosis en los músculos. En fase activa se observa hiperseñal, mayor celularidad (edema-agua), y en fase inactiva hay hiposeñal (fibrosis residual).
Cabanis confirma la importancia que tiene para evaluar el tratamiento con esteroides al descubrir en T1 la presencia de lesiones endomusculares precoces (áreas de hiperseñal en medio de la iso-hiposeñal normal del músculo en T1, que en la evolución se agrandan concéntricamente y corresponden a edema que precede a la degeneración grasa que a su vez camina hacia la atrofia) (17). En T2, la aparición de zonas de hiperseñal en el músculo se interpreta como una infiltración edematosa con acumulación de mucopolisacáridos (signo de actividad inflamatoria). También aporta el estudio de Gemen-RM, en el que analiza la grasa, exoftalmos, músculos, etmoides y nervio óptico con una valoración de 0 a 66 según la intensidad de los síntomas, así como la actividad.
La RM tiene la desventaja de no mostrar en detalle el tejido óseo, con lo que es menos útil que la TC para planear y valorar las decisiones quirúrgicas de tipo descompresivo, aún así es el estudio de rutina indicado por algunos especialistas en orbita, para evaluar la OT; nosotros no consideramos su utilización necesaria de manera rutinaria porque va a mostrar la expresión de los signos y síntomas que se evidencian en la anamnesis y exploración.
TRATAMIENTO DE LA ORBITOPATÍA TIROIDEA
En el centro de órbita hemos tratado en los últimos 30 años 1.632 pacientes con patología tiroidea, con una media de 110 casos/años en los últimos años. En el apartado de cirugía hemos descomprimido 604 órbitas con una media en los últimos años de 85 órbitas/año, lo que nos permite apoyar nuestros enfoques terapéuticos actuales en la experiencia.
El tratamiento de la OT, dependerá fundamentalmente del estadio (activo-no activo) de la enfermedad orbitaria, de su grado de afectación y del compromiso visual del paciente. Es importante señalar que la terapéutica en estos pacientes no sigue un esquema rígido, sino que depende de la variación individual de cada paciente, además de verse influenciado de manera importante por el entorno social y laboral. Hay que recordar que la OT es una enfermedad limitante desde el punto de vista de la función visual, con alteraciones físicas y psíquicas importantes en los pacientes, por lo que el objetivo primordial es la rehabilitación temprana de estos enfermos. El tratamiento de la OT es uno de los ejemplos mas claros donde se puede aplicar la frase de ir «sin prisas pero sin pausa» en un entorno donde la paciencia debe ser la primera virtud del oftalmólogo y del enfermo.
Los pacientes que presentan inicialmente cambios inflamatorios mínimos o que no tienen evidencia clínica de afectación orbitaria (fase inactiva) no requiere tratamiento especial porque en un 60 a 70% se presenta una mejoría espontánea de la enfermedad. El enunciado el anterior es el peor enemigo del especialista de órbita, ya que sugiere la errónea concepción entre los endocrinos y los oftalmólogos generales de que la OT remite espontáneamente sin tratamiento, lo que hace que aún veamos grandes deformidades e inflamaciones orbitarias por ser remitidas muy tardíamente. El hecho anterior nos lleva a aclarar el concepto, objetivo primordial de esta revisión, de que el mejor tratamiento de la OT es el diagnóstico precoz de la enfermedad. Por lo anterior debe quedar claro que ante la mínima evidencia clínica de inflamación, el paciente debe ser valorado por un especialista en órbita y que solo las enfermedades muy leves y sin evidencia clínica de inflamación o actividad pueden ser tratadas con observación, ya que si bien es cierto que la inflamación orbitaria algún día cederá espontáneamente, las consecuencias de esta serán permanentes, y en algunos casos, irreparables.
En caso de orbitopatías clínicamente inactivas, con ligeros o mínimos cambios pálpebro-orbitarios puede realizarse tratamiento sintomático, según las molestias que refiera el paciente, como puede ser:
• Retracción palpebral: ß-bloqueantes (guanetidina) o toxina botulínica.
• Fotofobia, lagrimeo: Gafas de sol.
• Sensación de cuerpo extraño: Lágrima artificial.
• Lagoftalmos: Uso de gel (oclusión nocturna).
• Diplopía: Prismas.
Para la simplificación clínica y terapéutica de una enfermedad tan compleja como la OT, debemos puntualizar las bases del tratamiento, que deberá ser la regla de oro a tener en cuenta siempre que estemos ante un paciente con esta enfermedad:
— Los pacientes con orbitopatia activa (en fase inflamatoria) deberán ser tratados con medicación antiinflamatoria como son:
• Esteroides (V.O o I.V).
• Radioterapia.
• Inmunosupresores.
— Los pacientes con orbitopatía no activa (en fase no inflamatoria) deberán ser tratados quirúrgicamente (de ser necesario) según la rehabilitación requerida:
• Descompresión orbitaria.
• Retracción palpebral.
• Estrabismo.
• Lipectomía periorbitaria.
• Blefaroplastia.
— Los pacientes, independientemente de la fase en que estén (aunque generalmente suelen estar activos), que presenten compromiso importante de la función visual por neuropatía óptica compresiva o por riesgo de perforación corneal deberán ser tratados como urgencia médico-quirúrgica:
• Agresivo tratamiento médico.
• Cortisona I.V (pulsos o bolos) / Radioterapia.
• Descompresión orbitaria de urgencia (asociada a tratamiento médico agresivo).
En la orbitopatía tiroidea es siempre importante el control sistémico del paciente por parte del endocrino, pero lo es aún más en la fase activa de la enfermedad, para evitar los brotes o recaídas clínicamente observados cuando hay episodios agudos de hiper o hipotiroidismo por un mal control, observación clínica notada con mayor frecuencia en pacientes jóvenes.
Cuando la inflamación es mínima, o incluso, si no hay evidencia clínica de ella, pero el paciente subjetivamente nos refiere sintomatología (empeoramiento por las mañanas, sensación o dolor a la motilidad, lagrimeo, etc) se debe indicar una pauta de esteroides en dosis de 90-120 mg/prednisona/día por 9-10 días y si la respuesta es positiva, seguir con reducción progresiva del tratamiento hasta las 4-6 semanas. Algunos autores han sugerido tratamiento con antiinflamatorios no esteroideos (AINES) u otras drogas antiinflamatorias para estos pacientes, pero nuestra experiencia clínica desaconseja estos métodos por ser poco eficaces y además por la buena respuesta a los corticoides, los cuales por su corta duración no producen alteraciones sistémicas significativas.
Para los casos con mayor grado de inflamación se debe indicar el uso de esteroides a dosis mayores para conseguir efectos no solo antiinflamatorios (interfierir en la función de los linfocitos T y B, a la vez de reducir los neutrófilos, macrófagos y monocitos, inhibir las citoquinas como mediadoras y actúar también sobre los fibroblastos disminuyendo la síntesis y la secreción de GAG) sino también inmunosupresores. Es importante recalcar que dosis de 60 mg de prednisona en pacientes con actividad evidente son insuficientes y de esta dosis solo obtendremos los efectos colaterales negativos de los corticoides (los cuales además tenderán a prolongarse en el tiempo) sin efectos beneficiosos para los pacientes. Para los pacientes con OT activa nos planteamos dos alternativas terapéuticas de ataque, la primera es el uso oral de 120-150 mg/prednisona/día, por un mínimo de 9 días, y si la respuesta es positiva se baja la pauta progresivamente hasta 30 días, continuando si es necesario con una dosis mínima de mantenimiento por 2-3 meses. Otra alternativa son los pulsos intravenosos de 1 g/metilprednisolona/día 3 días seguidos o alternos cada 4-5 semanas en casos de marcada inflamación. El beneficio de los pulsos I.V. de cortisona es porque se ha demostrado un efecto de linfocitolisis (6) además del efecto de supresión de la actividad inflamatoria. Los pacientes suelen necesitar menos de tres pulsos I.V. de tratamiento, pero se pueden repetir incluso hasta 6 veces. El beneficio de esta modalidad terapéutica es que se evita el efecto colateral del uso de corticoides por largo tiempo (hirsutismo, HTA, aumento de peso, úlcera péptica, descalcificación, diabetes, cataratas, enfermedad de Cushing, etc) ya que no es necesario indicar tratamiento oral luego de los pulsos (aunque algunas veces puede hacerse), lo que lo hace más indicado en pacientes diabéticos (en los que a veces es necesario el uso de insulina durante los bolos de esteroides) que, sin embargo, suelen responder peor que los pacientes no diabéticos. El mayor inconveniente es que su aplicación requiere de un medio hospitalario (durante 4 a 5 horas) para control de los parámetros sistémicos como glicemia, tensión arterial, electrolitos y la realización de un electrocardiograma.
En caso de pacientes con mala respuesta al tratamiento esteroideo, diabéticos que necesiten su uso prolongado, enfermos con úlcera gástrica o cualquier otro caso en que el uso de corticoides desee evitarse o disminuirse se puede utilizar tratamiento con drogas alternativas como:
1. Inmunosupresores:
• Ciclosporina (3-5mg/kg/día).
• Azatioprina (2 mg/kg/día).
• Ciclofosfamida (2 mg/kg/día).
• Metotrexate (20 mg/semana).
2. Tratamientos en fase de estudio:
• Somatostatina y análogos.
• Inmunoglobulinas iv.
• Complementos minerales antioxidantes.
• Colchicina.
El uso de estos medicamentos puede hacerse bien como monoterapia o como coadyuvantes de la terapia esteroidea. El mayor conocimiento fisiopatológico de la enfermedad hace que el uso de inmunosuprosores se haga cada día más común y más precoz, además de orientar su uso hacia el tipo de medicamentos que actúan sobre el grupo celular especifico involucrado en cada fase de la OT. Nuestra experiencia con el uso de inmunosupresores es muy satisfactoria, en especial el uso de ciclosporina (hasta por 6 meses), cuya función esta dirigida sobre los linfocitos T, lo que la hace muy efectiva en las etapas iniciales de la enfermedad cuando el mecanismo inflamatorio es de tipo celular, su efectividad disminuye en etapas tardías de la OT. Con el uso de otros inmunosupresores (Metrotexate, Azatioprina, Ciclofosfamida) hemos tenido peores resultados, siendo el ideal del tratamiento más tardío un efectivo inmunosupresor de linfocitos B.
En casos de orbitopatía activa, en especial si hay compromiso muscular importante el uso de la radioterapia debe plantearse, bien sea en caso de poca respuesta al tratamiento médico o también como complemento del mismo, no siendo nunca ambas modalidades excluyentes la una de la otra ni tampoco se tiene que ver a la radioterapia como un paso siguiente al uso de esteroides en todos los pacientes.
La radioterapia a dosis de 20 Gy (2 Gy/día, 5 días/semana, 2 semanas) en campos oblicuos, tiene buenos resultados en la fase activa en un 70% de los casos, disminuyendo cuando se indica en fases inactivas o crónicas. Su uso disminuye o frena la actividad inflamatoria, los estudios han demostrado que acorta el periodo de actividad de esta enfermedad (5) y se ha recomendado su aplicación en casos de neuropatía óptica (incipiente). El mecanismo de acción de la radioterapia no es bien conocido, no existe una explicación clara para el efecto de un tratamiento local en una enfermedad sistémica. Se conoce que la radiación tiene efectos antiinflamatorios produciendo la destrucción de la población de linfocitos T, lo cual explicaría parcialmente su utilidad (en especial en fases iniciales) ya que no explica el porque una nueva población de linfocitos no puede repoblar la orbita. Se ha demostrado que en cultivos de fibroblastos orbitarios, estas células cambian la expresión de sus antígenos de superficie celular al recibir radioterapia, produciendo un fenotipo mas parecido al de los fibroblastos extraorbitarios. Alternativamente la radioterapia puede inactivar o destruir las células locales presentadoras de antígenos, explicando así sus efectos beneficiosos a largo plazo. Últimos reportes, cuestionan el uso y la eficacia de la radioterapia en la OT (23), aún así pensamos que esta se ha ganado un lugar en el tratamiento de la enfermedad con una efectividad clínica basada en la experiencia. El hacer estudios adecuados para valorar la verdadera eficacia de este tratamiento es muy difícil ya que su indicación no suele estar estandarizada, y sabemos que no es efectiva si no existe actividad inflamatoria evidente y es mucho menos efectiva en enfermedades crónicas. De igual modo la gran mayoría de pacientes tratados con radioterapia han sido previamente o concomitantemente tratados con esteroides lo que complica aún más el objetivo análisis de esta técnica terapéutica. Las complicaciones de la radioterapia son en la práctica clínica inexistentes, pero están descritas (cataratas, retinopatía, etc), su uso esta contraindicado en pacientes diabéticos y debe evitarse en gente joven. Se puede producir un empeoramiento temporal de la inflamación durante la radioterapia que cede espontáneamente pero que puede prevenirse con esteroides (30-50 mg/día/prednisona).
En fases activas de la enfermedad no hay que olvidar las medidas básicas y sintomáticas para el alivio del paciente, como son la utilización de lubricación de la superficie ocular (preferiblemente sin preservativos) la buena oclusión nocturna, el uso de compresas frías en la región periocular, etc. En algunos casos el uso de toxina botulínica para la retracción palpebral puede ser útil como medida paliativa temporal.
Es el objetivo de esta revisión recalcar el gran valor del diagnóstico precoz y por lo tanto del tratamiento temprano de esta enfermedad, para evitar las alteraciones orbitarias que produce las fase inflamatoria y que son solo susceptibles a tratamiento quirúrgico, por lo que debemos considerar este último como el fracaso del tratamiento de la OT.
El tratamiento de la OT no activa es de tipo quirúrgico-rehabilitador, no debemos pensar en la cirugía como un tratamiento cosmético o plástico porque no lo es, los cambios perioculares y orbitarios no son producto del envejecimiento natural de los pacientes sino de un proceso mórbido que altera la anatomía normal de la orbita del paciente y coloca sus estructuras (globo ocular, párpados, grasa, etc) en lugares anatómicamente incorrectos.
Tradicionalmente se recomienda un esquema gradual y ordenado para la rehabilitación quirúrgica de los pacientes, haciendo cirugía por etapas, según las necesidades del enfermo, de la siguiente manera:
— Descompresión orbitaria (Ósea y Grasa).
— Estrabismo Restrictivo.
— Cirugía palpebral (retracción).
— Blefaroplastia-Lipectomía periorbitaria.
Hemos dicho antes que la OT tiene graves consecuencias psicológicas y sociales, encontrándonos que muchos pacientes que llegan a la fase de rehabilitación quirúrgica han pasado por un periodo de actividad que dependiendo de la severidad y duración ha generado, no solo deformidad orbitaria sino que ha causado un prolongado tiempo de inactividad laboral y otros trastornos en la calidad de vida del paciente. Es por esta razón, y por ser centro de referencia de pacientes fuera de nuestra comunidad, que nos hemos visto obligados a desarrollar un planteamiento quirúrgico más agresivo, que no condene al paciente a un número predeterminado de cirugías y que resuelva a la brevedad posible su incapacidad para desarrollar actividades productivas. La experiencia de más de 600 órbitas descomprimidas e incontables cirugías de párpados y estrabismo nos han permitido hacer la rehabilitación de estos pacientes en un solo paso quirúrgico, con resultados satisfactorios en los últimos 3 años, lo que también nos ha motivado y obligado al diseño de técnicas personales como en el caso de la descompresión orbitaria a través del pliegue palpebral superior interno, con muy buenos resultados (fig. 16).

Fig. 16. Rehabilitación quirúrgica de una orbitopatía no activa.
Recuadro superior: pre-operatorio. Recuadro inferior: post cirugía de
descompresión, lipectomía, reparo de la retracción palpebral,
blefaroplastia superior e inferior y resección de SOOF.
Toda la cirugía que realizamos en la rehabilitación quirúrgica del paciente con OT la hacemos a través de microscopio (OPMI 111 de Zeiss) utilizando bisturí eléctrico con aguja de Colorado, variando la potencia en los modos de corte y coagulación según los requerimientos del tejido intervenido. Hemos aplicado el concepto de la cirugía de pequeña incisión de la catarata a la cirugía orbitaria, trabajamos por pequeñas incisiones en el pliegue palpebral superior que nos llevarán a espacios más grandes, como si estuviésemos realizando la intervención a través de la vía endoscopica. Pensamos que la magnificación del microscopio y la utilización de instrumental de microcirugía son imprescindibles para el cuidadoso manejo de los tejidos orbitarios. El presente de esta cirugía es la microcirugía orbitaria y el futuro más lejano deberá ser a través de navegadores que nos permitan introducir elementos por mínimas incisiones que nos den una adecuada visualización y expansión los tejidos orbitarios.
D
Nuestra experiencia y aplicación de las técnicas quirúrgicas esta ampliamente detallado en otras publicaciones (1) por lo que limitaremos la descripción de la técnica quirúrgica de descompresión a la que mas empleamos hoy en día. Utilizamos la técnica personal de descompresión de la pared interna de la órbita y del suelo en su parte interna (por dentro del canal del N. Infraorbitario) por vía transpalpebral, dejando la descompresión de la porción externa del suelo y de la pared lateral para casos de gran exoftalmia donde también realizamos un fresado de su parte media y posterior hasta alcanzar la fosa temporal y posteriormente la duramadre. La vía caruncular para descompresión media (suelo y pared interna) es una muy buena alternativa para casos en los que solo se vaya a realizar la descompresión sin otra cirugía agregada, palpebral o muscular.
En el abordaje palpebral superointerno se debe utilizar un microscopio quirúrgico que tenga luz coaxial (OPMI 111 de Zeiss) con lente de 250 mm para que pueda llegar a etmoides posterior. La incisión de 10-15 mm. en el mismo pliegue palpebral se hace con el bisturí de Colorado n.º 104 en 6-7 watts en corte para no lesionar excesivamente la piel y orbicular, accediendo directamente al compartimiento graso superointerno por dentro del músculo elevador del párpado. Se hace una incisión en el septum y lipectomía de este cuadrante cuidando no lesionar la rama de la vena oftalmica superior (V.O.S.) ni el nervio frontal, desde aquí podemos acceder a la grasa intraconica, teniendo mucho cuidado al hacer lipectomía anterior de ella, de no lesionar los ligamentos del recto medio que pueda causar fibrosis post cirugía (fig. 17). Si es necesario se puede realizar lipectomia de la mitad de la grasa palpebral superior (preaponeurótica) que va paralela y por encima del pliegue y es de color amarillo brillante en comparación a la orbitaria intracónica que tiene color mas pálido y blanquecino. Una vez concluida la lipectomia nos dirigimos hacia la pared ósea superointerna para despegar la periórbita por encima del ligamento cantal interno y por detrás de la cresta lagrimal posterior. Incidimos con un periostotomo el periostio e intentamos despegarlo de la pared ósea, continuando la disección hacia abajo y atrás en todo el etmoides lo cual se hace con facilidad, igualmente liberamos el suelo en su tercio interno. Se protege y tracciona el periostio y los elementos orbitarios (músculo recto medio y grasa) hacia fuera con una espátula para convertir este espacio virtual en real y así hacer la osteotomía de todo el etmoides con una pinza de microcirugía recta de 3-4 mm de ancho hasta casi el ala menor. Al terminar la osteotomía del etmoides hacemos también la osteotomia del suelo hasta llegar si es posible hasta el canal infraorbitario (utilizando pinzas microquirúrgicas curvas), generalmente no dejamos puente óseo entre el etmoides y el suelo orbitario e incluso en muchos casos abrimos una vía hacia fosa nasal para que nos sirva de drenaje en el postoperatorio y así evitar una hemorragia o hematoma en orbitario. Una vez finalizada la descompresión ósea es necesario crear desgarros controlados en la periórbita para permitir que la grasa orbitaria se prolapse en el nuevo espacio formado, para esto hay muchas formas posibles, seccionando con tijera de puntas romas el periostio desde la cresta lagrimal posterior hacía el canal óptico. Otra forma interesantes es la utilizada por Rootman, quien emplea un cuchillete de artroscopia de corte reverso (Arthro-Lok reverse cutting blade no. 6083, Beaver) para desgarrar la periórbita en sentido postero-anterior una vez creado un pequeño agujero en la periórbita posterior con una aguja doblada en forma de cistotomo (24). Dejamos un drenaje con un Penrose de 2-3 mm. que retiramos a las 12-24 horas, se sutura del plano muscular orbicular con vycril 6.0 y piel con Prolene 6/0 en sutura continua que se retira a los 4-5 días. Cuando hacemos lipectomia de la grasa palpebral subciliar superior (SOOF) y/o blefaroplastia, la incisión se extiende a lo largo de todo el pliegue palpebral superior (fig. 18).

Fig. 17. Cirugía. A: Incisión en pliegue palpebral supero-interno. B: límite
entre aponeurosis y septum (flechas) y lugar de incisión del septum para
lipectomía (--). C: lipectomía superointerna. D: lugar de incisión del periostio
para acceder al etmoides (flechas), grasa palpebral (*).

Fig. 18. Cirugía palpebral. A: blefaroplastia, resección de grasa preaponeurótica.
B: debilitamiento anterior del elevador. C: resección de SOOF. D: lipectomía.
Hemos descomprimido más de 600 órbitas en las que las últimas 328 se han hecho con esta técnica personal con muy buenos resultados, con reducción del exoftalmos entre 3 y 6,5 mm promedio. Realizando solo etmoides obtenemos reducciones de 2,7-4,25 mm, descomprimiendo etmoides y todo el suelo obtenemos entre 4 y 8 mm, que asociado a la pared lateral puede llegar a 10-11 mm. Es una técnica que aporta excelentes resultados cosméticos al permanecer oculta la pequeña cicatriz en el pliegue y que además permite realizar cirugía del párpado superior (retracción vía anterior, blefaroplastia y lipectomia subciliar) prolongando la incisión, también permite trabajar sobre la conjuntiva en caso de necesidad de realizar cirugía de estrabismo en el mismo acto operatorio. La complicación más común de la descompresión suele ser la aparición de estrabismo en posición primaria, lo que generalmente sucede en pacientes que ya tienen compromiso muscular previo y sufren una descompensación post quirúrgica. Puede existir riesgo de perdida de visión por isquemia (importante valorar la pupila durante la cirugía), hematoma post operatorio, pérdida de líquido cefalorraquideo, neumo orbita e infecciones.
Para complementar la descompresión del suelo, en su porción externa, por fuera del nervio infraorbitario y dejar expuesto este nervio, utilizamos la vía conjuntival inferior. Con la aguja de Colorado incidimos la conjuntiva (4-5 watts) por debajo del borde tarsal inferior evertiendo el párpado sobre un Desmarres, separamos el bloque retractores-conjuntiva del borde tarsal y lo disecamos del músculo orbicular por delante del septum inferior hasta alcanzar el reborde orbitario, si deseamos realizar lipectomia inferior palpebral podemos incidir el septum y resecar la grasa o, en algunos casos, se puede retraer el tejido graso con coagulación (potencias de 20-25 watts) con el fin de evitar la perdida de soporte del párpado inferior que con el paso del tiempo causará una retracción del mismo. En este momento también es posible la resección del paquete graso inferoexterno, que se comunica con la grasa intracónica entre el recto lateral y el inferior y que puede servir para aumentar el efecto descompresivo (4-5 cc grasos). Al llegar al reborde orbitario se incide el periostio y se diseca con un periostotomo para despegarlo del suelo óseo, en este momento la exposición del campo se facilita retrayendo el periostio y el globo ocular con retractores maleables ejerciendo la mínima presión posible. Una vez expuesto el suelo se fractura por fuera del canal del infraorbitario o, utilizando pinzas curvas, se continua la resección ósea lograda a través de la vía palpebral superior (por dentro del canal) para resecar todo el suelo óseo orbitario y dejar expuesto el infraorbitario (fig. 19), evitando su manipulación excesiva, al quedar expuesta la mucosa del seno maxilar se despliega hacia el interior del seno y luego se realizan incisiones en la periorbita para permitir el prolapso del tejido orbitario al nuevo espacio creado. Es importante realizar el cierre por planos, en especial el periostio anterior para evitar retracciones palpebrales.
Fig. 19. Cirugía inferior vía conjuntival. A y B: lipectomía, clara exposición de
los 3 paquetes grasos inferiores a través del septum. C: abordaje del suelo, la
flecha señala el reborde orbitario y el asterisco muestra el suelo óseo de la
órbita. D: la flecha señala al nervio infraorbitario que ha sido denudado luego
de una completa resección del suelo de la órbita.
Para corregir quirúrgicamente el estrabismo primario, debe transcurrir un mínimo de 4-5 semanas desde el comienzo de la diplopía y no haber cambios evidentes en el ángulo de desviación con mínimas modificaciones en la pantalla de Weiss. La cirugía es siempre debilitante, es decir se realiza retroinserción de los músculos la cual se puede hacer con suturas fijas, cuando el músculo no tiene capacidad de retracción-contracción como sucede después de grandes descompresiones o con suturas ajustables que nos permite en el espacio de 48 horas reajustarla si no se consigue visión binocular. La decisión para hacer fija o ajustable la sutura la tomamos en el acto quirúrgico una vez estudiamos la elasticidad del músculo antes y después de seccionar la inserción en el globo, utilizando el test de ducción forzada. La cirugía debilitadora puede llegar a 10 mm en los rectos horizontales y a 8 mm en los verticales.
El grado de retracción palpebral superior no tiene relación con la exoftalmia y en algunos casos esta relacionada con la fibrosis del músculo recto inferior. Empleamos habitualmente la técnica de debilitamiento posterior vía conjuntival bajo anestesia local para obtener una mejor posición y simetría palpebral. Se evierte el párpado sobre un Desmarres y con la aguja de colorado se separa la conjuntiva y el músculo de Müller de su inserción sobre el tarso. Como realizamos la cirugía bajo microscopio podemos sin dificultad separar el Müller de la conjuntiva y resecarlo parcial o totalmente (fig. 20). De ser insuficiente (baja 1-2 mm) debilitamos la aponeurosis del elevador, especialmente en su cuerno lateral donde genera mayor retracción. La desinserción de la aponeurosis y la resección del músculo de Müller también es posible por vía anterior, e incluso es más fácil para el cirujano inexperto. Durante la Müllerectomia posterior es importante evitar los orificios de salida de los ductos de la glándula lagrimal y provocar así un ojo seco. El uso de espaciadores esta reservado a casos extremos o luego de múltiples cirugías.

Fig. 20. Debilitamiento del complejo elevador por vía conjuntival. A: eversión y
anestesia subconjuntival. B: disección de la conjuntiva. C: disección del músculo de
Müller entre la conjuntiva y el elevador. D: disección del tercio externo del elevador.
En el párpado inferior también se corrigen las retracciones palpebrales. Desinsertamos el retractor y la conjuntiva inferior después de inyectar anestesia local en el párpado evertido sobre un Desmarres. Una vez seccionado el retractor al que va adherido la conjuntiva podemos debilitarlo y aislarlo de ella para conseguir 1-1,5 mm. de elevación del párpado, pero si queremos mas de 2 mm. es necesario poner un espaciador entre el borde inferior del Tarso y el bloque conjuntiva-retractor o fascia capsulo-palpebral. En la misma cirugía podemos hacer lipectomia de las bolsas palpebrales inferiores e incluso lipectomia de la grasa orbitaria inferior, inferoexterna en incluso por esta vía abordamos el suelo orbitario para su descompresión.
Se pueden realizar posteriormente o junto con la descompresión orbitaria al ser en gran medida causante de la gran deformidad palpebral que evidencia el paciente. Al resecar la grasa subciliar localizada entre el reborde óseo superolateral y la ceja hay que tener precaución en el tercio interno de no acercarse mucho a la escotadura del N. Supraorbitario para evitar problemas posteriores de sensibilidad, además el problema de acumulación de esta grasa es principalmente temporal y no requiere grandes resecciones mediales. La blefaroplastia, tanto superior como inferior siguen las técnicas convencionales descritas, es importante recalcar que en los pacientes con OT hay que hacer una resección generosa en el párpado superior ya que es frecuente la formación de un doble pliegue, en especial cuando se realiza la cirugía junto con la descompresión orbitaria. Por el contrario, hay que evitar las resecciones de piel en el párpado inferior por la fácil hipercorrección que se puede producir, por lo general en este nos limitamos ha hacer lipectomia de los 3 bolsillos grasos. Durante la cirugía descompresiva, al hacer la lipectomía inferior, existe un paquete graso, que se comunica con la grasa intracónica, que puede ser resecado con relativa seguridad, en el área externa del párpado y que se extiende a la orbita entre el músculo recto lateral y el inferior, esta lipectomía nos puede ayudar para aumentar un poco el efecto descompresivo. Al coagular la grasa inferior con 20-25 watts se produce una retracción cutánea en el párpado inferior que hace innecesaria la resección de piel y orbicular.
BIBLIOGRAFÍA
1. Perez Moreiras JV, Prada Sanchez MC, Coloma Bockos J, Prats J, Adenis JP, Rodriguez Alvarez F, Perez Becerra E. Oftalmopatia distiroidea. In: Perez Moreiras JV, Prada Sanchez MC. Patología Orbitaria. Barcelona: Edika Med 2002; II: 949-1033. [ Links ]
2. Wiersinga WM, Bartalena L. Epidemiology and Prevention of Graves’ ophthalmopathy. Thyroid 2002; 12: 855-860. [ Links ]
3. Jacobson DL, Gange SJ, Rose NR, Graham NM. Epidemiology and estimated population burden of selected autoimmune diseases in the United States. Clin Immunol Immunopathol 1997; 84: 223-243. [ Links ]
4. Perez Moreiras JV, Prada Sanchez MC, Coloma Bockos J. Oftalmopatia Distiroidea. Oftalmologia Practica 2002; 16: 24-58. [ Links ]
5. Kazim M, Goldberg RA, Smith TJ. Insights into pathogenesis of thyroid-associated orbitopathy: evolving rationale for therapy. Arch Ophthalmol 2002; 120: 380-386. [ Links ]
6. Rootman J, Dolman PJ. Thyroid Orbitopathy. In: Rootman J. Diseases of The Orbit. Philadelphia: Lippincott Williams & Wilkins 2003; 169-212. [ Links ]
7. Facciani JM, Kazim M. Absence of seasonal variation in Graves disease. Ophthal Plast Reconstr Surg 2000; 16: 67-71. [ Links ]
8. Bartley GB, Fatourechi V, Kadrmas EF, Jacobsen SJ, Ilstrup DM, Garrity JA et al. The treatment of Graves’ ophthalmopathy in an incidence cohort. Am J Ophthalmol 1996; 121: 200-206. [ Links ]
9. Pfeilschifter J, Ziegler R. Smoking and endocrine ophthalmopathy: impact of smoking severity and current vs lifetime cigarette consumption. Clin Endocrinol (Oxf) 1996; 45: 477-481. [ Links ]
10. Kimball LE, Kulinskaya E, Brown B, Johnston C, Farid NR. Does smoking increase relapse rates in Graves’ disease? J Endocrinol Invest 2002; 25: 152-157. [ Links ]
11. Bahn RS. Thyrotropin receptor expression in orbital adipose/connective tissues from patients with thyroid-associated ophthalmopathy. Thyroid 2002; 12: 193-195. [ Links ]
12. Mack WP, Stasior GO, Cao HJ, Stasior OG, Smith TJ. The effect of cigarette smoke constituents on the expression of HLA-DR in orbital fibroblasts derived from patients with Graves ophthalmopathy. Ophthal Plast Reconst Surg 1999; 15: 260-271. [ Links ]
13. Anderson DJ, Axel R. Molecular probes for the development and plasticity of neural crest derivates. Cell 1985; 42: 649-662. [ Links ]
14. Cockerham KP, Hidayat AA, Brown HG, Cockerham GC, Graner SR. Clinicopathologic evaluation of the Mueller muscle in thyroid-associated orbitopathy. Ophthal Plast Reconstr Surg 2002; 18: 11-17. [ Links ]
15. Kikkawa DO, Pornpanich K, Cruz RC Jr, Levi L, Granet DB. Graded orbital decompression based on severity of proptosis. Ophthalmology 2002; 109: 1219-1224. [ Links ]
16. Lacey B, Chang W, Rootman J. Nonthyroid causes of extraocular muscle disease. Surv Ophthalmol 1999; 44: 187-213. [ Links ]
17. Cabanis E, Bourgeois H, Iba-Zizen MT. Orbitopathies dysthyroidiennes. L’Imagirie en ophtalmologie. Societe Française D’Oftalmologie 1996; 35: 558-572. [ Links ]
18. Nugent RA, Belkin RI, Neigel JM, Rootman J, Robertson WD, Spinelli J et al. Graves orbitopathy: correlation of CT and clinical findings. Radiology 1990; 177: 675-682. [ Links ]
19. Dolman P, Rootman J. Visa classification for Graves orbitopathy. In: Vancouver Orbital Symposium. Vancouver 2002; 135-136. [ Links ]
20. Mourits MP, Koornneef L, Wiersinga WM, Prummel MF, Berghout A, van der Gaag R. Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: a novel approach. Br J Ophthalmol 1989; 73: 639-644. [ Links ]
21. Konuk O, Atasever T, Unal M, Ayvaz G, Yetkin I, Cakir N et al. Orbital gallium-67 scintigraphy in Graves’ ophthalmopathy. Thyroid 2002; 12: 603-608. [ Links ]
22. Diacon AH, Schuurmans MM, Colesky FJ, Bolliger CT. Paraneoplastic bilateral proptosis in a case of non-small cell lung cancer. Chest 2003; 123: 627-629. [ Links ]
23. Prat Partomeu J. ¿La radioterapia en la oftalmopatia asociada al tiroides es o no beneficiosa? Arch Soc Esp Oftalmol 2003; 78: 131-132. [ Links ]
24. Rootman J, Stewart B, Goldber R. Descompression for Thyroid Orbitopathy. In: Rootman J, Stewart B, Goldber R. A Conceptual Approach. Philadelphia: Lippincott-Raven 1995; 353-384. [ Links ]















