Introducción
En España, desde el año 2003, se han notificado un total de 56.748 nuevos casos de infección por el virus de la inmunodeficiencia humana (VIH). Las tasas anuales de nuevos diagnósticos por 100.000 habitantes oscilaron entre 12,81 en 2008 y 5,94 en 2019, asociándose este descenso con el tratamiento antirretroviral (TAR)1. En un estudio publicado recientemente se ha calculado que el TAR en España ha requerido una inversión desde su introducción en 1987 hasta 2018 de 6.185 millones de euros, además el gasto en 2019 del tratamiento TAR se estimó en 677 millones de euros, lo que supone un 2,86% del gasto total del Sistema Nacional de Salud (SNS) en productos farmacéuticos y sanitarios2. El coste anual de los TAR teniendo en cuenta el coste farmacológico, los eventos adversos derivados del tratamiento, así como los estudios de resistencia y las pruebas HLA B*5710 necesarias, puede oscilar entre 6.788 € y 10.649 € por paciente3.
El TAR ha disminuido la morbimortalidad, además de la transmisión de la infección, y ha hecho posible que estos pacientes tengan una esperanza de vida similar a la de la población general3. Según las recomendaciones del Grupo de Estudio de SIDA (GeSIDA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y el Plan Nacional sobre el SIDA (PNS)4, el TAR debe iniciarse en todos los pacientes con infección por VIH. En el momento de iniciar el TAR, es importante valorar de forma individual los fármacos que deben formar parte del régimen inicial, debido a sus diferencias en eficacia, toxicidad, resistencias, tropismo, interacciones, etc., además de seleccionarse el esquema terapéutico que mejor se adapte al estilo de vida y comorbilidades, valorando el riesgo de mala adherencia4. Las pautas de inicio recomendadas en la actualidad consisten en una combinación de tres (terapia triple) o dos fármacos (terapia doble), siendo el objetivo del tratamiento reducir la carga viral plasmática a menos de 50 copias/ml. Las terapias triples de inicio recomendadas como preferentes en el tratamiento de los pacientes con VIH son bictegravir/emtricitabina (FTC) /tenofovir alafenamida (TAF); dolutegravir (DTG)/abacavir/lamivudina (3TC); DTG + FTC/TAF; y raltegravir (400 mg dos veces al día o 1.200 mg una vez al día) + FTC/TAF. La única pauta doble recomendada actualmente consiste en la combinación DTG/3TC (un inhibidor de la integrasa [INI] y un inhibidor transcriptasa inversa análogo de nucleósido/tido [ITIAN]). No obstante, esta terapia presenta una serie de restricciones respecto a su uso, ya que no está recomendada en pacientes con una cifra basal de CD4+ menor de 200/μl, y no debe utilizarse en pacientes con hepatitis crónica por el virus de la hepatitis B (VHB)4.
Una vez el paciente recibe TAR, existen diferentes motivos para cambiarlo, incluyendo falta de eficacia, mala tolerabilidad, toxicidad, comorbilidades, interacciones farmacológicas, disminución del número de comprimidos o de dosis diarias, requerimientos dietéticos, embarazo y coste del propio TAR5. Pese a que la simplificación del TAR supone la mayor parte de los cambios, le siguen la toxicidad y el fracaso terapéutico entre las causas más frecuentes de cambio del TAR en España6,7.
En este sentido, con el objetivo de comparar los resultados en vida real en relación con la interrupción del tratamiento con triple terapia con INI frente a la terapia doble basada en DTG y/o inhibidores de la proteasa potenciados (IP/p) en nuestro entorno, se llevó a cabo un análisis de los pacientes pertenecientes a la cohorte VACH (cohorte prospectiva integrada por más de 14.833 pacientes con VIH confirmado en seguimiento en 23 hospitales españoles)8. Los resultados mostraron un mayor riesgo de discontinuación por cualquier causa, así como un mayor riesgo de discontinuación por fracaso virológico de los pacientes en tratamiento con terapia doble. En esta línea, otro subanálisis de esta cohorte que incluía a pacientes que cambiaron su tratamiento a terapia doble con DTG o que cambiaron a terapia triple con INI, concluyó que el riesgo de discontinuación por fracaso del tratamiento en una terapia doble fue 2,3 veces mayor que en una terapia triple9.
En un entorno con recursos limitados, se hace necesario gestionar adecuadamente el presupuesto destinado al TAR4. Algunos análisis farmacoeconómicos3,10realizados en España han evaluado la relación coste efectividad de las distintas terapias o el impacto económico de la optimización del TAR recomendado por GeSIDA; sin embargo, desde nuestro conocimiento, no se ha analizado el uso de recursos y costes sanitarios que implica el proceso de discontinuación y cambio de TAR, siendo relevante también para la toma de decisiones.
El objetivo principal del estudio fue la estimación del uso de recursos y costes asociados al seguimiento de pacientes con VIH tras la discontinuación y cambio de TAR debido a falta de efectividad o toxicidad inaceptable (evento adverso cuya gravedad supera el beneficio del tratamiento), comparado con el seguimiento habitual de los pacientes con TAR, desde la perspectiva del Sistema Nacional de Salud español.
Métodos
A partir de una revisión de la literatura y un panel de expertos multidisciplinar formado por tres clínicos especializados en enfermedades infecciosas y dos farmacéuticas hospitalarias, se realizó una estimación del uso de recursos asociados al seguimiento de un paciente estable y al cambio de TAR debido a una discontinuación. El análisis se basó en tres perfiles hipotéticos de pacientes con VIH en seguimiento con TAR (Figura 1): paciente estable, paciente que discontinúa por falta de efectividad y cambia a un nuevo TAR y paciente que discontinúa por toxicidad inaceptable y cambia a un nuevo TAR. El horizonte temporal considerado para la estimación del uso de recursos fue hasta los dos años desde la discontinuación.
Uso de recursos y costes
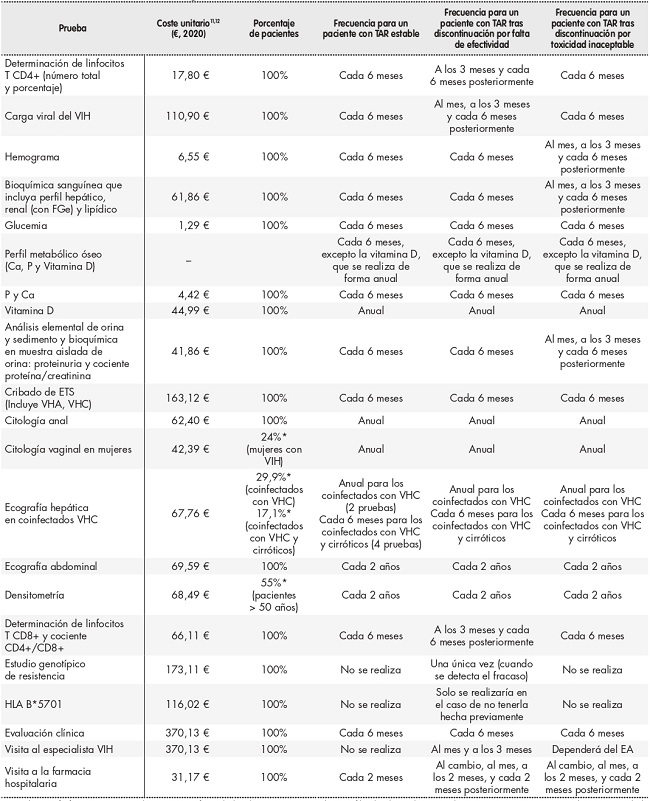
Se consideraron únicamente los costes directos sanitarios, incluyendo costes relativos a las pruebas clínicas, visitas médicas y visitas a la farmacia hospitalaria relacionadas con el manejo del paciente con TAR y con el seguimiento de los eventos adversos (no se ha tenido en cuenta el coste del propio evento ni el coste del TAR). Para ello, se revisaron las recomendaciones para el manejo del paciente establecidas por GeSIDA4,5, identificando los principales recursos sanitarios asociados al seguimiento (pruebas clínicas y visitas médicas) en los tres perfiles de pacientes planteados. El uso de estos recursos (cantidad y frecuencia), así como la frecuencia de las visitas a la farmacia hospitalaria en un periodo de dos años, fue estimado por el panel de expertos (Tabla 1).
Tabla 1. Uso de recursos asociado al seguimiento del paciente.
Ca: calcio; P: fósforo; EA: evento adverso; ETS: enfermedades de transmisión sexual; FGe: filtrado glomerular estimado; TAR: tratamiento antirretroviral; VHA: virus de la hepatitis A; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
*El porcentaje de pacientes ha sido extraído de la encuesta hospitalaria de pacientes con infección por el VIH18.
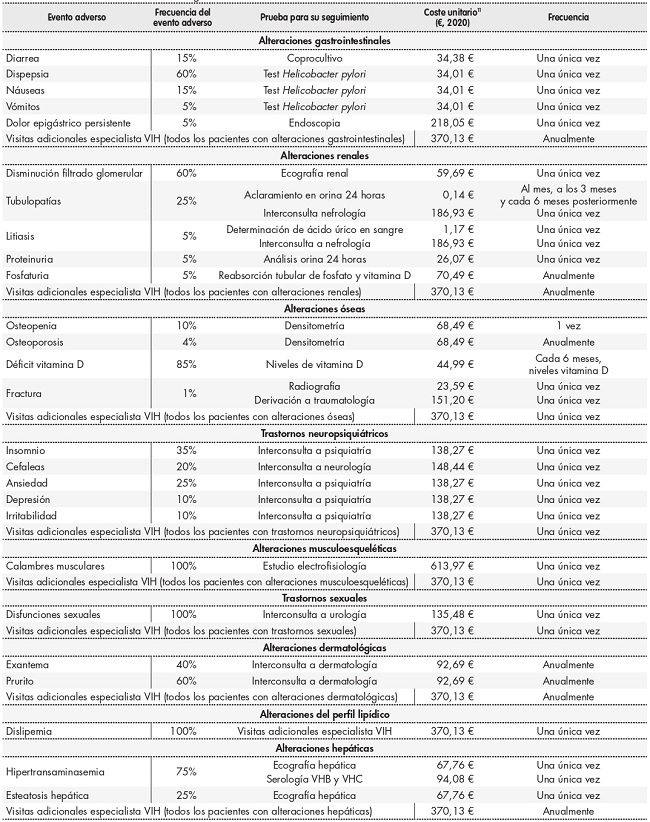
Adicionalmente, para aquellos pacientes que discontinúan por toxicidad inaceptable, el panel de expertos identificó los eventos adversos más comunes por categorías según su tipología: alteraciones gastrointestinales, alteraciones renales, alteraciones óseas, trastornos neuropsiquiátricos, alteraciones musculoesqueléticas, trastornos sexuales, alteraciones dermatológicas, alteraciones del perfil lipídico y alteraciones hepáticas, así como el uso de recursos asociado a las pruebas clínicas y visitas médicas necesarias (Tabla 2). Los costes unitarios se extrajeron de la base de datos de costes sanitarios eSalud11. En el caso de los costes derivados de una visita a la farmacia hospitalaria, fueron extraídos de la literatura12 (Tabla 1).
Análisis de costes
Se calculó y comparó el coste asociado al seguimiento del paciente con TAR estable con el coste del seguimiento del paciente tras discontinuación y cambio de TAR por falta de efectividad y el coste del seguimiento de un paciente tras discontinuación y cambio de TAR por toxicidad inaceptable para cada evento adverso considerado, distinguiendo el coste derivado de pruebas clínicas y el coste derivado de visitas médicas.
Análisis de sensibilidad
Con el fin de evaluar cómo afectaría la modificación de los valores de uso de recursos (que podrían presentar diferencias entre hospitales, en función del manejo de los pacientes) y costes incluidos en el análisis, se ha llevado a cabo un análisis de sensibilidad en el cual se ha hecho variar en un 25% el coste total de seguimiento del paciente con TAR estable y del paciente que discontinúa (por falta de efectividad o por toxicidad inaceptable).
Resultados
Paciente estable
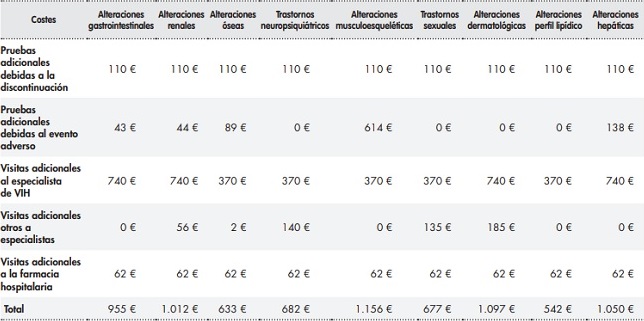
El coste total del seguimiento de un paciente estable con TAR hasta los dos años de seguimiento se estimó en 4.148 €, de los cuales 2.293 € correspondían a pruebas clínicas y 1.481 € a visitas médicas y 374 € a visitas a la farmacia hospitalaria (Figura 2).
Paciente que discontinúa por falta de efectividad>
El coste total del seguimiento de un paciente con TAR hasta los dos años de seguimiento tras la discontinuación por falta de efectividad y el cambio a un nuevo TAR se incrementó en un 31,0% respecto al coste total del seguimiento habitual del paciente con TAR. Se calculó en 5.434 €, de los cuales 2.777 € correspondían a pruebas clínicas (incremento del 21,1% respecto al paciente estable), 2.221 € a visitas médicas (incremento del 50,0% respecto al paciente estable) y 436 € a visitas a la farmacia hospitalaria (incremento del 16,6% respecto al paciente estable) (Figura 2).
Paciente que discontinúa por toxicidad inaceptable
El coste total del seguimiento hasta los dos años de seguimiento tras la discontinuación por toxicidad y el cambio a un nuevo TAR varió en función de la naturaleza del evento adverso (Figura 2).
El incremento en el coste total del seguimiento de un paciente con TAR tras la discontinuación por toxicidad inaceptable y el cambio a un nuevo TAR comparado con el coste total del seguimiento habitual del paciente estable osciló entre un 13,1% asociado a las alteraciones del perfil lipídico y un 27,9% asociado a las alteraciones musculoesqueléticas.
El coste total del seguimiento de un paciente con TAR tras la discontinuación por toxicidad inaceptable y el cambio a un nuevo TAR se estimó entre 4.690 € correspondientes a las alteraciones del perfil lipídico, de los cuales 2.403 € correspondían a pruebas clínicas (incremento del 4,8% respecto al paciente estable), 1.851 € correspondían a visitas médicas (incremento del 25,0% respecto al paciente estable) y 436 € a visitas a la farmacia hospitalaria (incremento del 16,6% respecto al paciente estable) y 5.304 € asociados a las alteraciones musculoesqueléticas, de los cuales 3.017 € correspondían a pruebas clínicas (incremento del 31,6%), 1.851 € correspondían a visitas médicas (incremento del 25,0%) y 436 € a visitas a la farmacia hospitalaria (incremento del 16,6% respecto al paciente estable) (Figura 2). En la tabla suplementaria 1 se presentan los costes adicionales para cada uno de los eventos adversos considerados, distinguiendo si se debía al seguimiento de la discontinuación o al propio evento adverso.
Análisis de sensibilidad
Tras la variación del 25% en los costes totales de seguimiento de los pacientes, con el fin de evaluar posibles diferencias en el manejo de los pacientes entre distintos hospitales, se observó que el coste total del seguimiento de un paciente estable con TAR hasta los dos años de seguimiento podría variar entre 3.111 € y 5.185 €. En el caso de un paciente que cambia de tratamiento por falta de efectividad, este coste variaría entre 4.076 € y 6.793 €. Entre los pacientes que discontinúan por toxicidad inaceptable, el coste variaría entre 3.518 €, correspondiente a las alteraciones del perfil lipídico, y 6.630 €, correspondiente a las alteraciones musculoesqueléticas.
Discusión
Los resultados obtenidos en este análisis muestran que el uso de recursos y los costes asociados al seguimiento de los pacientes con VIH tras la discontinuación y el cambio a un nuevo TAR son mayores que los del seguimiento habitual, debido principalmente al incremento de las visitas médicas. En el caso de un paciente que discontinúa por falta de efectividad, el gasto asociado a las visitas médicas ascendió en un 50% respecto al paciente estable, mientras que en un paciente que discontinúa por toxicidad inaceptable el incremento en el coste asociado a las visitas médicas osciló entre un 25% asociado a alteraciones musculoesqueléticas y alteraciones del perfil lipídico y un 63% asociado a alteraciones dermatológicas. En el caso de las visitas a la farmacia hospitalaria, se observó un incremento de cerca del 17% en todos los perfiles de pacientes, al considerarse dos visitas adicionales a este servicio como consecuencia del cambio de tratamiento.
A través del análisis de sensibilidad llevado a cabo se observa que los costes totales derivados del manejo de un paciente con VIH que cambia de tratamiento por falta de efectividad o toxicidad inaceptable podrían llegar a ser más del doble en relación con los de un paciente estable (teniendo en cuenta un manejo conservador en el caso del paciente estable, y el seguimiento más exhaustivo en el escenario del paciente que cambia de tratamiento).
Las nuevas pautas de TAR han supuesto mejoras en eficacia y tolerabilidad; sin embargo, los cambios de TAR, sobre todo durante el primer año, son frecuentes (alrededor del 30% de los pacientes)13,14, siendo las principales causas la mala tolerabilidad, las interacciones farmacológicas, la aparición de nuevas comorbilidades, los requerimientos dietéticos, el deseo del paciente, decisiones no especificadas del médico, los costes del propio tratamiento y el fracaso virológico15. Debido al impacto negativo en la adherencia al tratamiento y en la eficacia virológica, el TAR inicial debería durar un periodo prolongado sin cambios15. No obstante, cuando se hace un cambio de TAR, se debe realizar un seguimiento del paciente más exhaustivo4.
Los cambios actuales de tratamiento recomendados para aquellos pacientes con supresión virológica tienen en cuenta los fármacos antirretrovirales (FAR) que contiene el tratamiento del paciente y se agrupan en cambio a terapias triples que incluyen: cambio de ITIAN, cambio a regímenes basados en inhibidor transcriptasa inversa no nucleósido (ITINN) y cambio a regímenes basados en INI; y cambios de tratamiento a terapias con menos de tres FAR que pueden ser terapias duales con IP/p + 3TC, terapia dual con DGT + rilpivirina (RPV) y terapia dual con DGT + (3TC)4. Para aquellos pacientes con fracaso virológico se recomienda instaurar un TAR con tres o al menos dos FAR activos, incluyendo, si es posible, al menos un fármaco de nueva familia4.
En línea con estas recomendaciones, dos análisis realizados a partir de datos de vida real, extraídos de una cohorte de pacientes españoles, han mostrado un mayor riesgo de discontinuación por fracaso virológico cuando el paciente es tratado con terapia doble frente a terapia triple (análisis 1: hazard ratio [HR] = 2,06 [1,54; 2,77] para toda la población, HR = 2,78 [1,71; 4,51] para pacientes con terapias dobles o triples que contienen DTG, y HR = 1,86 [1,15; 3,02] para pacientes en supresión virológica al inicio [ARN del VIH < 50 copias/ml]8; análisis 2: pacientes que cambian su tratamiento a terapia doble con DTG o terapia triple con INI: HR = 2,3 [1,3; 4,1]9). Estos resultados concuerdan con otros estudios realizados a nivel internacional, entre los que encontramos el estudio OPERA, estudio observacional de la base de datos OPERA (que contiene datos de 79.803 pacientes con VIH en Estados Unidos recogidos entre 2010 y 2016), donde también se observa un riesgo de discontinuación significativamente superior en terapia doble frente a terapia triple (HR = 1,51 [1,41; 1,61])16.
Aunque el coste farmacológico supone el mayor desembolso en el tratamiento de pacientes con VIH3,17, es relevante tener en cuenta si otros recursos asociados al seguimiento del paciente pueden evitarse. Teniendo en cuenta que los pacientes que realizan el cambio a terapia doble tienen
un riesgo de fracaso virológico casi dos veces superior al de los pacientes que realizan un cambio a terapia triple (entre HR = 1,86 y HR = 2,78), este estudio puede ayudar en la toma de decisiones en cuanto a la elección del TAR, puesto que el coste de seguimiento tras interrupción y cambio a un nuevo TAR, ya sea por falta de efectividad o por toxicidad inaceptable, supone un incremento respecto al seguimiento habitual, por lo que resulta relevante tener este incremento de recursos en consideración.
Este trabajo presenta limitaciones, principalmente debidas al propio diseño del estudio, al tratarse de una estimación de costes basada en la revisión de la literatura y consulta a expertos. Por una parte, existe un cierto grado de simplificación del análisis, ya que no se tiene en cuenta diferentes perfiles de pacientes con VIH en TAR que requieran un manejo y seguimiento diferencial en función de sus necesidades. No obstante, el análisis se ha basado en el uso de recursos para un paciente estándar con VIH tratado con TAR siguiendo las recomendaciones de las guías4,5. Por otra parte, no se ha tenido en cuenta el coste farmacológico del TAR, puesto que se asumió que el manejo del paciente estable o tras una discontinuación no difiere en función del tipo de tratamiento, sirviendo el análisis para cualquiera de las combinaciones disponibles. Del mismo modo, no se han considerado los costes asociados a la medicación concomitante de las toxicidades para centrar el análisis en los costes derivados de pruebas y visitas. Finalmente, respecto a los costes, no se han tenido en cuenta costes indirectos asociados a pérdidas de productividad del paciente, debido a que la perspectiva analizada ha sido la del SNS español.
A pesar de las limitaciones indicadas, el análisis realizado proporciona una aproximación al coste asociado a la discontinuación del TAR que puede contribuir a la toma de decisiones en la práctica clínica habitual.
En conclusión, este análisis pone de manifiesto la importancia de tener en cuenta las tasas de discontinuación del TAR a la hora de elegir la terapia más adecuada en los pacientes con VIH, ya que además de las consecuencias clínicas, es un factor influyente en el uso de recursos y costes sanitarios.