Introducción
Las hormonas tiroideas (HT) intervienen en el desarrollo del esqueleto, en la adquisición del pico de masa ósea y en el mantenimiento del remodelado óseo. Los estudios clínico-epidemiológicos señalan que tanto la deficiencia como el exceso de HT se asocian con riesgo de fracturas, considerándose que el eutiroidismo es fundamental para el normal funcionamiento del remodelado óseo [1].
Esta respuesta “homeostásica” a las HT es regulada a diferentes niveles, pero en particular por la conversión de tiroxina (T4) a tri-iodotinonina (T3) por las iodotironina deiodinasas, responsables de que esta última actúe sobre sus receptores periféricos.
En este trabajo vamos a revisar las acciones celulares de las HT sobre el hueso, y en especial el modelo experimental in vivo de exceso y de supresión de la hormona estimulante del tiroides (TSH) en pacientes con carcinoma diferenciado de tiroides (CDT) en mujeres pre y postmenopáusicas. En varones con CDT no existen estudios longitudinales de calidad para su análisis.
Hormonas tiroideas y hueso
Las HT y el hueso están estrechamente relacionados, ya que las HT son reguladoras clave del remodelado óseo. Las HT tienen un papel fundamental en el crecimiento y desarrollo de los vertebrados. Las HT son iodotironinas sintetizadas en la glándula tiroidea, cuya secreción constante es asegurada por dos mecanismos: 1) secreción de HT controlada por un mecanismo retroactivo, del eje hipotálamo-hipofisis-glándula tiroidea (Figura 1 y Figura 2) por activación intracelular regulada por iodotironina-deiodinasas tisulares [2].

Fig1 Las hormonas tiroideas circulantes se encuentran bajo el control del eje hipotálamo-hipófisis-tiroides. La TRH estimula la liberación de TSH de la hipófisis anterior, que a su vez estimula la síntesis y secreción de T4 yT3, que se unen y activan al TR, resultando en una inhibición retroactiva de la producción TRH y de la secreción de TSH. D2 convierte la T4 en T3 en los órganos periféricos, contribuyendo significativamente al deposito circulante de T3
La hormona estimulante del tiroides (TSH) producida por las células tirotróficas de la glándula hipofisaria, promueve la síntesis y secreción de las HT, principalmente de la 3, 5,3′,5′-tetraiodotironina (T4), o tiroxina. Se considera que la T4 se comporta como una prohormona que necesita convertirse a la 3,3′,5 triyodotironina (T3), que es más potente y se considera biológicamente activa, lo que es llevado a cabo a través de una 5′-monodeiodinación presente en los tejidos. Si la escisión de iodo es posición 5, de esta molécula da lugar al metabolito inactivo 3,3′,5′-triiodotironina, o T3 reversa (rT3), con actividad agonista débil sobre los mismos receptores que la T3.
La glándula tiroidea secreta T4 y también pequeñas cantidades de T3, la hormona activa. La mayoría de la T3 circulante se origina a partir de la deiodinación de la T4 en los tejidos periféricos. Para efectuar la acción genómica, la T4 tiene que convertirse en T3 (Figura 2). De las tres deiodinasas que intervienen en el metabolismo de las HT, la deiodinasa tipo 1 (D1) que se expresa fundamentalmente en la glándula tiroidea, es la principal responsable de la transformación de T4 a T3. Se estima que la D2 interviene en el control de sus concentraciones, contribuyendo a limitar el acceso de las HT a los tejidos, durante los procesos de desarrollo y reparación tisular. La acción conjunta de D2 y D3 sería responsable del control intracelular de la disponibilidad de T3 [3].

Fig2 La T3 actuaría indirectamente sobre el osteoclasto por una acción mediada por el osteoblasto, posiblemente induciendo la liberación de RANKL y de interleukinas 6 y 8, y de PGE2, en etapas tempranas sobre precursores o favoreciendo la diferenciación del preosteoclasto. La T3 actuaría favoreciendo la diferenciación del osteoblasto y las fase de la mineralización de la matriz. Es posible que la inducción de la transcripción de IGF-1 y sus proteínas transportadoras, y de otros factores estimule la proliferación y diferenciación del osteoblasto. Sobre el condrocito, la disponibilidad de TRα1 y TRβ1 en este linaje celular, permite que la T3 estimule su maduración y por tanto el proceso de osificación endocondral. (Modificada de Wojcika y cols.4 )
La captación de las hormonas tiroideas por los tejidos, es llevada a cabo por proteínas transportadoras específicas. Ambas, T4 y T3, entran en las células diana a través de transportadores específicos de membrana, entre ellos los transportadores monocarboxilados 8 y 10 (MCT8 y MCT10) y el OATP1c1 [4]. El mejor estudiado ha sido el transportador monocarboxilado MCT8, habiéndose descrito mutaciones inactivantes en el gen 8 localizado en el cromosoma X de esta proteína que causan el síndrome de Allan-Herndon-Dudley, con concentraciones elevadas de las HT y anormalidades neurológicas, además de trastornos en la audición [5].
Receptores para las HT
Una vez en el interior celular, la deiodinasa D2 convierte la T4 a T3 y la deiodinasa D3 inactiva tanto a T3 como a T4, convirtiéndolas en T2 y T3 reversas. La T3 entra en el núcleo donde se encuentran 3 tipos de receptores de hormonas tiroideas (TR): TRα1, TRβ1 y TRβ2, a los que se une formando un heterodímero con el receptor X retinoide (RXR), que se une a su vez a la secuencia de ADN denominada “elemento de respuesta a HT” (TRE) del gen diana de T3, controlando su expresión [1].
Estos tres receptores funcionales para las HT (TRα1, TRβ1 y TRβ2) son codificados por los genes THRα y THRβ, que regulan su expresión y las respuestas transcripcionales a los TR. En el hueso se ha descrito la expresión de TRα1 y TRβ1, estando la primera en concentraciones predominantes de 10:1. Se considera, por tanto, que TRα es el mediador fundamental de la acción de la T3 sobre el hueso [6].
HT, TSH y desarrollo del hueso
El eutiroidismo es imprescindible para el desarrollo normal del esqueleto. Este se lleva a cabo a través del proceso de osificación intramembranosa (diferenciación de progenitores mesenquimales a células formadoras de osteoblastos) y osificación endocondral, a través de la cual los huesos largos forman un molde de cartílago. Los condrocitos se forman a partir de los precursores mesenquinales para formar este molde de cartílago; en el centro primario de osificación de este se produce la mineralización progresiva. La invasión vascular y emigración de osteoblastos transforman a esta zona en hueso trabecular; los precursores localizados en el mesénquima más periférico en el pericondrio se diferencian a osteoblastos y forman hueso cortical. Esta proliferación y crecimiento longitudinal continúa hasta la madurez [1,2,3].
Tanto el receptor TRα1 como el TRβ1 se expresan en los condrocitos de las placas de crecimiento, lo que sugiere son dianas para la acción de la T3. La proliferación de los condrocitos y su diferenciación es controlada por indian hedgehog, PTHrp, BMP-R1A, IGF1, Wnt, y FGFs. Los tres primeros por un feedback negativo que induce el crecimiento de la placa e inhibe su diferenciación controlando su crecimiento lineal. Las HT intervienen en esta regulación, sensible a la disponibilidad de T3, que estimula expresión de genes para la síntesis de matriz del cartílago y su mineralización posterior.
En los osteoclastos no se ha podido establecer que la T3 tenga efectos a través de los receptores funcionales expresados en estas células, siendo posible que sean indirectos mediado a través de los osteoblastos. En los estados de exceso de HT se detecta un incremento del número y la actividad de los osteoclastos, así como pérdida ósea. La T3 también estimula la diferenciación de los osteoblastos, la síntesis y mineralización de la matriz ósea; estos efectos los lleva a cabo a través de la regulación de enzimas del procolágeno, incluyendo la fosfatasa alcalina ósea, y de las metalo-proteinasas 9 y 13 [7]. No está dilucidado aún si estos efectos están mediados a través de la vía ligando de receptor activador para el factor nuclear κB (RANKL) [8], aunque estudios con cultivos celulares de osteoblastos o precursores, demuestran que la T3 aumenta la expresión de RANKL y de interleukinas 6 y 8 [9].
Es posible que la acción de la T3 en los osteoblastos sea mediada por la expresión de osteoprotegerina, que actuaría inhibiendo al RANKL, que a su vez estimula la osteoclastogénesis. Lo que sí se ha demostrado es que la T3 induce la transcripción de IGF1, al mismo tiempo que estimula sus proteínas transportadoras IGF1BP-2 y IGFBP-4, lo que, junto a la mayor actividad de la fosfatasa alcalina (y, por tanto, mejor calidad de mineralización) y los otros efectos ya descritos, se comporta como estimulador de la actividad osteoblástica a diferentes niveles [1]. El eje TSH-tiroides es necesario para este desarrollo esquelético normal; la TSH tiene un efecto directo sobre el hueso, como lo demuestran los estudios in vitro en los que se comporta como un inhibidor directo del remodelado óseo, a través de actuar sobre la TSHR expresada en los osteoblastos y osteoclastos. En relación a la fase de desarrollo del esqueleto, las alteraciones de la TSH están implicadas en tres enfermedades: 1) en el hipotiroidismo congénito y adquirido que puede causar disminución del remodelado óseo y mayor riesgo de fracturas; 2) en el hipertiroidismo, con acciones contrarias al anterior, mayor remodelado, pero también mayor riesgo de fracturas; y 3) en la craniosinostosis con cierre prematuro de las suturas craneales, osteoporosis y fracturas. Sin embargo, dado que existen niveles circulantes de HT en esas enfermedades, sus efectos no pueden separarse de la acción de la TSH sobre el hueso; la descripción de que la deficiencia aislada de TSH, con una mutación que afecta a la subunidad beta TSH, se caracteriza por un fenotipo con metacarpianos y metatarsianos acortados, pero con respuesta normal de la densidad mineral ósea (DMO) tras tratamiento con HT en ausencia de TSH, ha llevado a sugerir que el papel predominante sobre el desarrollo óseo corresponde a la T3.
Recientemente se ha descrito una mutación heterocigótica en el gen THRα en una niña de 6 años, que a pesar de tener HT en el límite bajo o normal y TSH normal, tenía retraso del crecimiento y afectación histológica ósea similar al hipotiroidismo, lo que implica un papel importante para estos receptores TRα en el desarrollo óseo humano [10].
En los adultos, el hipotiroidismo se caracteriza por disminución del remodelado óseo con menor resorción osteoclástica y menor formación ósea. Esto implica una mayor duración del ciclo de remodelado óseo, con incremento del periodo secundario de mineralización. Lo que podría traducirse en un mayor riesgo de fracturas en estos individuos. En cambio, en el hipertiroidismo del adulto, hay un elevado remodelado óseo con osteoporosis caracterizado por incremento de la resorción ósea neta. También hay más fracturas y menor densidad mineral ósea.
HT y TSH en relación con la densidad mineral ósea y fracturas en población normal
Existen estudios prospectivos en mujeres premenopáusicas y postmenopáusicas que valoran el efecto de los niveles de TSH y HT sobre la DMO en población normal. Kim y cols. estudiaron la relación entre la T3 y la TSH circulantes y su efecto sobre la masa ósea en sujetos sanos [11]. En una población de 37.431 adultos realizaron medición de la DMO y test de función tiroidea, excluyendo enfermedades que puedan afectar estos parámetros. Niveles bajos de TSH y elevados de T3 se asociaron con valores menores de DMO en todos los sitios esqueléticos, y confirman un efecto protector de la TSH en la perdida ósea independiente del efecto de la T3. El impacto negativo de la T3 sobre la DMO podría ser compensado por un aumento de la TSH solamente en aquellos que tenían los niveles de T3 en el rango normal-alto.
Los estudios en relación con el riesgo de fracturas y la pérdida ósea y los niveles de TSH han sido conflictivos. Niveles de TSH en el rango bajo-normal se asociaron con fracturas de cadera en mujeres ancianas [12]; mientras, en la misma línea, un estudio realizado en mujeres postmenopáusicas más jóvenes mostró que los niveles por encima del rango normal se asociaron a una disminución del 35% del riesgo de fracturas no vertebrales [13]. Finalmente, un meta-análisis realizado con 70.298 participantes describe un riesgo de fracturas de cadera de 1,61 ( IC 95%: 1,21-1,15) y para otras fractura de 1,98 (IC 95%: 1,41-2,78) en pacientes con hipertiroidismo subclínico con niveles de TSH <0,10 mUI/L [14].
El antecedente de hipertiroidismo parece ser un factor de riesgo. En el estudio SOF (Study of Osteoporotic Fractures) realizado en 192 mujeres de edad avanzada con un seguimiento de 4,1 años, la mayor incidencia de fractura osteoporótica se registro en las pacientes que tenían antecedentes de fracturas y/o de hipertiroidismo [15]. En este estudio no se encontró evidencia para relacionar los niveles bajos de TSH con baja DMO. Los autores concluyeron que el hipertiroidismo puede o no reducir la masa ósea, pero que en su estudio la disminución de la DMO no fue responsable de la fuerte asociación entre hipertiroidismo previo y el riesgo de fractura de cadera.
HT y TSH: relación con la densidad mineral ósea y fracturas en mujeres con disfunción tiroidea
El hipertiroidismo clínico es reconocido como un factor de riesgo para la pérdida ósea, promoviendo el recambio óseo y la perforación trabecular. En relación al hipertiroidismo endógeno (Enfermedad de Graves, bocio tóxico multilocular), los datos señalan que también puede aumentar el riesgo de fracturas en general y/o de fracturas vertebrales en mujeres postmenopáusicas. El estudio prospectivo de Bauer y cols. [16] muestra que las mujeres hipertiroideas con niveles de TSH <0,1 mU/L, comparadas con las controles eutiroideas, tenían un riesgo tres veces mayor de fractura de cadera (OR: 3,6; IC 95%: 1,0-12,9) y cuatro veces de fractura vertebral (OR: 4,5; IC 95%: 1,3-15,6).
En un estudio realizado por Baqi y cols. en mujeres premenopáusicas en tratamiento con levotiroxina oral (LT4), se observó que existía una correlación significativa entre la DMO a nivel de columna lumbar (CL) y cadera y los niveles de TSH, así como una correlación negativa entre niveles de TSH y los marcadores osteocalcina y telopéptido N-terminal del colágeno tipo I (NTX) [17]. Los resultados eran más favorables en cuanto a DMO y niveles de marcadores de remodelado óseo (MRO) en las pacientes con TSH >0,3 mU/l que en aquellas con valores <0,3 mU/l.
Sin embargo, a nivel del hipertiroidismo subclínico (TSH suprimida con hormonas tiroideas en rango normal), los efectos de las HT sobre el hueso son más controvertidos. Un estudio prospectivo realizado en 2.004 pacientes con hipertiroidismo subclínico, refirió un aumento de fractura del 1,25 veces en estos, similar al aumento del 1,9 del riesgo para fracturas encontrado en pacientes tratados con T4 [18,19]. Sin embargo, un estudio reciente de Garin y cols., realizado en 4.936 sujetos de más de 65 años seguidos durante 12 años, no encontró relación entre el riesgo de fractura de cadera y el hipertiroidismo subclínico [20].
Dos meta-análisis de estudios realizados en postmenopáusicas con hipertiroidismo subclínico por sustitución exógena han encontrado disminución de la DMO con una pérdida anual de 0,91% de masa ósea [21,22]. El meta-análisis de Wirth y cols., que incluye solo 5 estudios de los publicados con elevado índice de calidad, concluye que el hipertiroidismo subclínico puede asociarse con un riesgo de 2,16 (IC 95%: 0,87-5,37) para las fracturas de cadera y de 1,43 (IC 95%: 0,73-2,78) para las fracturas no vertebrales [23].
La mayoría de los estudios realizados en mujeres postmenopáusicas muestran una asociación entre los niveles en rango alto-normal de HT y menores valores de DMO, con incremento del riesgo de fractura no vertebral. Kim y cols. [24] estudiaron los resultados de DMO en un grupo de 959 mujeres con hipertiroidismo subclínico (TSH <0,5 mUI/L) vs. un grupo con TSH >0,5 mU/L. Las mujeres con valores de TSH en el límite normal-bajo mantuvieron menores valores de DMO en columna y cuello femoral que aquellas con TSH en el límite normal-alto. Estas primeras también tuvieron un riesgo aumentado 2,2 veces de osteoporosis. De forma similar, Morris y cols. [25], en una muestra de 581 mujeres sanas americanas, describen un riesgo mayor de osteoporosis en las mujeres con valores de TSH en límite normal-bajo (0,39-1,8 mUI/L) con respecto a aquellas con TSH en límite normal-alto (1,8-4,5 mUI/L) (OR: 3,4 [IC 95%: 1,3-9,2] y 2,2 [IC 95%: 1,2-3,8], respectivamente).
En resumen, los datos publicados indican que para demostrar una clara causalidad son necesarios ensayos randomizados y controlados con importante número de pacientes, y evaluar si la normalización de los niveles de TSH en el hipertiroidismo subclínico se asocia al riesgo de fractura. Los datos apuntan a que el hipertiroidismo subclínico se asocia a un mayor riesgo de fracturas de cadera y no vertebrales, pero deben ser analizados otros factores y realizarse estudios de mayor calidad.
En el hipotiroidismo clínico se produce disminución de la formación ósea que suele exceder a la disminución de la resorción, según confirman los datos de histomorfometría. En general, se ha descrito la existencia de una DMO normal, contrastando con un incremento de 2 a 3 veces la frecuencia de fracturas, particularmente de antebrazo en algunas series. En mujeres postmenopáusicas con hipotiroidismo subclínico, también se ha descrito un riesgo similar de fracturas, en especial las que tienen origen autoinmune [26].
HT y microarquitectura trabecular ósea
Se ha venido comentando sobre la posibilidad de que la calidad ósea, determinada por la microestructura trabecular, podría también estar influenciada por el estado tiroideo. En este sentido, Basset y cols. han demostrado adelgazamiento y disminución de la conectividad trabecular en un modelo de ratón con tirotoxicosis [27].
Más recientemente, Hwangbo y cols. han estudiado 1.376 sujetos eutiroideos (648 postmenopáusicas) en los que determinan HT, T4 libre y el trabecular bone score (TBS) [28]. El TBS es la técnica por la que, a partir del escaneo de la DXA lumbar, establece niveles texturales de grises como índices indirectos de microarquitectura. Concluyen que los niveles elevados de T4 libre se asociaron con deterioro de la microarquitectura trabecular, mientras que los niveles de TSH no se asociaron con el TBS lumbar. Esto apoyaría los resultados descritos en ratones resistentes a las HT, en lo que se ha demostrado que las HT elevadas, más que la TSH predominan en la regulación del estado óseo.
Criterios para la supresión de TSH en el cáncer diferenciado de tiroides
El carcinoma diferenciado de tiroides (CDT) es la neoplasia endocrina más frecuente (supone el 1% de todos los cánceres). El 85-90% de los cánceres de tiroides son CDT, que incluye dos variantes, el carcinoma papilar (el más frecuente) y el folicular. Su incidencia ha ido aumentando en los últimos 10 años, pero su mortalidad siguie siendo la misma [29]. Este aumento se debe en gran parte al incremento y mejoría de resolución de las pruebas diagnósticas, con mayor detección de microcarcinoma incidentales.
El tratamiento indicado en el CDT incluye la tiroidectomía total completada con dosis ablativa de yodo radioactivo. Posteriormente, en base al riesgo de recidiva, se administra una dosis de levotiroxina oral sustitutiva (pacientes de muy bajo riesgo) o supresora. La dosis supresora tiene como objetivo inducir una hipertiroxinemia con supresión hipofisaria de la TSH que podría ser estímulo potencial de restos tumorales. La dosis supresora inicial de levotiroxina se calcula a razón de 1,8-2,2 µg/kg/día que se modifica según los controles sucesivos. En función de la supresión obtenida durante el tratamiento hormonal, la Asociación Americana de Tiroides (ATA) ha establecido los siguientes grupos de riesgo en el tratamiento con levotiroxina: 1) Grupo de bajo riesgo >0,5 mUI/L; 2) Grupo de riesgo intermedio: 0,1-0,5 mUI/L y; 3) Grupo de riesgo alto: <0,1 mUI/L. Los pacientes con tratamiento exógeno (por CDT) así como los que tienen hipertiroidismo endógeno, son sometidos a períodos prolongados del efecto de las hormonas tiroideas sobre el hueso. En la actualidad se van conociendo muchos de los aspectos relacionados con la pérdida ósea que esta terapia puede ocasionar, ya sea directamente o bien por la supresión del eje hipófisis-tiroides.
Supresión de la TSH en el carcinoma tiroideo. Pérdida ósea y relación con el riesgo de recidiva
El tratamiento con levotiroxina en el CDT se basa en dar dosis que supriman los niveles de TSH séricos por debajo del rango normal, ocasionando un estado similar al de un hipertiroidismo subclínico. Ya hemos señalado cómo la TSH se comporta como un estimulo para la proliferación de las células tiroideas, además de para la captación de radioiodo y la producción de tiroglobulina, por lo que la supresión persigue remover este efecto y evitar una recidiva. Se han descrito receptores de TSH en las membranas de las células tumorales del CDT, cuyas concentraciones son afectadas por la reducción de TSH por la terapia con levotiroxina [30]. También hay estudios epidemiológicos observacionales en los que se ha encontrado una correlación positiva entre los niveles elevados de TSH sérica y el riesgo de malignidad en nódulos o en estadios más avanzados del CDT (Tabla 1). Finalmente, McGriff y cols., en un meta-análisis que incluyó a 4.174 pacientes con CDT, demostraron una disminución del riesgo de progresión tumoral en los pacientes con tratamiento supresor con levotiroxina (RR=0,73; IC 95%: 0,6-0,88; p<0,05) [31].
Tab1 Objetivos de TSH para el tratamiento prolongado con hormona tiroidea en el carcinoma diferenciado de tiroides. De acuerdo a Haugen BR y cols.32

Nota1tab1*0,5 mUI/L representa el límite más bajo de referencia del método de determinación de TSH que puede variar entre 0,3-0,5 mUI/L dependiendo del método.
Nota2tab1**El objetivo de TSH para pacientes con respuesta bioquímica incompleta puede variar dependiendo del riesgo ATA inicial, niveles de Tg, tendencia de la Tg en el tiempo y riesgo de supresión.
Aunque no existe un consenso generalizado, acerca de los niveles óptimos de TSH para disminuir las recidivas y al tiempo minimizar los efectos adversos del hipertiroidismo subclínico, recientemente la Asociación Americana de Tiroides (ATA) definió el impacto de la supresión de TSH en pacientes con CDT caracterizados por bajo, intermedio y elevado riesgo de recidivas teniendo en cuenta diversos factores clínicos [32].
Hay que señalar que, anteriormente, Biondi y Cooper, en una revisión, concluían que la supresión agresiva de TSH es importante en los pacientes con CDT y elevado riesgo, y es mucho menos crítica en los otros grupos [33]. Basados en estos criterios, recientemente Wang y cols., han estudiado 306 pacientes no suprimidos y 465 pacientes suprimidos con CDT clasificados de riesgo bajo o intermedio, y que presentaron al cabo de 6 años de seguimiento tasas similares de recidiva [34]. Sin embargo, los pacientes con supresión de TSH <0,4 mUI/L tuvieron mayor incidencia de osteoporosis y fibrilación auricular comparados con los no suprimidos (HR 2,1; p=0,05), significando que el tratamiento prolongado con levotiroxina con efecto supresor aumenta el riesgo de osteoporosis postoperatoria en pacientes con CDT de bajo y moderado riesgo, de acuerdo con la clasificación de la ATA.
Se puede concluir que la dosis optima de mantenimiento de TSH en pacientes con CDT de bajo o intermedio riesgo de recidiva aún no ha sido bien establecida. Los estudios sugieren que un nivel de 0,9-1,0 mUI/L podría ser el valor óptimo de supresión para los CDT de bajo e intermedio riesgo, con el fin, además, de reducir el desarrollo de osteoporosis y complicaciones cardiológicas a largo plazo, sin aumentar el riesgo de recidiva. Es posible, por tanto, que la supresión de TSH sea un predictor independiente del daño óseo que, además, no parece disminuir las recidivas en estos pacientes de bajo e intermedio riesgo.
Impacto de la supresión de TSH: efectos adversos y calidad de vida
La prescripción de hormonas tiroideas es amplia, llegando a casi el 5,1% de la población adulta. Se trata en general de una medicación bien tolerada y escasos efectos secundarios inmediatos. En los últimos años se están realizando publicaciones en relación a si a largo plazo la terapia con levotiroxina aumenta la incidencia de fractura. La evidencia actual no es definitiva, aunque Turner y cols. demostraron un aumento de fracturas en pacientes de edad avanzada (>70 años) tratados durante periodos largos con tiroxina [35]. Los mecanismos por los cuales la tiroxina induciría estas fracturas son desconocidos, pero se ha sugerido que sería a través de la disminución la densidad mineral ósea, lo que tendría lugar por la inducción de un hipertiroidismo subclínico, o bien que niveles normales-elevados lo provoquen. La mayor frecuencia de caídas por arritmias favorecidas por este aumento de las hormonas tiroideas sería otra de la causas.
Los principales efectos adversos de la supresión de TSH afectan al sistema cardiovascular, al metabolismo óseo y a la calidad de vida (Tabla 2). En el hipertiroidismo clínico, la incidencia de fibrilación auricular, infarto de miocardio y mortalidad se incrementan notablemente en las personas mayores [36]. Se conoce que la fibrilación auricular puede triplicarse en el curso de 10 años de tratamiento (TSH <0,1 mUI/L) en los mayores de 65 años, sujetos eutiroideos (TSH en el límite de la normalidad). En el hipertiroidismo subclínico del CDT, en los pacientes tratados con levotiroxina, el riesgo de fibrilación auricular puede llegar al 10,3% (17,5% en los >60 años), de acuerdo con un estudio realizado en un registro poblacional de medio millón de habitantes en Dinamarca [37]. Finalmente, la mortalidad global también se ha descrito incrementada (OR: 1,20; IC 95%: 1,06-1,36) en situaciones de hipertiroidismo en pacientes con TSH <0,03 mUI/L, comparada con la de aquellos con valores que oscilaban entre 0,04 y 0,4 mUI/L [38].
Tab2 Relación de estudios longitudinales sobre el efecto de la supresión de la TSH con levotiroxina sobre la densidad mineral ósea (DMO) en mujeres pre y postmenopáusicas con cáncer de tiroides
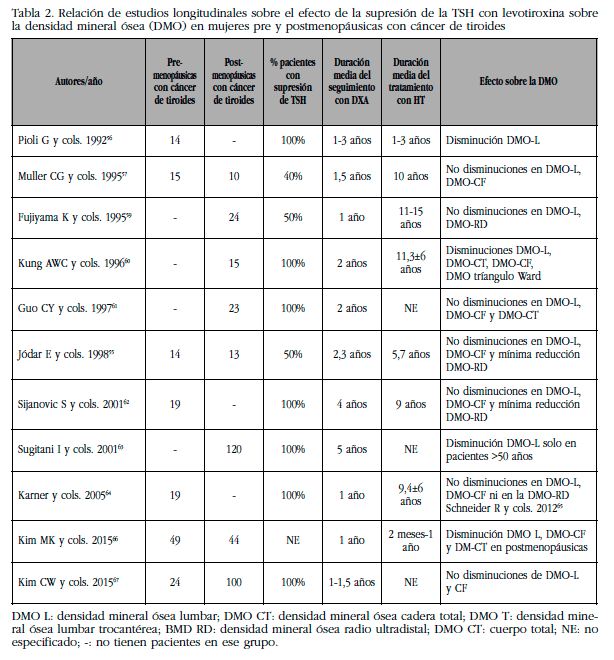
Nota1tab2DMO L: densidad mineral ósea lumbar; DMO CT: densidad mineral ósea cadera total; DMO T: densidad mineral ósea lumbar trocantérea; BMD RD: densidad mineral ósea radio ultradistal; DMO CT: cuerpo total; NE: no especificado; -: no tienen pacientes en ese grupo.
El aumento de hormonas tiroideas puede ocasionar alteraciones emocionales (nerviosismo, ansiedad), trastorno del humor (depresión, trastornos del sueño, astenia) y diversas alteraciones cognitivas, que pueden influir en la calidad de vida del paciente. Samuel y cols. describen mayor ítems de fatiga y depresión en las pacientes tratadas con dosis supresores de levotiroxina [39]. Jarcas y cols. refirieron alteraciones cognitivas en 31 pacientes con CDT y tratamiento supresor con hormonas tiroideas [40]. Frente a estos, Moon y cols. han señalado que las funciones cognitivas estudiadas en un grupo de 50 pacientes con CDT mayores de 65 años, guardaban correlación positiva con la mayor elevación de T4 sérica de estos pacientes en relación a los controles [41].
Un estudio observacional de Flynn y cols. ha estudiado los efectos sobre el sistema cardiovascular y las fracturas en una población de 17.684 sujetos en tratamiento prolongado con T4 [38]. Encontraron que los pacientes con TSH elevada (>4 mUI/L) o suprimida (<0,03 mUI/L) tenían un riesgo aumentado de enfermedad cardiovascular, con una HR=1,95 (IC 95%: 1,73-2,21), para las arritmias de 1,80 (IC 95%: 1,33-2,44) y para las fracturas de 1,83 (IC 95%: 1,41-2,37), mientras que los que tenían una TSH baja pero no suprimida (0,04-0,4 mUI/L) no presentaron aumento de riesgo en ninguno de esos objetivos. Estos autores concluyen que podría ser seguro para los pacientes que ingieren T4 mantener una TSH baja pero no suprimida.
Hormonas tiroideas, supresión de TSH y cáncer diferenciado tiroideo
El hipertiroidismo clínico es un reconocido factor de riesgo para la perdida ósea, promoviendo el remodelado óseo, la perforación trabecular y el aumento del riesgo para las fracturas. A nivel de hipertiroidismo subclínico (TSH suprimida con HT en rango normal) los efectos de las HT sobre el hueso son más controvertidos. Los estudios experimentales y datos clínicos han demostrado que la proliferación de las células tiroideas es TSH dependiente [42]. La puesta en marcha del tratamiento con supresión de la TSH provoca una situación de hipertiroidismo subclínico. Baliran y cols. [43] han demostrado que el exceso de HT y los niveles bajos de TSH estimulan la resorción ósea. Esto debe tenerse en cuenta, dado en general el buen pronostico de estos enfermos, lo que podría conllevar a la aparición de fracturas en periodos prolongados de terapia supresora. En general los trabajos describen tratamientos más agresivos para la supresión de TSH en pacientes con elevado riesgo de la enfermedad o recidivas tumorales, mientras que una supresión menos agresiva parece recomendable en los pacientes con bajo riesgo. Además, hay que tener en cuenta que, en los últimos años, el aumento de la prevalencia de microcarcinomas papilares con buena supervivencia obliga a modificar estos criterios de supresión. El mantenimiento de cifras de TSH en rango normal puede ser aconsejable para el tratamiento a largo plazo en pacientes con CDT de edad avanzada y libres de recidivas.
Tratamiento supresor con HT en cáncer diferenciado de tiroides y hueso. Estudios longitudinales vs. tranversales
Hasta la fecha se ha publicado un gran número de estudios transversales sobre el efecto de la terapia supresora con HT en el CDT, tanto en mujeres premenopáusicas como en postmenopáusicas. En premenopáusicas hay tres estudios que encuentran una disminución de la DMO en algunas de las zonas estudiadas [44,45,46]. Frente a ellos, hay tres veces más estudios que no encuentran ningún efecto deletéreo de la supresión de TSH sobre el hueso en estas pacientes [47].
En las pacientes postmenopáusicas con CDT, hay mas disparidad de resultados: unos señalan disminución de la DMO lumbar y de cuello, y en algunos también hay pérdida ósea en radio [46,48,49], frente a una gran mayoría que registran cambios en la DMO con tratamiento supresor [50,51,52,53]. Es posible que la heterogeneidad de los pacientes con cáncer de tiroides seleccionados para los estudios, los diferentes niveles de supresión de TSH y las diferentes técnicas utilizadas para las determinaciones hormonales y la densidad mineral ósea, puedan influir en las notables diferencias de estos resultados.
Por las razones anteriormente expresadas, pensamos que tiene mayor valor el estudio del seguimiento de la masa ósea en estos pacientes con CDT, descartando los estudios transversales, que reflejan una situación puntual. Comparados con los estudios longitudinales, los análisis transversales son más susceptibles a error de muestra y otros sesgos [54]. El objetivo ha sido reseñar las publicaciones con criterio prospectivo, las posibles pérdidas óseas en las diferentes zonas estudiadas con densitometría ósea, con tiempo de tratamiento y de seguimiento detallado, y asimismo los criterios y tiempos de supresión de TSH de estos pacientes. Siguiendo estos objetivos hemos encontrado en PubMed 11 publicaciones, con seguimiento longitudinal, incluyendo una de nuestro grupo [55], que a continuación vamos a analizar (Tabla 2).
El primer ensayo longitudinal publicado fue el de Pioli y cols. [56], que estudiaron a 14 pacientes premenopáusicas (edad 43±6,8 años) con CDT intervenido, con densitometrías cada seis meses y durante un seguimiento con levotiroxina que alcanzaba los 3 años. Aunque diez de estas pacientes fueron sometidas a tiroidectomía casi total y 5 a subtotal, las pautas de HT y de supresión fueron similares, llegando a la supresión a los 4 meses, que se mantuvo durante el estudio. Los autores señalaron pérdida ósea a nivel de columna vertebral de 2,6±1,9% anual, vs. el 0,2±1% que hallan en el grupo control de 15 normales. Paradójicamente, si esta pérdida se continuara por espacio de diez años, sería del 26% en exceso respecto a los controles, hecho que no se ha repetido en ningún otro estudio. La densidad ósea radial fue normal. Es posible que en estos resultados incida la gran variedad interindividual de los parámetros óseos que refieren, al igual que el haber utilizado dos técnicas diferentes, como son la SPA (single photon absorptiometry) y la DXA.
El segundo estudio longitudinal reseñado es el de Mulller y cols. [57] Estudiaron a 15 mujeres premenopáusicas y a 10 postmenopáusicas en tratamiento supresor con T4 por un espacio variable de 1,5 años. De este grupo terminaron con 24 pacientes con CDT, reevaluadas con DXA con un intervalo de seguimiento de 1,5±0,5 años. Seleccionaron 15 sujetos controles pareados en sexo, estado menopáusico, edad y BMI. Concluyeron que la supresión de TSH se acompañó de reducciones no significantivas (2-5%) de la DMO lumbar y de la DMO de cuello femoral, sin haber fracturas incidentes. La disminución de DMO encontrada, es inferior a la clásica descrita por Mazess, en la que el aumento del riesgo de fractura vertebral aumenta 1,5-2 veces por cada desviación estándar (DS) que disminuye la DMO [58], lo que intuye no efecto a este nivel.
En la serie de Fujiyama y cols. [59] se describieron 24 pacientes postmenopáusicas, repartidas en dos grupos, con y sin dosis supresoras de TSH, teniendo 12 pacientes con CDT cada uno. Ambos grupos tenían una tasa de pérdida ósea similar: -0,849 ±0,605 en las suprimidas, y -0,669±0,659 en las no suprimidas. Por otro lado, los valores de Z-score de DMO lumbar y de cuerpo total fueron similares a los referidos para las controles sanas.
En 1996, Kung y cols. [60] detallaron un estudio en mujeres postmenopáusicas operadas por CDT y que distribuyeron en tres subgrupos con 15 pacientes en cada uno: el primero, en tratamiento con calcitonina; el segundo, con calcio solo; y el grupo tercero, con placebo sin ningún tratamiento, que es el grupo que incluimos en esta revisión. Las pacientes de este tercer grupo son seguidas por espacio de dos años, después de la administración de levotiroxina y supresión efectiva de TSH (<0,03 mUI/L) postoperatoria por aproximadamente 9 años. Encuentran una perdida ósea significativamente superior a nivel lumbar, cadera total, trocánter y triangulo de Ward (5,0%, 6%, 4,7%, 8,8%, respectivamente; p<0,05). Sin embargo, al no encontrar fracturas, pensaron que la importancia clínica de esta disminución ósea debía ser cuestionada.
Guo y cols. [61] realizaron un estudio prospectivo en 23 mujeres postmenopáusicas con CDT intervenido y con supresión de TSH posterior, seguidas por 2 años con densitometría ósea y marcadores óseos. Los niveles de TSH séricas se midieron cada 6-12 meses para controlar la supresión de TSH. Los niveles de TSH se correlacionaron con los marcadores óseos (osteocalcina, fosfatasa alcalina ósea y NTX). Este grupo de mujeres postmenopáusicas fue comparado con otros dos grupos control (con y sin niveles de TSH suprimidos) que tenían hipotiroidismo primario o tiroiditis de Hashimoto (n=41). Encontraron que las pacientes control tenían un incremento de DMO lumbar y de cuello femoral y una disminución de los marcadores óseos, mientras que las pacientes con CDT tuvieron disminución de los marcadores óseos sin modificación de la DMO. Sus resultados abonan que en las mujeres postmenopáusicas en tratamiento con T4 el remodelado óseo guarda relación con el grado de supresión de TSH, y que la disminución de la dosis de T4 en las que tienen la TSH suprimida puede inducir una disminución del remodelado óseo.
En nuestra experiencia [55], estudiamos a 14 mujeres premenopáusicas y 13 postmenopáusicas con CDT y supresión de TSH seguidas en nuestro Servicio desde su tiroidectomía total con densitometría dual fotónica repetida por espacio de dos años. El 50% de nuestras pacientes mostraron una TSH por debajo de 0,1 mUI/L. La dosis de LT4 mostró un valor predictivo positivo en cada sitio óseo estudiado lo que escasamente había sido descrito. Ninguno de los parámetros óseos y minerales estudiados se correlacionaron con la masa ósea, excepto la fosfatasa alcalina a nivel de triangulo de Ward y radio ultradistal. Esto es consistente con los valores de DMO y de remodelado óseo normales encontrados en estos pacientes con tratamientos supresivos prolongados. Las pacientes suprimidas mostraron una pequeña reducción de la DMO en 1/3 distal de radio (Z-score =-0,77±0,98; IC 95: -1,11; -0,44), sin existir diferencias entre las pre y postmenopáusicas.
El estudio con mayor duración de seguimiento es el de Sijanovic y cols. [62] Estos autores estudiaron a 19 premenopáusicas con CDT intervenido (edad media 39±8 años) sometidas a tratamiento supresivo con T4 por una media de 9,4 años. El estudio prospectivo con densitometría ósea se realizó en 4 años. Señalaron que al cabo de un año no había pérdida ósea significativa en ninguna región del esqueleto, y, sin embargo, después de realizar 3 mediciones, a los 4 años registran pérdida significativa de BMD en el radio distal y no en otras zonas. Comentaron, sorprendentemente, que en su análisis sí hay disminución aunque no significativa de la masa ósea en otras zonas (datos no dados), por lo que la terapia supresora de TSH con tiroxina en un periodo aproximado de 10 años puede inducir un riesgo de osteopenia en las premenopáusicas que llegan a la menopausia.
En un grupo selectivo y bastante amplio de pacientes postmenopáusicas con CDT papilar, Sugitani y cols. [63] analizaron el efecto que la terapia supresiva postoperatoria de TSH induce en la supervivencia libre de enfermedad y sus efectos sobre la DMO. Analizaron dos grupos: 140 pacientes con supresión (TSH media: 0,07±0,10 mUI/L, y 127 sin supresión (TSH media: 3,14±1,60 mUI/L). Del grupo no suprimido, 120 pacientes postmenopáusicas fueron seguidas por espacio de 5 años, mostrando disminución de la DMO lumbar el subgrupo de postmenopáusicas con más de 50 años de edad. La supresión de TSH no marcó efectos importantes en la prevención de recidivas en los CDT papilar, aunque la mayoría de sus pacientes eran de bajo riesgo. Al final recomiendan que la supresión de TSH, especialmente en pacientes con bajo riesgo y en pacientes de edad avanzada, no se indique, teniendo en cuenta además que no se ha demostrado que disminuya las recidivas incluso en pacientes con elevado riesgo.
El estudio longitudinal de Karner y cols. [64] se llevó a cabo en mujeres premenopáusicas con CDT durante un año. La duración de la supresión de TSH al inicio del estudio era de 9,4±6,4 años, y, por tanto, amplia. Las mediciones de DMO se realizaron dos veces durante un periodo de un año. Utilizando SPA (single photon absorptiometry) para extremidades y DXA no encontraron disminución de DMO a nivel de radio distal, ni en DMO lumbar y/o de cadera. Se trata de un estudio longitudinal de corta duración, pequeño número de sujetos (19 premenopáusicas). Su principal recomendación es la de practicar el estudio de densitometría ósea antes de iniciar el tratamiento supresor de TSH para identificar los pacientes con elevado riesgo de osteoporosis.
Más recientemente fue publicado por Schneider R y cols. [65] un estudio para evaluar los efectos potenciales del tratamiento supresor de LT4 en 46 mujeres premenopáusicas intervenidas por CDT sobre la DMO y la fuerza ósea y muscular. Es un estudio prospectivo controlado con cohorte, de 1 año de seguimiento, en el que se mide la masa ósea por densitometría dual fotónica lumbar y de cadera, y la fuerza ósea y muscular utilizando el índice polar de estrés con dinamometría. Estudian simultáneamente a 23 mujeres premenopáusicas sometidas a terapia sustitutiva con LT4. En ambas poblaciones de premenopáusicas, con tratamiento supresor o con tratamiento sustitutivo, no encuentran disminución de la DMO axial; la pérdida anual (g/cm2) en las pacientes con CDT no fue significativamente diferente de las que recibían tratamiento sustitutivo con LT4 (DMO lumbar: -0,005 vs. +0.004; DMO cuello femoral: -0,005 vs. +0,006; DMO cadera total: +0,001 vs. +0,003, respectivamente). Los autores concluyeron que hay escasa evidencia de efectos adversos de la levotiroxina sobre el hueso, y que las mujeres premenopáusicas con CDT podrían tener riesgo para menor DMO a nivel del radio ultradistal. A pesar de sus nulos datos en este sentido, atribuyen pérdida de BMD cortical no equilibrada por aumento trabecular, probablemente indicando una elevada trabecularización endocortical.
Kim y cols. [66], en un estudio prospectivo de un año, encuentran disminución de masa ósea que afecta predominantemente a las mujeres postmenopáusicas en relación a las premenopáusicas de su estudio. La pérdida anual registrada en postmenopáuscias fue -2,1% en columna lumbar, -2,2% en cuello femoral, -2,1% en cadera total, significativamente superior a las premenopáusicas (p<0,05 para todas). Aunque los autores señalan que la perdida ósea fue sobre todo durante el periodo temprano post-tiroidectomía, un estudio más prolongado podría confirmar este hecho.
Finalmente, Kim y cols. [67] realizaron un estudio prospectivo de 12-18 meses en 24 mujeres premenopáusicas con CDT (6 hipoparatiroideas) y en 100 postmenopáusicas (50 hipoparatiroideas), concluyendo que no encontraron ningún efecto deletéreo de la terapia supresiva con T4, señalando incluso un efecto protector en las pacientes con hipoparatiroidismo postquirúrgico.
Factores de riesgo en pacientes con CDT y tratamiento supresor de TSH
López Alvarez y cols. [68], estudiaron los factores de riesgos implicados en la posible pérdida ósea en 43 mujeres premenopáusicas y 53 postmenopáusicas con CDT tratadas con hormonas tiroideas a dosis supresoras y seguidas durante una media de 75 meses. La edad, como factor de riesgo, y el peso, como factor protector, fueron las variables que más influyeron sobre la DMO. No se encontraron diferencias significativas al comparar las pacientes con concentraciones normales de tiroxina libre frente a las que las tenían discretamente elevada. En las postmenopáusicas, había mayor DMO lumbar en el grupo con ingestión adecuada de calcio (957 mg/día) en relación a las que no la tenían (855 mg/día) (p<0,05). A nivel del cuello femoral y región lumbar, la TSH, junto con la edad y el peso, fueron las variables que más influyeron. Gómez de Melo y cols. [69] realizaron otro estudio similar en 109 postmenopáusicas con CDT y tratamiento supresor, en las que identifican que, en el análisis regresión multivariable logístico, los factores significativamente relacionados con menores valores de DMO fueron: bajo IMC y TSH; no encuentran relación entre la DMO y los valores medios de T4 libres. Sugieren que la TSH puede tener efectos negativos sobre la DMO, solo cuando sus niveles están suprimidos.
En resumen, la mayoría de lo publicado en relación a las mujeres premenopáusicas con CDT y con tratamiento supresor de TSH, no demuestra ningún efecto deletéreo sobre la DMO en ningún sitio anatómico. En las mujeres postmenopáusicas con CDT y supresión de TSH los estudios son más heterogéneos, pero, sin embargo, hay que apuntar que hay tres estudios, comentados, con población importante que refieren perdida ósea.
Conclusiones
En los últimos años, ha habido importantes aportaciones al mejor conocimiento de la regulación del esqueleto por las HT y el eje hipotálamo-hipófisis. La deiodinación de las HT durante su metabolismo se considera un importante determinante del estado tiroideo a nivel circulante y de los tejidos periféricos. En el hueso, la actividad de la deiodinasa D2 se involucra en los osteoblastos y en el mantenimiento de la mineralización adecuada y fuerza ósea. La deiodinasa D3 intervendría muy tempranamente, a nivel del cartílago favoreciendo el desarrollo y crecimiento esquelético.
En sujetos con hipertiroidismo subclínico diferente al del CDT, se consideran necesarios ensayos controlados con número importante de pacientes, para evaluar la eficacia de normalizar los niveles de TSH asociados al riesgo de fractura. La experiencia acumulada con el tratamiento supresor de TSH en el CDT está configurando una estrategia terapéutica con mayor evidencia para el tratamiento de los pacientes con bajo riesgo e intermedio, en los que esta aproximación no sería necesaria. En cambio, los pacientes con elevado riesgo sí podrían beneficiarse; sin embargo, son los pacientes mayores con elevado riesgo los que suelen tener mayor comorbilidades y, en los que con frecuencia habrá que evaluar la indicación.











 texto en
texto en 


