Introducción
El fracaso renal agudo (FRA) puede llegar a afectar hasta un 50% de los pacientes ingresados en unidades de cuidados intensivos (UCI), dato que variará en función del estudio consultado1-3. La mortalidad del paciente crítico puede aumentar entre un 35-53%, si presenta FRA asociado al síndrome de disfunción multiorgánica, factor indicador de la complejidad de su situación4.
De los pacientes afectados por FRA, entre un 4-10% precisarán terapias continuas de depuración extrarrenal (TCDE), en alguna de sus modalidades. De los que reciban el alta, hasta un 20% entrarán en programa de hemodiálisis crónica 4-5.
Las TCDE son la terapia sustitutiva renal de elección en pacientes que se encuentran en situación crítica, ya que presentan una mejor tolerancia hemodinámica a las mismas, a pesar de que la supervivencia no sea mayor que en la hemodiálisis intermitente6-8.
Las primeras experiencias en TCDE, aplicadas con hemofiltración arteriovenosa continua, fueron descritas por Kramer en 19779. Pero desde entonces, muchos han sido los avances introducidos en la terapia. Éstos abarcan tantos aspectos técnicos, introducidos en los monitores, como aspectos de seguridad y eficacia en el tratamiento.
Los cuidados de Enfermería a cargo de pacientes tratados con TCDE, incluyen los cuidados habituales de un paciente crítico, e integran los cuidados de la terapia y del acceso vascular (AV). Tales como mantener el flujo de sangre adecuado (Qb), la permeabilidad del circuito extracorpóreo, flujos de terapia, monitorización de las presiones del circuito, e indicación de la anticoagulación. Referentes al AV, habitualmente catéter temporal, mantener la permeabilidad y el correcto funcionamiento2-3), (10.
Entre las complicaciones de las TCDE relacionadas con la técnica, destacan: la disfunción del AV, y la coagulación del circuito extracorpóreo2-3),(10-11. Continúan siendo uno de los puntos débiles de la terapia, y los cuidados de Enfermería irán encaminados a minimizarlos. Para la anticoagulación del circuito, el fármaco utilizado tradicionalmente ha sido la heparina sódica (HS); anticoagulando de forma sistémica al paciente, con el riesgo de sangrado y trombocitopenia inducida (TIH) que puede suponer, para aquéllos que se encuentran en situación crítica12.
Debido a estas complicaciones, otros métodos de anticoagulación empezaron a utilizarse en las TCDE. La heparina en diferentes modalidades (regional, no fraccionada o de bajo peso molecular), prostaciclinas (epoprostenol), o inhibidores directos de la trombina (argatrobán) son algunos ejemplos2), (11),(13-14.
El citrato, cuyo efecto es regional, actúa sólo a nivel del circuito extracorpóreo; evitando la anticoagulación del paciente. La primera experiencia con citrato fue descrita por Morita et al en 1961, en pacientes en hemodiálisis con riesgo de sangrado15. Pero no fue hasta los años 80, cuando aparecieron más estudios sobre su uso en hemodiálisis. Se introdujo en pacientes críticos y TCDE en la década de los 9016-18.
La acción del citrato consiste en quelar el calcio ionizado del paciente, que actúa en varios niveles de la cascada de coagulación, evitando la activación de la misma, inhibiendo la formación de fibrina y la agregación plaquetaria. En las TCDE, el citrato se administra a través de la línea aferente del circuito extracorpóreo; evitando la coagulación del mismo de forma regional, sin anticoagular al paciente, neutralizándose su efecto de dos maneras diferentes: un porcentaje de citrato (que puede variar desde el 30 al 60% en función de los estudios) es eliminado a través del hemofiltro; mientras que la posible carga de citrato que se infunde al paciente, dado que éste posee efecto buffer, es metabolizado a través de hígado, músculo y corteza renal, dando lugar a bicarbonato sódico (generándose tres moles de bicarbonato por cada mol de citrato, y liberando el calcio ionizado) (19-21.
Durante el tratamiento de TCDE con citrato, se debe reponer el calcio del paciente, para compensar la pérdida del mismo que se produce al quelarse junto al citrato en el circuito extracorpóreo, y ser eliminado éste último en parte a través del hemofiltro. La reposición de calcio siempre se realizará post-filtro.
De lo descrito, se deriva que la administración de citrato puede presentar complicaciones, entre las que destacan22-23:
Episodios de hipernatremia: dado que el citrato utilizado para las TCDE es citrato trisódico (Na3C6H5O7).
Episodios de hipomagnesemia: ya que el citrato también forma complejos con el magnesio, y ambos son eliminados en el hemofiltro.
Alteraciones del estado ácido-base metabólico: alcalosis metabólica, por acúmulo de citrato durante el tratamiento y debido a su efecto buffer. Por ello, se evita el uso de citrato en pacientes con insuficiencia hepática.
Episodios de hipocalcemia: ya que el citrato unido al calcio en el circuito extracorpóreo, es eliminado a través del filtro, dando lugar a la disminución de calcio sérico del paciente.
Por tanto, el objetivo de este estudio es evaluar la eficacia y seguridad de dos métodos de anticoagulación utilizados en pacientes tratados con TCDE, en unidades de cuidados intensivos (UCIs) del Hospital Clínic de Barcelona.
Material y Método
Estudio observacional, prospectivo, en una población de pacientes con TCDE ingresados en UCIs del Hospital Clínic de Barcelona, durante los meses de enero a septiembre de 2016. Fueron incluidos 54 sujetos ingresados en las UCIs de cirugía cardiovascular, coronaria y quirúrgica. El muestreo realizado fue no probabilístico intencional.
Como criterios de inclusión se establecieron: TCDE superior a 72 horas de duración, portador de AV temporal, sin antecedentes de TIH. Se excluyeron a aquellos pacientes con contraindicación para la anticoagulación, insuficiencia hepática, IRC en estadio V en programa de hemodiálisis crónica.
Los criterios de insuficiencia renal aguda (IRA) aplicados, fueron los descritos en el protocolo “Guía para el tratamiento sustitutivo renal en la insuficiencia renal aguda del Hospital Clínic”.
Respecto a la TCDE, la modalidad de tratamiento fue la hemodiafiltración (HDFVVC), que combina terapias convectivas y de difusión, con una fracción de filtración que no superaba el 25% (% de agua plasmática que es extraída de la sangre en función del volumen que entra en el filtro, a través de su membrana); y una dosis de efluente de 30 ml/kg/h.
Se trataron 27 sujetos con anticoagulación sistémica con HS (ASHS), y HDFVVC con reposición pre-filtro. Y el resto, con anticoagulación regional con citrato (ARC), y HDFVVC con reposición post-filtro. El estudio incluyó un seguimiento de 72 horas para cada paciente.
El monitor utilizado para la terapia fue el Multifiltrate®, con versión 5.2 de software. La membrana de los hemofiltros fue polisulfona con superficie de 1.8 m2. Se empleó un equipo de TCDE con líneas incorporadas para la infusión de citrato y calcio, en el grupo ARC.
En la tabla 1, se detallan características diferenciales de la TCDE de ambos grupos.
Tabla 1 Características diferenciales de las terapias continuas de depuración extrarrenal de ambos grupos de anticoagulación.
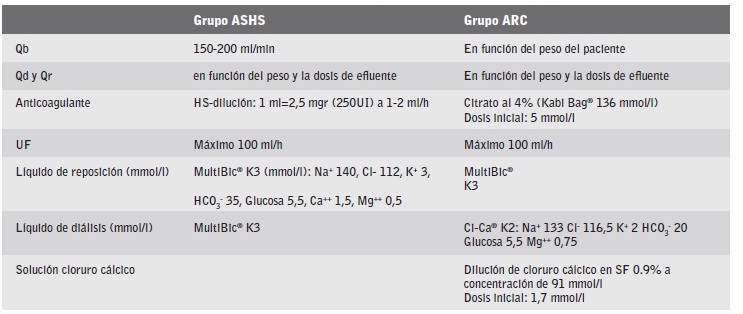
Qb: Flujo de sangre.
Qd y Qr: Flujo de diálisis y de reposición (mil/h).
UF: Ultrafiltración.
Anticoagulante ARC: La dosis de citrato se modificó según el calcio iónico post-filtro, muestra de la línea eferente del circuito, manteniéndose en 0.25-0.34 mmol/l.
ASHS: El líquido de diálisis y el de reposición fue el mismo, Multibic® K3.
ARC: Líquido de diálisis usado fue Ci-Ca® K2, y de reposición, MultiBic® K3. La reposición se realizó post-filtro, para evitar la interacción del calcio contenido en el líquido de sustitución, con el citrato.
Solución cloruro cálcico ARC: Infundida al final del circuito extracorpóreo o por vía central no conectada al equipo de TCDE.
Se modificó a partir del calcio sérico del paciente, para mantener una concentración de 1,12-1,20 mmol/l.
Como criterios de interrupción de la TCDE con citrato, se utilizaron los siguientes:
Cociente de calcio total/calcio ionizado > 2.5 mmol/l.
Alcalosis metabólica persistente con exceso de base (EB) > 10 mmol/l.
Signos clínicos de hipocalcemia.
Acidosis metabólica progresiva.
Las variables estudiadas incluyeron las características demográficas de los pacientes, y variables relacionadas con la seguridad y eficacia de las TCDE. Las variables descritas para seguridad fueron episodios de sangrado, soporte transfusional, y episodios de TIH e hipocalcemia. En cuanto a eficacia, duración en horas de los equipos extracorpóreos, y número de los mismos utilizados en cada grupo.
Las variables categóricas se han descrito con frecuencias y porcentajes, las continuas con medias y desviación estándar o mediana y amplitud intercuartil (percentil 25-percentil 75) de acuerdo a su distribución. La estrategia general de análisis se estableció de la siguiente manera: para comparar entre variables categóricas se utilizó la prueba exacta de Fisher entre grupos, para las continuas la t de student y en caso de no cumplirse las asunciones de aplicabilidad, se aplicaron métodos no paramétricos (prueba de U de Mann-Whitney). Las variables de evaluación repetida a lo largo del tiempo como EB o Calcio, se analizaron usando modelos mixtos para medidas repetidas.
Se consideró el valor de p<0,05 como estadísticamente significativo, y el análisis se realizó con la versión 9.4 de software del paquete estadístico SAS (SAS Institute Inc, Cary, NC).
El estudio fue aprobado por el Comité de Ética e Investigación del Hospital Clínic.
Resultados
Un 70,4% (38) eran hombres, con una media de edad de 70.19±11.79 años, un peso medio de 73.25±15.60 kilogramos; y una media de índice de comorbilidad de Charlson de 7.56±1.31 puntos.
Para conocer el estado crítico de los pacientes, se aplicaron escalas de gravedad. Como Acute Physiology and Chronic Health Evolution Score II (APACHE II), con una media de 24.06±5.89 puntos; y Sepsis-related organ failure assessment (SOFA), con una media de 11.28±2.7 puntos. Todos los pacientes precisaron soporte vasoactivo, y un 72.2% (39) estuvieron ventilados mecánicamente durante la terapia.
Las características demográficas y epidemiológicas de los pacientes estudiados (n=54), por grupo de anticoagulación se pueden observar en la tabla 2.
Tabla 2 Características demográficas y epidemiológicas de los pacientes estudiados (n=54), por grupo de anticoagulación.
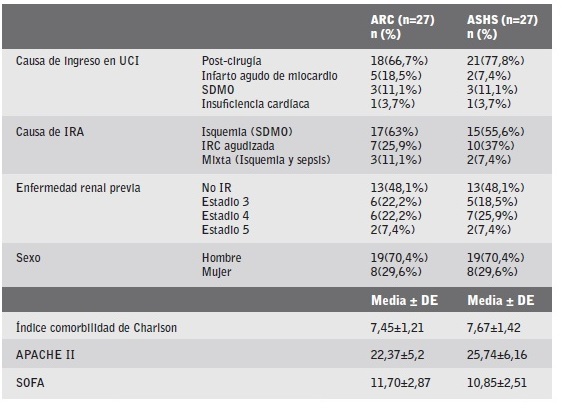
IR: Insuficiencia renal.
IRC: Insuficiencia renal crónica.
SDMO: Síndrome de disfunción multiorgánica.
APACHE II: Acute Physiology and Chronic Health Evolution Score II.
SOFA: Sepsis-related organ failure assessment.
DE: Desviación estándar.
Un 51.9% (28) de los pacientes presentaban algún estadio de insuficiencia renal crónica (IRC), sin requerimiento dialítico previo.
Todos eran portadores de AV temporal. La mayoría de ellos localizados en vena femoral 88.9% (48), yugular derecha 7.4% (4), y yugular izquierda 3.7% (2).
Durante el tiempo de estudio, las 54 terapias comprendieron un total de 109 circuitos extracorpóreos: 43 circuitos pertenecieron al grupo de ARC; y los 66 restantes, a los pacientes tratados con ASHS.
Durante las 72 horas de seguimiento de los pacientes, se requirió un mayor número de circuitos en las HDFVVC con ASHS, que en las HDFVVC con ARC (ASHS=2.44±1.15 circuitos vs ARC=1.59±0.75 circuitos, p=0.002).
En cuanto a eficacia, los circuitos con ARC presentaron una mayor supervivencia en horas, que el grupo de ASHS (95% IC, MD 65.00, 44.00-72.00 horas vs MD 36.00, 15.00-72.00 horas, p=0.02), figura 1. A pesar de que un total de 9 (33.3%) circuitos del grupo de ARC fueron sustituidos por coagulación, comparados con los 17 (63%) del grupo de ASHS (p=0.027); destacar que 3 (11.1%) circuitos del grupo de ARC se coagularon por disfunción del AV, y sólo 1 (3.7%) por este motivo, en el grupo de ASHS (p=0.027).

Figura 1 Curva de Kaplan-Meier para la supervivencia de los cir cuitos extracorpóreos (en horas) en función de la anticoagulación utilizada.
Un mayor número de circuitos fueron cambiados de forma electiva, llegando a las 72 horas de funcionamiento (tiempo recomendado como máximo de uso sin pérdida de eficacia), en la ARC vs ASHS (95% IC, n=9 (33.3%) vs n=1 (3.7%), p=0.027).
Relacionado con la seguridad, los pacientes tratados con ARC presentaron menos episodios de sangrado activo que el grupo de ASHS, pero no hubo diferencias estadísticamente significativas (95% IC, n=6 (22.2%) vs n=9 (33.3%), p=0.537). El número de pacientes que requirieron soporte transfusional fue similar en ambos grupos (95% IC, n=19 (70.3%) vs n=18 (66.6%), p=0.985).
Cabe destacar que a estadio más avanzado de IRC previo, el requerimiento transfusional fue mayor (95% IC, estadio 3=0.91±1.38 vs estadio 4=2.59±2.12, p=0.045).
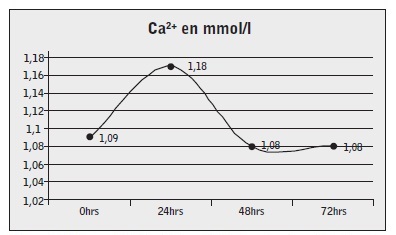
En cuanto al grupo de ASHS, no se dio ningún caso de TIH. Y en el grupo de ARC, se presentó un solo caso de hipocalcemia, que fue corregido según protocolo. La evolución de los niveles de Calcio ionizado (Ca2+), y Calcio total en el grupo de ARC se pueden observar en las figuras 2y3. No se objetivaron alteraciones metabólicas del equilibrio ácido-base significativas. Se produjo un aumento del exceso de base en el grupo de pacientes con ARC, sin exceder los límites de la normalidad, por la propia corrección de la IRA. El EB sólo se estudió en el grupo ARC (ver figura 4).
En cuanto a la dosis de citrato y calcio administradas, expresadas en medias y desviación estándar, en mmol/l: Citrato=4.60±0.58 y Calcio=1.94±0.21.
La mortalidad de los pacientes del grupo estudiado fue del 35.2%, una vez finalizado el estudio (ARC n=8 (29.6%), ASHS n=11 (40.7%)).
Discusión / Conclusiones
El objetivo del presente trabajo ha sido comparar dos métodos de anticoagulación: HS administrada de forma sistémica; y citrato, actuando a nivel regional. Siendo el primer estudio realizado en el Hospital Clínic sobre ARC.
Aunque con una muestra de estudio pequeña, comparte resultados con otros estudios más extensos. Éstos han comparado la eficacia de la ARC y ASHS con diferentes métodos. Usando terapias de convección, hemofiltración, convección y difusión, HDFVVC; con reposición de líquidos post-filtro o pre-filtro y con ASHS, o incluso de forma regional (administración de HS junto a protamina-ARH), de amplio uso en Australia y Nueva Zelanda13-14), (24-25. Los estudios muestran mejor eficacia de la ARC, para mantener la permeabilidad del circuito extracorpóreo, evitar su coagulación y la aparición de TIH13), (24-25.
En nuestro estudio, hemos comparado AHS infundiendo el líquido de reposición pre-filtro; y ARC con reposición post-filtro. En el grupo AHS, se realizó la reposición del líquido de infusión pre-filtro, para favorecer la permeabilidad del circuito3. Se optó por este tipo de reposición porque previene y/o evita la coagulación del circuito en comparación con el mismo procedimiento pero con infusión post-filtro; y aunque condiciona el aclaramiento de pequeñas moléculas, como la urea, no existen evidencias de que una mayor eficacia de la diálisis, mejore la supervivencia del paciente crítico26. Por tanto, y aun comparando la ARC con infusión post-filtro con la AHS con reposición pre-filtro, que previene la coagulación del circuito, la ARC demostró mayor eficacia en la supervivencia de la técnica.
En cuanto al riesgo de sangrado, el grupo tratado con ARC presentó un menor número de episodios de sangrado activo, aunque sin diferencias significativas; dato que se relaciona con los obtenidos en el resto de trabajos publicados, que favorecen el uso de la ARC13-14),(24-25. No ocurre lo mismo en cuanto al requerimiento de concentrados de hematíes que fue similar en ambos grupos, y no coincide con lo presentado hasta el momento; si se comparan ARC con ASHS, o con ARH, se precisan un número menor de concentrados en el grupo ARC13-14),(27.
Sobre las complicaciones de ambos métodos de anticoagulación, todos los trabajos destacan el riesgo de presentar episodios de hipocalcemia o alcalosis metabólica de los pacientes tratados con ARC; y de sangrado o TIH de los tratados con ASHS. En este estudio, sólo se dió un caso de hipocalcemia, que fue corregido según el protocolo, sin repercusión clínica para el paciente. Y no se presentaron casos de TIH13-14), (24-25.
A pesar de que en la mayoría de trabajos, la insuficiencia hepática sea un criterio de exclusión para la ARC; hay dos estudios, que estiman efectiva y viable la ARC, con mayor atención a los posibles cambios metabólicos, en estos pacientes28-29.
Algunas de las características demográficas del grupo de estudio se comparten con otros trabajos. Pacientes predominantemente varones con media de 66 años de edad, y la localización de los AVs fue en un porcentaje muy alto en vena femoral5, a pesar de las recomendaciones de las KDIGO30.
Aun siendo un estudio pequeño, la mortalidad de los pacientes es muy similar a la del resto de trabajos, un 35,2% de los pacientes. Y ésta, no está relacionada con la TCDE o con el método de anticoagulación utilizado4-5), (13-14), (24-25.
El análisis de coste-efectividad, se ha realizado en varios trabajos y precisa de más estudios y evidencia científica; aunque se atribuye un menor coste a la ARC asociado a un menor número de circuitos utilizados, y complicaciones13-14), (25), (27), (31.
Varias son las limitaciones, como el hecho de que sea un trabajo observacional sin randomización, de un solo centro, con una población de estudio pequeña, y comprenda un periodo corto de tiempo; provocando que no pueda poseer validez externa. Pero a pesar de ello, está apoyado por resultados similares de otros estudios más extensos.
La ARC presenta una mayor eficacia en la supervivencia de los filtros y evitando la coagulación. El riesgo de sangrado es menor que en la ASHS, y presenta escasas complicaciones.