Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.34 no.2 Cantabria 2014
https://dx.doi.org/10.3265/Nefrologia.pre2014.Jan.12280
ARTÍCULOS ORIGINALES
Los nefrólogos españoles y el manejo de las alteraciones del metabolismo óseo-mineral en la enfermedad renal crónica
Spanish nephrologists and the management of mineral and bone metabolism disorders in chronic kidney disease
Jorge Cannata-Andía1, J. Vicente Torregrosa2
1Servicio de Metabolismo Óseo y Mineral. Hospital Universitario Central de Asturias. Oviedo
2Servicio de Nefrología y Trasplante Renal. Hospital Clínic. Barcelona
El presente trabajo ha sido posible gracias al soporte logístico de Shire Pharmaceutical Ibérica y al aval de la Sociedad Española de Nefrología.
Dirección para correspondencia
RESUMEN
El presente estudio fue diseñado para evaluar la percepción actual de los nefrólogos españoles en el manejo clínico de las alteraciones del metabolismo óseo y mineral en la enfermedad renal crónica (CKD-MBD). Para ello se empleó un procedimiento semiestructurado de consenso profesional a distancia, por correo electrónico (método Delphi modificado), a un panel representativo del colectivo nefrológico, bajo la dirección de un comité coordinador. Para analizar la opinión grupal y el tipo de consenso alcanzado sobre cada cuestión planteada, se empleó la posición de la mediana de puntuaciones del grupo y el «nivel de concordancia» alcanzado por los encuestados. Sobre un total de 86 cuestiones se logró un consenso en acuerdo y desacuerdo en 70 (81,4 %), de los cuales un 60,5 % (52 ítems) lo fueron en términos de acuerdo con la aseveración y un 20,9 % (18 ítems) en desacuerdo. En 16 ítems (18,6 %) no se consiguió suficiente unanimidad de criterio en el panel, bien por disparidad de opinión profesional, bien por falta de criterio establecido en una mayoría del comité de expertos. Aceptando las limitaciones del estudio, consideramos que los ítems en los que hubo consenso refuerzan algunos conceptos de CKD-MBD con su repercusión en la práctica clínica diaria y permiten valorar el grado de homogeneidad que podríamos esperar en esta área. Los ítems en los que no hubo consenso nos ayudan a conocer las áreas de incertidumbre y resultan de gran utilidad para precisar en qué aspectos existe una mayor necesidad de profundización y de emprender estudios prospectivos que permitan mejorar el manejo de estas alteraciones.
Palabras clave: Método Delphi, Hormona paratiroidea, Calcio, Fósforo, Vitamina D, Calcimiméticos, CKD-MBD.
ABSTRACT
This study was designed to assess the current perception of Spanish nephrologists in the clinical management of mineral and bone metabolism disorders in chronic kidney disease (CKD-MBD). As such, we used a semi-structured distance professional consensus procedure via e-mail (modified Delphi method) on a representative nephrologist panel, under the direction of a coordinating committee. To analyse the group's opinion and the type of consensus reached on each issue raised, we used the median of the group's scores and the "level of agreement" reached by those surveyed. On a total of 86 issues, a consensus agreement and disagreement was achieved in 70 (81.4%), of which 60.5% (52 items) agreed with the statement and 20.9% (18 items) disagreed. In 16 items (18.6%), there was insufficient unanimity in the panel's opinion, either due to professional opinion disparity or due to the lack of opinion established in the majority of the expert committee. Accepting the study's limitations, we considered that the items for which there was a consensus reinforce some CKD-MBD concepts with their impact on daily clinical practice and allow the degree of homogeneity that we could expect in this area to be assessed. The items in which there was no consensus help us to know the areas of uncertainty and are very useful for clarifying which aspects have a greater need for further knowledge and which areas require prospective studies to be conducted to improve the management of these disorders.
Key Words: Delphi method, Parathyroid hormone, Calcium, Phosphorus, Vitamin D, Calcimimetics, CKD-MBD.
Introducción
Las alteraciones del metabolismo óseo y mineral en el escenario de la enfermedad renal crónica (CKD-MBD) constituyen un campo de estudio muy dinámico, que además ha experimentado muchos cambios, especialmente en el último quinquenio.
Al conjunto de los considerados «reguladores clásicos del metabolismo óseo y mineral» (calcio, fósforo, hormona paratiroidea [PTH] y calcitriol) se han añadido otros factores, algunos ya conocidos, como el calcidiol, y otros nuevos, como el factor de crecimiento fibroblástico 23 (FGF-23) y kloto1. Además, otras alteraciones que hasta hace poco eran consideradas fuera del área del CKD-MBD, como la calcificación vascular, la enfermedad cardiovascular y las fracturas óseas, han pasado, progresivamente, a ser parte de la constelación CKD-MBD2.
A la par de estos cambios y avances en el conocimiento del CKD-MBD, se han comercializado nuevos fármacos para el control de sus alteraciones, que, si bien potencialmente ofrecen una mayor flexibilidad y un abanico terapéutico más completo, han aumentado el número de interrogantes sobre su eficacia y limitaciones de uso en la práctica diaria.
La mayoría de estos temas han sido tratados en las recientes guías de práctica clínica, entre ellas las de la Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD 2009, que serán revisadas nuevamente a finales de 20132, y las Guías de CKD-MBD de la Sociedad Española de Nefrología (S.E.N.)3. Aun así, existe un marco importante de incertidumbre que se traduce en variaciones importantes en el manejo clínico de estas alteraciones, área que explora este trabajo.
El presente estudio fue diseñado para evaluar la percepción actual de los nefrólogos españoles en el manejo clínico de las alteraciones del CKD-MBD.
Material y métodos
Para investigar la percepción de los nefrólogos españoles sobre el metabolismo óseo y mineral se empleó un procedimiento semiestructurado de consenso profesional a distancia, por correo electrónico (consenso Delphi)4,5, que permite una participación reflexiva e igualitaria de los participantes y que se aplicó a un panel representativo del colectivo nefrológico. Su ejecución requiere dos rondas sucesivas de una encuesta estructurada (con escalas de respuesta cerradas), con procesamiento y devolución a los participantes de los resultados intermedios para que puedan contrastar confidencialmente sus opiniones personales con las del resto de los panelistas.
El proyecto se desarrolló en cuatro fases (figura 1): 1) Constitución de un comité científico, formado por 10 nefrólogos con especial interés en el área de metabolismo óseo y mineral, que fue el responsable de la dirección del proyecto y el encargado de elaborar el cuestionario, proponer los miembros del panel de expertos, analizar e interpretar los resultados y elaborar las conclusiones finales. 2) Elección de un panel de expertos: el comité científico eligió 59 nefrólogos, que representasen a todas las regiones de España, interesados en el área del metabolismo óseo y mineral, que cumplían los requisitos antes detallados basándose en una preselección de un panel de 192 nefrólogos que desempeñaban su labor fundamentalmente en áreas de diálisis, prediálisis y trasplante renal. 3) El panel de expertos recibió la encuesta con las preguntas, que fueron contestadas por correo electrónico en dos rondas. 4) Análisis de resultados y discusión de estos en una reunión presencial final conjunta del comité científico y del comité de expertos.
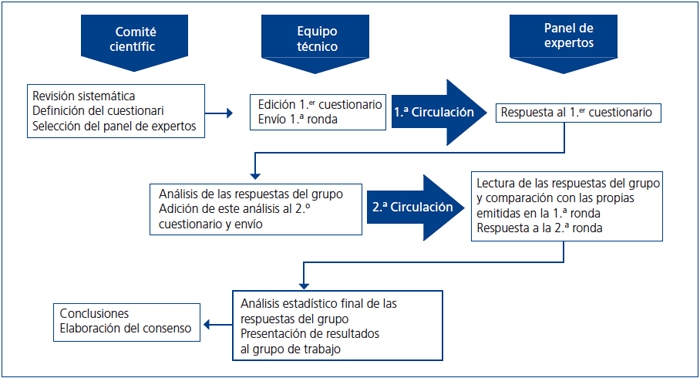
Figura 1. Circuito del método Delphi. Esquema del desarrollo del estudio.
Se requirió también de un equipo técnico, responsable de la implementación del método, la edición y la difusión del primer cuestionario, el análisis de las respuestas de la primera circulación, el informe provisional y la difusión del segundo cuestionario, el análisis del segundo cuestionario y la interpretación estadística del consenso logrado.
Elaboración del cuestionario y método de respuesta
Inicialmente se definió el procedimiento sistemático de revisión bibliográfica y de elaboración del cuestionario. Cada ítem del cuestionario es una aseveración (afirmativa o negativa) que recoge un criterio sobre las alteraciones del CKD-MBD en cualquier aspecto de interés o controversia. Tras un proceso de revisión y agrupación temática de los ítems propuestos, se elaboró una versión final del cuestionario constituida por 86 ítems, que fue aceptada por el comité científico y dividida en los siguientes bloques temáticos:
- Metabolismo del fósforo, calcio y magnesio.
- Hueso y sistema cardiovascular.
- Vitamina D.
- Calcimiméticos, paratiroidectomía y asociaciones con vitamina D.
- Trasplante renal.
Escala de valoración de las recomendaciones clínicas sometidas a juicio
Para la valoración de las cuestiones se propuso una única escala ordinal de tipo Likert de nueve puntos, similar al formato convencional (UCLA-Rand Corporation) usado para la valoración comparativa y la priorización entre distintas opciones sanitarias (tecnologías, etc.)6,7. Las categorías de respuesta se describieron mediante cualificadores lingüísticos de acuerdo/desacuerdo agrupados en tres regiones, con las propuestas presentadas como posibles conclusiones:
- 1-3: Estoy en desacuerdo con la afirmación (cuanta menor puntuación, mayor grado de desacuerdo).
- 4-6: Ni acuerdo ni desacuerdo con la afirmación; no tengo un criterio totalmente definido sobre la cuestión (se elige 4 o 6 si se está más bien cerca del desacuerdo o del acuerdo, respectivamente).
- 7-9: Estoy de acuerdo con la afirmación (cuanta mayor puntuación, mayor grado de acuerdo).
La encuesta ofrecía también la posibilidad de añadir observaciones libres a cada ítem y un apartado final de nuevas propuestas que valorar por el comité. A efectos estadísticos las cuestiones no contestadas se analizaron como casos perdidos.
Análisis e interpretación de los resultados
Se realizó un análisis descriptivo de las respuestas utilizando la mediana, la media y el rango intercuartil con las particularidades que se detallarán a continuación. Las comparaciones se realizaron utilizando la media con intervalo de confianza del 95%. Para valorar la opinión grupal y el tipo de consenso alcanzado sobre cada cuestión planteada, se empleó la posición de la mediana de puntuaciones del grupo y el «nivel de concordancia» alcanzado por los encuestados, según los siguientes criterios: se consideró consensuado un ítem cuando en el panel hubo «concordancia» de opinión. En tal caso, el valor de la mediana determinó el consenso grupal alcanzado, que se basó en los tres supuestos antes indicados: «desacuerdo» mayoritario con el ítem, si la mediana fue ≤ 3; «acuerdo» mayoritario con el ítem, si la mediana fue ≥7. Los casos en los que la mediana estuvo entre 4-6 se consideraron ítems «dudosos» para una mayoría representativa del grupo y no quedaron consensuados. Se estableció que existía «discordancia» de criterio en el panel cuando el porcentaje de respuesta de los panelistas en contra (aquellos que puntuaron fuera de la región que contiene la mediana de ese ítem) fue mayor del 33%. Los ítems restantes en los que no se observó concordancia ni discordancia se consideraron con un nivel de consenso «indeterminado».
Todos los ítems en los que el grupo no alcanzó un consenso manifiesto a favor o en contra de la cuestión planteada (los ítems dudosos, aquellos en los que se apreció discordancia y los que mostraron un nivel de consenso indeterminado) se propusieron a la reconsideración del panel en la segunda ronda Delphi (figura 1). También se sometieron a revaluación los ítems en los que se apreció una importante dispersión de opiniones entre los encuestados, con un rango intercuartílico ≥4 puntos (rango de puntuaciones contenidas entre los valores p25 y p75 de la distribución).
Entre ambas rondas, se informó a los panelistas de la distribución detallada de las respuestas anónimas del grupo en la primera encuesta (mediante gráficos de barras), facilitándose anónimamente los comentarios y aclaraciones aportadas por cada participante.
Después de revisar esta información, se solicitó una nueva valoración personal de los ítems no consensuados en la primera ronda. Tras la segunda ronda de encuesta se aplicaron criterios idénticos para discriminar los ítems definitivamente consensuados de aquellos en los que no resultó posible unificar el criterio del panel. El tiempo total en el que se realizaron las dos rondas fue de dos meses.
A efectos de comparación gráfica entre ítems, se calculó el promedio de puntuación de los panelistas en cada cuestión con su intervalo de confianza al 95%. Cuanto más extremo resultó el promedio de puntuaciones de un ítem (más próximo a 1 o a 9), más manifiesto se consideró el consenso logrado, bien en el acuerdo o en el desacuerdo, respectivamente, sobre la propuesta expresada por cada ítem.
La menor amplitud del intervalo de confianza se interpretó como expresión de mayor unanimidad de opiniones en el grupo. Los ítems en los que no se logró un consenso tras completar el proceso descrito se analizaron de forma descriptiva para distinguir si tal situación era debida a que persistía discordancia de criterio o al posicionamiento mayoritario del panel en la región de duda respecto al ítem (la mayoría del grupo declaró no tener un criterio definitivo; voto=4-6).
Resultados
Sobre un total de 86 cuestiones se logró un consenso en acuerdo y desacuerdo en 70, es decir, se logró un consenso suficiente en el 81,4%, de los cuales un 60,5% (52 ítems) lo fueron en términos de acuerdo con la aseveración y un 20,9% (18 ítems) en desacuerdo. En 16 ítems (18,6%) no se consiguió suficiente unanimidad de criterio en el panel, bien por disparidad de opinión profesional, bien por falta de criterio establecido en una mayoría del comité de expertos. En la primera ronda se consensuaron 40 de las 86 cuestiones analizadas (34 en el acuerdo y 6 en el desacuerdo). De los 46 ítems restantes propuestos a la reconsideración de los expertos en la segunda ronda se lograron consensuar 30 más (18 en el acuerdo y 12 en el desacuerdo) (tabla 1). Los resultados/conclusiones que a continuación se detallan agrupan los aspectos fundamentales de dicho consenso.
Tabla 1. Resultados estadísticos de las 86 preguntas 
ERC: enfermedad renal crónica; FGF-23: factor de crecimiento fibroblástico 23;
PTH: hormona paratiroidea; VDR: receptores de vitamina D.
Afirmaciones consensuadas
Los 52 ítems consensuados se pueden agrupar en los 36 puntos siguientes:
1. En la enfermedad renal crónica existe una sobrecarga corporal de fósforo antes de que aparezca hiperfosfatemia. Dicha sobrecarga puede ser valorada mediante la fracción excretada de fósforo.
2. Se debe intentar una restricción dietética de la ingesta de fósforo cuando se sospeche sobrecarga. Una restricción razonable de la dieta lactoproteica (2 raciones [±120g] de proteínas animales y una o dos de lácteos) no conlleva riesgo de desnutrición y contribuye al control del metabolismo mineral en el paciente en diálisis.
3. La disponibilidad y absorción de fósforo procedente de la ingesta de proteínas animales y de conservantes es significativamente mayor que el fósforo que acompaña a las proteínas de origen vegetal.
4. Los pacientes deberían recibir captores de fósforo solo si se detecta el fósforo por encima de los valores normales de laboratorio.
5. El hidróxido de aluminio sigue siendo el captor más potente (útil ante P>6,5mg/dl) y su empleo no parece perjudicial mientras se use durante períodos cortos de tiempo (2-3 meses).
6. Deben evitarse los captores de fósforo que contienen calcio en pacientes con enfermedad renal crónica y calcificación vascular o valvular y, en el caso de emplearlos, no deben sobrepasarse los 1500mg de calcio elemento al día.
7. La combinación de carbonato de magnesio y acetato de calcio parece al menos tan eficaz como el resto de captores cálcicos y, si se emplea, debe monitorizarse el magnesio sérico.
8. En pacientes con enfermedad renal crónica y calcificación vascular o valvular que presenten hiperfosfatemia, pueden emplearse carbonato de lantano o sevelamer como primera elección.
9. Existen datos clínicos y experimentales que sugieren una mayor potencia captora de fósforo del carbonato de lantano sobre el carbonato de sevelamer.
10. El carbonato de lantano y el sevelamer presentan una ventaja en términos de supervivencia en la subpoblación mayor de 65 años con respecto a los captores cálcicos.
11. El elevado precio del carbonato de lantano y del sevelamer puede condicionar que no se consideren de primera elección en todos los casos.
12. La tolerancia gastrointestinal y el grado de adherencia a la prescripción son factores muy importantes a la hora de emplear un captor de fósforo.
13. El calcio sérico no representa el balance neto de calcio ingerido, pudiendo estar el paciente con sobrecarga de calcio y presentar calcemia dentro del rango de normalidad.
14. Las calcificaciones vasculares tienen consecuencias diferentes según el tipo y la localización y son un factor que contribuye a la morbimortalidad cardiovascular.
15. La mineralización ósea y vascular se produce por mecanismos similares.
16. La severidad y progresión de calcificaciones vasculares, fracturas óseas y una menor masa ósea están relacionadas y se asocian con mayor morbimortalidad.
17. Los factores de riesgo cardiovascular modificables (tradicionales y no tradicionales) deben ser prevenidos y tratados precozmente.
18. El déficit de vitamina D ha de corregirse en cualquier estadio de la enfermedad renal crónica o en diálisis, debiéndose situar los niveles de calcidiol entre 25-40ng/ml en cualquier estadio de la enfermedad.
19. La medición de 1,25(OH2) D3 no parece útil desde el punto de vista clínico.
20. En la enfermedad renal crónica, la administración de vitamina D puede tener efectos adversos tanto en las dosis recomendadas por las guías como en dosis elevadas, por lo que la monitorización de calcio, fósforo y creatinina debe ser estrecha.
21. Los efectos adversos de la suplementación de vitamina D para corregir el déficit/insuficiencia son los mismos en cualquier estadio de la enfermedad renal crónica.
22. La prescripción de calcitriol, en enfermedad renal crónica no en diálisis, deberá iniciarse con 0,25 microgramos a noches alternas.
23. En todos los estadios de la enfermedad renal crónica, si tuviese que asociarse a los metabolitos de la vitamina D un captor de fósforo, se evitarán los que contengan calcio.
24. En pacientes en diálisis, la administración de vitamina D nativa o calcidiol junto con vitamina D activa favorece la aparición de hiperfosfatemia e hipercalcemia, motivo por el que hay que reducir la dosis de ambas; en estos casos parece preferible utilizar paricalcitol para reducir dicho riesgo.
25. En relación con el uso de vitamina D, en diálisis peritoneal ha de emplearse la misma estrategia que en hemodiálisis.
26. Sería importante controlar los niveles de fósforo antes de empezar terapias dirigidas a actuar directamente sobre la producción y secreción de PTH, como calcimiméticos y/o activadores de los receptores de vitamina D (VDR).
27. Existe acuerdo sobre la efectividad de la combinación de calcimiméticos con activadores de los VDR para reducir los niveles de PTH. Sin embargo, la elección de calcimiméticos y/o activadores de los VDR está condicionada por los valores de calcio y fósforo sérico.
28. La paratiroidectomía se debe realizar cuando el nivel de PTH es superior a 1000pg/ml a pesar del tratamiento médico.
29. En todos los receptores de trasplante renal debería practicarse una radiografía lateral simple dorso-lumbar para evaluar la presencia de fractura vertebral, así como determinar la densidad mineral ósea.
30. En los trasplantados renales, la periodicidad de la determinación de PTH y calcidiol debería ser semestral.
31. A los trasplantados renales se les debe suplementar con vitamina D, al igual que al resto de la población, para mantener valores séricos normales de calcidiol.
32. El tratamiento con vitamina D activa o análogos de la vitamina D se ha mostrado eficaz para reducir la pérdida de masa ósea en el postrasplante inmediato.
33. Es aconsejable la administración continuada de dosis bajas de calcio (500mg/día) y algún tipo de vitamina D para preservar la masa ósea de los pacientes con dosis de esteroides superiores a 5mg/24h.
34. Se aconseja tratar con calcimiméticos la hipercalcemia postrasplante secundaria a hiperparatiroidismo persistente. Si tras un período de tratamiento con calcimiméticos, estos se suspenden y reaparece la hipercalcemia, la actitud más adecuada sería reiniciar el tratamiento con calcimiméticos.
35. La administración de calcimiméticos probablemente debería mantenerse en aquellos pacientes trasplantados en los que había sido necesario su uso para controlar un hiperparatiroidismo secundario severo antes del trasplante.
36. No existe ningún captor de fósforo de elección para tratar a los pacientes con trasplante renal y deterioro de la función renal que presenten hiperfosfatemia.
Afirmaciones no consensuadas
Los 18 ítems no consensuados se pueden resumir en los 9 puntos siguientes:
1. Probablemente el paciente diabético requiera un criterio diferencial en la elección del captor de fósforo, pero no está claro cuál debería ser dicho criterio.
2. Existen serias dudas respecto a si los pacientes mayores de 65 años en cualquier estadio de la enfermedad renal crónica requieren similar dosificación de calcidiol que los menores de 65 años.
3. No está claro si la administración de vitamina D nativa junto con análogos de la vitamina D activa está plenamente justificada para inhibir el FGF-23 en los estadios iniciales de la enfermedad renal crónica.
4. Tampoco lo está si en pacientes en diálisis siempre que se utilice vitamina D se debe combinar con captores de fósforo no cálcicos.
5. El grupo no logró uniformidad en el ítem de que el hiperparatiroidismo secundario debe comenzar a tratarse cuando el nivel de PTH (pg/ml) es mayor de 300.
6. No existe acuerdo respecto a que el uso de paricalcitol o de los calcimiméticos sea adecuado para el control de las calcificaciones vasculares cuando los niveles de PTH están controlados.
7. También se observa indefinición respecto a si un nivel de PTH menor de 100 en un paciente en diálisis obliga a usar un líquido de diálisis bajo en calcio.
8. Respecto a los pacientes portadores de trasplante renal, no existe uniformidad en si es adecuado el uso de calcimiméticos para controlar la hipofosfatemia postrasplante evitando la administración de fósforo oral, ni en si el paciente que recibe calcimiméticos en diálisis debería mantener el tratamiento después del trasplante renal.
9. Tampoco se observa posicionamiento sobre cuándo suspender el calcimimético en los pacientes trasplantados que lo reciben para el control de la hipercalcemia.
Discusión
En nuestro conocimiento, este es el primer estudio diseñado para evaluar la percepción de los nefrólogos, en este caso españoles, en el manejo clínico de las alteraciones del CKD-MBD. El estudio se efectuó, a través de Internet y posteriormente en reunión presencial, mediante el método Delphi modificado, que es un procedimiento fiable de consenso a distancia ya empleado en la investigación biomédica4,5 que evita las dificultades e inconvenientes de los métodos de discusión presencial: entre ellos, desplazamientos, sesgos de influencia y pérdida de confidencialidad. Las ventajas más importantes que ofrece el Delphi son la interacción controlada entre los miembros del panel, la oportunidad de reflexionar y reconsiderar la opinión propia sin perder el anonimato y la validación estadística del consenso logrado.
El Delphi se desarrolló en la década de 1950 por científicos de la Rand Corporation como un método para tomar decisiones informadas basadas en opiniones de expertos8. Desde entonces, se ha utilizado para evaluar comportamientos y toma de decisiones en diferentes sectores9-12, recientemente también en áreas de la nefrología13-19. A pesar de haber sufrido algunas modificaciones, sigue siendo un enfoque viable para la recopilación de opiniones de expertos a través de un proceso estructurado iterativo que acaba elaborando un consenso20,21.
Este proceso implica múltiples interacciones con los participantes que, por lo general, generan dos o más rondas de respuestas en un período razonable de tiempo, en nuestro caso de dos meses. Los resultados de la primera ronda de contestaciones se pueden modificar de cara a la segunda ronda e incluso es posible proponer otros ítems con base en los posibles comentarios de todos los participantes22. Además, la técnica Delphi ofrece una serie de ventajas específicas y es especialmente útil, porque evita los obstáculos comúnmente observados en otros grupos de discusión, tales como la influencia interpersonal y la presión del tiempo22-24.
Con esta técnica, los encuestados desconocen la identidad del resto de los componentes del panel y, por lo tanto, son más libres, con menos limitaciones personales y sociales21. Además, pueden completar las respuestas adaptadas a su comodidad personal y de manera asincrónica entre los diferentes participantes25. La técnica Delphi tiene la ventaja de que para su análisis estadístico se pueden emplear varias técnicas26.
En nuestro estudio se logró un elevado grado de consenso ya en la primera ronda, recogiéndose observaciones que fueron muy útiles para mejorar o modificar algunas cuestiones en la ronda. Al final del estudio se alcanzó consenso en la mayoría de los ítems planteados; de hecho, fue superior al 80%, lo cual muestra una muy buena uniformidad en el manejo de las alteraciones del CKD-MBD por parte de los nefrólogos.
Es importante recalcar que, si bien parte de los miembros del comité científico de este estudio y a la vez autores del presente artículo han participado en la elaboración de las guías de práctica clínica de la S.E.N.3 y de KDIGO2, lo que detallan en este trabajo no representa su opinión personal ni su interpretación de las 86 preguntas realizadas en la encuesta. Su papel ha sido resumir objetivamente (sin influir en el resultado final) el consenso alcanzado por los 59 nefrólogos encuestados siguiendo la metodología Delphi en relación con lo que piensan dichos nefrólogos, especialmente interesados en el tema, sobre el manejo del metabolismo óseo y mineral. Estas opiniones pueden o no coincidir con lo recomendado por las guías de práctica clínica2,3, pero tienen la utilidad de permitir conocer su grado de acuerdo, cumplimiento, aplicación e implementación en la práctica clínica. Por tanto, los puntos de acuerdo y desacuerdo representan el escenario real y son la base de los comentarios y reflexiones que se presentan a continuación en la discusión de estos resultados.
Existió acuerdo sobre la escasa utilidad de los niveles séricos de fósforo y calcio para valorar el metabolismo de ambos y sobre que a medida que se deteriora la función renal existiría una sobrecarga de fósforo y de calcio. Aun así, al menos con el fósforo, el panel consideró que no deben utilizarse captores de fósforo a no ser que los valores séricos de este se encuentren por encima de la normalidad. Esta opinión generalizada de aceptar que, a pesar de una posible sobrecarga de fósforo, no hay todavía evidencia suficiente para comenzar tratamiento con captores de fósforo (afirmaciones 1 a 3) indica una actitud de prudencia de los nefrólogos ante un tema en el que indudablemente se necesita una mayor evidencia científica antes de encaminarnos en nuevas indicaciones de los captores de fósforo.
Además, esta actitud es coherente con resultados recientes que han despertado polémica y que sugieren que, si bien en estadios de la enfermedad renal crónica 3 y 4 existiría una tendencia a la sobrecarga de fósforo, gracias a los conocidos mecanismos fosfatúricos de compensación, fundamentalmente vía FGF-23 y PTH, todavía no se daría una sobrecarga importante de fósforo, pero sí una evidente sobrecarga de calcio, por la incapacidad del riñón de regular la excreción de este último a medida que disminuye la función renal27,28. Por tanto, en estadios de la enfermedad renal crónica 3 y 4, la utilización de captores de fósforo no estaría indicada sin hiperfosforemia, menos aún si se utilizan captores que contienen calcio, dado que por evitar una teórica sobrecarga de fósforo podríamos empeorar más que mejorar la situación, sometiendo a los pacientes a una innecesaria sobrecarga de calcio28,29. En consonancia con este último concepto, destaca la importancia que se ha concedido en las respuestas de los nefrólogos a la sobrecarga de calcio, aspecto en el que hubo directa e indirectamente acuerdo y homogeneidad (afirmaciones 6 a 8 y 13 a 16) en considerarla un condicionante de morbimortalidad.
En los dos bloques relacionados con otros aspectos muy importantes del manejo del CKD-MBD, como son el uso de vitamina D nutricional, formas activas de vitamina D, calcimiméticos y cuándo habría que pasar del tratamiento médico a la paratiroidectomía, hubo en general más puntos de acuerdo que de desacuerdo, pero quedan todavía muchas lagunas por cubrir. Entre ellas, por sus implicaciones en el manejo rutinario de los pacientes, hay que destacar la falta de consenso sobre los valores de PTH que deberían usarse para iniciar tratamiento farmacológico y en si existe justificación para combinar el uso de vitamina D nativa con formas activas de vitamina D. Esta falta de acuerdo no sorprende, dado que refleja la indefinición (por falta de evidencia científica) de las recomendaciones de algunas guías de práctica clínica, como por ejemplo las K/DIGO CKD-MBD 20092.
Por el contrario, hubo un elevado grado de acuerdo en relación con en qué niveles de PTH debemos considerar que hay fracaso terapéutico y optar por la paratiroidectomía. La cifra considerada como umbral fue de 1000pg/ml. Esto coincide con lo recientemente publicado del estudio COSMOS, en el que se constató que los países mediterráneos consideran ese nivel como el más adecuado, mientras que los nórdicos recurren a la cirugía con niveles más bajos de PTH, cercanos a 700pg/ml30. Si tenemos en cuenta las recomendaciones K/DIGO CKD-MBD 2009 y los recientes resultados preliminares del COSMOS (coincidentes con los previos), presentados en la European Renal Association-European Dialysis and Transplant Association31, sobre qué valores de PTH deberían ser considerados como aceptables, una PTH sérica de 700pg/ml sería un valor bajo para indicar la paratiroidectomía.
Por último, en relación con el CKD-MBD, el trasplante renal y los calcimiméticos, hubo también puntos de acuerdo y desacuerdo. Existió consenso en que la necesidad de calcimiméticos postrasplante se relaciona con la severidad del hiperparatiroidismo pretrasplante, pero no sobre su necesidad en el manejo de la hipofosfatemia postrasplante renal.
En resumen, creemos que la información obtenida a través del consenso Delphi tiene utilidad práctica, dado que describe la situación actual del CKD-MBD en España, acercándose a lo que piensan y muy probablemente hacen los nefrólogos españoles más relacionados con el área de metabolismo óseo y mineral en el manejo habitual de los pacientes. Como se puede apreciar por las respuestas, esto no siempre coincide con lo recomendado por las guías2,3, pero ello no necesariamente representa una práctica clínica inadecuada. En algunos casos probablemente sí lo sea, pero en otros puede ser la base para replantearse algunas de las recomendaciones y, por tanto, la necesidad de revisar periódicamente las guías con objeto de mejorarlas o actualizarlas en función de las nuevas evidencias disponibles.
No obstante, hay que reconocer que el consenso alcanzado se encuadra en un escenario muy específico y, por ello, tiene varias limitaciones. Entre ellas, se ha de destacar que se circunscribe solo a nuestro país y al grupo encuestado (catalogados empíricamente a priori como expertos), por su especial interés en el tema, pero que no representan la opinión global de los nefrólogos ni de muchos otros que no han participado porque tienen una menor relación con este tema, pero que también participan en el manejo de las alteraciones del CKD-MBD.
Aceptando las limitaciones del estudio, consideramos que los ítems en los que hubo consenso refuerzan algunos conceptos del CKD-MBD con su repercusión en la práctica clínica diaria y permiten valorar el grado de homogeneidad que podríamos esperar en esta área. Como ya se ha comentado, los ítems en los que no hubo consenso nos ayudan a conocer las áreas de incertidumbre y resultan de gran utilidad para precisar en qué aspectos existe una mayor necesidad de profundización y de emprender estudios prospectivos que permitan mejorar el manejo de las alteraciones del CKD-MBD.
Agradecimientos
El equipo técnico responsable de la implementación del método y del análisis estadístico fue Luzan 5.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Addendum
Comité Científico
Jorge Cannata (Coordinador) (Hospital Central de Oviedo); Jordi Bover (Fundación Puigvert. Barcelona); Secundino Cigarrán (Hospital da Costa Burela. Lugo); Elvira Fernández (Hospital Arnau de Vilanova. Lérida); Emilio González Parra (Hospital Fundación Jiménez Díaz. Madrid); Víctor Lorenzo (Hospital Universitario de Canarias. La Laguna. Tenerife); Isabel Martínez (Hospital de Galdakao. Bilbao); Juan Navarro (Hospital La Candelaria. Tenerife); Mariano Rodríguez (Hospital Universitario Reina Sofía. Córdoba); José Vicente Torregrosa (Hospital Clínic. Barcelona).
Panel de expertos
Francisco José Ahijado Hormigos (Hospital Virgen de la Salud. Toledo); Jaume Almirall (Parc Taulí de Sabadell. Barcelona); Rafael Alonso Valente (Complejo Hospitalario Universitario de Santiago de Compostela); M.ª Luisa Amoedo Rivera (Hospital General de Elche. Alicante); Francisco José Ariza Fuentes (Centro de Diálisis Fresenius Cabra. Córdoba); Eduardo Baamonde Laborda (Centro de Diálisis Avericum. Cádiz); Guillermina Barril (Hospital de La Princesa. Madrid); Sergio Bea (Hospital La Fe. Valencia); Josep Calpe (Diaverum Rotellar. Barcelona); Antonio Crespo Navarro (Fresenius Gandía. Valencia); Alfonso Cubas (Hospital de Getafe. Madrid); Antonio de Paula (Hospital Universitario Río Hortega. Valladolid); Patricia de Sequera Ortiz (Hospital Infanta Leonor. Madrid); Rodrigo Delgado Zamora (Hospital Virgen del Rocío. Sevilla); Gloria del Peso (Hospital de La Paz. Madrid); Rafael Díaz-Tejeiro Izquierdo (Hospital Virgen de la Salud. Toledo); Amparo Fernández (Fresenius Rambla Marina. Barcelona); Adreu Foraster (Diaverum Baix Llobregat. Barcelona); Antonio Galán (Hospital General Universitario. Valencia); César García Cantón (Hospital Insular de Las Palmas); Gorka García Erauzquin (Hospital de Cruces. Bilbao); Sagrario García Rebollo (Hospital Universitario de Canarias); Remedios Garofanos López (Hospital de Torrecárdenas. Almería); José Manuel Gil Junquero (Hospital General Ciudad de Jaén); Miguel Ángel González (Hospital Clínico. Valencia); Enrique Gruss (Hospital de Alcorcón. Madrid); José Antonio Herrero Calvo (Hospital Clínico de San Carlos. Madrid); M.ª Victoria Hidalgo Barquero (Hospital de Zafra. Badajoz); Emma Huarte (Hospital San Pedro. Logroño); María Jesús Izquierdo (Complejo Asistencial Universitario de Burgos); José Lacueva (Alcer Liria. Valencia); Luz Lozano (Hospital de Fuenlabrada. Madrid); Joaquín Manrique (Complejo Hospitalario de Navarra. Pamplona); Rosario Moreno López (Hospital Militar. Zaragoza); M.ª Antonia Munar (Hospital Son Espasses. Mallorca); Agustín Ortega (Asyter. Albacete); Magdalena Palomares Bayo (Hospital Carlos Haya. Málaga); María Parallé Alcalde (CMD Montequinto. Sevilla); Jesús Pérez (Hospital Miguel Servet. Zaragoza); Miguel Pérez Fontán (Complejo Hospitalario Universitario de A Coruña); Celestino Piñera (Hospital Universitario Marqués de Valdecilla. Santander); José Luis Pizarro (Centro de Diálisis Diaverum. Málaga); Dolores Prados Garrido (Hospital San Cecilio. Granada); Mario Prieto (Hospital de León); Constantino Fernández Rivera (Complejo Hospitalario Universitario de A Coruña); Minerva Rodríguez García (Hospital Universitario Central de Asturias. Oviedo); Esther Romero Ramírez (Hospital Virgen de las Nieves. Granada); Emilio Sánchez (Hospital Universitario Central de Asturias. Oviedo); Dolores Sánchez de la Nieta García (Hospital General de Ciudad Real); Olga Sánchez García (Hospital San Pedro de Alcántara. Málaga); Ramón Saracho (Hospital Santiago Apóstol. Vitoria); Rafael Selgas (Hospital La Paz. Madrid); Jordi Soler (Fresenius Reus. Tarragona); Daniel Torán Montserrat (Hospital General de Jerez. Cádiz); Fernando Tornero Molina (Hospital de Arganda. Madrid); Martí Vallés (Hospital Josep Trueta. Gerona); Nicanor Vega Díaz (Hospital Doctor Negrín. Gran Canaria); Borja Zalduendo (Hospital Donostia. San Sebastián).
Referencias Bibliográficas
1. Mejía N, Roman-García P, Miar AB, Tavira B, Cannata-Andía JB. Chronic kidney disease-mineral and bone disorder: a complex scenario. Nefrologia 2011;31(5):514-9. [ Links ]
2. Moe SM, Drüeke TB, Block GA, Cannata-Andía JB, Elder GJ, Fukagawa M, et al. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl 2009;(113):S1-130. [ Links ]
3. Torregrosa JV, Bover J, Cannata Andía J, Lorenzo V, de Francisco AL, Martínez, et al. Spanish Society of Nephrology recommendations for controlling mineral and bone disorder in chronic kidney disease patients (S.E.N.-M.B.D.).Nefrologia 2011;31 Suppl 1:3-32. [ Links ]
4. Dalkey NC. The Delphi Method: an experimental study of group opinion. Santa Monica (California): Rand Corporation; 1969. Publication no RM-59999 PR. [ Links ]
5. Dalkey N, Brown B, Cochran S. The Delphi Method, III: use of self ratings to improve group estimates. Santa Monica (California): Rand Corporation; 1969. Publication no RM-6115-PR. [ Links ]
6. Likert R. A technique for the measurement of attitudes. Archives of Psychology 1932;140:1-55. [ Links ]
7. Carifio J, Perla R. Resolving the 50-year debate around using and misusing Likert scales. Med Educ 2008;42:1150-2. [ Links ]
8. Cornish E. The study of the future: an introduction to the art and science of understanding and shaping tomorrow's world. Maryland: World Future Society; 1977. [ Links ]
9. Kelly CM, Jorm AF, Kitchener BA. Development of mental health first aid guidelines on how a member of the public can support a person affected by a traumatic event: a Delphi study. BMC Psychiatry 2010;10:49. [ Links ]
10. Tran D, Hall LM, Davis A, Landry MD, Burnett D, Berg K, et al. Identification of recruitment and retention strategies for rehabilitation professionals in Ontario, Canada: results from expert panels. BMC Health Serv Res 2008;8:249-52. [ Links ]
11. Vandelanotte C, Dwyer T, Van Itallie A, Hanley C, Mummery WK. The development of an internet-based outpatient cardiac rehabilitation intervention: a Delphi study. BMC Cardiovasc Disord 2010;10:27-31. [ Links ]
12. van Stralen MM, Lechner L, Mudde AN, de Vries H, Bolman C. Determinants of awareness, initiation and maintenance of physical activity among the over-fifties: a Delphi study. Health Educ Res 2010;25(2):233-47. [ Links ]
13. Lavergne V, Nolin TD, Hoffman RS, Roberts D, Gosselin S, Goldfarb DS, et al. The EXTRIP (EXtracorporeal TReatments In Poisoning) workgroup: guideline methodology. Clin Toxicol (Phila) 2012;50(5):403-13. [ Links ]
14. Lindberg M, Lundström-Landegren K, Johansson P, Lidén S, Holm U. Competencies for practice in renal care: a national Delphi study. J Ren Care 2012;38(2):69-75. [ Links ]
15. Cantú Quintanilla G, Reyes A, Romero Navarro B, Luque Coqui M, Rodríguez Ortega G, Reyes R, et al. Usefulness of the Delphy method for reaching consensus in the allocation of deceased donor kidneys in six Mexican hospital. Cuad Bioet 2010;21(73):359-74. [ Links ]
16. Himmelfarb J, Joannidis M, Molitoris B, Schietz M, Okusa MD, Warnock D, et al. Evaluation and initial management of acute kidney injury. Clin J Am Soc Nephrol 2008;3(4):962-7. [ Links ]
17. Gibney N, Hoste E, Burdmann EA, Bunchman T, Kher V, Viswanathan R, et al. Timing of initiation and discontinuation of renal replacement therapy in AKI: unanswered key questions. Clin J Am Soc Nephrol 2008;3(3):876-80. [ Links ]
18. Murray PT, Devarajan P, Levey AS, Eckardt KU, Bonventre JV, Lombardi R, et al. A framework and key research questions in AKI diagnosis and staging in different environments. Clin J Am Soc Nephrol 2008;3(3):864-8. [ Links ]
19. Davenport A, Bouman C, Kirpalani A, Skippen P, Tolwani A, Mehta RL, et al. Delivery of renal replacement therapy in acute kidney injury: what are the key issues? Clin J Am Soc Nephrol 2008;3(3):869-75. [ Links ]
20. Gupta UG, Clarke RE. Theory and applications of the Delphi technique: A bibliography (1975-1994). Technological Forecasting and Social Change 1996;53(2):185-211. [ Links ]
21. de Villiers MR, de Villiers PJ, Kent AP. The Delphi technique in health sciences education research. Med Teach 2005;27(7):639-43. [ Links ]
22. Hsu C-C, Sandford BA. The Delphi technique: making sense of consensus. Practical Asessment Research & Evaluation. 2007. Available at: http://pareonline.net/getvn.asp?v=12&n=10. [ Links ]
23. Hasson F, Keeney S, McKenna H. Research guidelines for the Delphi survey technique. J Adv Nurs 2000;32(4):1008-15. [ Links ]
24. Dalkey NC, Rourke DL. Experimental assessment of Delphi procedures with group value judgments. In: Dalkey NC, Rourke DL, Lewis R, Snyder D, editors. Studies in the quality of life: Delphi and decision-making. Lexington, MA: Lexington Books; 1972. pp. 55-83. [ Links ]
25. Bowles KH, Holmes JH, Naylor MD, Liberatore M, Nydick R. Biomedical and Health Informatics: From Foundations to Applications: 2003; Washington, DC. AMIA 2003 Symposium Proceedings; 2003. Expert Consensus for Discharge Referral Decisions Using Online Delphi. pp. 106-9. [ Links ]
26. Linstone HA, Turoff M. In: Linstone HA, Turoff M, editors. The Delphi method, techniques and applications. 2002. Available at: http://www.is.njit.edu/pubs/delphibook/. [ Links ]
27. Langman CB, Cannata-Andía JB. Calcium in chronic kidney disease: Myths and realities. Clin J Am Soc Nephrol 2010;5:S1-2. [ Links ]
28. Hill KM, Martin BR, Wastney ME, McCabe GP, Moe SM, Weaver CM, et al. Oral calcium carbonate affects calcium but not phosphorus balance in stage 3-4 chronic kidney disease. Kidney Int 2013;83:959-66. [ Links ]
29. Block GA, Wheeler DC, Persky MS, Kestenbaum B, Ketteler M, Spiegel DM, et al. Effects of phosphate binders in moderate CKD. J Am Soc Nephrol 2012;23(8):1407-15. [ Links ]
30. Fernandez-Martin JL, Carrero JJ, Benedik M, Bos WJ, Covic A, Ferreira A, et al. COSMOS: the dialysis scenario of CKD-MBD in Europe. Nephrol Dial Transplant 2013;28:1922-35. [ Links ]
31. Fernández-Martín JL, Locatelli F, London G, Gorriz JL, Floege J, Ferreira A, et al.; on behalf of COSMOS. Cosmos: abnormalities in the main bone and mineral biochemical parameters are associated with higher risk of mortality. Nephrol Dial Transplant 2013;28 Suppl 1 (abstract). [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Jorge Cannata-Andía,
Servicio de Metabolismo Óseo y Mineral,
Hospital Universitario Central de Asturias,
C/ Julián Clavería, s/n, 33006, Oviedo
E-mail: cannata@hca.es
E-mail: vtorre@clinic.ub.es
Enviado a Revisar: 19 Sep. 2013
Aceptado el: 21 Ene. 2014














