Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.31 supl.3 Pamplona 2008
Diabetic retinopathy
D. Aliseda, L. Berástegui
Servicio de Oftalmología. Hospital de Navarra.
Dirección para correspondencia
RESUMEN
La diabetes mellitus es una patología metabólica que en su evolución afecta a diferentes órganos, entre ellos los ojos. La microangiopatía diabética afecta de manera precoz y específica a la retina. La aparición de la retinopatía está directamente relacionada con el tiempo de evolución de la enfermedad y del control metabólico. La microangiopatía diabética en la retina muestra alteraciones específicas como son los microaneurismas, los exudados duros o blandos, las microhemorragias intrarretinianas, dilataciones venosas arrosariadas y anomalías microvasculares intrarretinianas. Estas alteraciones en la microcirculación retiniana causan dos fenómenos fisiopatológicos: cierre capilar con la consiguiente isquemia o extravasación del contenido intravascular al estroma provocando edema. En este capítulo se exponen la clasificación y tratamientos de la retinopatía diabética, excluyendo el edema macular, según los diferentes estudios multicéntricos presentes en la bibliografía actual.
Palabras clave: Diabetes mellitus. Retinopatía diabética. Factores de riesgo. Láser. Vitrectomía.
ABSTRACT
Diabetes mellitus is a metabolic pathology whose evolution affects different organs, amongst them the eye. Diabetic microangiopathy affects the retina in an early and specific way. The appearance of retinopathy is directly related to the time of evolution of the disease and metabolic control. Diabetic microangiopathy in the retina shows specific alterations such as micro-aneurysms, soft or hard exudates, intra-retinal micro-haemorrhages, beaded veins and intraretinal microvascular anomalies. These alterations in the retinal microcirculation cause two physiopathological phenomena: capillary closure with the resulting ischaemia or extravasation of intravascular content to the stroma causing edema. In this chapter we set out the classification and treatments of diabetic retinopathy, excluding macular edema, according to the different multicentric studies present in the current bibliography.
Key words: Diabetes mellitus. Diabetic retinopathy. Risk factors. Laser. Vitrectomy.
Epidemiología
La diabetes mellitus (DM) es un trastorno plurimetabólico frecuente en humanos. El principal trastorno metabólico que se produce es el aumento de la concentración de glucosa en sangre. Esta hiperglucemia mantenida en el tiempo es la responsable del desarrollo de complicaciones microvasculares de la enfermedad, de las que la retinopatía diabética es una de ellas.
La prevalencia de DM en el mundo occidental es alta y se ha visto aumentada en las últimas décadas. Se estima en un 5% en nuestro medio, si bien podemos encontrar diferencias que van del 1,5% al 7 % según diferentes áreas geográficas y etnias1. Este aumento observado podría tener diferentes motivos entre los que están: el aumento de la obesidad, el incremento en la ingesta de azúcares refinados, el diagnóstico más preciso y precoz del trastorno metabólico glucémico, el aumento de la expectativa de vida de la población general y del paciente diabético.
La retinopatía diabética (RD) es la principal causa de pérdida visual no recuperable en los países industrializados en pacientes entre los 20 y 64 años de edad, siendo responsable de un 10% de nuevos casos de ceguera cada año. El riesgo de ceguera en pacientes diabéticos seria aproximadamente 25 veces mayor al resto de la población.
La prevalencia de retinopatía diabética ha sido objeto de múltiples estudios1-5. Como resumen podríamos afirmar que en nuestro medio la prevalencia de retinopatía diabética en los pacientes diabéticos adultos es del 20 al 25%, mientras que la prevalencia en los pacientes juveniles es del 50 al 65%3. La prevalencia de RD al diagnóstico de DM sería del 6 al 10%. Y en un seguimiento de 15 años la severidad sería de 26% retinopatía no proliferante leve, un 10% de grado moderado a severo y un 11% retinopatía proliferante3,4.
Igualmente existen múltiples estudios clínicos que han intentado aclarar los factores de riesgo para la presentación y progresión de la retinopatía diabética. Por ser éste un punto de especial interés para todos los clínicos que intervienen en la prevención y tratamiento de la retinopatía diabética haremos una revisión de las conclusiones de algunos de ellos.
The Wisconsin Epidemiology Study of Diabetic Retinopathy3-15 es un estudio epidemiológico con un seguimiento a 4, 10 y 14 años que ha permitido conocer la historia natural de la RD y su relación con diferentes factores sistémicos. Sus principales hallazgos son: el evidenciar que la RD severa es muy rara en los cinco primeros años de diagnóstico, que el riesgo de progresión de la RD a una forma severa aumenta con la duración de la enfermedad y que los pacientes con cifras alta de HbA1c o con microalbuminuria tienen un riesgo tres veces mayor de presentar RD a corto plazo.
The United Kingdom Prospective Diabetes Study2,16,17 es un estudio de cohortes de pacientes con DM tipo 2, en los que evalúan el beneficio del tratamiento optimizado con insulina sobre la aparición de complicaciones microvasculares no sólo a nivel ocular sino también sobre la nefropatía, la neuropatía y la enfermedad cardiovascular. Sus principales hallazgos fueron el observar cómo el control optimizado de la glucemia (HbA1c < 7%) se traducía en una disminución del riesgo de progresión de la RD, de la necesidad de fotocoagulación láser, de hemorragia vítrea y de cirugía de catarata. También demostró que el control de la HTA y la hiperlipemia hacía disminuir la aparición y progresión del edema macular.
The Diabetes Control and Complications Trial5,18-25 es un estudio prospectivo randomizado sobre dos cohortes de pacientes diabéticos tipo 1, una sin RD y otra con RD leve-moderada, en los que se estudia el efecto de la terapia intensiva con insulina sobre la aparición de RD y la progresión de la RD en el otro grupo. Sus principales conclusiones son: el tratamiento optimizado con insulina es beneficioso con cualquier tiempo o grado de evolución de la enfermedad, si bien su beneficio es mayor cuanto antes se instaura, la terapia intensiva disminuye significativamente la incidencia de nuevos casos de RD y la progresión de la RD a forma severas y proliferantes, así como de edema macular.
De manera general podemos decir que los principales factores de riesgo para la aparición y evolución de la RD serían:
El tiempo de evolución de la diabetes y el tipo de diabetes. De forma que el 98% de los diabéticos tipo 1 y el 60% de los tipo 2 sufre RD en algunos de sus grados después de 20 años de evolución de su enfermedad.
El deficiente control glucémico, habiéndose demostrado que el tratamiento optimizado de las cifra de Hba1c retrasa la aparición y progresión de la RD en ambos tipos de DM.
El control de la hipertensión arterial, hiperlipemia y de la anemia asociadas a la diabetes disminuyen la aparición y progresión de la RD en especial en su forma de edema macular.
Existen cambios hormonales asociados la pubertad y al embarazo que pueden acelerar la aparición de la RD.
Se puede considerar que existen factores genéticos investigados y relacionados con el desarrollo y progresión de la RD. Así los pacientes con HLA-DR4 tiene una mayor prevalencia de retinopatía proliferante.
La aparición de microalbuminuria como marcador de enfermedad microvascular aumenta la probabilidad de desarrollar RD.
Desde el punto de vista ocular existen algunos factores que pueden ser considerados de riesgo para el desarrollo y progresión de RD como son la hipertensión ocular, el antecedente de oclusión venosa de rama retiniana, la presencia de inflamación ocular, traumatismos oculares y el tratamiento con radioterapia. De igual manera existirían factores locales que protegerían frente al desarrollo de la RD, como la miopía, la atrofia del epitelio pigmentado retiniano o el desprendimiento vítreo posterior.
Otro aspecto importante es considerar la retinopatía diabética como un marcador del estado general del paciente diabético. La presencia de una retinopatía diabética proliferante indica que el paciente tiene un mayor riesgo cardiovascular, con una tasa aumentada de infarto agudo de miocardio, de amputación y de muerte. Así de manera orientativa se estima que el riesgo de muerte a los 5 años en el paciente diabético se puede asociar a la severidad de la RD; si no tiene RD su riesgo será del 4%, si tiene microaneurismas será del 10%, si presenta hemorragias y exudados será del 59% y si lo que presenta es una retinopatía proliferante será del 68%.
Clasificación de la retinopatía diabética
A nivel fisiopatológico, la hiperglucemia mantenida induce una serie de cambios bioquímicos en el metabolismo glucídico, reológicos en el flujo sanguíneo, y anatómicos en la pared vascular que serían los responsables de la aparición de una microangiopatía a nivel de las arteriolas, capilares y vénulas. Esta microangiopatía se traduce en un aumento de la permeabilidad de los vasos con extravasación del contenido intravascular al espacio retiniano, con formación de exudados y edema intrarretiniano, con especial afectación clínica de la visión cuando se presenta en la mácula. La alteración de la pared vascular altera el flujo sanguíneo y por tanto la perfusión del tejido retiniano tan sensible a la isquemia. Ésta, activa la cascada proangiogénica, con la formación de neovasos, que clínicamente producirán la retinopatía proliferante con hemorragias y tracciones sobre la retina.
En la práctica clínica es necesaria un clasificación de la severidad de la RD, que sea fácilmente memorizable, realizable e interpretable por oftalmólogos y por todos los demás clínicos que han de tratar pacientes diabéticos. En el tiempo han sido varias las aproximaciones a este tema taxonómico; obviaremos hablar de anteriores clasificaciones para evitar confusiones. En la actualidad existe una clasificación elaborada por un grupo multidisciplinar, el Global Diabetic Retinopathy Project Group (GDRPG), cuya publicación en 2003 por la Academia Americana de Oftalmología28 se ha convertido en el estándar de trabajo para una práctica clínica de calidad. Esta clasificación está basada en el trabajo realizado por Early Treatment Diabetic Retinopathy Study (EDTRS)29,30, que sería el estándar en investigación, por lo que podríamos encontrar publicaciones que trabajan con esta clasificación. Por su complejidad no es efectiva para la práctica clínica y sus resultados son fácilmente traducibles a la actual clasificación en uso.
La clasificación actual de la retinopatía diabética evalúa de manera separada el edema macular y la retinopatía diabética del polo posterior, lo cual hace que sean abordadas en diferentes capítulos en esta monografía.
La severidad de la retinopatía diabética será estudiada en 5 niveles perfectamente definidos por la simple observación oftalmoscópica del fondo de ojo:
Sin retinopatía aparente
No se observan lesiones características al examen oftalmoscópico (nivel 10 de la EDTRS).
Retinopatía no proliferante leve
Sólo se encuentran microaneurisma retinianos, como primera alteración apreciable oftalmoscópicamente de RD. Los microaneurismas son dilataciones de la pared de los capilares y aparecen como puntos rojos pequeños de bordes muy nítidos (nivel 20 de la EDTRS).
Retinopatía diabética no proliferante moderada
Aparecen hemorragias retinianas en número inferior a 20 en los cuatro cuadrantes. Pueden existir exudados duros o lipídicos y blandos o algodonosos (Fig. 1) y además dilataciones venosas arrosariadas en un solo cuadrante. Las dilataciones venosas consisten en zonas bien localizadas de dilatación con zonas de estrechez venosa, como cuentas de un rosario. El trayecto venoso se vuelve tortuoso y en ocasiones parece bifurcado (niveles 35 y 43 con probabilidad de progresión a RD proliferante de 5,4 al 11,9% en un año) (La presencia de tortuosidades aumenta el riesgo al 26,3%, nivel 47).
Existe consenso en que dada la baja incidencia de RD proliferante a un año, la fotocoagulación con láser no está indicada a este nivel. Se debe optimizar control metabólico, hipertensivo y lipídico. Los exudados duros son depósitos lipídicos intrarretinianos profundos de color amarillento brillante y bien definidos. En ocasiones aparecen formando un anillo en torno a un foco de microangiopatía diabética con microaneurismas y capilares incompetentes. Los exudados blandos o algodonosos son engrosamientos isquémicos de la capa de fibras nerviosas, de forma más redondeada de bordes más difusos y color blanco, tapan los vasos retinianos.
Retinopatía diabética no proliferante severa
Pueden presentarse cualquiera de las siguientes alteraciones: hemorragias intrarretinianas severas en número superior a 20 en cada uno de los cuatro cuadrantes (Fig. 2), o dilataciones venosas arrosariadas en 2 ó más cuadrantes, o anomalías microvasculares intrarretinianas (IRMA) bien definidas en un cuadrante. Sería la regla 4:2:1. Los IRMA son vasos finos tortuosos anormales anejos a la arquitectura vascular retiniana, a veces pueden ser difíciles de identificar en la exploración oftalmoscópica directa. El riesgo de progresión a RD proliferante es del 50,2% en un año. Y de RD proliferante de alto riesgo 14,6%, si se dan la regla completa este riesgo será del 45% en un año. En este nivel y en consideración al riesgo de pérdida visual severa se debe tratar con panfotocoagulación en pacientes con mal control metabólico, afectación más severa en el ojo contralateral, aquellos en los que no se tenga certeza de cumplir con los controles programados o si existe catarata en progresión.
Retinopatía diabética proliferante
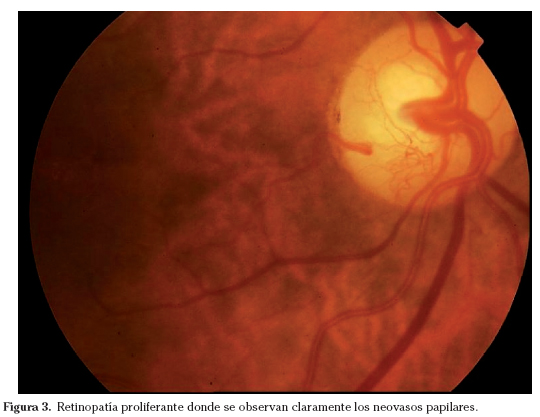
Incluye toda neovascularización retiniana o papilar (Fig. 3) bien definida y/o hemorragia vítrea o prerretiniana extensa. (Incluye los niveles 61 y 65 como formas leves o moderadas de neovascularización, y el 71 a 85 como formas de alto riesgo y avanzadas con proliferación fibrovascular (Fig. 4) y desprendimiento de retina traccional). En este nivel de severidad la fotocoagulación láser (Fig. 5) será necesaria para controlar la evolución, en el caso de neovasos en el disco extensos o hemorragia vítrea y será necesaria de manera inmediata. En las formas avanzadas será necesaria la vitrectomía en combinación con láser intraocular.
Tratamiento médico
El mejor tratamiento para la retinopatía diabética es la prevención. Un control adecuado de los niveles de glucosa en sangre y de la hipertensión, una dieta sana, hacer ejercicio y buena educación sanitaria del paciente diabético son los elementos esenciales que pueden prevenir o demorar la aparición de la retinopatía diabética. Los estudios DCCT5,18-27 y UKPDS2,16,1 realizados en pacientes diabéticos tipo 1 y 2 han demostrado claramente la importancia del control glicémico bajo tratamientos intensivos en la prevención y estabilización de la retinopatía diabética. El seguimiento de la glicemia ha de realizarse en base a los niveles de HbA1c por ser un parámetro de la glucemia media en las 4-6 últimas semanas.
Desde el punto de vista oftalmológico, la prevención secundaria se basará en una detección precoz de la retinopatía y un adecuado seguimiento. La pauta de revisiones del fondo de ojo ha de ajustarse a las necesidades reales de los pacientes, pero como norma debería realizarse una exploración completa oftalmológica al diagnóstico. En los diabéticos tipo 1 la norma será una revisión anual. Por el contrario, en los pacientes tipo 2 en los que se realice control sin medicación, podría posponerse el siguiente examen hasta 5 años, dada la baja probabilidad de desarrollar la retinopatía en fases tan iniciales de la enfermedad. Cuando se realice tratamiento médico, y en especial si es con insulina, las revisiones oftalmoscópicas se realizarán anualmente. Cuando exista una retinopatía no proliferante leve o moderada se puede mantener la pauta de revisiones anuales, pero tomando conciencia el paciente de que un óptimo control metabólico puede estabilizar la retinopatía o incluso provocar una reversión de la misma. Cuando la severidad es mayor se reforzará la idea de que un control estricto con terapia intensiva con insulina puede frenar una mala evolución de la retinopatía, si bien se planteará ya el tratamiento con láser.
La fotocoagulación láser es hoy en día el estándar de tratamiento de la retinopatía diabética. Existen dos ensayos clínicos prospectivos, multicéntricos y aleatorizados que avalan la eficacia de la fotocoagulación en el tratamiento de la retinopatía diabética y del edema macular diabético. Si bien hoy en día existen nuevas posibilidades terapéuticas que, solas o combinadas a la fotocoagulación, parecen abrir nuevas perspectivas en el tratamiento de la RD.
El Diabetic Retinopathy Study (DRS)31-37 es un estudio clínico prospectivo, multicéntrico respaldado por el National Eye Institute, diseñado para descubrir si la panfotocoagulación láser previene la pérdida de agudeza visual severa en RDNP en ambos ojos o RDP en al menos un ojo con visión superior a 20/100. La panfotocoagulación se aplicó en un solo ojo de manera aleatoria, siendo el contralateral el ojo control. A los 24 meses se evidenció una pérdida severa de visión en el 16,3% de los ojos no tratados frente al 6,4% de los ojos tratados, con una diferencia relativa del 61%. El DRS identificó unas características que denotaban un alto riesgo de progresión para pérdida visual severa:
Neovascularización del disco (NVD) que incluya 1/3 ó más del área del disco.
Neovascularización del disco asociado a hemorragia vítrea o prerretiniana
Neovascularización fuera del disco (NVE) de por lo menos la mitad del área del disco asociada a hemorragia vítrea.
El estudio concluyó que en caso de alto riesgo la panfotocoagulación debería hacerse de manera inmediata, pero en caso de no existir estas características no se determinó cuándo era el mejor momento para realizar la fotocoagulación.
El Early Treatment Diabetic Retinopathy Study30,38-40 fue diseñado para responder a esta cuestión de determinar el momento más adecuado para realizar el tratamiento láser en la evolución de la RD y para evaluar la eficacia del tratamiento láser en el edema macular diabético. Se realizó un estudio clínico prospectivo, multicéntrico, aleatorizado, en que se realizaba tratamiento en un ojo con RDNP moderada a severa y RDP sin signos de alto riesgo de manera temprana comparando con el otro ojo que se trató de forma diferida cuando presentaba algún signo de alto riesgo. La diferencia a los 5 años de pérdida visual severa fue del 2,6% de los ojos tratados tempranamente frente al 3,7% en el grupo tratado de manera diferida. La diferencia fue significativa, pero también se vieron efectos adversos en estos pacientes tratados tempranamente, como pérdidas de campo visual, progresión de catarata, aumento de la incidencia de edema macular, lo que llevó a dar la recomendación de no tratar las formas no proliferantes moderadas y tratar tempranamente las formas RDNP severas y las RDP en DM tipo 2 de manera individualizada según control metabólico y accesibilidad a las revisiones y tratamiento láser.
Cuando una retinopatía diabética proliferante presenta hemorragia vítrea que impide el tratamiento láser se valorará la realización de una vitrectomía con endofotocoagulación láser. Cuando la retinopatía proliferante sea severa con proliferación fibrovascular que traccione la retina y/o la mácula, la panfotocoagulación parece aumentar la contracción de la proliferación y por tanto la afectación macular, por lo que parece estar indicada la vitrectomía con pelado de las membranas (Fig. 6) con posterior endofotocoagulación.
El Diabetic Retinopathy Vitrectomy Study 40-44 fue un estudio aleatorizado, realizado sobre pacientes con hemorragia vítrea severa o neovascularización muy grave. Su objetivo fue demostrar los beneficios y riesgos de la vitrectomía en estos pacientes. Básicamente se realizaron tres grupos de pacientes: Grupo N (pacientes con retinopatía proliferante muy grave), grupo NR (pacientes con retinopatía proliferante grave con visión útil) y grupo H (pacientes con hemorragia vítrea grave de más de 5 meses de evolución). Los resultados demostraron que en los pacientes con hemorragia vítrea severa la probabilidad de lograr una buena visión era menor en el tratamiento convencional (vitrectomía demorada más de un año, o hasta que se produjera desprendimiento traccional). Los resultados eran especialmente significativos en los pacientes tipo I en los que la probabilidad de mantener visiones superiores a 0,5 a los dos años era del 36% con vitrectomía precoz frente al 12% de los tratados convencionalmente. En los pacientes con retinopatía proliferante grave con agudeza visual superior a 0,05, con mácula aplicada y proliferación extensa y activa, la probabilidad de mantener visiones útiles era mayor que en el grupo de vitrectomías tempranas45, especialmente en los pacientes tipo I en los que a los 5 años la visión podía ser de 0,5 a superior en el 50% frente al 12% de los tratados convencionalmente. Durante el estudio existieron pacientes con complicaciones severas como ptisis bulbi, endoftalmitis, glaucoma neovascular, uveítis, y queratopatías en ambos grupos.
Bibliografía
1. The Beaver Dam Eye Study. Retinopathy in adults with newly discovered and previously diagnosed diabetes mellitus. Ophthalmology 1992; 99: 58-62. [ Links ]
2. UK Prospective Diabetes Study (UKPDS). VIII. Study design, progress and performance. Diabetologia 1991; 34: 877-890. [ Links ]
3. The Wisconsin epidemiologic study of diabetic retinopathy. II. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol 1984; 102: 520-526. [ Links ]
4. The Wisconsin epidemiologic study of diabetic retinopathy. III. Prevalence and risk of diabetic retinopathy when age at diagnosis is 30 or more years. Arch Ophthalmol 1984; 102: 527-532. [ Links ]
5. A comparison of the study populations in the Diabetes Control and Complications Trial and the Wisconsin Epidemiologic Study of Diabetic Retinopathy. Arch Intern Med 1995; 155: 745-754. [ Links ]
6. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. VI. Retinal photocoagulation. Ophthalmology 1987; 94: 747-753. [ Links ]
7. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. VII. Diabetic nonproliferative retinal lesions. Ophthalmology 1987; 94: 1389-1400. [ Links ]
8. The Wisconsin Epidemiologic Study of Diabetic Retinopathy IX Four years incidence and progression of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol 1989; 107: 237-243. [ Links ]
9. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. X. Four-year incidence and progression of diabetic retinopathy when age at diagnosis is 30 years or more. Arch Ophthalmol 1989; 107: 244-249. [ Links ]
10. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. XIII. Relationship of serum cholesterol to retinopathy and hard exudate. Ophthalmology 1991; 98: 1261-1265. [ Links ]
11. The association of microalbuminuria with diabetic retinopathy. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. Ophthalmology 1993; 100: 862-867. [ Links ]
12. Incidence of cataract surgery in the Wisconsin Epidemiologic Study of Diabetic Retinopathy. Am J Ophthalmol 1995; 119: 295-300. [ Links ]
13. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. XV. The long-term incidence of macular edema. Ophthalmology 1995; 102: 7-16. [ Links ]
14. The Wisconsin Epidemiologic Study of diabetic retinopathy. XIV. Ten-year incidence and progression of diabetic retinopathy. Arch Ophthalmol 1994; 112: 1217-1228. [ Links ]
15. The Wisconsin Epidemiologic Study of Diabetic Retinopathy: XVII. The 14-year incidence and progression of diabetic retinopathy and associated risk factors in type 1 diabetes. Ophthalmology. 1998; 105: 1801-1815. [ Links ]
16. UK Prospective Diabetes Study Group. Intensive blood-glucose control with silphonyureas and insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes. Lancet 1998; 352: 837-853. [ Links ]
17. UK Prospective Diabetes Study Group. Tight blood pressure control and risks of macrovascular and microvascular complications in type 2 diabetes. BJM 1998; 317: 708-713. [ Links ]
18. The Diabetes Control and Complications Trial (DCCT). Design and methodologic considerations for the feasibility phase. The DCCT Research Group. Diabetes 1986; 35: 530-545. [ Links ]
19. Lipid and lipoprotein levels in patients with IDDM diabetes control and complication. Trial experience. The DCCT Research Group. Diabetes Care 1992; 15: 886-894. [ Links ]
20. Effect of intensive therapy on the development and progression of diabetic nephropathy in the Diabetes Control and Complications Trial. The Diabetes Control and Complications (DCCT) Research Group. Kidney Int 1995; 47: 1703-1720. [ Links ]
21. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993; 329: 977-986. [ Links ]
22. Progression of retinopathy with intensive versus conventional treatment in the Diabetes Control and Complications Trial. Diabetes Control and Complications Trial Research Group. Ophthalmology 1995; 102: 647-661. [ Links ]
23. The effect of intensive diabetes treatment on the progression of diabetic retinopathy in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial. Arch Ophthalmol 1995; 113: 36-51. [ Links ]
24. Retinopathy and nephropathy in patients with type 1 diabetes four years after a trial of intensive therapy. The Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group. N Engl J Med 2000; 342: 381-389. [ Links ]
25. Early worsening of diabetic retinopathy in the Diabetes Control and Complications Trial. Arch Ophthalmol 1998; 116: 874-886. [ Links ]
26. The relationship of glycemic exposure (HbA1c) to the risk of development and progression of retinopathy in the diabetes control and complications trial. Diabetes 1995; 44: 968-983. [ Links ]
27. Epidemiology of Diabetes Interventions and Complications (EDIC). Design, implementation, and preliminary results of a long-term follow-up of the Diabetes Control and Complications Trial cohort. Diabetes Care 1999; 22: 99-111. [ Links ]
28. Wilkinson CP, Ferris FL 3rd, Klein RE, Lee PP, Agardh CD, Davis M et al. Global Diabetic Retinopathy Project Group. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales. Ophthalmology 2003; 110: 1677-1682. [ Links ]
29. Early treatment for Diabetic Retinopathy Study Research Group. Granding diabetic retinopathy from stereoscopic color fundus photographs-An extension of the modified Airlie House Classification. ETDRS report nº 10. Ophthalmol 1991; 98: 786-806. [ Links ]
30. Early treatment for Diabetic Retinopathy Study Research Group. Early treatment diabetic retinopathy design and baseline characteristics. ETDRS report nº 7. Ophthalmology 98: 741-756. [ Links ]
31. Diabetic Retinopathy Study Research Group: Preliminary report on effects of photocoagulation therapy. Am J Ophthalmol 1976; 81: 383-396. [ Links ]
32. Diabetic Retinopathy Study Research Group: Photocoagulation treatment of proliferative diabetic retinopathy: the second report of diabetic retinopathy findings. Ophthalmol 1978; 85: 82-106. [ Links ]
33. Diabetic Retinopathy Study Research Group: Photocoagulation treatment of proliferative diabetic retinopathy: relationship of adverse treatment effects to retinopathy severity: diabetic retinopathy study report nº 5. Dev Ophthalmol 1981; 2: 248-261. [ Links ]
34. Diabetic Retinopathy Study Research Group: Report 6: Desing, methods and baseline results. Invest Ophthalmol Vis Sci 1981; 21: 149-210. [ Links ]
35. Diabetic Retinopathy Study Research Group: A modification of the Arlie House classification of diabetic retinopathy, DRS report nº 7. Invest Ophthalmol Vis Sci 1981; 21: 210-226. [ Links ]
36. Diabetic Retinopathy Study Research Group: Photocoagulation treatment of proliferative diabetic retinopathy: Clinical application of diabetic retinopathy study (DRS) findings. DRS report number 8. Ophthalmol 1981: 88: 583-600. [ Links ]
37. Diabetic Retinopathy Study Research Group: Indications for photocoagulation treatment of diabetic retinopathy: diabetic retinopathy study report nº 14. Int Ophthalmol Clin 1987; 27: 239-253. [ Links ]
38. Early treatment for Diabetic Retinopathy Study Research Group. Techniques for scatter and local photocoagulation treatment of diabetic retinopathy: ETDRS report nº3. Int Ophthalmol Clin 1987; 27: 254-264. [ Links ]
39. Early treatment for Diabetic Retinopathy Study Research Group. Early photocoagulation for diabetic retinopathy. ETDRS report nº 9. Ophthalmol 1991; 98: 785-787. [ Links ]
40. Two-year course of visual acuity in severe proliferative diabetic retinopathy with conventional management. Diabetic Retinopathy Vitrectomy Study (DRVS) report 1. Ophthalmology 1985; 92: 492-502. [ Links ]
41. Diabetic Retinopathy Vitrectomy Study Research Group. Early vitrectomy for severe vitreous hemorrhage in diabetic retinopathy. Two-year results of a randomized trial. Diabetic Retinopathy Vitrectomy Study report 2. The Arch Ophthalmol 1985; 103: 1644-1652. [ Links ]
42. Diabetic Retinopathy Vitrectomy Study Research Group. Early vitrectomy for severe proliferative diabetic retinopathy in eyes with useful vision. Clinical application of results of a randomized trial-Diabetic Retinopathy Vitrectomy Study Report 4. Ophthalmology 1988; 95: 1321-1334. [ Links ]
43. Dibetic Retinopathy Vitrectomy Study Research Group. Early vitrectomy for severe proliferative diabetic retinopathy in eyes with usefull vision: Results of a randomized trial. Diabetic Retinopathy Study report nº 3. Ophthalmology 1988; 95: 1307-1320. [ Links ]
44. Dibetic Retinopathy Vitrectomy Study Research Group. Early vitrectomy for severe hemorrhage in diabetic retinopathy: four year results of a randomized trial. Diabetic Retinopathy Study report nº 5. Arch Ophthalmol 1990; 108: 958-964. [ Links ]
45. The Early Treatment Diabetic Retinopathy Study Research Group. Pars plana vitrectomy in the Early Treatment Diabetic Retinopathy Study. ETDRS report number 17. Ophthalmology 1992; 99: 1351-1357. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Daniel Aliseda Pérez de Madrid
Servicio de Oftalmología
Hospital de Navarra
Irunlarrea, 3
31008 Pamplona
E-mail: dalisedp@navarra.es