INTRODUCCIÓN
Un aneurisma aórtico es una dilatación, por debilidad o degeneración de su pared, con un diámetro transversal máximo de ≥ 50 % del diámetro normal (1).
Los aneurismas de la aorta torácica (AAT) son poco frecuentes (20 % de los aneurismas de la aorta). La localización más frecuente es la aorta ascendente (40 %), seguida de la descendente (35 %), el arco aórtico (15 %) y la abdominotorácica (10 %). El 10-15 % de los AAT se asocian a un aneurisma de la aorta abdominal (AAA) (2).
La incidencia de los ATT se estima en 6-10 casos/100 000 habitantes al año, incrementada actualmente por el envejecimiento de la población y por la mayor utilización de pruebas de imagen. Afecta 2-4 veces más a hombres y se presenta en ambos sexos entre la sexta y la séptima década de la vida (1,2).
La etiología más frecuente de los AAT es la arterioesclerosis (80 %). El resto de causas son: anastomóticas, infecciosas (sífilis terciaria), inflamatorias no infecciosas (arteritis de Takayasu), traumáticas, disecciones crónicas, conectivopatías (síndromes de Marfan, Ehlers-Danlos y Loeys-Dietz) y congénitas (coartación de aorta) (3).
Los AAT pueden ser fusiformes (80 %) o saculares (20 %). La mitad de los fusiformes se localizan en la aorta torácica descendente, mientras que los saculares son más comunes (75 %) en la aorta ascendente y el arco aórtico. La historia natural, independientemente de su localización, es el crecimiento: a mayor diámetro transversal, más probabilidad de rotura y elevada tasa de muertes por shock hemorrágico.
En el texto y en las figuras se señala, cuando sea pertinente, el nivel de recomendación (I, II o III) y el grado de evidencia (A, B o C).
CLASIFICACIÓN
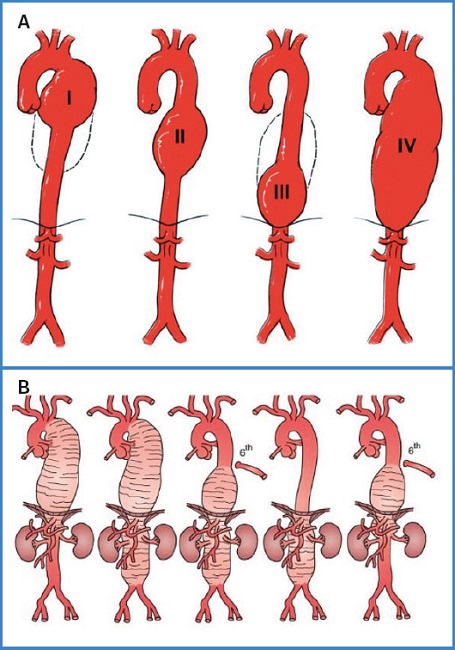
Existen 4 grupos de AAT: aorta ascendente, arco aórtico, descendente y abdominotorácico. Por su interés quirúrgico, Ishimaru identificó 9 zonas en la aorta (3) (Fig. 1).
Tradicionalmente la arteria subclavia izquierda marca el límite del campo de actuación entre la cirugía vascular y la cardiaca. Por ello, el presente protocolo se centrará en los AAT que afectan a la aorta torácica descendente (AATD) y abdominotorácicos (ATA) y tienen como fundamento cuatro guías de práctica clínica (4-7).
Kieffer clasifica los AATD en cuatro tipos según su localización y su extensión (8). Crawford clasificó los ATA en cuatro tipos, algo que modificó posteriormente Safi-Miller, que incluyó el tipo V según su inicio en la aorta torácica descendente y extensión a la aorta abdominal. Lo común a todos los ATA es que engloban las arterias viscerales (3) (Fig. 2).
DIAGNÓSTICO
La mayoría de los AAT son asintomáticos, por ello su diagnóstico es difícil y suelen ser hallazgos casuales a través de exploraciones solicitadas por otros motivos (radiografías de tórax, TC, etc.).
Como la mayoría de AAT son degenerativos (arterioesclerosis), estos pacientes suelen ser mayores de 60 años, presentan factores de riesgo cardiovascular (tabaco, dislipemia, e hipertensión arterial) y antecedentes familiares de aneurismas. En este sector aórtico es en el que tienen gran importancia otras etiologías, por lo que es importante valorar antecedentes de sífilis o el fenotipo del paciente (Marfan).
La localización, el tamaño, el crecimiento, la extensión y el estado estructural del aneurisma pueden inducir diversas manifestaciones clínicas (9). Las complicaciones más frecuentes son la compresión de estructuras vecinas, como el esófago, la tráquea, el bronquio o los nervios próximos, lo que provoca disfagia, tos, disnea, disfonía, etc. El embolismo periférico es infrecuente. En caso de rotura se produce un dolor intenso y repentino en el tórax, en la espalda o en el abdomen (según la localización del AAT), con sudoración, palidez, náuseas y vómitos, mareo, debilidad e incluso pérdida de la consciencia. La rotura puede ser a pericardio, vena cava superior, bronquio, esófago, mediastino o cavidad pleural. La rotura de un AAT es una de las múltiples causas del síndrome aórtico agudo.
Por todo lo mencionado, la clínica (en asintomáticos) y la exploración física son poco útiles para el diagnóstico precoz de un AAT. La radiografía de tórax, habitualmente solicitada por otros motivos, es orientativa (calcificaciones o ensanchamiento mediastínico). La confirmación diagnóstica se obtiene mediante angio TC (recomendación: IC). La ecografía transtorácica y la transesofágica también son de utilidad (IIaC). La ecografía intravascular (IVUS) es útil intraoperatoriamente (9).
La angio RM, y especialmente el angio TC, por su amplia disponibilidad, son las pruebas de elección, ya que aportan el diagnóstico de certeza y de información esencial para indicar y planificar la cirugía (diámetro, características de la pared, extensión, relación con las ramas arteriales, etc.). La arteriografía no es útil para el diagnóstico (no identifica la luz arterial parcialmente trombosada), aunque en ocasiones puede ser necesaria para la planificación quirúrgica (Tabla I).
Tabla I. Comparación entre diferentes métodos de diagnóstico por imagen de la aorta según Erbel y cols. 2014 (5).

+:comentario positivo (el número de signos indica el valor potencial estimado);
-:comentario negativo.
ETT: ecocardiografía transtorácica; ETE: ecocardiografía trasnsesofágica; TC: tomografía computarizada; RM: resonancia magnética.
TRATAMIENTO
Existen cuatro modalidades: 1) médico y seguimiento, 2) quirúrgico abierto, 3) endovascular (TEVAR: thoracic endovascular aortic repair) y 4) cirugía híbrida (endovascular y abierta combinada) (4-6,10).
En los AAT pequeños, sin crecimiento y asintomáticos, lo más adecuado es un seguimiento con controles periódicos mediante TC y un tratamiento basado en el control de los factores de riesgo (no fumar, controlar la presión arterial, etc.) (IC). No existen fármacos que reduzcan el crecimiento de los aneurismas.
Una conducta adecuada de seguimiento es realizar otro TC a los 6 meses del diagnóstico. Si el diámetro no cambia puede realizarse un nuevo control a los 12 meses. Después de 3 años sin crecimiento pueden realizarse controles cada 2-3 años. En caso contrario (crecimiento), el control debe reducirse nuevamente a 6 meses.
A diferencia de los AAA, en los AAT existe menos información sobre su historia natural. Los AAT con un diámetro de entre 50 y 60 mm presentan un crecimiento más rápido y un mayor riesgo de rotura respecto de los aneurismas pequeños (40 mm). Así, el riesgo de rotura a 5 años es cinco veces superior para los AAT con un diámetro > 60 mm (10).
También sabemos que a mayor ritmo de crecimiento hay un mayor riesgo de complicaciones. Se estima que la tasa de crecimiento medio de un AAT es 1-4 mm al año, dependiendo del diámetro inicial (10). Los factores que influyen en el crecimiento son: la edad, el sexo femenino, el tabaco, la hipertensión arterial, el EPOC, la historia familiar de AAT, la enfermedad arterial periférica, la disección aórtica y la cantidad de trombo del aneurisma.
Cirugía abierta o endovascular
El objetivo de la cirugía es evitar la rotura del aneurisma, cuyo pronóstico es ominoso: el 50 % de los pacientes en esa situación no llega con vida al hospital.
La cirugía está indicada en los casos complicados, sintomáticos (a veces también de forma urgente) y de forma programada en los casos asintomáticos con un diámetro transversal > 60 mm (variable en relación con la etiología y localización del AAT, así como en la experiencia quirúrgica) en pacientes con aceptable riesgo quirúrgico, dado que este tipo de cirugía (sobre todo de cierta localización y características) presenta una importante morbimortalidad, en ocasiones superior a la evolución natural de la enfermedad.
Como norma general, en los AATD se indica la cirugía cuando el diámetro transversal máximo de la aorta excede de 60 mm y en crecimientos rápidos (> 5 mm en 6 meses) (10). Entre 55 y 60 mm hay que valorar los riesgos-beneficios. Intervenir por debajo de 55 mm de diámetro no aporta beneficios de supervivencia (IIIC), aunque esto puede cambiar en caso de mujeres y de enfermedades del tejido conectivo.
Los casos de anatomía favorable para TEVAR pueden tratar AATD > 55 mm (IIbC) y mayores de 60 mm (IIaC). En los casos no favorables para TEVAR se indicará cirugía abierta en pacientes con aceptable riesgo quirúrgico, con diámetros > 55 mm (IIbC) y mayores de 60 mm (IIaC). En pacientes con AATD rotos el tratamiento endovascular es la primera opción (IB) (Fig. 3).

Figura 3. Algoritmo diagnóstico y terapéutico de los aneurismas de la aorta torácica. Entre paréntesis se señala el nivel de recomendación (I, II o III) y el grado de evidencia (A, B o C).
El tratamiento endovascular bien indicado (que cumple con los requisitos anatómicos y técnicos necesarios para su implantación), además de eficaz y seguro, presenta varias ventajas: menor morbimortalidad, mejor posoperatorio (menor dolor) y hospitalización y convalecencia más cortas. Por el contrario, precisa un seguimiento más exhaustivo para descartar el correcto sellado del aneurisma, que en caso contrario ocasiona fugas endoleak y posible endotensión (presurización) del saco aneurismático.
Con respecto a los ATA, existe un consenso de indicación quirúrgica en pacientes con bajo y moderado riesgo quirúrgico y ATA > 60 mm, salvo en pacientes con enfermedades del tejido conectivo, crecimiento rápido (> 10 mm/año) y casos sintomáticos (IIaC).
El fundamento de la cirugía abierta es la sustitución del segmento aneurismático por una prótesis y en los casos necesarios el reimplante de las ramas aórticas (troncos supraaórticos, viscerales, etc.) a la prótesis. Es decir, la localización del AAT determina la complejidad quirúrgica. De hecho, en ocasiones se precisa de una serie de medidas especiales y de dispositivos técnicos (por ejemplo, derivaciones totales o parciales) que protejan el corazón, el cerebro, la médula espinal y el riñón de las consecuencias proximales o distales del pinzamiento de la aorta (8,10).
Por la referida problemática en algunos sectores (como en la aorta torácica descendente), las técnicas endovasculares (endoprótesis), por su carácter menos agresivo, son de primera elección terapéutica. Se reserva la cirugía abierta para pacientes de bajo riesgo quirúrgico y anatomía no tributaria de TEVAR (8,10).
La cirugía abierta de los ATA es especialmente compleja y debe valorarse con especial cuidado el riesgo-beneficio. En este tipo de intervenciones las posibles complicaciones son muy numerosas y más frecuentes que en la cirugía sobre la aorta descendente (por ejemplo, paraplejía) y la mortalidad posoperatoria es elevada, incluso en grupos con experiencia. Son aneurismas que exigen la máxima prudencia (indicación) y experiencia (técnica). Es aconsejable la regionalización en centros de elevado volumen (IIbC).
Finalmente, la inclusión de las arterias viscerales en el aneurisma complica el tratamiento endovascular estandarizado de los ATA. Recientes evoluciones de las endoprótesis (fenestradas, multirramificadas, etc.) están haciendo cada vez más posible y seguro esta modalidad de tratamiento. La combinación de técnicas endovasculares y abiertas (híbridas) mediante el debranching son una alternativa a la cirugía abierta de los ATA.
CONCLUSIONES
Los AAT no son frecuentes, pero su historia natural es ominosa. El diagnóstico precoz es difícil y suele ser incidental. El seguimiento de los aneurismas pequeños y la cirugía programada tienen como objetivo prevenir la rotura del aneurisma. El tratamiento endovascular es de elección y sus buenos resultados han modificado el pronóstico.