INTRODUCCIÓN
Desde su primera descripción en 1865, el endotelio vascular fue considerado como una mera barrera que separaba las células sanguíneas del tejido circundante. Actualmente sabemos que esta afirmación no es cierta. Son tantas y tan diversas las funciones del endotelio vascular que es considerado una importante glándula de secreción interna del organismo con funciones autocrina, paracrina y endocrina, aunque también puede reaccionar ante fuerzas físicas, sustancias químicas o mediadores inmunológicos. Entre estas funciones es conocida su capacidad para producir la propia matriz extracelular, óxido nítrico (NO) y factor de crecimiento vascular-endotelial (VEGF). Sin embargo, menos conocida es la producción de la propia hormona de crecimiento (GH), así como de su mediador, el factor de crecimiento parecido a insulina o IGF-I (1,2). Como veremos, el hecho de que el endotelio de los distintos lechos vasculares tenga receptores para la GH y la produzca con acción autocrina y paracrina va a tener una gran trascendencia para apoyar los estudios que fueron desarrollados por nuestro grupo (3).
Tras revisar los numerosos trabajos en los que parece haber un potencial regenerativo por parte de la GH, quisimos apostar por testar esta novedosa vía terapéutica para el tratamiento de la isquemia crónica que amenaza la extremidad (CLTI), algo inédito hasta ese momento en seres humanos. La GH es una hormona de supervivencia transcendental en el organismo desde épocas tempranas del desarrollo embrionario, y es clave para el desarrollo del sistema cardiovascular junto a otras hormonas proangiogénicas (4,5). En la actualidad es considerada una hormona polifacética, que responde solo de forma moderada a su nombre (6,7), y es capaz de adaptar su función a las condiciones celulares: por ejemplo, ante una hipoxemia, pondrá en marcha numerosos mecanismos celulares entre los que destaca la angiogénesis (2,8).
Así pues, en este artículo intentaremos acercar a todos los angiólogos y cirujanos vasculares al reto del uso clínico de la GH para el tratamiento de la CLTI.
OBJETIVOS
El objetivo primario de los estudios que presentamos era ver si la hormona de crecimiento recombinante humana (rhGH), administrada de forma subcutánea (s.c.) en situaciones de isquemia grave y sin opciones terapéuticas, era capaz de inducir neovascularización, aliviando el dolor de reposo isquémico y ayudando en la cicatrización de las lesiones tróficas.
Como objetivos secundarios, se pretendía agrupar todas las evidencias sobre GH y sistema vascular, formular nuevas hipótesis de trabajo y realizar un análisis crítico de las ventajas e inconvenientes del uso de la rhGH en dichos pacientes.
MATERIAL Y MÉTODO
Realizamos una búsqueda profunda en bases de datos científicas: PubMed, WOS, Embase y Cochrane Library siguiendo las guías PRISMA, el modelo PICO y las fichas de lectura crítica. Además, se diseñaron dos estudios pioneros, uno experimental y otro clínico, que nos permitieron aproximarnos al posible beneficio de esta hormona en el contexto de la CLTI.
La figura 1 trata de resumir los aspectos cronológicos y éticos que fueron necesarios para la realización tanto del estudio experimental como del ensayo clínico. Solo señalar, que ambos estudios cumplieron con toda la normativa vigente, tanto para ensayos clínicos como para estudios con animales.
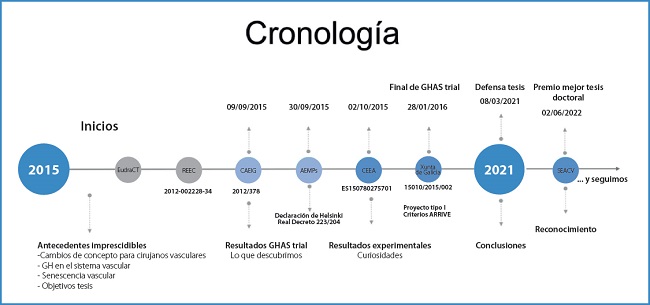
Figura 1. Representación cronológica de los principales hechos asociados a los estudios que se presentan en esta tesis. EudraCT: base de datos de ensayos clínicos en la que deben registrarse todos los ensayos clínicos desde el 2004. Es un prerrequisito de autorización por parte de comités éticos y agencias de medicamentos; REEC: Registro Español de Ensayos Clínicos; CAEIG: Comité Autonómico de Ética en Investigación de Galicia; AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; CEEA: Comité de Ética en Experimentación Animal; GHAS: Growth Hormone Angiogenic Study.
Por una parte, el ensayo clínico o estudio GHAS fue un estudio diseñado como en fase III, aleatorizado, controlado y con enmascaramiento, que utilizó la rhGH o placebo (grupo control) en 36 pacientes con CLTI sin opciones de revascularización. Con relación al estudio experimental, podemos resaltar que ha sido presentado ya en su mayoría en un artículo anterior publicado en esta misma revista (9). En este estudio, además de estudiar el valor de la fotopletismografía (PPG) como método de estudio de la reperfusión tras angiogénesis terapéutica en un modelo murino de isquemia periférica, se compararon dos modelos animales diferentes de isquemia y se testó el uso de la GH en el animal con isquemia frente a placebo. Para ello se usaron ratas macho Sprague Dawley en las cuales se excluyeron los sectores arteriales ilíaco y femoral de la pata trasera izquierda, usando como control la pata contralateral del propio animal. Los animales se dividieron en tres grupos: GH, placebo y sham group.
RESULTADOS
Revisión bibliográfica
A modo de resumen pudimos constatar que las células endoteliales (CE) son heterogéneas y adaptarán su morfología y función al microambiente que les rodea mediante la secreción de sustancias entre las que se encuentra la GH autocrina. Actualmente se ha descrito cómo el endotelio de múltiples territorios presenta receptores para GH e IGF-1, y también los segrega (10,11).
Además, cuando ponemos GH a CE en cultivo procedentes de determinados lechos vasculares, a las pocas horas estas se organizan en estructuras que recuerdan a capilares, incrementando tanto la formación como su longitud. Esto es debido a la capacidad que tiene dicha hormona para estimular la producción del factor de crecimiento endotelial vascular o VEGF, uno de los factores clave dentro de la neovascularización (11). Si nos fijamos en colgajos de piel ventral de la rata tras el cierre de sus arterias epigástricas, la administración de GH protege de la necrosis e incrementa el flujo sanguíneo, ya de forma muy temprana (12).
Esta característica de la GH de adaptar su función al ambiente que rodea a la célula está ya presente durante la embriogénesis. Las hormonas proangiogénicas de la familia de la GH/prolactina tienen un papel crucial durante el desarrollo embrionario, como consecuencia de su acción sobre la proliferación, migración y supervivencia celular. Esta acción puede observarse ya en el día 7 en la médula espinal del embrión de pollo, incluso antes del desarrollo de la propia hipófisis, lo que demuestra que esta secreción autocrina/paracrina (extrapituitaria) a nivel celular suple la función de la hipófisis y tiene gran relevancia (4). La mediación angiogénica de la GH durante el desarrollo prenatal se ha estudiado in vivo en la membrana corioalantoidea del pollo (CAM) utilizando distintos fragmentos de la hormona. Mientras que la molécula completa de GH mejora la neovascularización respecto al estado basal, su fragmento de 16 KDa la bloquea. Este hecho es común para la familia GH/prolactina, y parece ser un mecanismo eficaz para la regulación de la angiogénesis (13).
Es necesario resaltar los cambios paralelos entre el declive fisiológico de la producción de GH, también llamado somatopausia, y la senescencia celular, que se caracteriza principalmente por un aumento del estrés oxidativo, objetiva- do por el incremento en la producción de especies reactivas de oxígeno (ROS) a nivel mitocondrial y un aumento de la inflamación, expresado por diferentes biomarcadores como el TNF-α. Estos elementos afectarán a la función del NO para mantener la homeostasis vascular, traduciendo la disfunción endotelial y de células progenitoras (14). Muchos de estos cambios podrían, al menos desde un punto de vista teórico, ser compensados por la administración de GH, que puede inducir la movilización de células mononucleares desde la médula ósea (15), corregir la disfunción endotelial (16) y aumentar la producción de NO (17,18), disminuyendo citocinas proinflamatorias (19). Valga como ejemplo que, el receptor para GH se ha hallado en células mononucleares como las células madre mesenquimales. Curiosamente, en dichas células mesenquimales va a desempeñar un papel clave, ya que, si a estas células se les quita el receptor para GH, se convertirán a adipocitos en un altísimo porcentaje y perderán su función progenitora respecto a las originales. Por el contrario, en aquellas que sobreexpresan dicho receptor la conversión a adipocitos se reduce drásticamente (20).
Derivado de los estudios realizados por nuestro grupo, podemos señalar los siguientes hallazgos:
Ensayo clínico: estudio GHAS
En el timeline de la figura 2 representamos todas las variables que utilizamos para evaluar el papel angiogénico de la GH en este contexto. Por otro lado, las principales características de los pacientes de este estudio se exponen en la tabla I. Los resultados más importantes de este estudio fueron los siguientes:

Figura 2. Línea de tiempo que representa las características de diseño del estudio GHAS. D-PPG: Doppler-fotopletismografía; SF-12: versión corta del cuestionario de calidad de vida SF-36.
Tabla I. Características principales de los pacientes del estudio GHAS.
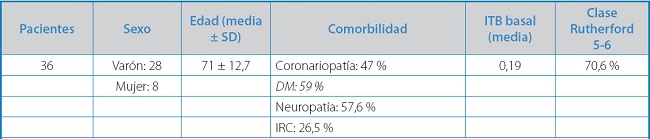
IRC: insuficiencia renal crónica; ITB: índice tobillo/brazo.
– El 70 % de los pacientes con CLTI evaluados en este estudio presentó aumento de los niveles de TNF-α.
– El tratamiento con rhGH durante 8 semanas disminuyó de forma significativa los niveles plasmáticos de TNF-α y los niveles de ARNm de la NOX4 a nivel del músculo esquelético isquémico.
– El tratamiento con rhGH durante 8 semanas aumentó los niveles de ARNm del KDR o VEGFR2 a nivel del músculo esquelético isquémico.
– Se detectó un incremento significativo del ITB y de la presión sistólica a nivel del tobillo en los pacientes del estudio, si bien dicho aumento no pudo asociarse al tratamiento con rhGH.
Estudio experimental:
– El modelo doble de isquemia animal produjo cambios isquémicos más profundos y duraderos en el tiempo que el modelo simple.
– La PPG fue capaz de detectar los cambios isquémicos producidos tras la isquemia y la recuperación tras esta durante 30 días.
– La rhGH aplicada a los animales pareció mostrar ventajas de recuperación tras la isquemia en los animales tratados, medidas por la PPG y escalas clínicas y funcional de valoración, si bien ninguna de ellas resultó ser significativa.
DISCUSIÓN
En cuanto al ensayo clínico, las características de la población de estudio quedan reflejadas en la tabla I, destacando que estábamos tratando a una población de edad avanzada, más de la mitad de ellos diabéticos y con una alta tasa de neuropatía establecida; es decir, se trataba de una población de pacientes con un muy alto riesgo de amputación
Como cabía esperar en un estudio de angiogénesis, los principales hallazgos vinieron de la mano de los aspectos bioquímicos, moleculares y clínicos, y no tanto hemodinámicos. Así, como apreciamos en la tabla II, el tratamiento con rhGH disminuyó significativamente los niveles de TNF-α en sangre. Dicha molécula es conocida por su papel deletéreo mediador de la oxidación e inflamación que conlleva la isquemia. Puede también observarse que algunos de los biomarcadores estaban significativamente elevados de forma basal en el grupo GH, lo que podía significar que este grupo pudo tener una enfermedad isquémica más grave. Estos datos vienen soportados por estudios experimentales realizados en ratas donde se ve cómo se van elevando los niveles de TNF-α con la edad, especialmente si están previamente ovariectomizadas. Cuando se administra GH, las cantidades de dichas citocinas se reducen, lo que resalta el claro efecto antiinflamatorio de la GH (19). Este mismo fenómeno se ha encontrado en pacientes adultos con deficiencia de GH. Al dar la terapia de reemplazo hormonal, las citocinas inflamatorias disminuyen (21).
Tabla II. Biomarcadores utilizados en el estudio GHAS.
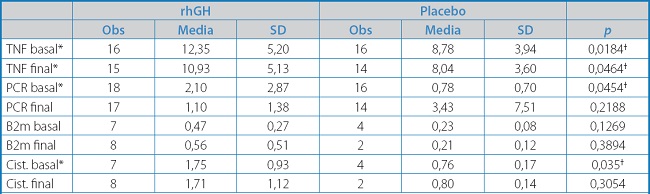
*Parámetros que se han encontrado elevados.
†Diferencias estadísticamente significativas (p < 0,05).
TNF: factor de necrosis tumoral; PCR: proteína C reactiva; B2m: beta 2 microglobulina; Cist.: cistatina C.
En nuestro estudio, el TNF-α estaba aumentado en el 70 % de los pacientes con CLTI (22). Y, aunque finalmente no pudieron medirse los niveles en sangre de IL-6, debemos señar que la producción de IL-6 es también en gran parte dependiente de TNF-α y, por tanto, esta última molécula debe desempeñar un rol principal en la isquemia (23), aunque pueda haber diferencias con la enfermedad coronaria (24).
Fijémonos ahora en los resultados moleculares más importantes del estudio GHAS, representados en la figura 3. Como se puede observar, en el grupo tratado con rhGH se produjo un aumento del nivel de eNOS, principal enzima productora de NO. Sin embargo, curiosamente, este aumento fue menor que el detectado en los pacientes tratados con placebo (Fig. 3A). Este sorprendente resultado nos indujo a pensar inicialmente que con toda seguridad se trataba de un error. No obstante, tras una revisión profunda de la literatura, comenzamos a entender los resultados cuando observamos una disminución paralela y significativa del estrés oxidativo, medido por los niveles de NOX4, en el grupo de GH comparado con placebo (Fig. 3B). Esto traducía que a nivel clínico la actividad de la eNOS depende en gran medida de la oxidación en el músculo isquémico, lo cual está además soportado por estudios experimentales. Así, cuando se comparan ratas añosas y jóvenes, las primeras muestran un nivel de estrés oxidativo elevado respecto a las segundas, sobre todo si están ovariectomizadas. Al aplicar la GH, los niveles de dicha oxidación se reducen (19). Este hecho también se ha descrito en pacientes con deficiencia de GH del adulto como en el estudio GREAT. En ellos la producción de radicales libres aparece aumentada respecto al control sin deficiencia de GH, y disminuye al administrar la GH (25,26).
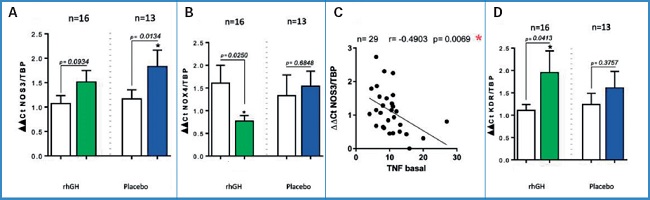
Figura 3. Datos moleculares del GHAS trial. RNAm en músculo esquelético. A. Niveles de enzima NOS3 o eNOS en músculo esquelético isquémico. B. Niveles de la enzima NOX4 en músculo esquelético. C. Correlación entre niveles plasmáticos basales de TNF y niveles de NOS3 en el músculo esquelético. Obsérvese la correlación inversa. D. Niveles del receptor 2 del VEGF o KDR en músculo esquelético isquémico. *Significación estadística (p < 0,05). n = número de pacientes. rhGH: recombinant human Growth Hormone.
Como vemos, ambos parámetros, estrés oxidativo y función endotelial, se relacionan de forma inversa. Pero, ¿cómo afecta el equilibrio redox a la producción angiogénica?. De forma muy resumida diremos que, mientras que pequeñas cantidades de oxidación son beneficiosas, las concentraciones altas o crónicamente elevadas, típicas de las enfermedades crónicas como la isquemia crítica, serán deletéreas para la producción y para el aprovechamiento del NO. Por tanto, el proceso isquémico promueve un aumento de ROS y de NO compensatorio. No obstante, el problema es que este NO es rápidamente inactivado por el exceso de radicales libres, fenómeno llamado insensibilidad al NO (27,28). Este hecho es trascendental porque indica que nuestros pacientes producen NO, pero no lo pueden aprovechar bien en la isquemia crítica porque es inactivado. En el ensayo clínico, los pacientes bajo placebo mantuvieron un alto nivel de NOX4 y eNOS en su tejido muscular, tratando de compensar la disminución de la disponibilidad de NO. La administración de GH detuvo este círculo vicioso en el grupo GH, disminuyendo el desequilibrio oxidativo y aumentando también la disponibilidad del NO, por lo que no se precisó así de un aumento especialmente significativo de la cantidad de enzima eNOS.
No hay que olvidar que, típicamente, la NOX4 está regulada al alza en las células bajo estrés y se activa ante los niveles elevados de TNF-α. Efectivamente, la figura 3C muestra unos datos muy interesantes obtenidos en nuestro estudio: una correlación significativa e inversa entre los niveles basales de TNF-α y eNOS. Estos datos son de una extraordinaria relevancia, ya que hasta ahora no se había descrito esta relación entre marcador plasmático y muscular en un escenario clínico real de pacientes con CLTI.
Otro hallazgo destacable fue un aumento paralelo y significativo de los niveles ARNm del KDR o receptor 2 del VEGF en el grupo GH (Fig. 3D). ¿Qué significado tiene este hallazgo? Para entenderlo conviene recordar que el receptor KDR es un receptor tirosina-cinasa que media la mayoría de los efectos del VEGF relacionados con la permeabilidad celular, la supervivencia y la mitogénesis. Es trascendental para la angiogénesis, y representa un marcador indirecto de la presencia y acción tanto de VEGF como de células progenitoras. Además, recientemente, este receptor se ha relacionado con la arteriogénesis, mediando la mecanotransducción junto a los mastocitos, plaquetas y neutrófilos, es decir, media la transformación de la señal mecánica de las fuerzas de cizallamiento a una señal química (29-33). Estas funciones del KDR y su relación con la GH soportan la acción angiogénica de la hormona a nivel muscular.
Por último, vamos a señalar de forma muy resumida que también hubo ventajas desde el punto de vista hemodinámico, con un incremento significativo del ITB y de la presión sistólica a nivel del tobillo, tal y como queda reflejado en la figura 4A. Sin embargo, cuando intentamos determinar si dicho aumento detectado era debido al uso de la hormona, no alcanzamos diferencias significativas entre los grupos, posiblemente debido al tamaño muestral (Fig. 4B). No obstante, se pudo constatar que el grupo de pacientes menores de 65 años era el más beneficiado para dicho aumento (Fig. 4C). Tenemos que sumar, también, ventajas desde el punto de vista clínico, ya que observamos una mejoría muy significativa tanto del dolor de reposo (medido mediante la escala visual EVA de dolor) como de las heridas en los pacientes tratados con GH, aunque los datos completos no pueden por el momento ser expresados aquí por dos razones: no es- tán recogidos en la tesis presentada y, además, están siendo evaluados para otra publicación. Valga como ejemplo el box plot de superficie resultante del análisis de las fotografías de las heridas (Fig. 5A).
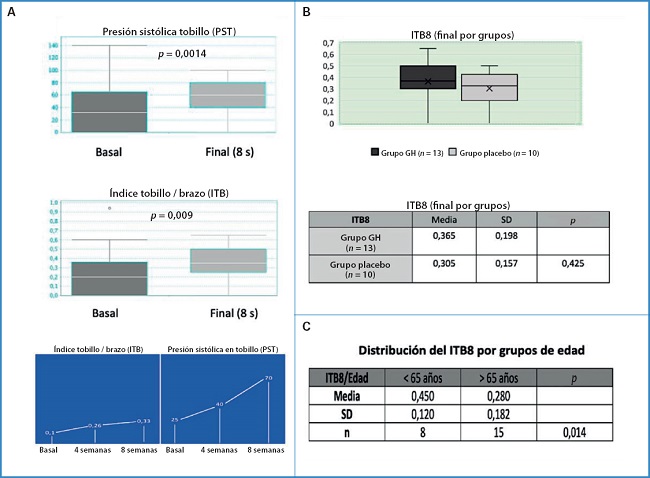
Figura 4. Cambios hemodinámicos (valores basales y finales: a las 8 semanas) en los pacientes del estudio GHAS. A. Arriba: presión sistólica a nivel del tobillo (PST). Centro: índice tobillo/brazo (ITB). Abajo: curva de incremento de valores medios de PST. B. Arriba: distribución del ITB a las 8 semanas o final por grupos (GH y placebo). Abajo: tabla comparativa de valores entre ambos grupos con la media y desviación estándar. C. Distribución del ITB 8 o final por grupo de edad. GH: Growth Hormone; SD: desviación estándar; n = tamaño muestral.
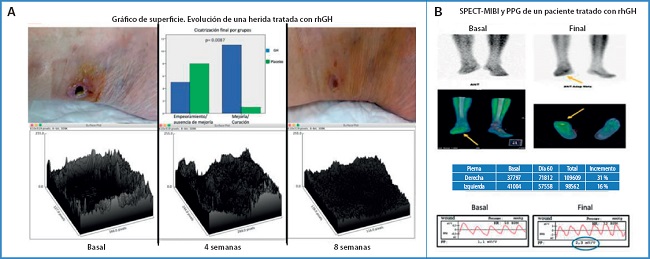
Figura 5. A. Arriba (izquierda y derecha): fotografías de evolución de una úlcera en un paciente CLTI tras 2 meses de tratamiento con rhGH. Arriba centro: histograma que muestra la evolución de los pacientes del estudio divididos en dos grandes grupos: mejoría/curación o empeoramiento/ausencia de mejoría. Abajo: gráficos de superficie que muestran la evolución a los 2 meses del tejido de granulación en una úlcera de un paciente con CLTI tratado con rhGH. B. Arriba: imagen gammagráfica y SPECT-MIBI basales y finales que muestran el incremento de flujo alrededor de la herida de un paciente diabético. Centro: valores de incremento cuantitativo en el mismo paciente. Abajo: PPG basal y final se representa en la zona inferior de la imagen. Obsérvese el incremento de la PP remarcado con un círculo azul. Gráficos: A (abajo): imágenes obtenidas con el programa Image J. A (arriba, izquierda y derecha). B. Propiedad del autor, previamente publicadas. rhGH: recombinant human Growth Hormone. PPG: fotopletismografía.
La siguiente cuestión fue dilucidar si este beneficio podría ser solo secundario a la capacidad de la GH para hacer crecer el tejido de granulación. Para aclarar eso, en el estudio GHAS se demuestra un aumento del flujo en el SPECT-MIBI, tanto de forma cualitativa como de forma cuantitativa, que es paralelo al aumento de flujo fotopletismográfico alrededor de la úlcera en los pacientes bajo tratamiento con GH (Fig. 5B).
No obstante, a pesar de los estimulantes datos de este primer estudio piloto sobre GH y angiogénesis en pacientes con CLTI sin opciones de revascularización, este ensayo no está exento de limitaciones que exponemos brevemente:
– Aunque aleatorizado y controlado con placebo, presenta un tamaño de muestra relativamente pequeño, y no fue doble ciego (sí contó con enmascaramiento).
– Pérdida de información final, en parte derivada de los pacientes con amputación dentro del período de estudio si no había mejoría significativa.
– Las dosis de GH autorizadas por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) fueron las recomendadas para la edad, pero probablemente insuficientes pa- ra estos pacientes con una oxidación tan avanzada y cronificada.
– Además, la administración sistémica de la hormona puede implicar una menor concentración en las zonas isquémicas.
– La obtención de solo dos muestras de músculo separadas 2 meses en estos pacientes puede llevar a la pérdida de importante información.
En cuanto al estudio experimental, se observaron diferencias de recuperación de la perfusión entre dos modelos de isquemia animal a los 30 días desde la cirugía, y dicha recuperación fue mucho menor en el modelo doble de isquemia (más agresivo) que en el simple. La PPG fue, además, capaz de detectar dichas diferencias. Por tanto, el modelo doble de isquemia fue finalmente el elegido para nuestro experimento.
Se observó la existencia de variabilidad de pulsatilidad y morfología de la onda PPG entre patas antes de la isquemia. Para analizar dicha variabilidad se utilizó un gráfico de dispersión y se estudió el grado de correlación entre dichos valores en los 14 animales a estudio, incluyendo el grupo sham. Aplicando el test de correlación de Pearson, pudimos comprobar una correlación significativa positiva de 0,9 (0,74-0,97, IC 95 %, p < 0,001). Así pues, ya teníamos una prueba fiable y un modelo de isquemia elegido. Ahora restaba ver si la PPG era capaz de mostrar diferencias mínimas de flujo (mayores del 5 %) entre animales con isquemia tratados con GH y aquellos tratados con placebo. Para ello se utilizó rhGH a la dosis total de 15 µg/día/30 días.
Lo que comprobamos fue un fenómeno ya descrito por otros autores usando GH y láser Doppler: las curvas comenzaban a separarse a partir del día 10, con una recuperación mayor en las ratas GH (Fig. 6A). Así pues, aunque la media de recuperación no fue aparentemente muy elevada, sí que existió variabilidad entre los animales, con una recuperación muy importante para algunos de ellos en el grupo GH. Por tanto, a pesar de ser los mismos animales, estos muestran variabilidad en la respuesta a GH. No obstante, no se alcanzó la significación estadística, probablemente debido al escaso número de animales usados.
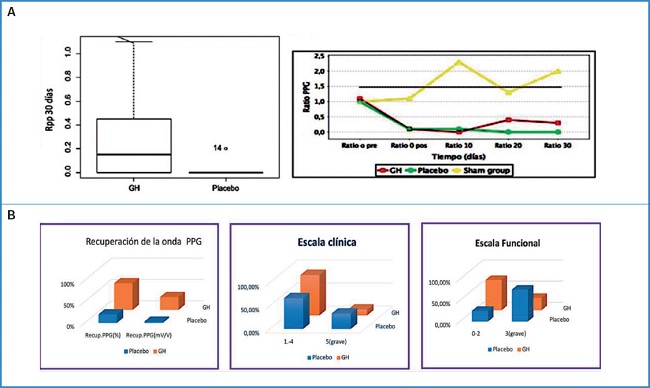
Figura 6. A. Derecha. Diagrama de cajas que muestra el rpp medio alcanzado al final del tratamiento entre los grupos GH y placebo. Izquierda. B. Evolución gráfica durante el período de 30 días de los grupos de animales: GH, placebo y sham group. La línea representa la media del rpp medio del sham group. Rpp: ratio de valores PPG entre ambas patas (pata-pata); PPG: totopletismografía. GH: Growth Hormone; Ratio 0 pre: ratio p-p basal antes de la intervención; Ratio 0 pos: ratio p-p basal justo después de la intervención; Recup.: recuperación; mV/V: milivoltios/voltio.
Dicho beneficio también se intuyó en las escalas de valoración clínica y funcional del daño isquémico. Al final del tratamiento, los animales con GH sufrieron menos daño isquémico en cuanto a la presencia de ulceraciones y necrosis, y también menor daño funcional, siendo dicha protección paralela a la recuperación de la onda de PPG (Fig. 6B).
Hay que resaltar, no obstante, que la PPG fue realizada con el animal en reposo y no tras vasodilatación, lo que podría afectar a los resultados, ya que pasa por alto la influencia sobre la perfusión del tono adrenérgico basal (9).
CONCLUSIONES
La hormona de crecimiento (GH) y el eje GH/IGF-I parecen tener un papel clave en la regulación de la homeostasis vascular.
La GH, aplicada de forma sistémica, parece disminuir el estado proinflamatorio de los pacientes con isquemia crítica de las extremidades inferiores, medido por el TNF-α, y el estrés oxidativo, medido por la NOX4.
La GH, aplicada de forma sistémica, podría disminuir el dolor de reposo e incrementar la cicatrización de las lesiones tróficas asociadas a la isquemia crítica.
La GH, aplicada sistémicamente, podría incrementar la angiogénesis en pacientes con isquemia crítica de miembros inferiores, medido mediante SPECT-MIBI y fotopletismografía.
Por tanto, la GH, aplicada sistémicamente, podría ser útil para el tratamiento de la enfermedad vascular periférica en su estado crítico, especialmente en pacientes sin posibilidades de revascularización.
Finalmente, nos gustaría señalar que el estudio GHAS, aunque lleno de dificultades y retos, supone un valiente salto desde el laboratorio al ámbito clínico, pero que sus resultados deben ser confirmados en un estudio más amplio (mayor tamaño muestral e interdisciplinar), debiendo establecerse de forma adecuada la dosis, los intervalos de tratamiento y la mejor forma de administración de la hormona.
CONSIDERACIONES ÉTICAS
El autor declara haber elaborado el artículo de forma completa, tanto en la concepción y diseño como en el análisis e interpretación de los datos. El ensayo clínico (GHAS trial) fue dirigido de acuerdo a las guías de la Declaración de Helsinki y fue aprobado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), con número EudraCT 2012-002228-34, y por el Comité Autonómico de Ética en la Investigación de Galicia (CAEIG), con número 2012/378.
El estudio experimental fue aprobado por el Comité de Ética en Experimentación Animal (CEEA) de Galicia, con número de proyecto ES150780275701, así como por la Xunta de Galicia, adhiriéndose a las directrices del ARRIVE, y se realizó de acuerdo con el Acta de 1986 de Reino Unido sobre Animales (Procedimientos Científicos) y las recomendaciones relacionadas de la Directiva UE 2010/63/UE para experimentos con animales, y la guía sobre el cuidado y utilización de los animales de laboratorio del National Institute of Health (NIH Publications No. 8023, revised 1978).











 texto en
texto en 


