Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.29 no.1 ene. 2005
ORIGINAL
Estudio de la expresión de cerbB-2 en el adenocarcinoma de prostata
P. San Miguel Fraile, J.E. Dos Santos*, E. Pélaez Boismorand, J.A. Ortiz Rey, B. Iglesias Rodríguez,
J. Cambronero Santos*, J.L. Fajardo Seijo, J.M. Rodríguez Costas, M. Fernández Regueiro
Servicio de Anatomía Patológica. *Servicio de Urología. Centro Médico POVISA. Vigo. Pontevedra.
|
El carcinoma de próstata es el tumor más frecuente en el hombre1 y la segunda causa más frecuente de muerte por cancer en el varón2. El pronóstico ha mejorado con el empleo de diferentes modalidades terapéuticas como la cirugía y la radioterapia; pero todavía los parámetros clínicos e histológicos no son suficientes para prever el pronóstico en todos los casos, ya que pacientes con características clínicas e histológicas similares tienen una evolución clínica muy diferente3. Por este motivo, se están estudiando nuevos marcadores moleculares. El estudio de oncogenes, genes supresores y otros factores reguladores del crecimiento tumoral han sido extensamente estudiados en múltiples neoplasias4-8, pero están insuficientemente analizadas en los tumores prostáticos.
El oncogen Her-2/neu, situado en el brazo largo del cromosoma 17, codifica una proteína transmembrana (p185HER2) con actividad tirosin-kinasa que actúa como un factor de crecimiento. Su alteración se traduce en una sobreexpresión en la membrana celular, generalmente secundaria a la amplificación del gen. Ha sido detectada con expresión variable, en una gran variedad de tumores malignos, como marcador pronóstico adverso, especialmente adenocarcinomas como: mama (20%)5-8, ovario (33%)6 y estómago (20%)9.
En el carcinoma de próstata la sobreexpresión es muy variable10-25 y la causa de mayor discrepancia parece ser el método empleado23. Nosotros analizamos la sobreexpresión del oncogen cerbB-2 con técnicas de inmunohistoquímica en 32 piezas de prostatectomía y evaluamos su relación con diferentes variables histopatológicas y clínicas: estadio clínico, volumen tumoral, índice de Gleason, niveles de PSA, infiltración perineural y afectación ganglionar.
MATERIAL Y MÉTODO
Selección de pacientes
Se han estudiado retrospectivamente piezas de prostatectomías correspondientes a 32 pacientes diagnosticados de adenocarcinoma prostático entre los años 1998 y 2003; y que fueron tratados mediante cirugía con intención curativa. Ninguno de los pacientes recibió tratamiento hormonal y/o radioterapia previa a la cirugía. En todos los casos se revisaron las biopsias para confirmación del diagnóstico histológico y se realizó determinación de la expresión del oncogen cerbB- 2 en la sección más representativa del tumor.
La serie estudiada se compuso de 32 varones con un rango de edad entre 48 y 77 años y una edad media de 60,78 años El seguimiento medio fue de 34 meses (65 a 5 meses).
Estudio histológico e inmunohistoquímico
En el estudio histopatológico se consideraron los siguientes parámetros para su análisis: Volumen tumoral, grado de Gleason, estadio tumoral, infiltración perineural y afectación ganglionar.
El estadio tumoral, afectación ganglionar (metástasis o no), infiltración perineural (si o no) y volumen tumoral aproximado en la pieza de prostatectomía se categorizó tras el estudio histopatológico de las piezas quirúrgicas.
La determinación de la expresión del oncogen cerbB-2 se realizó en muestras de tejido tumoral incluidas en parafina. La técnica de inmunohistoquímica se realizó de dos formas:
• Método 1 (método estándar): Se utilizó la olla a presión durante 5 minutos en tampón citrato a pH6. Posteriormente se realizó una inhibición de la peroxidasa endógena con peróxido de hidrógeno al 3% durante 10 minutos y se incubaron con el anticuerpo primario cerbB-2 (A0485, DAKO Diagnósticos S.A.) diluidos en proporción 1:200 con el anticuerpo diluyente (DAKO, 50809) durante 30 minutos. El método utilizado para la detección fue el de estreptoavidina-biotina marcada con peroxidasa y el cromógeno del revelado fue diaminobencidina (DAB).
• Método 2 (método modificado)23: Se utilizó la olla a presión durante 5 minutos en tampón citrato a pH9. Posteriormente se realizó una inhibición de la peroxidasa endógena con peróxido de hidrógeno al 3% durante 10 minutos y se incubaron con el anticuerpo primario cerbB-2 (A0485, DAKO Diagnósticos S.A.) diluidos en proporción 1:200 con el anticuerpo diluyente (DAKO, 50809) durante 30 minutos. El método utilizado para la detección fue el de estreptoavidina- biotina marcada con peroxidasa y el cromógeno del revelado fue DAB.
Valoración de la expresión inmunohistoquímica
Antes de proceder a la cuantificación de los resultados de inmunohistoquímica, se valoró en todos los casos la calidad de la técnica y se seleccionaron las áreas con más positividad, evitando mediciones en áreas periféricas, zonas desvitalizadas, con necrosis o artefacto. Todas las muestras fueron evaluadas sin saber en ningún momento de que pacientes procedían y la cuantificación de la técnica de inmunohistoquímica se realizó según está especificado en la Tabla 1.
Estudio estadístico
Para determinar la asociación entre las variables se empleó el test de χ2 o la prueba exacta de Fisher. Previamente las variables fueron estratificadas de la siguiente forma:
• Índice de Gleason: 5, 6, 7, 8, 9.
• Estadio Tumoral: pT2a, pT2b, pT2c, pT3a, pT3b, pT4.
• Infiltración perineural: si, no.
• Afectación ganglionar: si, no.
• Volumen tumoral: ≤15%, 15-30%, 30%.
• Niveles de PSA: ≤10, 10-15, >15.
Como nivel de significación estadístico se consideró un valor de p ≤ 0,05.
RESULTADOS
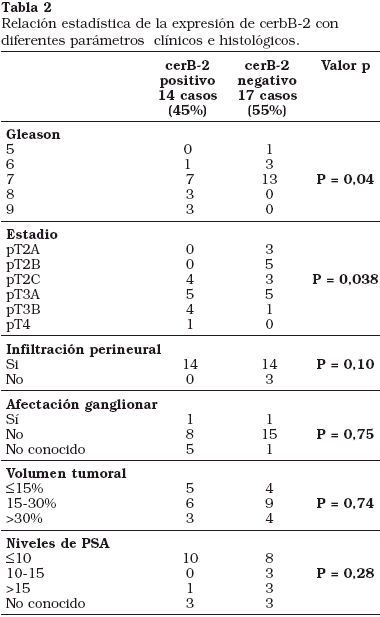
Las características clínico-patológicas de los 32 casos de adenocarcinoma prostáticos evaluados se muestran en la Tabla 2.
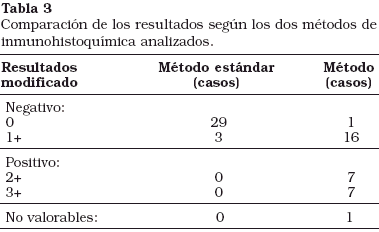
Con el método de inmunohistoquímica estándar no se demostró positividad en la expresión para cerbB-2 en ningún caso (3 casos 1+, 29 casos 0) y se demostró positividad en la expresión para cerbB-2 según el método modificado de Sánchez et al22 en 14 casos (44%), mientras que en 17 casos (53%) la tinción fue negativa y en un caso fue no valorable (3%) (Tabla 3).
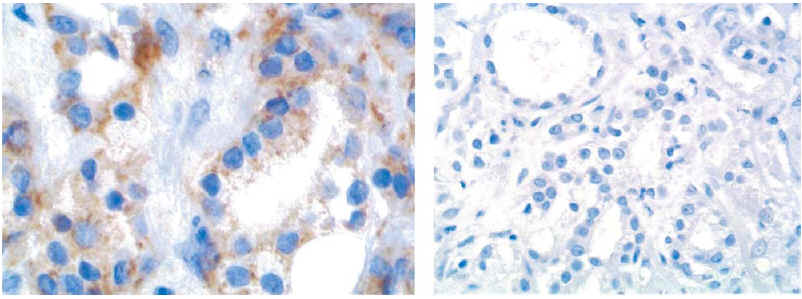
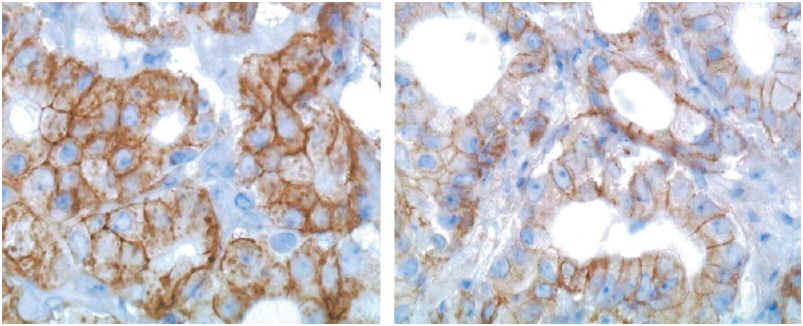
Las Figuras 1 y 2 representa ejemplos de negatividad (a y b) y positividad (c y d) para cerbB-2. Para el estudio estadístico únicamente se valoraron los resultados obtenidos según el método modificado.
FIGURA 1. Ejemplo de tinción inmunohistoquímica para cerbB-2: Adenocarcinoma de próstata con expresión de membrana negativa (0 y 1+).
FIGURA 2. Ejemplo de inmunohistoquímica para cerbB-2: Adenocarcinoma de próstata con expresión de membrana positiva 2+ y 3+).
No se demostró asociación estadística significativa entre la expresión de cerbB-2 en el tumor con la infiltración perineural, afectación ganglionar, volumen tumoral y niveles de PSA. Sin embargo, si observamos asociación estadística significativa entre la expresión de cerbB-2 con el índice de Gleason (p=0,04) y el estadio tumoral (p=0,038).
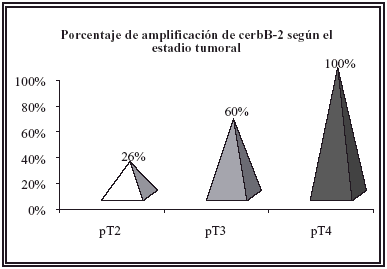
En nuestra serie se observó una relación directa entre el índice de Gleason y el estadio tumoral con la expresión de cerbB-2 en las células tumorales. De forma que cuanto mayor era el índice de Gleason, o el estadio del tumor era más avanzado aumentaba la expresión de cerbB-2. En el grupo de pacientes con estadio tumoral pT2 4 de los 15 pacientes (26%) mostraban amplificación para cerbB-2 en sus células tumorales, mientras que en los casos con estadio pT3 9 de los 15 pacientes (60%) mostraban amplificación para cerbB-2 y el 100% para el estadio pT4 (Fig. 3).
FIGURA 3. Porcentaje de amplificación de cerbB-2 según el estadio tumoral.
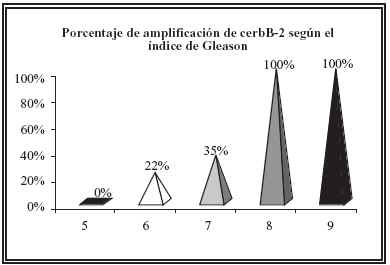
Algo similar ocurre con el índice de Gleason apreciándose una amplificación del 0% para los tumores con índice de Gleason 5, una amplicación del 100% para los tumores con índice de Gleason 8 y 9 y una amplificación del 22% y 35% para los tumores con índice de Gleason 6 y 7 respectivamente (Fig. 4).
FIGURA 4. Porcentaje de amplificación de cerbB-2 según el grado de Gleason.
DISCUSIÓN
Este estudio tiene un doble objetivo: evaluar los métodos semicuantitativos de expresión del cerbB-2 con técnicas de inmunohistoquímica en pacientes con adenocarcinoma de próstata y analizar la correlación entre la expresión de cerbB-2 detectadas por técnicas de inmunohistoquímica con las variables pronósticas clásicas.
La expresión de cerbB-2 en adenocarcinomas prostáticos es muy variable (rango 0-100%)10-25, con un porcentaje medio en la mayoría de los estudios que oscila entre el 25 y el 40%24. Esta discrepancia en las series se debe principalmente a la gran heterogeneidad de las mismas y a la diversidad de métodos empleados para su determinación23.
Los resultados con los dos métodos inmunohistoquímicos analizados fueron muy diferentes. Con la técnica estándar, no se demostró positividad en ningún caso; mientras que con la técnica modificada, la expresión fue del 44%. Estos resultados son totalmente superponibles a los aportados por Sánchez et al23, que según la literatura revisada, es el único trabajo en el que también se analiza la expresión de este marcador con dos métodos inmunohistoquímicos diferentes. En este último, la expresión media de cerbB-2 fue del 3 y 50% con el método estándar y modificado, respectivamente. Nuestra serie y la de Sánchez et al23 nos permite deducir la necesidad de estandarizar la técnica en función del tipo de tejido a analizar con la finalidad de disminuir el número de falsos negativos.
La expresión de cerbB-2 es un factor pronóstico de máxima importancia en varias neoplasias como el cáncer de cérvix9, mama10-12, ovario11 y estómago13. El cáncer de próstata, no parece ser una excepción, aunque los resultados hayan sido menos concluyentes. En la próstata la expresión de cerbB-2 es mayor en los tumores metastásicos que en los localizados y su expresión podría ser un marcador de progresión tumoral22. Además son varias las publicaciones previas, con series amplias y estudios estadísticos que han investigado el valor pronóstico de la expresión de cerbB-2 y su asociación con otros parámetros clínicopatológicos10,15,16,22,23. En algunos de estos estudios se confirma que existe asociación estadística entre la expresión de la oncoproteína y el estadio clínico15,16,23. En este sentido, nuestra serie es equiparable (p=0.038) y el porcentaje de tumores con expresión para el cerbB-2 según el estadio clínico fue del 27%, 60% y 100% para los tumores en estadio pT2, pT3 y pT4, respectivamente. Estos datos sugieren que la expresión de cerbB-2 es un factor pronóstico adverso en el adenocarcinoma prostático que este asociado a la progresión tumoral, ya que su expresión es mayor en los tumores con estadios clínicos más avanzados.
Con respecto la relación entre el índice de Gleason y la expresión de cerbB-2, nuestros resultados son similares a los aportados por Ware10 y Sánchez23. Nosotros observamos mayor expresión de cerbB-2 en los tumores con mayor índice de Gleason. Otros autores14,15,22,24 no demostraron correlación entre la expresión de la oncoproteína y el índice de Gleason, aunque sí, con el pronóstico del tumor. Las discrepancias entre las series pueden reflejar heterogeneidad en la selección de los pacientes24, tratamientos24 y técnicas de inmunohistoquímica empleadas23.
Por último, en nuestra serie no encontramos asociación estadística de la expresión de la oncoproteína con la infiltración perineural, afectación ganglionar, volumen tumoral y niveles de PSA. Tan sólo dos autores22,26 han encontrado una relación directa entre que la expresión de cerbB- 2 y los niveles de PSA. Estos resultados deben de ser confirmados mediante estudios en series más amplias. En lo que conocemos, ningún estudio ha analizado la asociación entre expresión de cerbB-2 y la infiltración perineural, afectación ganglionar y volumen tumoral. Morote et al no observaron diferencias en la inmunotinción con el cerbB-2 y la existencia de metástasis óseas o extraóseas.
En resumen, nuestros resultados:
• Sugieren la necesidad de estandarizar la técnica inmunohistoquímica de cerbB-2 en función del tipo de tejido a analizar, con la finalidad de disminuir el número de falsos negativos.
• La expresión de cerbB-2 podría estar relacionado con el estadio tumoral e índice de Gleason en el adenocarcinoma de próstata. Estos resultados deben ser confirmados mediante estudios en series más amplias.
REFERENCIAS
1. Boring CC, Squires TS, Tong T. Cancer Statistics 1991; Ca,41:19. [ Links ]
2. Jemal A, Thomas A, Murray T, Thun M. Cancer Statistics, 2002. CA Cancer J Clin 2002;52:23-47. [ Links ]
3. Mydlo JH, Kral JG, Volpe M, Axotis C, Macchia RJ, Pertschuk LP. An analysis of microvessel density, androgen receptor, p53 and HER-2/neu expression and Gleason score in prostate cancer. Preliminary results and therapeutic implications. Eur Urol 1998;34:426-432. [ Links ]
4. Hale R, Buckley C, Fox H, Williams J. Prognostic value of c-erbB-2 expression in uterine cervical carcinoma. J Clin Pathol 1992;45:594-596. [ Links ]
5. Wright C, Angus B, Nicholson S et al. Expression of cerbB-2 oncoprotein: a prognostic indicator in human breast cancer. Cancer Res 1989;49:2087-2090. [ Links ]
6. Slamon DJ, Godolphin W, Jones LA, et al. Studies of HER-2/neu proto-oncogene in human breast and ovarion cancer. Science 1989;244:707-712. [ Links ]
7. Borg A, Tandon AK, Sigurdsson H, et al. HER-2/ neu amplification predicts poor survival in node-positive breast cancer. Cancer Res 1990;50:4332-4337. [ Links ]
8. Koeppen HKW, Wright BD, Burt AD, et al. Overexpression of HER2/neu in solid tumours: an immunohistochemical survey. Histopathology 2001;38:96-104. [ Links ]
9. Falck VG, Gullick WJ. c-erbB-2 oncogene product staining in gastric adenocarcinoma. An immunohistochemical study. J Pathol 1989;159:107-111. [ Links ]
10. Ware JL, Maygarden SJ, Koontz WW, Strom S. Immunohistochemical detection of c-erbB-2 protein in human benign and neoplastic prostate. Hum Pathol 1991;22:254-258. [ Links ]
11. Mellon K, Thomston S, Charlton RG, et al. P53, c-erbB-2 and the epidermal growth factor receptor in the benign and malignant prostate. J Urol 1992;147:496-499. [ Links ]
12. Berner A, Nesland JM, Waehre H, Side J, Fossa SD. Hormone resistant prostatic adenocarcinoma: an evaluation of prognostic factors in pre- and post-treatment specimens. Br J Cancer 1993;68:380-384. [ Links ]
13. Kokuho M, Yoshiki R, Hamaguchi A, Okada Y, Tomoyhosi T, Higuchi K. Immunohistochemical study of c-erbB-2 protooncogene product in prostatic cancer. Jpn J Urol 1993; 84:1872-1878. [ Links ]
14. Giri DK, Wadhwa SN, Upadhaya SN, Tawar GP. Expression of NEU/HER-2 oncoprotein (p185neu) in prostate tumors: an immunohistochemical study. Prostate 1993;23:329-336. [ Links ]
15. Sadasivan R, Morgan R, Jennings S, et al. Over-expression of HER-2/NEU may be an indicator of poor prognosis in prostate cancer. J Urol 1993;150:126-131. [ Links ]
16.Kuhn EJ, Kurnot RA, Sesterhenn IA, Chang EH, Moul JW. Expression of the c-erbB-2 (Her-2/neu) oncoprotein in prostate cancer. J Urol 1993;150:1427-1433. [ Links ]
17. Myers RB, Srivastava S, Oelschlager DK, Grizzle WE. Expression of p160erbB-3 and p185erbB-2 in prostatic intraepithelial neoplasia and prostatic adenocarcinoma. J Natl Cancer Inst. 1994;86:1140-1145. [ Links ]
18. Fox SB, Persad RA, Coleman N, Day CA, Silcocks PB, Collins CC. Prognostic value of c-erbB-2 and epidermal growth factor receptor in stage A1 (T1a) prostatic adenocarcinoma. Br J Urol 1994;74:214-220. [ Links ]
19. Lyne JC. Naraghi RM, Melhem MA et al. Human prostate cancer cells respond to but do not express neu differentiation factor (NDF) in spite of HER2/neu gene amplification and protein overexpression. Cancer J Sci Am 1995;3:21-30. [ Links ]
20. Cohen RJ, Cooper K, Haffejee Z, Robinson E, Becker PJ. Immunohistochemical detection of oncogene proteins and neuroendocrine differentiation in different stages of prostate cancer. Pathology 1995;27:229-232. [ Links ]
21. Gu K, Mes-Masson A, Gauthier J, Saad F. Overexpression of Her-2/neu in human prostate cancer and benign and malignant prostate. Cancer 1996;99:185-189. [ Links ]
22. Morote J, Torres I, Caceres C, Vallejo C, Schwartz S, Reventos J. Prognostic value of immunohistochemical expression of the c-erbB-2 oncoprotein in metastasic prostate cancer. Int J Cancer 1999;84:421-425. [ Links ]
23. Sánchez KM, Sweeney CJ, Mass R, et al. Evaluation of HER-2/neu expression in prostatic adenocarcinoma. A request for a standardized, organ specific methodology. Cancer 2002;95:1650-1655. [ Links ]
24. Fossa A, Lilleby W, Fossa SD, Gaudernack G, Torlakovic G, Berner A. Independent prognostic significance of HER-2 oncoprotein expression in pN0 prostate cancer undergoing curative radiotherapy. Int J Cancer 2002;99:100-105. [ Links ]
25. Lara PN, Meyers FJ, Gray CR, et al. Her-2/neu is overexpressed infrequently in patients with prostate carcinoma. Results from california cancer consortium screening trial. Cancer 2002;94:2584-2589. [ Links ]
26. Zhau HE, Wan DS, Zhou J, Miller GJ, Von Eschenbach AC. Expression of cerbB-2/neu proto-oncogene in human prostatic-cancer tissues and cell lines. Mol Carcinogen 1992;5:320-327. [ Links ]
Dra. P. San Miguel Fraile
Servicio de Anatomía Patológica.
Centro Médico POVISA. C/ Salamanca, nº 5.
36211 Vigo (Pontevedra).
(Trabajo recibido el 1 junio de 2004)