Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.33 no.2 feb. 2009
Metástasis cutáneas de un carcinoma transicional vesical productor de ß-HCG
Cutaneous metastases from transitional cell carcinoma of the bladder producing ß-HCG
Miguel Pascual Samaniego, Manuel A. Ruiz Serrano, Mª Ángeles González Núñez, Inmaculada Bravo Fernández*, Juan A. Ramos Martín, Antonio García González
Servicio de Urología. *Servicio de Anatomía Patológica. Hospital San Pedro de Alcántara. Cáceres, España
Dirección para correspondencia
RESUMEN
A pesar de la alta incidencia de carcinoma transicional vesical, la aparición de metástasis cutáneas es infrecuente, más aún como primera manifestación de diseminación metastásica, asociándose a una pobre supervivencia.
La producción ectópica de beta-gonadotropina coriónica humana (ß-HCG) ocurre en un 35% de los carcinomas transicionales vesicales y se ha correlacionado con tumores de alto grado, estadios avanzados, enfermedad metastásica, falta de respuesta a la radioterapia y pobre supervivencia, en virtud de su efecto regulador del crecimiento tumoral por un probable efecto antagonista sobre receptores de la cascada apoptótica.
Presentamos el caso de una paciente de 36 años con carcinoma transicional de vejiga productor de ß-HCG que presentó dos metástasis cutáneas como primer signo de enfermedad a distancia. Ambas circunstancias asociadas de forma excepcional identificaron un comportamiento muy agresivo del tumor y su mal pronóstico, desarrollando a corto plazo un estallido metastático a múltiples niveles incluyendo una metástasis pericárdica.
Palabras clave: Metástasis cutánea. Carcinoma transicional vesical. Beta-gonadotropina coriónica humana.
ABSTRACT
In spite of the high incidence of transitional cell carcinoma, cutaneous metastases are infrequent, especially when they are the first sign of metastatic spread, with a low survival rate.
Thirty five per cent of transitional cell carcinoma of the bladder have ectopic beta- human chorionic gonadotropin (ß-HCG) production. It has been related with high grade tumors, advanced stage, metastatic disease, radioresistent tumors and low survival rate because of its effect as a growth modulator with a probably antagonist action in the apoptotic cascade.
We present a thirty six years old woman affected by a transitional cell carcinoma of the bladder producing ß-HCG that showed two cutaneous metastases as first sign of metastatic disease. The exceptional coincidence of these two circumstances announced a very aggressive tumor behaviour and bad prognostic, with a quickly multiple metastatic dissemination including a pericardic metastases.
Key words: Cutaneous metastases. Transitional bladder cancer. Beta-human chorionic gonadotropin.
La producción ectópica de gonadotropina coriónica humana (HCG) por un tumor urotelial fue descrita en 1972 por Civantos y Rywlin1 . La introducción del radioinmunoensayo permitió detectar la subunidad ß-HCG libre como la forma mayoritariamente expresada por los tumores epiteliales no trofoblásticos2, correlacionándose significativamente con carcinomas transicionales vesicales más agresivos3, de alto grado y estadio2, resistentes a la radioterapia, con mayor propensión a las metástasis y en definitiva de mal pronóstico, detectándose en aproximadamente el 35% de los carcinomas transicionales vesicales.
Los estudios inicialmente de Guillot4 demostrando un aumento dosis dependiente del número de células tumorales del cáncer vesical tras incubarlas in vitro con ß-HCG y posteriormente de Buttler5, comprobando su efecto inhibidor dosis dependiente de la apoptósis de las células tumorales, explican que caracterice a los pacientes de mal pronóstico.
Por otro lado, la aparición de metástasis cutáneas en el cáncer vesical transicional es muy infrecuente con una incidencia del 0,84%, relacionándose con estadios muy avanzados y supervivencias inferiores a 6 meses. La coincidencia excepcional en nuestro caso de un carcinoma vesical transicional productor de ß-HCG en una paciente joven, con metástasis cutáneas como primer signo de enfermedad a distancia, nos anticipó un comportamiento extraordinariamente agresivo con resultado de estallido metastásico a muy corto plazo.
Caso clínico
Mujer de 36 años, alérgica a codeína y tetraciclinas, con antecedentes de hipotiroidismo, talasemia minor, alopecia areata occipital, intervenida de sinus pilonidal, un parto vaginal eutócico. Remitida desde consulta de ginecología donde acudió por dolor hipogástrico intermitente irradiado a genitales, asociado a disuria, polaquiuria y tenesmo vesical de 5 meses de evolución, con hematuria microscópica autolimitada caprichosa en el último mes, presentando un falso positivo en el test de embarazo, dado que la paciente no mantenía relaciones coitales. Como antecedente urológico, refería cistitis de repetición de al menos 3 episodios por año en los últimos 7 años, manejadas desde atención primaria. En los últimos dos meses aumentó su clínica irritativa miccional con frecuencia diurna cada hora y nocturna de 7 veces, explicando episodios ocasionales compatibles con neumaturia, sin síntomas obstructivos del tracto urinario inferior. Menstruaciones regulares normales. A la exploración no se palpaban masas abdominales, la puñopercusión renal era negativa, los genitales externos normales, sin prolapsos ni dolor al tacto vaginal bimanual en cuya cara anterior se identificaba una masa indurada móvil.
Analíticamente, en sangre se encontraron elevados los niveles de ß-HCG (557UI/l), antígeno carcinoembrionario (25,4 ng/ml), Ca 19-9 (311 UI/ml) y Ca 125 (63,2 UI/ml), siendo normal el valor de la alfafetoproteína. Hb: 11,2 g/dl, 15200 leucocitos/mm3, resto normal incluido el estudio de coagulación. Test de embarazo repetido en orina falsamente positivo y análisis con intensa piuria, nitritos negativos y más de 200 hematíes/campo.
La ecografía abdominal informaba de engrosamiento irregular hiperecogénico del fondo y la pared vesical anterior por probable neoplasia, siendo los riñones, el útero y los anejos normales. La urografía intravenosa mostraba un gran defecto de repleción hemivesical izquierdo, siendo normal el tracto urinario superior (Fig. 1). Se realizó una uretrocistoscopia confirmando una tumoración sólida de aspecto infiltrante, en la cara lateral izquierda, fondo, cara anterior y hemitrígono izquierdo hasta el cuello vesical. Se completó el estudio mediante RMN abdominopélvica comprobando un severo engrosamiento concéntrico parietal vesical sin afectación de la grasa perivesical, con presencia de aire en la cúpula por posible fístula enterovesical y adenopatía de 15 mm iliaca derecha (Fig. 2). La radiografía de tórax preoperatoria fue normal.
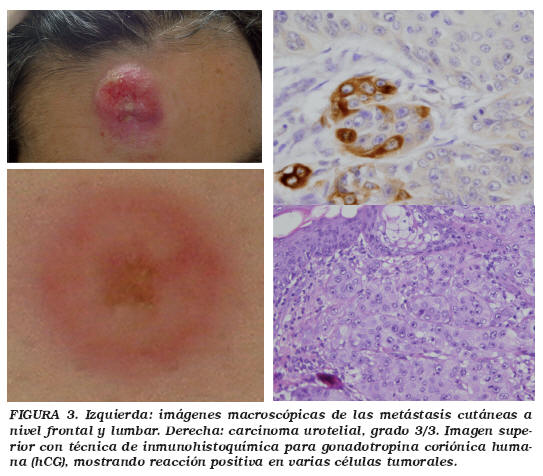
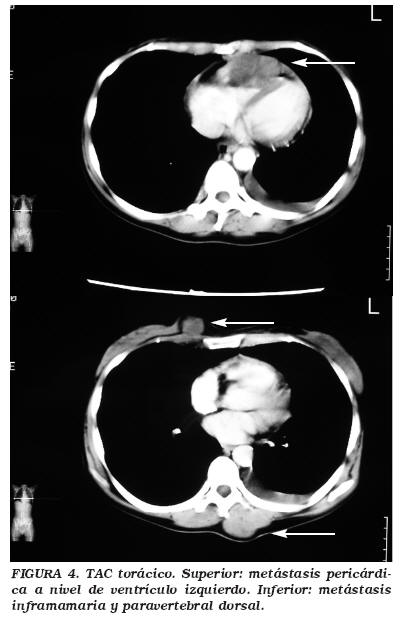
Se realizó una resección transuretral vesical de la tumoración, con informe patológico de carcinoma transicional vesical invasivo de alto grado G3T2, sin diferenciación trofoblástica siendo la inmunohistoquímica compatible con origen urotelial (CK7 y CK34BE12 positivos). Dos semanas tras la cirugía la paciente presentaba dos lesiones cutáneas de rápido crecimiento. Un nódulo sólido a nivel frontal, ulcerado y sangrante al roce y otra lesión lumbar sobreelevada de crecimiento excéntrico. Ante la sospecha de metástasis cutáneas se realizó exéresis con informe patológico de tumor sólido infiltrando piel, tejidos blandos subyacentes incluyendo músculo y fascia, afectando los bordes en profundidad al hueso frontal, con inmunofenotipo compatible con metástasis cutáneas de carcinoma transicional infiltrante de alto grado (Fig. 3). Se inició quimioterapia con cisplatino y gemcitabina quincenal. El TAC toracoabdominal (Fig. 4) a los dos meses mostraba un estallido metastásico con múltiples implantes a nivel inframamario izquierdo, glúteo, psoas, músculo paravertebral dorsal y lumbar izquierdos, metástasis pericárdica de 4 cm en cara anterior de ventrículo izquierdo, múltiples adenopatías retroperitoneales y metástasis osteolíticas en sacro izquierdo y parrilla costal, acetábulo e isquion derechos. Localmente la extensión del tumor vesical infiltraba el sigma y el uréter izquierdo distal. La paciente en tratamiento paliativo, falleció a los tres meses del debut metastásico a nivel cutáneo.
Discusión
La producción de HCG se ha detectado en tumores no trofoblásticos de distintos órganos como estómago, pulmón, riñón, próstata, mama o hígado además del cáncer vesical, no resultando infrecuente en casos pobremente diferenciados6. Se puede determinar en distintas muestras como orina de 24 horas, tejido tumoral fresco o fijado o radioinmunoensayo en plasma. En los tumores no trofoblásticos la molécula pierde la cadena de carbohidratos provocando una vida media en sangre menor de un minuto, lo que explica su rara asociación a ginecomastia. La producción de HCG intacta por cáncer vesical se ha asociado con carcinomatosis7, pero es la subunidad ß-HCG libre detectada por radioinmunoensayo su forma más expresada2. Iles encontró niveles de ß-HCG superiores a 25 UI/l en sangre y orina sólo en pacientes con metástasis de cáncer vesical, de modo que se detectaba en suero en el 76% de los pacientes con metástasis evidentes frente al 4% sin evidencia de metástasis3, como ocurría inicialmente en el caso que presentamos. Otro estudio prospectivo en pacientes con carcinoma vesical T2-T4 mostró diferencias significativas en el mayor desarrollo de metástasis en pacientes con niveles elevados de ß-HCG en orina preoperatoria y una fuerte asociación entre la expresión de ß-HCG y una pobre supervivencia8. La ß-HCG se detecta en aproximadamente el 35% de los carcinomas transicionales vesicales correlacionándose con alto grado tumoral y estadio avanzado. Entre sus variantes moleculares, la ß-HCG core fragment se detecta en el 17% de los casos como segunda forma más frecuentemente expresada y se forma directamente en las células productoras de ß-HCG tras una modificación proteolítica intracelular9. La detección por radioinmunoensayo localizaba típicamente las células productoras en las líneas de invasión tumoral, correspondientes a áreas con alto grado de proliferación e índice mitótico9, no asociándose a carcinoma in situ. Esto hacía pensar en una posible acción biológica de la ß-HCG. Sin embargo, las subunidades libres de la HCG no tienen por si mismas actividad endocrina10, por lo que inicialmente se consideró que su expresión por los tumores epiteliales no tenía significado biológico. El estudio de la estructura tridimensional de la HCG mostró que sus subunidades pertenecían a la familia de factores de crecimiento con enlace de cistina11 por lo que se pensó en una posible acción local como factor de crecimiento, planteándose el origen de su producción por el tumor de células transicionales en una metaplasia9 o desdiferenciación celular12 aún no bien identificada. Estudios in vitro posteriores mostraron que la adicción de la ß-HCG a un cultivo celular de tumor vesical incrementaba la población celular, aunque esto no se acompañaba de aumentos en el índice de replicación. Puesto que la población celular es un balance entre mitosis y apoptósis, Butler5 valoró el efecto de la ß-HCG en la apoptósis, demostrando en estudios in vitro una reducción del número de cuerpos apoptóticos dosis dependiente. Siendo el TGF-ß1 un conocido inductor de la apoptósis epitelial y en virtud de las particulares similitudes topológicas entre ß-HCG y TGF-ß1 y de la naturaleza opuesta de sus efectos, se comprobó in vitro la capacidad de la ß-HCG para inhibir de forma dosis dependiente al TGF-ß1 incubados simultáneamente, sugiriendo una posible interacción de la ß-HCG con el receptor de TGF-ß, lo que atribuiría su supuesto efecto en el crecimiento tumoral a una acción inhibidora de la apoptósis por antagonismo en los receptores de la cascada apoptótica5. Estos estudios aportan evidencias sobre la acción de la ß-HCG como regulador del crecimiento tumoral justificando la naturaleza agresiva de los tumores productores y su pobre pronóstico7 como en el caso que presentamos. En un metaanálisis de 40 estudios sobre tumores epiteliales de células no germinales productores de ß-HCG, el 78% de los que investigaron pronóstico, reportaron una fuerte asociación a pobre pronóstico y a enfermedad metastásica7. Ante los últimos conocimientos y aunque la incidencia del 30-40% de tumores vesicales productores de ß-HCG es baja para plantear su uso sistemático, su fuerte correlación con el grado tumoral, estadio, supervivencia, radiorresistencia y enfermedad metastásica, puede servirnos para detectar a aquellos pacientes con tumores de peor pronóstico dentro del heterogéneo comportamiento del cáncer vesical de células transicionales.
Las metástasis cutáneas se producen en menos del 1% de los tumores vesicales13. Su distribución más habitual afecta a la piel próxima al tumor primario por propagación linfática, la más frecuente. Los implantes a distancia se deben a diseminación hematógena, como en el caso aquí presentado. Su aspecto más común es un nódulo redondeado siendo menos frecuentes las formas ulceradas y necróticas. Son típicamente sólidos, de rápido crecimiento y con frecuencia múltiples, en cara, tronco y extremidades14. Suelen presentarse en el contexto de enfermedad metastásica multiorgánica aunque ocasionalmente son la primera manifestación sistémica con supervivencias en cualquier caso inferiores a 6 meses13. Su resección local asociada a quimioterapia sistémica con intención paliativa, mejora los síntomas locales y la calidad de vida sin modificar la baja supervivencia15.
En este caso, el hallazgo casual a partir de un falso positivo en el test de embarazo, de un cáncer vesical productor de ß-HCG, asociado a la temprana aparición de metástasis cutáneas como primer signo de enfermedad diseminada, permitieron anticipar el pronóstico infausto de esta joven paciente, que desarrollo múltiples metástasis en el plazo de dos meses, incluyendo localizaciones tan atípicas como el pericardio ventricular (Fig. 4). La determinación de ß-HCG en el cáncer vesical infiltrante, especialmente cuando se detectan niveles elevados sin signos clínicos iniciales de metástasis, podría ayudar en la diferenciación de pacientes de mal pronóstico así como en la orientación de su manejo terapéutico.
Referencias
1. Civantos F, Rywlin AM. Carcinomas with trophoblastic differentiation and secretion of chorionic gonadotrophins. Cancer. 1972;29(3):789-798. [ Links ]
2. Iles RK, Chard T. Human chorionic gonadotropin expression by bladder cancers: biology and clinical potential. J Urol. 1991;145(3):453-458. [ Links ]
3. Iles RK, Jenkins BJ, Oliver RT, Blandy JP, Chard T. Beta human chorionic gonadotrophin in serum and urine. A marker for metastatic urothelial cancer. Br J Urol 1989;64(3):241-244. [ Links ]
4. Guillot DJ, Iles RK, Chard T. The effects of ß-human chorionic gonadotrophin on the in vitro growth of bladder cancer cell lines. Br J Cancer. 1996;73(3):323-326. [ Links ]
5. Butler SA, Ikram MS, Mathieu S, Iles RK. The increase in bladder carcinoma cell population induced by the free beta subunit of human chorionic gonadotrophin is a result of an anti-apoptosis effect and not cell proliferation. Br J Cancer. 2000; 82(9): 1553-1556. [ Links ]
6. Jacobsen AB, Nesland JM, Fosså SD, Pettersen EO. Human chorionic gonadotropin, neuron specific enolase and deoxyribonucleic acid flow cytometry in patients with high grade bladder carcinoma. J Urol. 1990;143(4):706-709. [ Links ]
7. Iles RK. Ectopic hCGbeta expression by epithelial cancer: malignant behaviour, metastasis and inhibition of tumor cell apoptosis. Mol Cell Endocrinol. 2007;2(260-262):264-270. [ Links ]
8. Iles RK, Persad R, Trivedi M, Sharma KB, Dickinson A, Smith P, et al. Urinary concentration of human chorionic gonadotrophin and its fragments as a prognostic marker in bladder cancer. Br J Urol. 1996;77(1):61-69. [ Links ]
9. Dirnhofer S, Koessler P, Ensinger C, Feichtinger H, Madersbacher S, Berger P. Production of trophoblastic hormones by transitional cell carcinoma of the bladder: association to tumor stage and grade. Hum Pathol. 1998;29(4):377-382. [ Links ]
10. Pierce JG, Parsons TF. Glycoprotein hormones: structure and function. Annu Rev Biochem. 1981;50:465-495. [ Links ]
11. Lapthorn AJ, Harris DC, Littlejohn A, Lustbader JW, Canfield RE, Machin KJ, et al. Crystal structure of human chorionic gonadotropin. Nature. 1994 Jun 9;369(6480):455-461. [ Links ]
12. Wirt DP, Nagle RB, Gustafson HM, Philpott PJ, Kuivinen NA, Schuchardt M. The probable origin of an anemone cell tumor: metastatic transitional cell carcinoma producing HCG. Ultrastruct Pathol. 1984;7(4):277-288. [ Links ]
13. Mueller TJ, Wu H, Greenberg RE, Hudes G, Topham N, Lessin SR, et al. Cutaneous metastases from genitourinary malignancies. Urology. 2004;63(6):1021-1026. [ Links ]
14. Eardley I, Abercrombie J, Wright BJ, Hendry WF. Cystic cutaneous metastases from transitional cell carcinoma of the bladder. J R Soc Med. 1987; 80(5): 314-315. [ Links ]
15. Otto T, Krege S, Suhr J, Rubben H. Impact of surgical resection of bladder cancer metastases refractory to systemic therapy on performance score: a phase II trial. Urology. 2001; 57(1):55-59. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Miguel Pascual Samaniego
Servicio de Urología. Hospital Universitario de Valladolid
Avda. Ramón y Cajal, 3 - 47005 Valladolid
Tel.: 983 420 000 Extensión 226
E-mail autor: mpaski10@yahoo.es
Trabajo recibido: junio 2007
Trabajo aceptado: julio 2007