Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.34 no.8 sep. 2010
Detección de renina en carcinomas cromófobos de células renales
Detection of renin in chromophobe renal cell carcinomas
L.F. Ariasa, P. Brunevalb y J. Blancoc
aGrupo PRYT, Departamento de Patología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
bHopital Europeen Georges Pompidou, Service Anatomo-Pathologie, París, Francia
cDepartamento de Patología, Hospital Clínico San Carlos, Madrid, España
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar la expresión de renina en carcinomas cromófobos de células renales y la posible asociación de esta expresión con hipertensión arterial (HTA) sistémica.
Material y métodos: Estudio descriptivo retrospectivo. Se incluyeron todos los casos con diagnóstico confirmado de carcinoma cromófobo entre 1990-2004: 31 casos provenientes de 31 pacientes. De los bloques de tejido tumoral incluidos en parafina se hizo inmunohistoquímica para detectar renina usando un anticuerpo monoclonal. De los archivos de historias clínicas obtuvimos información completa con respecto a la presión arterial sistémica antes y después de la resección tumoral. Comparamos frecuencias de HTA en casos con y sin expresión de renina (prueba de Fisher o χ2, según lo adecuado) y evolución de la HTA posresección.
Resultados: En 10 de los 31 tumores (32,3%) hubo inmunotinción para renina; esta tinción fue difusa en 6 casos y focal en los 4 restantes. Se detectó HTA en 6 de los 10 pacientes con expresión de renina (60,0%) y en 6 de los 21 pacientes sin expresión de renina (28,6%) (p=0,13). Después de la resección tumoral, ningún paciente con expresión de renina e HTA mostró remisión de la hipertensión.
Conclusión: En el carcinoma cromófobo de células renales es frecuente la expresión de renina, pero esta renina parece clínicamente inactiva. Serán necesarios más estudios para conocer las implicaciones en el diagnóstico, la patogénesis y la presentación clínica de esta expresión.
Palabras clave: Inmunohistoquímica. Carcinoma cromófobo de células renales. Tumores renales. Renina.
ABSTRACT
Aim: To evaluate frequency of renin detection in chromophobe renal cell carcinoma, and if this expression was associated to systemic high blood pressure.
Material and methods: A descriptive retrospective study. All the cases with confirmed diagnosis of chromophobe carcinoma and resected between 1990 and 2004 were included in our study: 31 cases from 31 patients. Immunohistochemistry was carried out on sections from the paraffin-embedded tissue using a monoclonal antiserum. Patient blood pressure before and after neoplasm resection was registered from clinical histories. We compared frequencies of hypertension in cases with and without expression of renin (Fisher´s text or χ2 as appropriate) and evolution of HTA after tumour resection.
Results: We found that 10 of 31 tumors (32.3%) contained immunoreactivity for renin; this staining was diffuse in 6 cases and focal in the other 4. Systemic hypertension was detected in 6 of 10 (60.0%) patients with renin expression and in 6 of 21 (28.6%) patients without renin immunolabeling (p=0.13). After tumor resection none patient with renin expression and high blood pressure showed remission of the hypertension.
Conclusion: Renin is frequently expressed in chromophobe renal cell carcinoma, but this renin appears clinically inactive. More studies will be necessary to know implications of this feature on clinical presentation, diagnosis or pathogenesis.
Key words: Immunohistochemistry. Chromophobe renal cell carcinoma. Renal tumors. Renin.
Introducción
Muchas neoplasias benignas y malignas pueden secretar hormonas, algunas activas y otras sin evidencia de actividad clínica; varios tumores renales han demostrado secreción de estos productos1,2. Hay pequeñas series de casos e informes de casos aislados de tumores renales epiteliales que expresan renina3-8. La renina es sintetizada en las células del aparato yuxtaglomerular renal como una proenzima de 406 aminoácidos: la prorrenina, la cual es inactiva desde el punto de vista enzimático, pero es convertida por proteólisis en la enzima activa (renina), que contiene 340 aminoácidos9-11. La enzima responsable de la conversión de prorrenina en renina no ha sido identificada aún11. En muchos de los casos de tumores que expresan renina, la enzima ha demostrado ser inactiva (sin asociación con hipertensión arterial [HTA] sistémica); la hormona podría ser secretada al plasma como una forma inactiva o podría ser almacenada en el citoplasma de la célula, sin secretarse12. La mayoría de estos trabajos y casos han sido publicados antes de la década de 1990 y algunos antes de 1985, cuando el carcinoma cromófobo y el oncocitoma renal no habían sido bien reconocidos y caracterizados, así que en estas publicaciones no suele determinarse el tipo específico de tumor renal epitelial, al menos como se clasifica en la actualidad13. Más frecuentemente informado en la literatura médica es la expresión de renina en tumores de Wilms (nefroblastomas)14-17. También en tumores originados en otros órganos se ha informado expresión de renina12,18-23.
En una extensa revisión de la literatura médica encontramos, de acuerdo con la descripción microscópica de las neoplasias y/o de las imágenes microscópicas publicadas, que muchos de estos tumores renales productores de renina tienen aspecto granular eosinofílico del citoplasma de sus células, lo que sugiere que podrían ser carcinomas cromófobos, uno de los tumores renales que más frecuentemente tiene este aspecto citológico13. Esto ha llevado a plantearnos si en este tipo histológico de carcinoma es frecuente la expresión de renina. En una revisión retrospectiva del archivo de uno de los autores encontramos 31 casos de carcinoma cromófobo, que revaluamos microscópicamente e incluimos en el presente trabajo.
El objetivo de este estudio fue investigar, por inmunohistoquímica (IHQ), si los carcinomas cromófobos expresan renina, y, si es así, con qué frecuencia, qué características microscópicas tiene la inmunomarcación y si su expresión está asociada con HTA sistémica.
Material y métodos
Estudio descriptivo, retrospectivo, en el que se incluyeron casos de carcinoma cromófobo diagnosticados entre enero de 1990 y mayo de 2004. La razón para incluir solo casos diagnosticados a partir de 1990 fue una mejor calidad en el procesamiento del tejido a partir de este año (fijación e inclusión en parafina) y, por tanto, son más adecuados para la realización de la IHQ. Todos los casos de tumores renales fueron revisados y se seleccionaron sólo casos de carcinoma cromófobo diagnosticados con completa certeza. Se excluyeron aquellos casos en los que el diagnóstico no fue completamente seguro (principalmente casos con diagnóstico presuntivo de carcinoma cromófobo, variante eosinofílica versus oncocitoma). Con estos criterios se encontraron 31 casos (provenientes de 31 pacientes), los cuales fueron incluidos para detección de renina por IHQ. En todos tenemos datos clínicos básicos e información sobre la presión arterial sistémica, antes y después de la resección del tumor. Todos los casos corresponden a lesiones resecadas quirúrgicamente (nefrectomía total o parcial); no hay casos diagnosticados por biopsia incisional o con aguja. Las variables incluidas fueron las siguientes: edad y sexo al diagnóstico, tamaño tumoral, diagnóstico de HTA sistémica antes de la resección tumoral, persistencia o no de la HTA posresección, e inmunomarcación para renina y su extensión (ver más adelante). El material del estudio consistió en los cortes histológicos, los bloques de tejido incluidos en parafina y la información clínica disponible en los archivos respectivos.
Inmunohistoquímica. De los bloques de tejido tumoral seleccionados se realizaron cortes de 4μm en placas cargadas, adecuadas para IHQ; estos cortes fueron desparafinados con xilol por 30min y rehidratados usando etanol. La IHQ fue realizada usando un anticuerpo monoclonal contra renina humana. Este anticuerpo ha sido probado y ha demostrado ser específico24 es un anticuerpo no disponible comercialmente y la dilución es de 1:1.000 y la incubación de 40min. La actividad de peroxidasa endógena fue bloqueada con peróxido de hidrógeno. La recuperación antigénica se realizó con buffer fosfato en vaporizador, con ácido etilendiaminotetraacetic, pH 9,0, por 30min. Se usó diaminobenzidina como cromógeno. Como control positivo se usaron cortes de un tumor renal de células yuxtaglomerulares (reninoma). La tinción de renina fue considerada positiva si se expresaba en el citoplasma de las células neoplásicas. La extensión de la tinción fue semicuantificada como mínima, si el 5% o menos de las células tumorales fueron positivas; como focal, si del 5-50% de las células tumorales fueron positivas, o como difusa, si más del 50% de las células tumorales fueron positivas.
Análisis estadístico. Los resultados son presentados como medianas y valores mínimo y máximo, o como porcentajes. Para comparar porcentajes usamos prueba de Fisher o χ2 según lo adecuado. Los análisis fueron hechos con SPSS®, Chicago, Il, versión 17.
Resultados
La mediana de la edad de los pacientes al momento del diagnóstico fue de 60 años (32-80); 18 de ellos (58,1%) fueron mujeres. El tamaño tumoral varió entre 2,5-23,0cm (mediana de 7,0cm). La estadificación tumoral al momento de la resección fue estadio I: 15 pacientes (48,4%); estadio II: 11 pacientes (35,5%); estadio III: 3 pacientes (9,7%), y estadio IV: 2 pacientes (6,5%). En 12 pacientes (38,7%) hubo diagnóstico de HTA antes de la resección tumoral; en estos 12 pacientes la hipertensión fue leve a moderada (estadio I o II25). Ninguno de los pacientes presentaba daño de órgano atribuible a la HTA. En ninguno de los casos se encontraron otras lesiones renales o lesiones tumorales en otros órganos.
Inmunotinción para renina. Encontramos positividad para renina en 10 de los 31 carcinomas (32,3%). Esta inmunomarcación fue granular y difusa (en más del 50% de las células tumorales) en 6 casos (19,4%), y focal (>5% a 50%) en 4 casos (12,9%) (figuras 1 y 2). En 2 casos, la marcación se evidenció en el 100% de las células tumorales. Llamativamente, en 2 casos la positividad granular fue evidenciada en la porción apical del citoplasma, y en ambos la inmunotinción fue difusa (>50% de las células). En los 8 casos restantes, la marcación se evidenció en todo el citoplasma (figuras 1 y 2). En los 10 casos positivos, las células que expresaron positividad para renina fueron células neoplásicas.
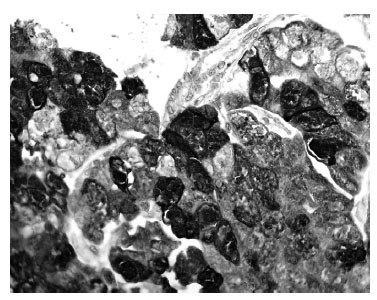
Figura 1. Carcinoma cromófobo con intensa inmunomarcación difusa,
la cual se expresa en todo el citoplasma de las células neoplásicas.
Inmunotinción para renina, aumento original ×400.
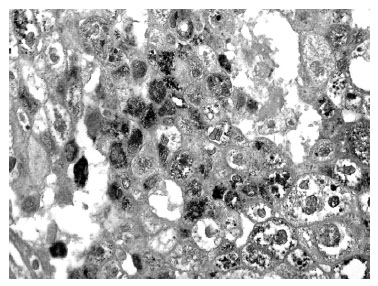
Figura 2. En 4 de los 10 casos positivos para renina la inmunotinción
fue focal: en menos del 50% de células neoplásicas, como en este
caso en el que las células que expresan la hormona se mezclan con
otras negativas. Inmunotinción para renina, aumento original ×400.
Del total de 31 casos, 7 correspondían a la variante eosinofílica del carcinoma cromófobo. En otros 5 casos, áreas con células que tenían aspecto citoplasmático granular eosinofílico fueron incluidas en los cortes seleccionados para la inmunomarcación; de estos 12 casos con células eosinofílicas, 4 mostraron expresión de renina (33,3%), comparados con 6 de 19 casos con aspecto citoplasmático usual (no eosinofílico) (31,6%) (p=1,00).
Expresión de renina e hipertensión arterial sistémica. En 6 de los 10 pacientes (60%) con expresión de renina y en 6 de los 21 pacientes (28,6%) sin expresión de renina en el carcinoma, se detectó HTA previamente a la resección tumoral; sin embargo, esta mayor proporción de HTA en pacientes con expresión de renina no fue estadísticamente significativa (p=0,13; prueba de Fisher). Después de la resección de la neoplasia, los 6 pacientes con HTA y expresión de renina en las células neoplásicas continuaron con HTA, con una mediana de seguimiento de 20 meses (12-65), todos recibiendo medicamentos para su control en algún momento durante los 12 meses posteriores a la resección.
Discusión
En la literatura médica se informan muchos casos de tumores de células renales productores de hormonas, y hay algunas pequeñas series de casos de tumores epiteliales productores de renina; sin embargo, no hay un estudio que nos indique la frecuencia de su expresión en cada tipo histológico de tumor renal. En nuestro trabajo buscamos la frecuencia de expresión en un tumor que, aunque no muy común (aproximadamente el 5% de los tumores epiteliales renales13,26), vemos con alguna frecuencia en nuestra práctica diaria. En este trabajo nos centramos en detectar la expresión de la enzima y su posible asociación con manifestaciones sistémicas: HTA.
Nuestros resultados muestran que aproximadamente una tercera parte de los carcinomas cromófobos expresan renina en el citoplasma de sus células; sin embargo, no sabemos aún el significado, el origen y las implicaciones clínicas de este hallazgo. Aunque fue algo más frecuente encontrar HTA en pacientes con positividad para renina (el 60 vs. el 28,6%), esta mayor frecuencia no demostró asociación estadísticamente significativa y en 4 de los 10 casos renina positivos no hubo HTA. Más relevante que estos datos es que en todos los 6 pacientes con expresión de renina e HTA, esta no desapareció con la resección tumoral y los pacientes continuaron con cifras de presión arterial sistémica en rangos similares a los previos a la resección y recibiendo medicamentos antihipertensivos. Este hallazgo sugiere que la renina detectada en el tejido no es activa (o es estructuralmente anormal), o que no es liberada a la circulación sistémica. Otra interesante opción, que ha sido planteada por otros autores, es que la renina detectada podría ser captada del plasma por las células tumorales5.
Sería útil saber si la renina es sintetizada o captada por las células neoplásicas; conocer la localización precisa de los gránulos de renina en el citoplasma podría ayudar en esta tarea: si la renina (o prorrenina) es sintetizada por las células, al menos algunos de los gránulos de renina estarían localizados en el retículo endoplasmático liso. Con IHQ no es posible determinar la localización exacta de los gránulos. En reninomas, ellos aparecen en todo el citoplasma, similar a 8 de nuestros casos; sin embargo, en 2 de ellos la localización fue apical, sugiriendo la posibilidad de que los gránulos estén en una organela citoplasmática, como vesículas de endocitosis.
La apariencia granular del citoplasma en la variante eosinofílica del carcinoma cromófobo de células renales es debida a la presencia de abundantes mitocondrias, como se ha evidenciado en estudios ultraestructurales27,28; sin embargo, este aspecto granular es frecuente en otras neoplasias renales positivas para renina (que han incluido carcinomas convencionales y oncocitomas)3-8, lo que podría sugerir que los gránulos de renina también pueden dar este aspecto granular, eosinofílico, al citoplasma de tumores que expresan la enzima. En el presente trabajo encontramos expresión de renina tanto en células granulares eosinofílicas como en las células con el aspecto granular claro del carcinoma cromófobo usual, y no hubo diferencia en la frecuencia de expresión de la enzima para casos de tumores eosinofílicos (33,3%) y casos con aspecto citológico usual (31,6%), por lo que el aspecto citoplasmático no tiene relación, en nuestra serie, con la expresión de renina.
En este trabajo buscamos detectar renina por IHQ en un tumor renal que no es el más frecuente, y ha mostrado resultados interesantes que nos llevan a plantear la necesidad de trabajos posteriores para conocer el origen de esta renina, si es una proteína estructuralmente modificada, si es o no liberada a la sangre, por qué no es activa desde el punto de vista clínico y si hay diferencia en la frecuencia de expresión de la enzima con respecto a otros tipos histológicos de tumores epiteliales renales. Aunque nosotros no tenemos estudios ultraestructurales en estos casos y desconocemos niveles plasmáticos de renina o de prorrenina, nuestros resultados son muy importantes para abordar otros proyectos buscando conocer mejor las implicaciones clínicas, de diagnóstico y/o terapéuticas de esta expresión aberrante.
De otro lado, aún desconocemos si esta expresión de renina puede tener implicaciones diagnósticas en la clasificación o "tipificación" histológica de tumores renales; nuestro trabajo, en el cual incluimos solo un tipo de tumor, no nos permite saber si puede tener utilidad para el diagnóstico diferencial. En cuanto a las implicaciones de esta expresión de renina en el entendimiento de la histogénesis, es posible que ayude a comprenderla mejor, ya que hasta el momento se ha creído que los carcinomas cromófobos son derivados del epitelio tubular renal, sitio en el que no se describe producción de renina.
En conclusión, estudiamos una serie de carcinomas cromófobos de células renales en los que logramos demostrar expresión citoplasmática de renina en cerca de una tercera parte de ellos. Esta renina demuestra ser inactiva, ya que no se asoció con HTA. Los carcinomas cromófobos pueden expresar renina en sus células mucho más frecuentemente de lo que creíamos. Este hallazgo plantea interrogantes para futuros proyectos que nos permitan buscar relevancia de esta expresión con respecto a características clínicas, diagnóstico, histogénesis o tratamiento.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Palapattu G.S., Kristo B., Rajfer J. Paraneoplastic syndromes in urologic malignancy: The many faces of renal cell carcinoma. Rev Urol. 2002; 4:163-70. [ Links ]
2. Wiesener M.S., Münchenhagen P., Gläser M., Sobottka B.A., Knaup K.X., Jozefowski K., et al. Erythropoietin gene expression in renal carcinoma is considerably more frequent than paraneoplastic polycythemia. Int J Cancer. 2007; 121:2434-42. [ Links ]
3. Hollifield J.W., Page D.L., Smith C., Michelakis A.M., Staab E., Rhamy R. Renin-secreting clear cell carcinoma of the kidney. Arch Intern Med. 1975; 135:859-64. [ Links ]
4. Leckie B., Brown J.J., Fraser R., Kyle K., Lever A.F., Morton J.J., et al. A renal carcinoma secreting inactive renin. Clin Sci Mol Med Suppl. 1978; 4:159s-61. [ Links ]
5. Lindop G.B., Fleming S. Renin in renal cell carcinoma. An immunocytochemical study using an antibody to pure human renin. J Clin Pathol. 1984; 37:27-31. [ Links ]
6. Lindop G.B., Leckie B., Winearls C.G. Malignant hypertension due to a renin-secreting renal cell carcinoma-an ultrastructural and immunocytochemical study. Histopathology. 1986; 10:1077-88. [ Links ]
7. Nielsen H.O. Arterial hypertension due to a renin-producing renal carcinoma. Scand J Urol Nephrol. 1975; 9:293-6. [ Links ]
8. Steffens J., Girardot P., Bock R., Braedel H.U., Alloussi S., Ziegler M. Carcinoma of the kidney with production of renin. A special form of hypertension. Ann Urol (Paris). 1992; 26:5-9. [ Links ]
9. Hardman J.A., Hort Y.J., Catanzaro D.F., Tellam J.T., Baxter J.D., Morris B.J., et al. Primary structure of the human renin gene. DNA. 1984; 3:457-68. [ Links ]
10. Hobart P.M., Fogliano M., O'Connor B.A., Schaefer I.M., Chirgwin J.M. Human renin gene: Structure and sequence analysis. Proc Natl Acad Sci USA. 1984; 81:5026-30. [ Links ]
11. Leckie B.J. Targeting the renin-angiotensin system: What's new?. Curr Med Chem Cardiovasc Hematol Agents. 2005; 3:23-32. [ Links ]
12. Korzets A., Nouriel H., Steiner Z., Griffel B., Kraus L., Freund U., et al. Resistant hypertension associated with a renin-producing ovarian Sertoli cell tumor. Am J Clin Pathol. 1986; 85:242-7. [ Links ]
13. Störkel S., Martignoni G., Van den Berg E. Chromopobe renal cell carcinoma. En: Eble J.N., Sauter G., Epstein J.I., Sesterhenn I.A., editors. World Health Organization Classification of Tumours. Pathology and genetics of tumours of the urinary system and male genital organs. Lyon: IARC Press; 2004. 30-2. [ Links ]
14. Leckie B.J., Birnie G., Carachi R. Renin in Wilms´ tumor: Prorenin as an indicator. J Clin Endocrinol Metab. 1994; 79:1742-6. [ Links ]
15. Maas M.H., Cransberg K., Van Grotel M., Pieters R., Van den Heuvel-Eibrink M.M. Renin-induced hypertension in Wilms tumor patients. Pediatr Blood Cancer. 2007; 48:500-3. [ Links ]
16. McKenzie K.J., Ferrier R.K., Howatson A.G., Lindop G.B. Demonstration of renin gene expression in nephroblastoma by in situ hybridization. J Pathol. 1996; 180:71-3. [ Links ]
17. Steege A., Fähling M., Paliege A., Bondke A., Kirschner K.M., Martinka P., et al. Wilms' tumor protein (-KTS) modulates renin gene transcription. Kidney Int. 2008; 74:458-66. [ Links ]
18. Bruneval P., Fournier J.G., Soubrier F., Belair M.F., Da Silva J.L., Guettier C., et al. Detection and localization of renin messenger RNA in human pathologic tissues using in situ hybridization. Am J Pathol. 1988; 131:320-30. [ Links ]
19. Langer P., Bartsch D., Gerdes B., Schwetlick I., Wild A., Brehm B., et al. Renin producing neuroendocrine pancreatic carcinomaa case report and review of the literature. Exp Clin Endocrinol Diabetes. 2002; 110:43-9. [ Links ]
20. Louiset E., Isvi K., Gasc J.M., Duparc C., Cauliez B., Laquerrière A., et al. Ectopic expression of serotonin7 receptors in an adrenocortical carcinoma co-secreting renin and cortisol. Endocr Relat Cancer. 2008; 15:1025-34. [ Links ]
21. Misiani R., Sonzogni A., Poletti E.M., Cassinelli G., Gualandris L., Pericotti S., et al. Hyponatremic hypertensive syndrome and massive proteinuria in a patient with renin-producing leiomyosarcoma. Am J Kidney Dis. 1994; 24:83-8. [ Links ]
22. Tetu B., Lebel M., Camilleri J.P. Renin-producing ovarian tumor. A case report with immunohistochemical and electron-microscopic study. Am J Surg Pathol. 1988; 12:634-40. [ Links ]
23. Wen M.J., Lin Y.F., Chen J.S. Newly developed hypertension as an early marker of recurrence of adrenocortical carcinoma with high renin expression. Int J Urol. 2008; 15:540-2. [ Links ]
24. Galen F.X., Devaux C., Atlas S., Guyenne T., Menard J., Corvol P., et al. New monoclonal antibodies directed against human renin. Powerful tools for the investigation of the renin system. J Clin Invest. 1984; 74:723-35. [ Links ]
25. Chobanian A.V., Bakris G.L., Black H.R., Cushman W.C., Green L.A., Izzo J.L., et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension. 2003; 42:1206-52. [ Links ]
26. Arias L.F., Hernández S., Bocardo G., González L., Vélez M., Arteta A.A., et al. Estudios auxiliares en el diagnóstico diferencial de tumores epiteliales renales con células granulares. Actas Urol Esp. 2008; 32:194-202. [ Links ]
27. Tickoo S.K., Lee M.W., Eble J.N., Amin M., Christopherson T., Zarbo R.J., et al. Ultrastructural observations on mitochondria and microvesicles in renal oncocytoma, chromophobe renal cell carcinoma, and eosinophilic variant of conventional (clear cell) renal cell carcinoma. Am J Surg Pathol. 2000; 24:1247-56. [ Links ]
28. Latham B., Dickersin G.R., Oliva E. Subtypes of chromophobe renal cell carcinoma. An ultrastructural and hictochemical study of 13 cases. Am J Surg Pathol. 1999; 23:530-5. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
lfarias@kidneypathology.com
(L.F. Arias)
Recibido 14 Enero 2010
Aceptado 13 Abril 2010














