Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.35 no.1 ene. 2011
Linfadenectomía retroperitoneal laparoscópica primaria para el tumor testicular de células germinales no seminomatoso en estadio clínico I*
Primary laparoscopic retroperitoneal lymph node dissection for clinical stage I nonseminomatous germ-cell testis tumor
O.A. Castilloa,b, R. Sánchez-Salasa,c, F.P. Secind, J.M. Camperoc, A. Fonerona e I. Vidal-Moraa
aDepartamento de Urología, Clínica Indisa, Santiago, Chile
bDepartamento de Urología, Facultad de Medicina, Universidad de Chile, Santiago, Chile
cDepartamento de Urología, Clínica Las Condes, Santiago, Chile
dCEMIC, Buenos Aires, Argentina
* Este trabajo ha sido presentado parcialmente en la Reunión Anual de la Asociación Americana de Urología en Atlanta 2007.
Dirección para correspondencia
RESUMEN
Introducción: El propósito de este informe es evaluar retrospectivamente el seguimiento de cáncer y la mortalidad en linfadenectomía retroperitoneal laparoscópica (LRL) primaria en pacientes con tumor de células germinales no seminomatoso (TCGNS) es estadio clínico I.
Materiales y métodos: Ciento sesenta y cuatro pacientes con TCGNS en estadio clínico I se sometieron a LRL diagnóstica primaria entre 1993 y 2006. Los pacientes fueron operados unilateralmente limitando la disección a áreas. Se generaron curvas Kaplan Meier estimando el período de recurrencia.
Resultados: De los 164 pacientes 82 (48%) tenían componentes embrionarios y 35 (20%) invasión linfovascular en la muestra de orquiectomía. La edad media (RI), tiempo operatorio, estancia en el hospital, pérdida de sangre y número de ganglios linfáticos recuperados fueron 28 años (24-33), 135 minutos (120-180), 48 horas (24-48), 50 cc (20-100) y 14 (10-18) ganglios linfáticos, respectivamente. Todos los pacientes tenían marcador sérico negativo antes de la intervención. La presencia de metástasis en ganglios linfáticos se identificó en 32 (19,5%) pacientes. Se hizo un seguimiento en 15 de ellos. Catorce recibieron quimioterapia adyuvante y dos de ellos sufrieron recurrencia a los 3 y 64 meses. La ausencia de metástasis en ganglios linfáticos se diagnosticó en 132 (80,5%) pacientes. Se hizo un seguimiento en 80 de ellos. Entre ellos 7 sufrieron recurrencia (5 retroperitoneo, 2 pulmonar), uno de ellos a los 33 meses de la LRL. El seguimiento medio de los pacientes sin recurrencia fue de 14 meses (RI: 4-35). La tasa acumulada de supervivencia libre de enfermedad a los tres años fue del 82% (IC 95%: 64-91). Diecisiete de 164 (10%) padecieron complicaciones intra o perioperatorias.
Conclusiones: Ésta es la serie más larga de LRL llevada a cabo en una única institución. Tanto la mortalidad como la seguridad oncológica de esta técnica deben ser evaluadas prospectivamente en ensayos aleatorios.
Palabras clave: Cáncer de testículo. Neoplasia no seminomatosa de células germinales. Laparoscopia. Disección retroperitoneal de ganglios linfáticos.
ABSTRACT
Introduction: This report is intended to retrospectively assess cancer control and morbidity of primary laparoscopic reproperitoneal lymphadenectomy (L-RPLND) in patients with clinical Stage I non seminomatous germ cell tumour (NSGCT).
Materials and methods: One hundred and sixty-four patients with clinical Stage I NSGCT underwent primary diagnostic LRPLND between 1993 and 2006. Patients were operated unilaterally limiting the dissection to templates. Kaplan Meier curves were generated estimating time to recurrence.
Results: Of the 164 patients, 82 (48%) had embryonal components and 35 (20%) lymphovascular invasion in the orchiectomy specimen. The median (IQR) age, operative time, length of hospital stay, blood loss and number of lymph nodes retrieved was 28 years (24-33), 135 minutes. (120- 180), 48 hours (24-48), 50 cc (20-100) and 14 (10-18) nodes, respectively. All patients had negative serum markers preoperatively.
Presence of lymph node metastasis was identified in 32 (19.5%) patients. Follow-up was available in 15 of these. Fourteen received adjuvant chemotherapy and 2 of them had recurrence at 3 and 64 months. Absence of lymph node metastasis was diagnosed in 132 (80.5%) patients. Follow-up was available in 80 of these. Among them 7 recurred (5 retroperitoneum, 2 lung), one of them 33 months after L-RPLND. Median follow-up for patients without recurrence was 14 months (IQR:4-35). The cumulative 3-year recurrence free rate was 82% (95%CI: 64-91). Seventeen (10%) of 164 patients had intra or perioperative complications.
Conclusions: This is the largest series of L-RPLND performed in a single institution. Both morbidity and oncologic safety of this technique needs to be prospectively evaluated in randomized trials.
Key words: Testis cancer, Non-seminomatous germ cell neoplasia, Laparoscopy, Retroperitoneal Lymph node dissection.
Introducción
Las mejoradas tasas de curación observadas en pacientes con cáncer de testículo se han basado en los esfuerzos conjuntos de terapias médicas y quirúrgicas1. Aunque los regímenes de seguimiento y quimioterapia son algunas de las opciones para tumores testiculares de células germinales no seminomatosos (TCGNS), la disección abierta retroperitoneal de los ganglios linfáticos (LR) continúa siendo el método más fiable para detectar metástasis en este estudio. No obstante, la mortalidad perioperatoria y el carácter invasivo de esta cirugía son temas preocupantes que han sido tratados por varios autores2,3.
La LR laparoscópica (LRL) se ha comprobado factible con tasas de complicación bajas en manos altamente experimentadas4-6. Sin embargo, existe controversia sobre la eficacia terapéutica como alternativa al abordaje abierto en el manejo de TCGNS2,3., Los resultados oncológicos a medio y largo plazo faltan en la literatura. Nuestro propósito se centra en evaluar retrospectivamente el seguimiento de cáncer y la mortalidad de L-RPLND primaria realizada en pacientes con TCGNS en estadio clínico I durante un período de 13 años.
Materiales y métodos
Pacientes
Los datos clínicos y patológicos fueron obtenidos prospectivamente en un total de 164 pacientes con TCGNS en estadio clínico I que se sometieron a LRL primaria entre 1993 y 2006. TCGNS en estadio clínico I se definió como tumor limitado a los testículos en pacientes con tomografía axial computarizada normal del tórax, abdomen y pelvis y marcador tumoral sérico normalizado tras la orquiectomía inguinal.
En todos los casos se realizó LRL con intención diagnóstica siguiendo una técnica de resección modificada. No se realizaron disección bilateral ni biopsia intraoperatoria de manera rutinaria. Los pacientes con ganglio/s linfático/s positivo/s en la evaluación patológica final fueron tratados con dos ciclos de quimioterapia adyuvante consistente en bleomicina, etopósido, cisplatino (BEP).
Técnica quirúrgica
Preparación y posicionamiento preoperatorio
Todos los pacientes recibieron instrucciones para tomar una dieta líquida el día anterior a la intervención quirúrgica. También se les administró enema de Fleet antes del ingreso en el hospital. Una vez bajo anestesia general, el paciente fue colocado de manera apropiada, con drenaje gástrico y vesical. Los pacientes se colocaron en posición decúbito lateral derecha o izquierda, dependiendo del lado indicado para la disección linfática.
Procedimiento operatorio
Se crea neumoperitoneo con la técnica Veress y la presión intraabdominal se establece en 15 mmHg. La posición de entrada varía según el lado a operar. Como se ha demostrado la preponderancia de estadio inicial de metástasis testicular retroperitoneal es ipsilateral e infrahilar7. La extensión de la disección del tejido linfático en este estudio corresponde a las áreas descritas por Weissbach y Boedefeld8, con la única modificación de excluir el espacio interaortocava y precava en el lado izquierdo (Figura 1). En todos los casos se intentó preservar las fibras nerviosas responsables de la eyaculación. Todas las intervenciones se realizaron con intención de preservar los nervios, y durante una parte de nuestra experiencia no seccionamos los vasos lumbares para disecar por debajo de los vasos mayores, porque creímos que la propagación de la metástasis linfática primaria en el carcinoma testicular ocurre ventral a los vasos lumbares. Además, para procedimientos diagnósticos la extirpación de este tejido linfático no sería necesaria según lo han presentado Holt et al9. Más recientemente estamos en el proceso de modificar nuestra técnica de linfadenectomía con intención terapeútica.
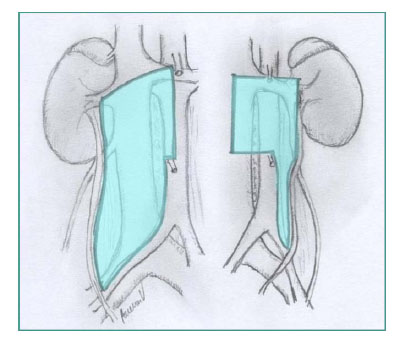
Figura 1. Resección modificada con intención diagnóstica
en la linfadenectomía retroperitoneal.
La Figura 2 muestra la posición del paciente sobre la mesa quirúrgica y la colocación de los trócares para llevar a cabo el procedimiento, bien sea en lado derecho o en el izquierdo.
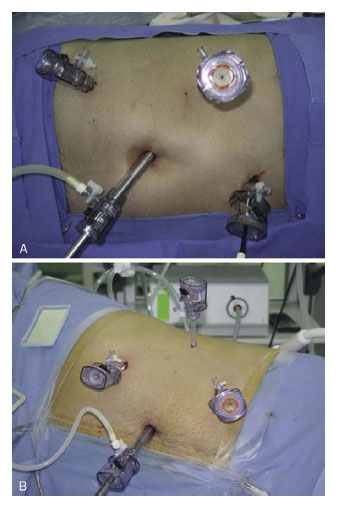
Figura 2. Colocación de los trócares para linfadenectomía
retroperitoneal laparoscópica (LRL) en lado derecho (A) e izquierdo (B).
LRL primaria del lado derecho. El hilum renal derecho delinea el límite superior de la disección, y el área anatómica caudal para la zona es el punto de cruce de los vasos iliacos con el uréter. Para comenzar la disección se moviliza el colon extensivamente y también se moviliza el duodeno aplicando la maniobra de Kocher. La posición de flanco y la inclinación de la mesa operatoria permiten que las vísceras caigan al campo quirúrgico. Una vez expuesto el retroperitoneo se identifican la arteria iliaca derecha y el uréter, además de los vasos espermáticos, la vena cava, la aorta y el hilum renal; caudal a craneal, la disección comienza en la bifurcación ilíaca y procede hacia arriba a la arteria renal derecha. Se hace una incisión y se disecciona el tejido linfático de la vena cava en su superficie anterior y bilateralmente. El espacio interaortacava se disecciona con cuidado, con preservación de las venas lumbares. La muestra quirúrgica incluye los ganglios linfáticos paracava, precava e interaortacava.
LRL primaria del lado derecho. El colon izquierdo se refleja medialmente. La disección se extiende caudo-cranealmente, de la arteria iliaca común izquierda hacia arriba a los vasos renales izquierdos. La muestra quirúrgica se limita a tejido preaórtico, paraaórtico y linfático interaortacava superior, incluyendo ganglios ubicados por debajo de la vena renal izquierda. Se requiere una movilización extensiva de colon en ambos lados como primer paso del procedimiento. Siempre realizamos disección y resección del cordón espermático, abajo en la zona del anillo interno, lo cual consideramos una parte esencial de la técnica, según lo describieron Chang et al10. En nuestra serie se operaron tres metástasis de cordón, y por lo tanto prestamos atención especial a esta parte de la intervención. Al concluir el procedimiento se recupera la muestra quirúrgica en un Endobag (Ethicon, Endosurgery).
Análisis estadístico
Los rangos medianos e intercuartiles (RI) (percentil 25-75) se estimaron para cada dominio. Se generaron curvas Kaplan-Meier estimando el período de recaída. Se realizaron análisis estadísticos con Stata 8.2 (Stat Corporation, College Station, TX). Se definió recaída como recurrencia de enfermedad manifestada por la presencia de ganglios linfáticos antes inexistentes en estudios de imagen o por el aumento en marcadores tumorales séricos. Definimos complicación perioperatoria como cualquier acontecimiento médico o quirúrgico adverso que ocurre durante o hasta 30 días después de la intervención.
Resultados
Un total de 164 pacientes con el diagnóstico de carcinoma germinal no seminomatoso y marcadores séricos negativos se operaron por linfadenectomía retroperitoneal laparoscópica. De los 164 pacientes 82 (48%) tenía algún componente embrionario en la muestra de orquiectomía y 35 (20%) invasión linfovascular. La edad media, duración de la intervención, estancia en el hospital, pérdida de sangre y número de ganglios linfáticos recuperados fueron respectivamente 28 (24-33) años, 135 (120-180) minutos, 48 (24-48) horas, 50 (20- 100) cc y 14 (10-18) ganglios linfáticos extraidos. Se expresa el rango intercuartil entre paréntesis para cada variable.
Treinta y dos pacientes (19,5%) padecían metástasis en los ganglios linfáticos. Se hizo un seguimiento en 15 de estos 32 pacientes. Catorce recibieron quimioterapia adyuvante y dos de ellos sufrieron recurrencia a los 3 y 64 meses (Figura 3). Ambos tuvieron recaída en el retroperitoneo, y uno de ellos también tuvo recurrencia en los puntos de entrada a los tres meses de la intervención. Los ganglios linfáticos fueron negativos en 132 (80,5%) pacientes. Se hizo seguimiento en 80 de ellos, 7 de los cuales sufrieron recaída, uno de ellos a los 33 meses después de la LRL. El seguimiento medio de los pacientes sin recurrencia fue 14 meses (rango 4-35). La tasa acumulada de tres años de supervivencia sin recaída para este grupo fue del 82% (IC 95%: 64-91) (Figura 4). El retroperitoneo fue la ubicación de 5 recaídas, una de ellas también asociada a enfermedad mediastínica, y dos en los pulmones.
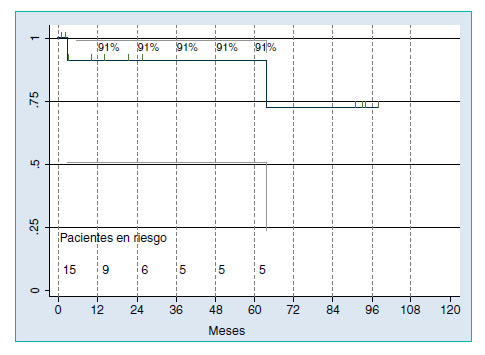
Figura 3. Supervivencia libre de enfermedad con ganglios positivos
tratados con LRL y quimioterapia adyuvante.
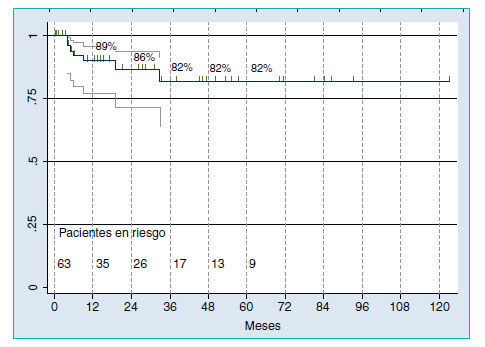
Figura 4. Supervivencia libre de enfermedad en pacientes con ganglios
negativos tratados sólo con LRL.
De los 164 pacientes 17 (10%) sufrieron complicaciones perioperatorias, incluyendo daño de la vena cava (3), arteria iliaca (1), duodeno (1), vena lumbar (3), vena espermática (1), arteria lumbar (1), arteria espermática (1), linfocele (3), hematoma postoperatorio (1), edema pulmonar (1) y recurrencia en el lugar de entrada (1). Solamente 4 (2,4%) pacientes necesitaron conversión a cirugía abierta. Dos pacientes (1,2%) requirieron transfusión sanguínea. Se registró eyaculación retrógrada en 3 (1,8%) pacientes. No hubo fallecimientos perioperatorios.
Discusión
El retroperitoneo representa el primer, y a veces el único grado en la propagación del cáncer testicular. La LR primaria tiene la ventaja de permitir una estadificación patológica minuciosamente precisa y efectiva en tumores germinales, y además, podría ser un procedimiento curativo en el 70% de los pacientes con enfermedad en estadio B111. Asimismo, la infraestadificación clínica, la importante tasa de recaída en los protocolos de seguimiento y la presencia de teratoma o carcinoma viable en tejido resecado de pacientes expuestos a protocolos de quimioterapia constituyen las razones por las que se prefiere la cirugía por encima de otras opciones terapéuticas en el cáncer testicular12.
Desde su descripción original, la LR ha sido modificada para reducir la mortalidad y a la vez mantener los estándares oncológicos requeridos. Las lecciones aprendidas tras años de cirugía laparoscópica, y los avances en las técnicas reconstructivas laparoscópicas, nos han permitido hoy día intentar aplicar unos procedimientos incluso más exigentes. La LRL ha surgido como una opción lógica para la cirugía de cáncer testicular, ya que se puede ofrecer para el tratamiento de cáncer germinal testicular no seminomatoso en estadio clínico I y enfermedad retroperitoneal de bajo volumen en estadio II7,9.
No hay duda de que el manejo quirúrgico de la enfermedad retroperitoneal en el cáncer testicular ha cambiado desde la aplicación inicial de la laparoscopia para este tipo de neoplasia. Nelson et al publicaron una revisión retrospectiva de 29 pacientes con TCGNS en estadio clínico I sometidos a LRL transperitoneal. Esta serie fue realizada por un único cirujano utilizando una plantilla modificada tanto en el lado derecho como en el izquierdo. Se detectaron ganglios positivos en el 41% de los pacientes. Entre los que tenían ganglios negativos (59%) sólo dos pacientes recayeron, uno en tórax y el otro bioquímicamente. No se encontró evidencia de recurrencia de enfermedad en el retroperitoneo tras un seguimiento medio de 65 meses. Las complicaciones en esta serie incluyeron linfocele en un paciente y síndrome de compartimental en el flanco en otro8.
Bhayani et al revisaron el resultado a largo plazo de sus series para verificar que los ganglios linfáticos eran negativos en 17 de 29 pacientes. De estos 17 pacientes 15 no sufrieron recaída y estaban libres de enfermedad tras 5,8 años de seguimiento. Dos pacientes sufrieron recaída, uno en el tórax y otro bioquímicamente, y ambos quedaron libres de enfermedad tras quimioterapia. Doce de los 29 pacientes tenían ganglios linfáticos con cáncer testicular metastático. Diez de estos pacientes recibieron quimioterapia adyuvante y se encontraban libres de enfermedad tras 6,3 años de seguimiento. Un paciente sufrió recurrencia bioquímica tras LR positiva y fue tratado con quimioterapia. Se examinó a otro paciente tras LR positiva encontrándose libre de enfermedad tras 4,9 años de seguimiento. La única complicación a largo plazo fue eyaculación retrógrada en un paciente9.
En una serie de 125 pacientes presentada por Janetschek et al sometidos a LRL por TCGNS, 76 pacientes en estadio I de enfermedad fueron tratados en un tiempo operatorio de 219 minutos, una vez conseguida la curva de aprendizaje. Sólo dos pacientes se convirtieron a cirugía abierta en esta serie, y las complicaciones postoperatorias menores incluyeron linfocele asintomático en 7 pacientes y ascitis quilosa en 6 casos. La estancia media postoperatoria en el hospital fue de 3,3 días; el seguimiento medio para el grupo en estadio I fue de 46 meses. Se observó una única recurrencia retroperitoneal falsa negativa y el resto de los pacientes continuaron libres de enfermedad13.
La serie actualizada del grupo de Innsbruck reportó 162 pacientes con cáncer testicular. Entre ellos, 103 pacientes correspondieron al estadio clínico I. Estos autores también compararon sus datos con la experiencia mundial en LRL. Los resultados oncológicos fueron evaluados con un seguimiento medio de 62 meses. Sólo se refirieron tres conversiones a LR abierta en estadio clínico I. El tiempo medio operatorio fue de 217 minutos, la media de sangre perdida fue de 144ml y la estancia en el hospital fue de 3,6 días. Durante el seguimiento se observaron dos recurrencias retroperitoneales (1,2%) y cuatro recurrencias a distancia (2,5%)14.
Un estudio interesante presentado por Poulakis et al comparó 21 pacientes con TCGNS que se sometieron a una LRL transperitoneal con 29 pacientes que se sometieron a LR abierta. El tiempo medio de seguimiento de los grupos fue de 14 meses para LRL y 26 meses para LR respectivamente. No se verificó ninguna complicación perioperatoria de importancia. No obstante, complicaciones postoperatorias menores iniciales y tardías fueron significantemente altas en la LR. Los pacientes de LRL estuvieron bastante menos tiempo ingresados, tuvieron mejores escalas de calidad de vida y mayor rapidez en el retorno a la vida diaria15.
Abdel-Azi et al compararon su experiencia basada en 28 pacientes que fueron sometidos a LR (6 pacientes) o LRL (22 pacientes) para TCGNS en estadio clínico I. La resección modificada se empleó en esta serie. El seguimiento medio fue similar en ambos grupos. El tiempo medio operatorio fue comparable (313 minutos para LRL y 284 minutos para LR). El grupo laparoscópico tuvo una estancia en el hospital bastante menor (1,2 contra 8,5 días). Un número de 33 contra 17 ganglios linfáticos fueron extirpados con cirugía abierta y laparoscópica, respectivamente. Se refirió una única recurrencia fuera de la resección modificada tanto para el grupo laparoscópico como para el grupo abierto. En esta serie la LRL se asoció a menor pérdida de sangre y menor estancia en el hospital, pero la LR abierta manifestó un elevado rendimiento en el número de ganglios extraídos16.
En este trabajo hemos tratado un importante número de pacientes de alto riesgo (48% componente embrionario y 20% invasión linfovascular) con una referencia de muestra patológica final de 132 pacientes con ganglios linfáticos negativos y 32 pacientes positivos para cáncer testicular metastático en el retroperitoneo. El tiempo medio operatorio de la presente serie es 135 (120-180) minutos con pérdida de sangre de 50 cc (20-100), y esto es alentador cuando se mira la literatura referente a LRL. Debe quedar claro que estos números representan el desarrollo de habilidades en la técnica a largo plazo.
Los ganglios linfáticos fueron negativos en el 80,5% de los pacientes, y se hizo seguimiento en 80 de estos casos. Siete presentaron recurrencia, lo que representa una tasa de recurrencia del 8,7% objetivo en la serie. En la literatura se refirió una recurrencia total de menos del 5% para la linfadenectomía laparoscópica17. Los 7 pacientes con ganglios linfáticos negativos en patología final que presentaron recurrencia tenían un número medio de 16 (5-20) ganglios linfáticos en la muestra retroperitoneal, y todos manifestaron factores de alto riesgo en el espécimen de orquiectomía del tumor primario. Este factor es muy importante para objetivamente diseñar decisiones terapéuticas a medida. Tenemos una población de considerable riesgo alto en la presente serie y creemos que esto podría explicar nuestra tasa de recurrencia.
Nuestra tasa de complicación del 10% a menudo incluye lesiones intraoperatorias que en esta intervención casi siempre indicaba conversión, tal como ocurrió en 4 personas. La principal limitación de nuestro estudio reside en un alto número de pacientes perdidos en el seguimiento, y esto implica que nuestra tasa de supervivencia libre de enfermedad debe interpretarse con sumo cuidado. La amplia variedad de diferencias culturales de nuestra población podría explicar, al menos en parte, la pérdida de seguimiento en cualquiera de ellos. Ésta es otra razón por la que no es fácil recomendar el seguimiento como una opción terapéutica en nuestra población.
Un punto débil probable en nuestra serie es cómo se refieren las complicaciones. No consideramos la LRL como un procedimiento mórbido, y éste es nuestro argumento para realizarla. Sin embargo, a pesar del hecho de que podamos considerar que nuestros datos de complicaciones mejoran lo señalado en la literatura, nos hemos dado cuenta de que faltan más detalles en cuanto a las molestias de los pacientes y el registro de síntomas específicos durante el período perioperatorio.
Por supuesto existe bastante controversia en relación con la LRL. El trabajo de Eggener et al18 plantea de manera contundente varias cuestiones sobre el tratamiento quirúrgico para TCGNS en estadio clínico I. Este artículo oportuno debe alentar a los grupos laparoscópicos para que legitimen la LRL en cuanto a referencias de resultados sólidos en el control del cáncer y sus complicaciones. Nielsen et al presentaron un estudio retrospectivo multiinstitucional de 120 pacientes con TCGNS tratados con LRL. El seguimiento medio de los pacientes con patología en estadio I (74 casos, 62%) fue de 28,5 meses y 29 meses (rango 12-108) para aquéllos con patología en estadio II (46 casos, 38%). Ningún paciente presentó recurrencia en esta serie19.
Conclusiones
La linfadenectmía retroperitoneal laparoscópica debe realizarse por cirujanos altamente especializados. Su mortalidad y seguridad oncológica deberán evaluarse prospectivamente en ensayos aleatorizados, aunque ya haya habido intentos a nivel mundial, no sólo para verificar la viabilidad de la técnica, sino también para validar de manera comprensiva sus resultados oncológicos. Hoy en día la linfadenectomía retroperitoneal laparoscópica es una opción razonable en el tratamiento de neoplasia testicular de células germinales no seminomatosa.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Nos gustaría dar las gracias a la Sra. Margarita Barrueto Naranjo y al Sr. Mauricio Mejías por su valiosa crítica de edición y apoyo.
Bibliografía
1. Donohue J.P., Thornhill J.A., Foster R.S., Rowland R.G., Bihrle R. Primary retroperitoneal lymph node dissection in clinical stage A non-seminomatous germ cell testis cancer: review of the Indiana University experience 1965-1989. Br J Urol. 1993; 71:326-35. [ Links ]
2. Yoon G.H., Stein J.P., Skinner D.G. Retroperitoneal lymph node dissection in the treatment of low-stage nonseminomatous germ cell tumors of the testicle: an update. Urol Oncol. 2005; 23:168-77. [ Links ]
3. Carver B.S., Sheinfeld J. The current status of laparoscopic retroperitoneal lymph node dissection for non-seminomatous germ-cell tumors. Nat Clin Pract Urol. 2005; 2:330-5. [ Links ]
4. Albqami N., Janetschek G. Laparoscopic retroperitoneal lymph-node dissection in the management of clinical stage I and II testicular cancer. J Endourol. 2005; 19:683-92. [ Links ]
5. Nelson J.B., Chen R.N., Bishoff J.T., Oh W.K., Kantoff P.W., Donehower R.C., Kavoussi L.R. Laparoscopic retroperitoneal lymph node dissection for clinical stage I nonseminomatous germ cell tumors. Urology. 1999; 54:1064-7. [ Links ]
6. Bhayani S.B., Ong A., Oh W.K., Kantoff P.W., Kavoussi L.R. Laparoscopic retroperitoneal lymph node dissection for clinical stage I nonseminomatous germ cell testicular cancer: a long-term update. Urology. 2003; 62:324-7. [ Links ]
7. Donohue J.P., Zachary J.M., Maynard S.M. Distribution of retroperitoneal lymph node metastases in non-seminomatous testicular cancer. J Urol. 1982; 128:315-20. [ Links ]
8. Weissbach L., Boedefeld E.A. Localization of solitary and multiple metastases in stage II nonseminomatous testis tumor as basis for a modified staging lymph node dissection in stage I. J Urol. 1987; 138:77-82. [ Links ]
9. Höltl L., Peschel R., Knapp R., Janetschek G., Steiner H., Hittmair A., Rogatsch H., Bartsch G., Hobisch A. Primary lymphatic metastatic spread in testicular cancer occurs ventral to the lumbar vessels. Urology. 2002; 59:114-8. [ Links ]
10. Chang S.S., Mohseni H.F., Leon A., Sheinfeld J. Paracolic recurren The importance of wide excision of the spermatic cord at retroperitoneal lymph node dissection. J Urol. 2002; 167:94-6. [ Links ]
11. Beck S.D., Cheng L., Bihrle R., Donohue J.P., Foster R.S. Does the presence of extranodal extension in pathological stage B1 nonseminomatous germ cell tumor necessitate adyuvant chemotherapy?. J Urol. 2007; 177:944-6. [ Links ]
12. Richie J.P. Clinical stage I testicular cancer: the role of modified retroperitoneal lymphadenectomy. J Urol. 1990; 144:1160-3. [ Links ]
13. Janetschek G., Peschel R., Hobisch A., Bartsch G. Laparoscopic retroperitoneal lymph node dissection. J Endourol. 2001; 15:449-53. [ Links ]
14. Albqami N., Janetschek G. Laparoscopic retroperitoneal lymph-node dissection in the management of clinical stage I and II testicular cancer. J Endourol. 2005; 19:683-92. [ Links ]
15. Poulakis V., Skriapas K., de Vries R., Dillenburg W., Ferakis N., Witzsch U., Becht E. Quality of life after laparoscopic and open retroperitoneal lymph node dissection in clinical Stage I nonseminomatous germ cell tumor: a comparison study. Urology. 2006; 68:154-60. [ Links ]
16. Abdel-Aziz K.F., Anderson J.K., Svatek R., Margulis V., Sagalowsky A.I., Cadeddu J.A. Laparoscopic and open retroperitoneal lymph-node dissection for clinical stage I nonseminomatous germ-cell testis tumors. J Endourol. 2006; 20:627-31. [ Links ]
17. Bhayani S., Allaf M., Kavoussi L. Laparoscopic RPLND for clinical stage I nonseminomatous germ cell testicular cancer: current status. Urol Oncol. 2004; 22:145-8. [ Links ]
18. Eggener S.E., Carver B.S., Sharp D.S., Motzer R.J., Bosl G.J., Sheinfeld J. Incidence of disease outside modified retroperitoneal lymph node dissection templates in clinical stage I or IIA nonseminomatous germ cell testicular cancer. J Urol. 2007; 177:937-42. [ Links ]
19. Nielsen M.E., Lima G., Schaeffer E.M., Porter J., Cadeddu J.A., Tuerk I., Kavoussi L.R. Oncologic efficacy of laparoscopic RPLND in treatment of clinical stage I nonseminomatous germ cell testicular cancer. Urology. 2007; 70:1168-72. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
octaviocastillo@vtr.net
(O.A. Castillo)
Recibido 4 Julio 2010
Aceptado 19 Agosto 2010














