Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Intensiva
versión impresa ISSN 0210-5691
Med. Intensiva vol.30 no.8 nov. 2006
Monitorización del dolor. Recomendaciones del grupo de trabajo de analgesia y sedación de la SEMICYUC
Monitoring pain. Recommendations of the Analgesia and Sedation Work Groupof SEMICYUC
C. Pardo1; T. Muñoz2; C. Chamorro3 y Grupo de Trabajo de Analgesia y Sedación de la SEMICYUC
1Servicio de Medicina Intensiva. Hospital de Fuenlabrada. Fuenlabrada. Madrid. España.
2Servicio de Medicina Intensiva. Hospital de Txagorritxu. Vitoria. Álava. España.
3Servicio de Medicina Intensiva. Hospital Puerta de Hierro. Madrid. España.
Dirección para correspondencia:
RESUMEN
El dolor es frecuentemente infravalorado, y por tanto insuficientemente tratado en los pacientes críticos. Las respuestas psicológicas, hemodinámicas, metabólicas y neuroendocrinas provocadas por un control inadecuado del dolor pueden producir mayor morbilidad e incluso mortalidad. La capacidad para detectar y controlar el dolor y el sufrimiento de los pacientes es un principio importante y fundamental de todos los miembros de un Servicio de Medicina Intensiva. La evaluación del dolor en el paciente crítico es difícil pero muy importante. El dolor referido por el paciente consciente es la base para instaurar la terapéutica. La escala visual analógica (EVA) y la escala verbal numérica (EVN) son las recomendadas para la evaluación del dolor del paciente consciente y la escala de Campbell para el paciente con incapacidad para comunicarse. No se deben admitir puntuaciones de dolor superiores a 3. La UCI sin dolor debe ser un objetivo de calidad asistencial de todos los Servicios de Medicina Intensiva.
Palabras clave: paciente crítico, dolor, monitorización, escalas, analgesia.
ABSTRACT
In critically ill patients, pain is frequently underestimated and so insufficiently managed. Psychological, haemodynamic and neuroendocrine responses, secondary to untreated pain, could produce morbidity and even increases in patient mortality. All members of the intensive care team must have abilities to assess and to manage pain. The evaluation of pain in the critically ill patient is very difficult but extremely important. Self-reported pain is the starting point for treatment. The pain scores recommended are, VAS (visual analogue scale) and NRS (numeric rating scale) in communicative patients and Campbell scale in uncommunicative patients. Adequate and regular patient assessment leads to improved pain control. Scores higher than 3 points should not be permitted. A pain-free Intensive Care Unit should be a quality standard healthcare aim.
Key words: pain, intensive care, scales, monitoring.
El dolor como problema
Diferentes encuestas muestran que la presencia de dolor en los pacientes es una de las mayores preocupaciones en el ámbito de los Servicios de Medicina Intensiva (SMI), tanto entre el personal, como entre los familiares y entre los propios pacientes ingresados1. El control del dolor es uno de los objetivos tradicionales de los cuidados médicos. Sin embargo, y a pesar del progresivo conocimiento de los mecanismos fisiopatológicos de la producción del dolor y de la disponibilidad de fármacos efectivos, el dolor es todavía detectado y tratado inadecuadamente en la mayoría de los pacientes hospitalizados. Entre el 50 y el 90% de los pacientes ingresados en el hospital refieren haber sufrido dolor durante su estancia hospitalaria. Este problema persiste en los SMI, donde teóricamente el paciente está más controlado y los problemas que pueden producir los analgésicos potentes pueden ser fácilmente solucionados. Un estudio multicéntrico mostró que entre el 50 y el 65% de los pacientes ingresados en los SMI polivalentes sufrieron dolor, incluso un 15% refirió dolor intenso durante más del 50% de su estancia2. Esta alta incidencia se ha corroborado en otros estudios3, e incluso en pacientes postquirúrgicos, donde se ha observado que entre el 22 y el 67% de los pacientes refiere dolor intenso durante el primer día del postoperatorio4. Todo esto explica que el dolor sigua siendo el recuerdo más desagradable referido por los pacientes tras su estancia en los SMI1,4.
Origen del dolor
El dolor en los pacientes críticos puede tener múltiples orígenes1,2,5,6: a) la propia enfermedad que motiva su ingreso (traumatismos, fracturas, inflamación, derrames, hemorragia subaracnoidea, etc.); b) los procedimientos invasivos que se realizan para su tratamiento (procedimientos quirúrgicos, colocación de drenajes, etc.); c) las técnicas necesarias para el manejo de los pacientes (presencia del tubo orotraqueal, mascarillas de ventilación mecánica no invasiva, colocación y presencia de sondas y catéteres, etc.); d) las técnicas de cuidados de enfermería (aspiración endotraqueal, movilizaciones, cambios de apósitos, fisioterapia, etc.); e) la presencia de infecciones ocultas como otitis, sinusitis, abscesos rectales etc. y d) la propia inmovilidad del paciente.
Consecuencias del dolor
Las respuestas psicológicas, hemodinámicas, metabólicas y neuroendocrinas provocadas por un control inadecuado del dolor pueden provocar mayor morbilidad e incluso mortalidad7-9. El dolor puede provocar ansiedad, insomnio, desorientación, agitación y delirio10. Puede ser responsable de estados depresivos y de una mayor incidencia de dolor crónico10-13.
El estado hiperadrenérgico, consecuencia del dolor, puede producir isquemia miocárdica14, disminución del peristaltismo15, aumento del catabolismo proteico e inmunodepresión16,17. El dolor no tratado puede ser responsable del aumento de complicaciones pulmonares y de infecciones quirúrgicas18-21. El uso combinado de agentes analgésicos y sedantes disminuye la respuesta de estrés de los pacientes de cuidados intensivos16-17.
Evaluación del dolor. Escalas
El primer paso para el tratamiento del dolor es su detección. La analgesia y sedación deben evaluarse por separado, a pesar de su interdependencia. Sólo la ausencia de instrumentos adecuados para monitorizar el dolor puede explicar la injustificable falta de prescripción de analgésicos en situaciones o ante actuaciones dolorosas sobre los pacientes críticos22.
La principal barrera en la evaluación del dolor es la discrepancia entre lo que valora el personal que atiende al paciente y lo que valora el propio paciente23,24. La mejor forma de evaluar el dolor es preguntar al paciente. El dolor es una sensación subjetiva y, por tanto, las sensaciones referidas por el paciente son la base para tomar decisiones25. Existen diferentes factores que pueden modificar la percepción dolorosa del paciente, como la edad, su situación cognitiva y el estado emotivo, las experiencias dolorosas previas y su expectación del dolor. Sin embargo, el evaluador debe conocer que también existen otra serie de barreras para una correcta detección, unas son obvias como la incapacidad de comunicación (inconsciencia, déficit neurológicos, sedación profunda, presencia de tubo orotraqueal, etc.), otras pueden ser no tan notorias como las barreras culturales, religiosas, la propia comprensión del paciente de su sintomatología o la simple deprivación de sueño26-28.
Las escalas ideales de evaluación del dolor deben ser simples, precisas, con mínima variabilidad interpersonal, deben cuantificar el dolor y discernir la respuesta al tratamiento. Estas escalas nos deben servir para comparar diferentes tratamientos5.
En la actualidad no existen herramientas validadas para evaluar el dolor de forma objetiva en los enfermos críticos. En el ámbito de los SMI podemos encontrar diferentes tipos de pacientes y por tanto las escalas de evaluación deben ser apropiadas para cada uno de ellos. Es necesario concienciar al paciente y a los profesionales implicados en su cuidado, principalmente al personal de enfermería, de la importancia de la valoración y control del dolor. Se han publicado trabajos que ponen de manifiesto que hasta el 40% de las enfermeras que trabajan en los SMI reconocen no saber valorar el dolor29.
La simple distribución, a pie de cama del paciente, de escalas para la medición de dolor aumenta de forma significativa el grado de cumplimiento de la evaluación del dolor y por tanto de su control30. La existencia de una escala es más importante que el tipo de escala usada. La educación del personal médico y de enfermería en la evaluación del dolor y el uso de algoritmos para su tratamiento pueden reducir la incidencia de dolor moderado-grave de un 37 a un 13%31.
Idealmente las escalas que se describen a continuación deben ser utilizadas, al menos, cada 4 horas, respetando el sueño, en todos los pacientes ingresados y más frecuentemente en los que refieren dolor, para así poder evaluar la respuesta al tratamiento (fig. 1).

Figura 1. Algoritmo de actuación ante un paciente con dolor. EVA: escala visual analógica; EVN: escala verbal numérica.
Evaluación del dolor en el paciente consciente y comunicativo
Se debe preguntar acerca tanto de las características del dolor (localización, irradiación, tipo de dolor, factores precipitantes o aliviantes), como de la intensidad y la respuesta al tratamiento instaurado.
Para la correcta interpretación de las escalas, hay que valorar no sólo el valor inicial que refiere el paciente, sino los cambios que se producen al instaurar el tratamiento.
Escala visual analógica (fig. 2)
En la escala visual analógica (EVA) la intensidad del dolor se representa en una línea de 10 cm. En uno de los extremos consta la frase de «no dolor» y en el extremo opuesto «el peor dolor imaginable»32. La distancia en centímetros desde el punto de «no dolor» a la marcada por el paciente representa la intensidad del dolor. Puede disponer o no de marcas cada centímetro, aunque para algunos autores la presencia de estas marcas disminuye su precisión. La forma en la que se presenta al paciente, ya sea horizontal o vertical, no afecta el resultado. Es la escala más usada33, incluso en los pacientes críticos34,35. Para algunos autores tiene ventajas con respecto a otras36. Se necesita que el paciente tenga buena coordinación motora y visual, por lo que tiene limitaciones en el paciente anciano y en el paciente sedado37.
Un valor inferior a 4 en la EVA significa dolor leve o leve-moderado, un valor entre 4 y 6 implica la presencia de dolor moderado-grave, y un valor superior a 6 implica la presencia de un dolor muy intenso38.

Figura 2. Graduación del dolor: de 1 a 3 dolor leve-moderado, de 4 a 6 dolor moderado-grave y más de 6 dolor muy intenso.
Escala verbal numérica
En la escala verbal numérica (EVN) el paciente expresa su percepción del dolor desde el 0 («no dolor») al 10 (el «peor dolor imaginable»)39. Puede ser por tanto hablada o escrita y por consiguiente más útil en pacientes críticos o geriátricos5. En ocasiones, y en pacientes concretos, el uso de la numeración de 0-100 puede tener más utilidad.
La EVN tiene una muy buena correlación con la EVA, con una menor incidencia de no respondedores (2 % frente a 11%)40,41. Probablemente es la escala de mayor utilidad en el paciente crítico5.
Escala verbal descriptiva
La escala verbal descriptiva (EVD) es similar a la anterior, salvo que el paciente califica su percepción del dolor de acuerdo a 6 grados, no dolor, dolor leve, moderado, intenso, muy intenso e insoportable.
Existen otras escalas más sofisticadas que son habitualmente empleadas por las unidades hospitalarias de dolor. Entre éstas, destaca el McGill Pain Questionnaire (MPQ), que precisa responder a 16 grupos de preguntas. Su empleo, debido a su complejidad, no supone ninguna ventaja ni en los pacientes críticos ni durante el postoperatorio inmediato. Otras escalas validadas en pediatría como la Comfort Scale pueden ser útiles en la valoración del dolor en adultos33,42,43.
Evaluación del dolor en el paciente intubado con sedación no profunda
No se debe presuponer que un paciente intubado y, por tanto, con la pérdida de su comunicación verbal no pueda comunicarse. Igual que con un paciente no intubado, hay que preguntar con claridad acerca de su dolor, y darle el tiempo suficiente para responder. El paciente puede comunicarse con movimientos, y usar por tanto las escalas EVA o EVN. El uso de diagramas del cuerpo facilita al paciente la descripción de sus puntos dolorosos y de su irradiación. En ocasiones sólo es posible obtener respuestas con movimientos de la cabeza o de los ojos. Sin embargo, estas respuestas a preguntas claras y concisas nos pueden orientar sobre la intensidad de dolor que padece el paciente44.
Evaluación del dolor en el paciente no comunicativo o bajo sedación profunda
Es preciso recordar que el dolor, y por tanto la respuesta fisiológica a éste, existe en el paciente comatoso, ya sea en el coma de origen estructural o de origen medicamentoso. Es, por tanto, necesario e imprescindible en este tipo de pacientes evaluar y descartar la posible presencia de dolor. Aquí se pierde la herramienta fundamental de la cuantificación del dolor, es decir la referida por el paciente, por lo que nos debemos apoyar en herramientas indirectas. Hay que tener en cuenta que la falta de especificidad de los signos puede ser mal interpretada y habitualmente es infraestimada por parte del personal involucrado en su cuidado45,46.
Indicadores fisiológicos
La presencia de dolor puede ir asociada a hipertensión arterial, taquicardia, sudoración, midriasis o lagrimeo47. Puntillo et al refirieron que la taquicardia y la hipertensión arterial son los indicadores de dolor más precisos en los pacientes críticos con incapacidad para comunicarse45. Aunque estos signos no son específicos, y menos en un paciente crítico, su control con analgésicos puede ser clave como indicador de presencia del dolor. También hay que tener en cuenta que en ocasiones, paradójicamente, un paciente con dolor puede evocar una respuesta vagal.
Indicadores conductuales
Entre estos indicadores figuran la expresión facial, la presencia de movimientos o posturas antiálgicas o el tono muscular. Teray et al encontraron una buena correlación entre la EVA y la observación de la expresión facial por parte del evaluador35. Los diferentes estudios que han comparado las escalas de conducta y la EVN han encontrado una buena correlación45,48.
Recientemente se han descrito diferentes escalas conductuales diseñadas expresamente para la evaluación del dolor en el paciente crítico. La escala BPS (behavioral pain scale) descrita por Payen et al49, valora del 1-4 la expresión facial, la movilidad y conducta de las extremidades superiores y la presencia o no de lucha contra el ventilador. Esta escala de 12 puntos fue utilizada y validada en 30 pacientes críticos postquirúrgicos, aunque recientemente ha sido empleada y validada sobre pacientes críticos médicos50,51.
La principal limitación de esta escala es que sólo estima si el estímulo producido es o no doloroso, teniendo poca utilidad para cuantificar la intensidad del dolor.
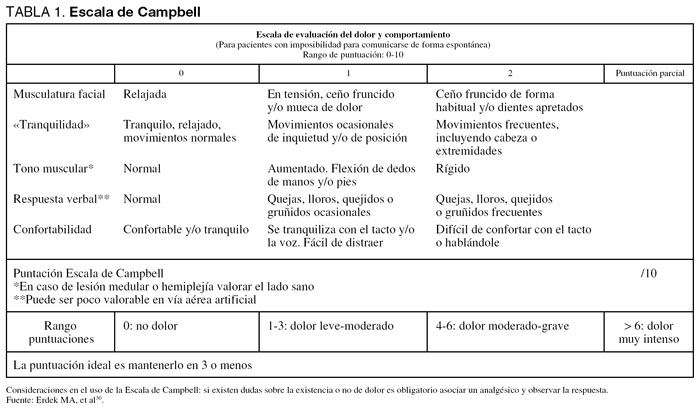
Por este motivo, el Grupo de Trabajo recomienda el uso de la escala de Campbell30 (tabla 1), que está diseñada no sólo para evaluar la presencia de dolor, sino para cuantificar su intensidad. Su graduación del dolor del 1 al 10 la hace más equiparable a las escalas usadas en los pacientes conscientes. Sin embargo, el uso de esta escala está poco extendido y necesita ser validada.
Monitores objetivos
En la actualidad no existe ningún monitor diseñado para la evaluación y cuantificación del dolor en el paciente crítico. Sin embargo, podemos extraer información de monitores diseñados para otros fines. En este sentido el uso del Índice Biespectral (BIS©), diseñado para valorar la profundidad de la sedación, nos puede servir de ayuda.
La presencia de electromiograma en la señal del BIS© puede alertarnos sobre la presencia del dolor; la contracción del músculo frontal es un reflejo («fruncir el ceño») que se activa con la presencia del dolor52. Esta contracción puede ser detectada por los electrodos del BIS© en forma de electromiograma y por tanto su presencia, y sobre todo su disminución o desaparición tras la administración de un analgésico, puede orientar sobre la existencia o no de dolor. Otros autores sugieren que frecuentes cambios de la numeración en el BIS©, no relacionados con cambios en la profundidad de sedación, pueden sugerir la presencia de dolor53-55.
Información recibida de los familiares
En ocasiones, la información recogida de los familiares directos, que conocen la expresión del paciente, puede orientar hacia la presencia de dolor. Su capacidad para observar la presencia e intensidad del dolor ha sido evaluada en diferentes estudios. Pueden estimar la ausencia o presencia de dolor en un 73% de los pacientes, aunque son menos fiables para detectar el grado del dolor (53%)37.
Conclusiones
A modo de conclusión presentamos los puntos clave que hay que tener en cuenta en la monitorización del dolor.
1. La presencia de dolor es un problema muy frecuente en los pacientes críticos.
2. La capacidad para detectar y controlar el dolor de los pacientes es un principio fundamental de todos los miembros de un SMI.
3. El control del dolor es no sólo una obligación por cuestiones huma nitarias, sino una obligación médica para reducir la morbilidad y mortalidad de los pacientes críticos.
4. El dolor referido por el propio paciente es la base para instaurar la terapéutica.
5. Los pacientes deben ser instruidos sobre la importancia del control de su dolor e interrogados de forma frecuente y sistemática acerca de su presencia.
6. La simple distribución de escalas de cuantificación del dolor mejora su detección y control.
7. Las escalas EVA y EVN son las más útiles en el paciente consciente y deben ser utilizadas al menos cada 4 horas, respetando el sueño.
8. La escala de Campbell es la recomendada para la evaluación del dolor de los pacientes que no pueden comunicarse y debe ser incluida en las constantes rutinarias del paciente intubado. Los parámetros fisiológicos y de comportamiento son indicadores indirectos y se deben combinar con las respuestas observadas tras la administración empírica de un analgésico.
9. Puntuaciones de dolor superiores a 3 en la EVA y en la de Campbell no deben ser admitidas.
10. La estancia de los enfermos sin dolor debe ser un objetivo de calidad asistencial de todos los SMI.
Declaración de conflicto de intereses
El Dr. Carlos Chamorro declara haber recibido honorarios por Conferencias organizadas por los Laboratorios GSK y por los Laboratorios Organon Española S.A.
Bibliografía
1. Novaes MA, Knobel E, Bork AM, Pavao OF, Nogueira-Martins LA, Ferraz MB. Stressors in ICU: perception of the patient, relatives and health care team. Intensive Care Med. 1999; 25:1421-6. [ Links ]
2. Desbiens NA, Wu AW, Broste SK, Wenger NS, Connors AF Jr, Lynn J, et al. Pain and satisfaction with pain control in seriously ill hospitalized adults: findings from the SUPPORT research investigations. For the SUPPORT investigators. Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatment. Crit Care Med. 1996;24:1953-61. [ Links ]
3. Walder B, Tramer MR. Analgesia and sedation in critically ill patients. Swiss Med Wkly. 2004;134:333-46. [ Links ]
4. Puntillo KA. Pain experiences of intensive care unit patients. Heart Lung. 1990;19:526-33. [ Links ]
5. Jacobi J, Fraser GL, Coursin DB, Riker RR, Fontaine D, Wittbrodt ET, et al. Clinical practice guidelines for the sustained use of sedatives and analgesics in the critically ill adult. Crit Care Med. 2002;30:119-41. [ Links ]
6. Puntillo KA, White C, Morris AB, Perdue ST, Stanik-Hutt J, Thompson CL, et al. Patients' perceptions and responses to procedural pain: results from Thunder Project II. Am J Crit Care. 2001;10:238-51. [ Links ]
7. Liebeskind JC. Pain can kill. Pain. 1991;44:3-4. [ Links ]
8. Anand KJ, Hickey PR. Halothane-morphine compared with high-dose sufentanil for anesthesia and postoperative analgesia in neonatal cardiac surgery. N Engl J Med. 1992;326:1-9. [ Links ]
9. Chamorro Jambrina C, Romera Ortega MA, Pardo Rey C. Analgesia y sedación del paciente crítico. Presente y futuro. Med Intensiva. 2004;2Supl 3:1-4. [ Links ]
10. Bond MR. Psychological and psychiatric aspects of pain. Anaesthesia. 1978;33:355-61. [ Links ]
11. Perkins FM, Kehlet H. Chronic pain as an outcome of surgery. A review of predictive factors. Anesthesiology. 2000;93: 1123-33. [ Links ]
12. Rotondi AJ, Chelluri L, Sirio C, Mendelsohn A, Schulz R, Belle S, et al. Patients' recollections of stressful experiences while receiving prolonged mechanical ventilation in an intensive care unit. Crit Care Med. 2002;30:746-52. [ Links ]
13. Schelling G, Stoll C, Haller M, Briegel J, Manert W, Hummel T, et al. Health-related quality of life and posttraumatic stress disorder in survivors of the acute respiratory distress syndrome. Crit Care Med. 1998;26:651-9. [ Links ]
14. Liu SS, Block BM, Wu CL. Effects of perioperative central neuraxial analgesia on outcome after coronary artery bypass surgery: a meta-analysis. Anesthesiology. 2004;101:153-61. [ Links ]
15. Fotiadis RJ, Badvie S, Weston MD, len-Mersh TG. Epidural analgesia in gastrointestinal surgery. Br J Surg. 2004;91: 828-41. [ Links ]
16. Epstein J, Breslow MJ. The stress response of critical illness. Crit Care Clin. 1999;15:17-33. [ Links ]
17. Lewis KS, Whipple JK, Michael KA, Quebbeman EJ. Effect of analgesic treatment on the physiological consequences of acute pain. Am J Hosp Pharm. 1994;51:1539-54. [ Links ]
18. Akca O, Melischek M, Scheck T, Hellwagner K, Arkilic CF, Kurz A, et al. Postoperative pain and subcutaneous oxygen tension. Lancet. 1999;354:41-2. [ Links ]
19. Ballantyne JC, Carr DB, deFerranti S, Suárez T, Lau J, Chalmers TC, et al. The comparative effects of postoperative analgesic therapies on pulmonary outcome: cumulative meta-analyses of randomized, controlled trials. Anesth Analg. 1998;86: 598-612. [ Links ]
20. Desai PM. Pain management and pulmonary dysfunction. Crit Care Clin. 1999;15:151-66. [ Links ]
21. Gust R, Pecher S, Gust A, Hoffmann V, Bohrer H, Martin E. Effect of patient-controlled analgesia on pulmonary complications after coronary artery bypass grafting. Crit Care Med. 1999;27:2218-23. [ Links ]
22. Puntillo KA, Wild LR, Morris AB, Stanik-Hutt J, Thompson CL, White C. Practices and predictors of analgesic interventions for adults undergoing painful procedures. Am J Crit Care. 2002;11:415-29. [ Links ]
23. Cleeland CS, Gonin R, Hatfield AK, Edmonson JH, Blum RH, Stewart JA. et al. Pain and its treatment in outpatients with metastatic cancer. N Engl J Med. 1994;330:592-6. [ Links ]
24. Crawford F, Thomson C. Interventions for treating plantar heel pain. Cochrane Database Syst Rev. 2003;CD000416. [ Links ]
25. Kwekkeboom KL, Herr K. Assessment of pain in the critically ill. Crit Care Nurs Clin North Am. 2001;13:181-94. [ Links ]
26. Ferguson J, Gilroy D, Puntillo K. Dimensions of pain and analgesic administration associated with coronary artery bypass grafting in an Australian intensive care unit. J Adv Nurs. 1997; 26:1065-72. [ Links ]
27. Nelson JE, Meier DE, Oei EJ, Nierman DM, Senzel RS, Manfredi PL, et al. Self-reported symptom experience of critically ill cancer patients receiving intensive care. Crit Care Med. 2001;29:277-82. [ Links ]
28. Zatzick DF, Dimsdale JE. Cultural variations in response to painful stimuli. Psychosom.Med. 1990;52:544-57. [ Links ]
29. Aslan FE, Badir A, Selimen D. How do intensive care nurses assess patients' pain? Nurs Crit Care. 2003;8:62-7. [ Links ]
30. Erdek MA, Pronovost PJ. Improving assessment and treatment of pain in the critically ill. Int J Qual Health Care. 2004;16: 59-64. [ Links ]
31. Harmer M, Davies KA. The effect of education, assessment and a standardised prescription on postoperative pain management. The value of clinical audit in the establishment of acute pain services. Anaesthesia. 1998;53:424-30. [ Links ]
32. Chapman CR, Casey KL, Dubner R, Foley KM, Gracely RH, Reading AE. Pain measurement: an overview. Pain. 1985; 22:1-31. [ Links ]
33. Ho K, Spence J, Murphy MF. Review of pain-measurement tools. Ann Emerg Med. 1996;27:427-32. [ Links ]
34. Meehan DA, McRae ME, Rourke DA, Eisenring C, Imperial FA. Analgesic administration, pain intensity, and patient satisfaction in cardiac surgical patients. Am J Crit Care. 1995;4: 435-42. [ Links ]
35. Terai T, Yukioka H, Asada A. Pain evaluation in the intensive care unit: observer-reported faces scale compared with self-reported visual analog scale. Reg Anesth Pain Med. 1998;23: 147-51. [ Links ]
36. DeLoach LJ, Higgins MS, Caplan AB, Stiff JL. The visual analog scale in the immediate postoperative period: intrasubject variability and correlation with a numeric scale. Anesth Analg. 1998;86:102-6. [ Links ]
37. Puntillo KA. Dimensions of procedural pain and its analgesic management in critically ill surgical patients. Am J Crit Care. 1994;3:116-22. [ Links ]
38. Collins SL, Moore RA, McQuay HJ. The visual analogue pain intensity scale: what is moderate pain in millimetres? Pain. 1997;72:95-7. [ Links ]
39. Kremer E, Atkinson JH, Ignelzi RJ. Measurement of pain: patient preference does not confound pain measurement. Pain. 1981;10:241-8. [ Links ]
40. Bijur PE, Silver W, Gallagher EJ. Reliability of the visual analog scale for measurement of acute pain. Acad Emerg Med. 2001;8:1153-7. [ Links ]
41. Gallagher EJ, Liebman M, Bijur PE. Prospective validation of clinically important changes in pain severity measured on a visual analog scale. Ann Emerg Med. 2001;38:633-8. [ Links ]
42. Gloth FM, III. Pain management in older adults: prevention and treatment. J Am Geriatr Soc. 2001;49:188-99. [ Links ]
43. Melzack R. The McGill Pain Questionnaire: major properties and scoring methods. Pain. 1975;1:277-99. [ Links ]
44. Vallejo R. Monitorización del dolor en Anestesia, Cuidados Intensivos y Medicina de Urgencias. En: de la Quintana Gordon FB, editor. Monitorización en Anestesia, Cuidados Críticos y Medicina de Urgencias. Madrid: Editorial Elsevier España SA; 2004. p. 546-56. [ Links ]
45. Puntillo KA, Miaskowski C, Kehrle K, Stannard D, Gleeson S, Nye P. Relationship between behavioral and physiological indicators of pain, critical care patients' self-reports of pain, and opioid administration. Crit Care Med. 1997;25:1159-66. [ Links ]
46. Sjostrom B, Haljamae H, Dahlgren LO, Lindstrom B. Assessment of postoperative pain: impact of clinical experience and professional role. Acta Anaesthesiol Scand. 1997;41:339-44. [ Links ]
47. Larson MD, Sessler DI, Ozaki M, McGuire J, Schroeder M. Pupillary assessment of sensory block level during combined epidural/general anesthesia. Anesthesiology. 1993;79:42-8. [ Links ]
48. Mateo OM, Krenzischek DA. A pilot study to assess the relationship between behavioral manifestations and self-report of pain in postanesthesia care unit patients. J Post Anesth Nurs. 1992;7:15-21. [ Links ]
49. Payen JF, Bru O, Bosson JL, Lagrasta A, Novel E, Deschaux I, et al. Assessing pain in critically ill sedated patients by using a behavioral pain scale. Crit Care Med. 2001;29:2258-63. [ Links ]
50. Aissaoui Y, Zeggwagh AA, Zekraoui A, Abidi K, Abouqal R. Validation of a behavioral pain scale in critically ill, sedated, and mechanically ventilated patients. Anesth Analg. 2005; 101:1470-6. [ Links ]
51. Young J, Siffleet J, Nikoletti S, Shaw T. Use of a behavioural pain scale to assess pain in ventilated, unconscious and/or sedated patients. Intensive Crit Care Nurs. 2006; 22:32-9. [ Links ]
52. Prkachin KM. The consistency of facial expressions of pain: a comparison across modalities. Pain. 1992;51:297-306. [ Links ]
53. Coste C, Guignard B, Menigaux C, Chauvin M. Nitrous oxide prevents movement during orotracheal intubation without affecting BIS value. Anesth Analg. 2000;91:130-5. [ Links ]
54. Fraser GL, Riker RR. Bispectral index monitoring in the intensive care unit provides more signal than noise. Pharmacotherapy. 2005;25:S19-27. [ Links ]
55. Guignard B, Chauvin M. Bispectral index increases and decreases are not always signs of inadequate anesthesia. Anesthesiology. 2000;92:903. [ Links ]
![]() Dirección para correspondencia
Dirección para correspondencia
Dr. C. Chamorro Jambrina.
Servicio Medicina Intensiva.
Hospital Puerta de Hierro.
C/ San Martín de Porres, 4.
28035 Madrid. España.
Correo electrónico: cchamorro.hpth@salud.madrid.org