«La verdad, la que más firme parece, no es sino un boceto de otra verdad más acabada, pero que nunca está terminada del todo; y solo así se la puede interpretar y juzgar».
(Gregorio Marañón y Posadillo, 1887-1960)
En la práctica pediátrica existen 2 situaciones muy frecuentes en las que se hace necesario tomar decisiones con respecto a las pruebas morfológicas que debemos practicar en los jóvenes pacientes afectos. Nos referimos a la infección de vías urinarias (IVU) y a las anomalías del desarrollo renal (CAKUT del inglés congenital anomalies of the kidney and urinary tract) que se detectan con harta frecuencia en las ecografías realizadas in utero. En muchos casos, ambas situaciones son simultáneas.
En el ámbito de las IVU, en concreto, los criterios de la indicación de las exploraciones a realizar han variado notablemente a lo largo de los tiempos. Al ser el reflujo vesicoureteral (RVU) un hallazgo común en pacientes con IVU, pronto se estableció el concepto de que jugaba un papel en su patogénesis, por lo que la indicación de la cistografía se realizaba, y en muchas colectividades aún se realiza, ante la primera infección. Además, se cimentó la idea de que el RVU era la causa de las cicatrices renales y, por ende, de la aparición de una insuficiencia renal crónica. De ahí viene el que, antaño, se acuñara el término de «nefropatía de reflujo» que, afortunadamente, se ha sustituido por el de «nefropatía cicatricial». Ese «miedo» a no realizar prontamente el diagnóstico del RVU con el fin de evitar sus posibles complicaciones acabó desarrollando el concepto de lo que se ha denominado el paradigma «reflujocéntrico»1 cuya noción, afortunadamente, ha ido evolucionando en los últimos años hacia territorios más ponderados2,3.
En todos los algoritmos que se pueden consultar dedicados al estudio de los niños con IVU o CAKUT, en las variables o condiciones que conducen a la petición de las pruebas de imagen, no aparecen nunca los parámetros indicativos de la función renal4-6. Esto ocurre, incluso, en los algoritmos diseñados por nefrólogos. En esta revisión, ofrecemos información acerca de la utilidad de las pruebas básicas de función renal en el manejo de los niños con IVU y CAKUT. En concreto, nos vamos a referir al estudio del manejo renal del agua (osmolalidad urinaria máxima) y a la eliminación urinaria de albúmina y de la N-acetil-glucosaminidasa (NAG).
Generalidades. Acerca de la capacidad de concentración renal, la albuminuria y la N-acetil-glucosaminidasa
La historia del estudio de la capacidad que tienen los riñones para ajustar de forma exquisita el metabolismo corporal del agua mediante los mecanismos de concentración y dilución urinarios perdura desde hace más de un siglo y medio. Así, en 1859 Hoppe-Seyler (1825-1895) (fig. 1), fisiólogo y químico alemán, demostró que cuando la orina y el suero de un mismo animal eran separados por una membrana de vejiga de cerdo, la dirección del flujo se producía desde el plasma hacia la orina7. En consecuencia, ese autor había descubierto que la orina podía estar más concentrada que el ultrafiltrado glomerular. Años más tarde, en Tübingen en 1892, Dreser (1860-1925) estudió la fisiología de la excreción del agua. Este autor estableció que la depresión del punto de congelación de la sangre determinado por el método crioscópico (−0,56 °C) no se altera con la ingesta de agua, en contraste con lo que sucede con la orina. Durante la restricción de agua, Dreser demostró un descenso del punto de congelación urinario de −2,40 °C en los seres humanos, o dicho de otro modo, la presión osmótica de la orina podía ser muy superior a la del plasma8. En un paciente con diabetes insípida, el punto de congelación de su orina fue de solo −0,20°C; como ha escrito Richet, probablemente, fue ese el primer paciente que se estudió con el método crioscópico9. Poco después, Winter, en París, determinó el punto de congelación de muchos fluidos y confirmó los hallazgos de Dreser10.
Poco después, el médico húngaro Korányi (1866-1944) asumió que los riñones regulan la presión osmótica de la orina con el objetivo de que la de la sangre permanezca constante. Para ello, estudió las modificaciones en la depresión del punto de congelación de la orina en una situación de restricción de líquidos y observó que en pacientes con uremia terminal la presión osmótica de la orina casi no se modificaba y se acercaba notablemente al valor del plasma9,11. A esta situación la denominó isostenuria. A partir de estos hallazgos, fue el primero en introducir el concepto funcional de insuficiencia renal12. Nótese, por tanto, como ese término tan familiar para los nefrólogos actuales surgió a partir del estudio del manejo renal del agua.
Albarrán (1860-1912) (fig. 2) fue un urólogo de origen cubano que estudió la carrera de medicina en Barcelona. A partir de 1878 se estableció en París donde trabajó con el anatomista Ranvier (1835-1922) y con el urólogo Guyon (1831-1920). A Albarrán se le debe un descubrimiento básico y poco conocido. En un momento en el que la única prueba de imagen disponible era los rayos X recientemente descubiertos, pudo discernir cuál era el riñón enfermo en los casos de lesiones unilaterales potencialmente quirúrgicas como, por ejemplo, en la tuberculosis renal. Y así, creó la denominada «uña de Albarrán», un pequeño aditamento del cistoscopio por el que se podía conducir un catéter hacia los meatos ureterales para recoger directamente la orina procedente de cada riñón13. Tras ello, creó una de las primeras pruebas funcionales de estímulo, la «poliuria experimental». Ante un estímulo acuoso, el riñón sano se adaptaba al estímulo y el enfermo, no14 (fig. 3). Su libro Exploration des functions rénales, escrito en 1905 es, seguramente, el primero de la historia sobre el tema y una deuda histórica agregada para los nefrólogos14.

Figura 3 Prueba de la «poliuria experimental» de Joaquín Albarrán. Ante el estímulo acuoso, el riñón sano (rein sain) se adapta aumentando el volumen urinario y el enfermo (rein malade), no14.
En 1909, Ambard y Papin precisaron el concepto de concentración máxima suministrando, así, todos los elementos propios de un nuevo índice de valoración funcional. En ese momento se conoció que, incluso en periodos de deshidratación severa, se seguía formando orina. Es lo que pasó a denominarse como la «orina obligatoria» de Ambard y Papin15.
Pronto se diseñaron pruebas destinadas a estimular la capacidad de concentración urinaria máxima mediante la restricción de líquidos como las de Volhard16 y Addis y Schevky17, en las que ya no se determinaba la presión osmótica de la orina sino la densidad (gravedad específica) urinaria. En todo caso, con estas pruebas se estimulaba la producción de la ADH endógena. Décadas más tarde, la denominada prueba de la «dieta seca» también se estandarizaría en niños desde los 2 años de edad, si bien midiendo la osmolalidad urinaria18.
A partir de la segunda década del siglo pasado se empezó a disponer de información acerca de que la glándula pituitaria o hipófisis regula la excreción de agua por parte de los riñones19. Pronto se pudo demostrar que en la porción posterior de esa glándula se produce una sustancia antidiurética que se comporta como una «auténtica» hormona al pasar a la circulación y actuar en el riñón20. A continuación, se empezaron a utilizar extractos de hipófisis para determinar la osmolalidad urinaria máxima21,22.
En 1968, se pudo disponer de un análogo sintético de la vasopresina, la desmopresina23, con el que se pudo realizar la prueba de concentración de una forma cómoda, en menos tiempo, al tener un efecto antidiurético superior al de la hormona natural24.
Queda fuera del objeto de esta revisión exponer la complejidad anatómica y funcional del mecanismo de concentración de la orina por parte del riñón, cuyos detalles se han ido conociendo, como se indicó más arriba, desde hace más de un siglo y medio y con momentos culminantes como la comprensión del mecanismo de contracorriente25 o el descubrimiento de las acuaporinas26.
Basta recordar que la capacidad de concentración renal depende de una adecuada entrega del ultrafiltrado glomerular a los túbulos, de un intersticio medular hipertónico, de un mecanismo medular contracorriente estructuralmente intacto25 y de una permeabilidad normal de los túbulos al agua en respuesta a la vasopresina. La capacidad de concentración es dependiente de la médula renal27. El gradiente de concentración medular se establece primordialmente por los túbulos renales del asa de Henle y los vasos sanguíneos que los rodean (vasa recta) durante el proceso de intercambio contracorriente. El propósito de este último mecanismo es crear un intersticio medular hipertónico25. En presencia de ese intersticio hipertónico, la vasopresina puede concentrar la orina a través de un mecanismo de equilibrio pasivo de agua en las células principales del ducto colector, lo que permite que el contenido de la luz tubular se equilibre con el intersticio medular hipertónico28. La secreción de la vasopresina en respuesta a la restricción de agua origina que las vesículas intracelulares de acuaporina 2 (AQP2) se reubiquen en la membrana apical de las células principales del ducto colector. Este traslado permite la reabsorción de agua de la luz tubular hacia la célula y, por ende, la concentración de la orina final29 (fig. 4).

Figura 4 Modelo simplificado del mecanismo de concentración urinario. Para crear un intersticio medular hipertónico es necesaria una adecuada función de todos los transportadores tubulares de sodio como, por ejemplo, NHE3 (type 3 Na+/H+ exchanger), NaPi-2, (type 2 Na-Pi cotransporter), BSC-1 (type 1 bumetanide-sensitive Na-K-2Cl cotransporter) o TSC (thiazide-sensitive cotransporter) en el lado luminal tubular (mecanismo 1). Un defecto en su función produciría una pérdida salina con pérdida acompañada de agua que originaría un intersticio medular menos hipertónico. Además, es necesaria una adecuada función de los transportadores de urea (UT-A1, UT-A2, UT-A3) para incrementar la osmolalidad del intersticio medular (mecanismo 2). En presencia de ese intersticio hipertónico, la vasopresina puede concentrar la orina gracias al estímulo que ejerce en las acuaporinas (AQP), lo que permite que el contenido de la luz tubular se equilibre con el intersticio medular hipertónico (mecanismo 3).
La introducción en la clínica de la determinación de la albuminuria y de la NAG es mucho más reciente en el tiempo. No obstante, el hallazgo de la proteinuria fue una de las primeras pruebas funcionales renales descubiertas en la historia. Así, en 1764 Cotugno (1736-1822) describió un caso típico de nefritis aguda con anasarca y grandes cantidades de una sustancia en la orina ovi albumini persimilem «coagulable» por el efecto del calor30. Sus hallazgos fueron confirmados años después por el médico inglés Blackall (1771-1860). No obstante, a finales de los años 80 del siglo pasado se dispuso de técnicas adecuadas que permitieron cuantificar pequeñas cantidades de albúmina no cuantificables con las técnicas anteriores. Para su designación se ha utilizado profusamente el término microalbuminuria que es incorrecto desde el punto de vista semántico. Por ello, es mejor usar sencillamente el nombre albuminuria. Inicialmente, se aplicó en clínica para intentar detectar la nefropatía diabética incipiente31. Desde entonces se ha demostrado que su excreción elevada mantenida es un signo precoz de daño glomerular en procesos que cursan con hiperfiltración, tanto en los casos en los que el conjunto de nefronas es completo (nefropatía diabética32, obesidad33) como en los que existe pérdida de parénquima34. Posteriormente, se demostró que, además, es un buena predictora de desarrollo de enfermedad cardiovascular35. En pediatría, se ha observado que puede estar elevada en los casos de RVU36,37. Una cuestión no conocida es si ese aumento es debido a la pérdida de parénquima que puede existir en algunos casos de RVU (displasia renal, cicatrices), o bien, a la hiperpresión que el RVU ejerce en la vía urinaria.
Desde los años 60 del siglo pasado se sabe que la NAG es una enzima presente en el tejido renal38, en los lisosomas de las células del túbulo proximal y que cuya eliminación en la orina se incrementa al pasar a la luz tubular cuando existe una agresión celular39. Se ha determinado, clásicamente, para estudiar la nefrotoxicidad producida por los antibióticos aminoglucósidos40. Además, sus niveles pueden estar elevados en los casos que cursan con hiperpresión como sucede en la obstrucción de la vía urinaria41 y en el RVU aunque, en este caso, como ocurre con la albuminuria, es difícil saber si obedece a la hiperpresión o a la reducción glomerular asociada36.
Acerca de las determinaciones básicas de la función renal como marcadores de pérdida de parénquima
En un estudio en el que incluimos a 77 niños con parénquima renal conservado confirmado en la gammagrafía realizada con ácido dimercaptosuccínico y 102 con pérdida de dicho parénquima (una o varias cicatrices, riñón único, hipodisplasia), determinamos los índices de calidad y eficiencia diagnóstica de los marcadores de función renal enumerados más arriba. La sensibilidad de la osmolalidad urinaria máxima para detectar pérdida de parénquima fue del 30,4% (especificidad 84,8%), la de la eliminación urinaria de albúmina fue del 15,6% (especificidad 92,1%), la del cociente NAG/creatinina del 11,5% (especificidad 100%) y la del filtrado glomerular renal (FGR) del 8,9% (especificidad 100%). No obstante, es llamativo que la sensibilidad mayor (37,9%) fuera la observada con el volumen urinario corregido por 100 ml de FGR. Este hallazgo demostró como este parámetro que se utiliza escasamente y es de cálculo muy sencillo (creatinina plasmática × 100/creatinina urinaria) puede ser muy útil en la práctica diaria. En todo caso, se demostró que los parámetros que estudian el manejo renal del agua son los más sensibles para detectar pérdida de parénquima42. Como corolario de este estudio, podemos resaltar que el FGR fue el parámetro menos sensible y que la sensibilidad alcanzada con los parámetros que estudian el manejo renal del agua fue muy baja, lo que indica que, en la actualidad, no tenemos medios que puedan estimar adecuadamente una situación de una pérdida nefronal modesta.
En 2008, en un trabajo en el que incluimos los datos de 160 niños con IVU o CAKUT, comprobamos que, en aquellos que tenían una osmolalidad urinaria máxima normal, el FGR siempre era normal, mientras que todos los pacientes con reducción del FGR tenían una capacidad de concentración alterada43. En ese estudio, el FGR se calculó con la fórmula clásica de Schwartz que utiliza una constante con un valor de 0,55 y que, ahora, sabemos que sobrestima el FGR. En una revisión reciente y con las nuevas fórmulas para calcular el FGR en las que se incluye la cistatina C y que son más verdaderos44, hemos observado que algunos pocos niños en estadio G2 de enfermedad renal crónica aún concentran bien (cerca del límite bajo de la normalidad), pero se trata de la excepción que confirma la regla (datos no publicados). Esta cualidad la utilizamos mucho en la práctica diaria para no extraer sangre para calcular el FGR, inicialmente, a nuestros jóvenes pacientes si la osmolalidad urinaria máxima es normal.
Como es sabido, en la Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease 2012 (Guía KDIGO), el estadio G1 de enfermedad renal crónica se define por la presencia de anomalías estructurales o funcionales de, al menos, 3 meses de duración no acompañadas de deterioro del FGR45. Curiosamente, los autores de la guía, entre las alteraciones funcionales, incluyeron el incremento de la albuminuria pero no mencionaron las alteraciones relativas al manejo renal del agua. En un trabajo reciente, hemos estudiado a 116 niños con un estudio gammagráfico anormal (ácido dimercaptosuccínico) (46. Entre los 100 niños incluidos en el estadio G1, la frecuencia del defecto de la capacidad de concentración (29%) y de elevación del volumen urinario (20%) fue superior a la del incremento de la albuminuria (12%) y de la eliminación urinaria de NAG (3%). Todos los niños incluidos en los estadios G2-G5 eran portadores de alteraciones en el manejo renal del agua. Además, se observó una correlación directa entre el FGR calculado por la fórmula de Schwartz CKID 201247 y la osmolalidad urinaria máxima (r = 0,63; p < 0,001) (fig. 5b).

Figura 5 a) En 1934, Alving y Van Slyke observaron una relación directa entre el aclaramiento de urea y la gravedad específica (densidad) urinaria máxima obtenida con «dieta seca». b) En un grupo de pacientes pediátricos actuales hemos encontrado una correlación con una pendiente similar entre el FGR y la osmolalidad urinaria máxima alcanzada tras estímulo con desmopresina. Obsérvese que en ambas figuras existe más dispersión de puntos en los casos de FGR normal que cuando la enfermedad renal es avanzada.
Todos los datos enumerados en este apartado coinciden con lo que empezó a vislumbrar Korányi hace ya un siglo9,11,12 y con lo que más tarde confirmarían tanto Alving y van Slyke en 193448 (fig. 5a) como Epstein en 196649. En palabras de este último autor: «La capacidad de los riñones para excretar una orina concentrada se deteriora junto con otras funciones renales cuando los riñones se cicatrizan progresivamente y se reduce la cantidad de parénquima renal funcional. El filtrado glomerular renal y la capacidad de concentración se reducen, por lo tanto, aproximadamente en paralelo en muchas enfermedades comunes que provocan una cicatrización generalizada de los riñones»49.
Acerca de las determinaciones básicas de la función renal como marcadores de hiperpresión sobre el parénquima renal
Los resultados que se obtienen en los modelos experimentales que producen hiperpresión en la vía urinaria es difícil asimilarlos a malformaciones que cursan con hidronefrosis en el humano, por 2 razones. La primera es que tanto en el RVU como en la estenosis pieloureteral (EPU) puede existir una pérdida asociada glomerular (displasia renal, cicatrices). La segunda es que en el RVU leve o moderado la hiperpresión puede ser intermitente y en la EPU el nivel de dicha hiperpresión puede variar sobremanera según el grado de estenosis existente en la unión pieloureteral.
La preocupación de los autores por la lesión funcional existente en los casos de hidronefrosis procede de antiguo50. En los años 60 se demostró que el bloqueo ureteral experimental alteraba la capacidad de concentración51. La posibilidad de utilizar la desmopresina permitió determinar más fácilmente la osmolalidad urinaria máxima, comprobándose su reducción tanto en adultos52,53 como en niños con hidronefrosis y, en concreto, con EPU54,55. Por su lado, con harta frecuencia se ha descrito la asociación entre RVU y el defecto de la capacidad de concentración56-61.
En los últimos años se han estudiado los mecanismos que posibilitan la alteración en el manejo renal del agua cuando existe hiperpresión en la vía urinaria. Así, se ha observado que la obstrucción ureteral origina una reducción en la actividad de algunos transportadores tubulares del sodio62-64 (mecanismo 1, fig. 4), en la expresión de los transportadores de urea65 (mecanismo 2, fig. 4) y en la actividad de las acuaporinas que se expresan en el ducto colector64,66 (mecanismo 3, fig. 4). Todo ello se traduce en poliuria y pérdida salina.
Un incremento en la eliminación urinaria de albúmina se ha descrito tanto en la EPU67 como en el RVU36,37,68. Igualmente, se ha comprobado una elevación de la excreción de NAG y de otras proteínas que son marcadores de función tubular proximal en ambas circunstancias, EPU41,69,70 y RVU36,71-73.
En medicina pediátrica se observan casos de dilatación de la vía urinaria que no son secundarios a RVU ni a obstrucción en los que no se demuestra la existencia de hiperpresión. Para los casos en los que el diámetro de la pelvis renal es mayor a 2 cm y no existe hiperpresión, se ha utilizado el término «hidronefrosis primaria» y cuando está dilatado el uréter se ha usado, asimismo, la expresión «megauréter no obstructivo». Pues bien, en un estudio en el que incluimos a 38 niños con un diámetro piélico mayor de 2 cm, estudiamos si existían diferencias en el comportamiento de la función renal en los distintos tipos de anomalías morfológicas potencialmente causales74. La osmolalidad urinaria máxima estaba reducida en el 100% de los casos de RVU, en el 75% de las EPU y, únicamente, en el 16,7% de las hidronefrosis primarias. La eliminación urinaria de albúmina estaba incrementada en el 62,5% de los RVU y, únicamente, en el 8,3% de las EPU y en el 11,1% de las hidronefrosis primarias. Por su parte, la excreción de NAG estaba elevada en el 42,8% de los casos de RVU, en el 25% de los de EPU y en el 6,7% de las hidronefrosis primarias. Puede observarse, por tanto, como la prueba de concentración es la más sensible para detectar alteración de la función renal en los casos de hidronefrosis. Además, la albuminuria se eleva especialmente en los casos de RVU, la NAG es un marcador de hiperpresión menos sensible que la osmolalidad urinaria máxima y, en los casos de hidronefrosis primaria, la función renal está escasamente alterada74.
Las ectasias piélicas son unas anomalías morfológicas renales, en general leves (pelvis renal entre 0,5 y 2 cm de diámetro), cuyo diagnóstico se ha incrementado notablemente a partir de la instauración universal de los estudios ecográficos que se realizan in utero en los embarazos. Las ectasias pueden ser un signo indicativo de RVU o de obstrucción subyacentes pero, en la mayoría de los casos, no obedecen a ninguna causa objetivable. En este caso concreto se denominan ectasias renales simples. No obstante, como pueden ser expresión de una situación patológica, se plantea la cuestión de si todos los niños deben ser estudiados mediante pruebas de imagen que son costosas, no exentas de riesgo y que producen radiación. En un estudio prospectivo en el que estudiamos a 79 niños con ectasia piélica, 11 pacientes tenían RVU de diversos grados75. En relación con estos, los 68 niños sin RVU mostraron una osmolalidad urinaria máxima significativamente superior, al tiempo que los valores de los cocientes albúmina/creatinina y NAG/creatinina fueron significativamente inferiores. El valor predictivo negativo de las 2 primeras pruebas fue del 93%, con lo que se demostró que la cistografía no se debe indicar, inicialmente, en los casos de osmolalidad urinaria máxima y albuminuria normales75.
En un estudio longitudinal en el que incluimos a niños con diversos grados de RVU observamos que, al diagnóstico, la osmolalidad urinaria máxima estaba reducida en el 69,5% de ellos61 pero, al final del periodo de seguimiento, solo estaba presente en el 19,5%76. Al inicio, el defecto en la capacidad de concentración estaba relacionado con el grado de RVU pero, al final, ese defecto estaba más relacionado con la pérdida de parénquima con la que habían quedado los pacientes que con el grado de RVU inicial. En cuanto a la albuminuria, no existieron diferencias entre el periodo inicial y el final (19,6 vs. 17,6%). No se observó relación de los valores de albuminuria con la intensidad del RVU. Se concluyó que la eliminación urinaria de albúmina es, preferentemente, un marcador de hiperfiltración en niños con RVU relacionado, en ambos momentos, con la pérdida de parénquima77. Con respecto a la NAG, al diagnóstico, estaba elevada en el 37% de los casos. En cambio, al final, fue normal en todos los casos, con lo que demostró que, en este caso, la eliminación urinaria de NAG es un marcador moderadamente sensible de hiperpresión en la vía urinaria78.
Acerca del caso concreto del reflujo vesicoureteral en niños que han padecido infección de las vías urinarias. Un algoritmo basado en las pruebas básicas de estudio de la función renal. Epílogo
La indicación de la cistouretrografía miccional seriada (CUMS) ha variado a lo largo de los años. Durante mucho tiempo se pensó que debía solicitarse en todos los casos de IVU, especialmente, en los niños de corta edad y, sobre todo, en los varones79. Esto fue motivado por la creencia inexacta de que la curación del RVU una vez diagnosticado, cualesquiera que fuera su grado, impediría la aparición de nuevos casos de IVU y de lesión renal secundaria. Puesto que muchos RVU se curan espontáneamente con el paso del tiempo80,81, dado que los de bajo grado no alteran la función renal76 y puesto que el RVU no es la causa final de las IVU82, la estrategia anteriormente citada ha sido ampliamente debatida1-3,5,83. Una de las cuestiones que es clave en el asunto es la respuesta a esta pregunta: ¿Ocurre algún problema si no se diagnostica un RVU de baja intensidad? Nosotros creemos que la respuesta es negativa, porque lo realmente importante es la calidad y cantidad del parénquima renal existente y asegurarse de que la función renal está indemne, comprobada por los métodos más sensibles recordados en esta revisión. Como se ha indicado más arriba, muchos casos de dilataciones leves de la vía urinaria no se asocian a RVU y, si lo hacen, este último suele ser de grado leve. La consecuencia final es que en ambas circunstancias (IVU y ectasias), muchas CUMS son normales y, por tanto, innecesarias. Nosotros, en un estudio ambispectivo quisimos comprobar si la utilización conjunta de parámetros ecográficos y funcionales sensibles podía predecir aceptablemente el resultado de una CUMS negativa y, con ello, evitar su solicitud84. Así, recogimos los datos anatómicos ecográficos y funcionales de 100 niños con CUMS normal y de 63 diagnosticados de RVU (10 de grado leve [I-II], 26 moderado [III] y 27 de grado grave [IV-V]). Las anomalías morfológicas más sensibles para sospechar RVU fueron las cicatrices renales, los riñones atróficos o hipodisplásicos, las hidronefrosis y las ectasias piélicas asociadas a otras anomalías morfológicas. En cuanto a la función renal, se comprobaron diferencias estadísticamente significativas (p = 0,004) al comparar la osmolalidad urinaria máxima de los niños con o sin RVU. Los valores de la eliminación urinaria de albúmina y de NAG fueron poco sensibles, pero muy específicos (87,9%) en los casos de RVU. Uniendo los parámetros morfológicos y funcionales, el 70% de los niños con RVU leve, el 76,9% de aquellos con RVU moderado y el 100% de los portadores de RVU grave tenían anomalías morfológicas o funcionales. Así, el valor predictivo negativo más elevado (80,8%) para detectar RVU se obtuvo cuando se aunaron los niños portadores de anomalías morfológicas, excluidas las ectasias piélicas simples, los que tenían solo anomalías funcionales renales y aquellos con ambas alteraciones (116/163). En estos casos, además, la sensibilidad para diagnosticar RVU fue del 85,7%. Nuestra conclusión es simple, es decir, si la función renal es normal, especialmente la capacidad de concentración, y si no existen anomalías morfológicas distintas de las ectasias piélicas, no está indicada, inicialmente, la realización de una CUMS (fig. 6). Es necesario resaltar que, en el caso de pielonefritis reciente, las pruebas deben realizarse entre 2 y 4 meses después para evitar resultados artefactados.
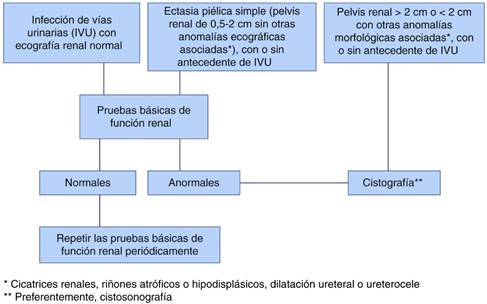
Figura 6 Propuesta de algoritmo para solicitar una cistografía en niños con IVU o CAKUT a partir de ciertos datos morfológicos ecográficos y de las pruebas básicas de estudio de la función renal.
En resumen, el uso adecuado de las pruebas básicas de función renal sirve para ofertar un giro marcado a la práctica habitual en la solicitud de las pruebas de imagen en niños con pérdida de parénquima renal o dilatación de la vía urinaria. El mecanismo de concentración renal es tan complicado que cualquier anomalía en su complejo proceso repercute en la osmolalidad urinaria máxima. Como se ha observado más arriba, es la primera alteración funcional que acontece en muchos trastornos renales. Así, en ausencia de hidronefrosis, en niños con IVU o ectasia de la pelvis renal, la solicitud de CUMS o pruebas de medicina nuclear podrían obviarse inicialmente si la osmolalidad urinaria máxima y la eliminación urinaria de albúmina son normales. A la inversa, una anomalía de la función renal obligaría a realizar dichas pruebas para intentar explicar su origen posible.
Como escribió Marañón en su Crítica de la Medicina dogmática (1950): «Quiero decir a los que trabajan a mi lado que no olviden nunca que cada cosa que los médicos sabemos hemos de procurar saberla lo más exactamente que nos sea dado, pero a conciencia de su posible valor provisional».
















