Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.18 no.4 Madrid jul./ago. 2003
Original
Estudio microbiológico comparativo de yogur fresco y termizado
en un modelo animal in vivo
J. E. García de los Ríos, J. Santos Jiménez Gómez, P. A. Jiménez Gómez, M.ª P. Reche Sainz, F. Álvarez Dávila
y A. M.ª Rojas Mendoza
Sección de Microbiología. Facultad de Ciencias Experimentales y de la Salud. Universidad San Pablo CEU. Boadilla del Monte.
Madrid. España.
| Resumen En un ensayo agudo, ratas en ayunas de 24 h fueron sondadas con 2 ml de yogur fresco, yogur termizado o agua destilada, y se sacrificaron a las 2, 4, 8 y 24 h después, siendo comparadas con ratas sin sondar. Se determinó la supervivencia de las bacterias lácticas del yogur administrado en estómago e intestinos de los animales, y si las bacterias aisladas tenían el perfil de las cepas de Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus thermophilus aisladas originalmente del yogur. Tambien se hizo el recuento del número de microorganismos totales que crecían en el medios para lactobacilos y estreptococos lácticos. Se hicieron análisis de los diferentes tipos de colonias resultantes en los medios para lactobacilos y estreptococos lácticos. Ninguna de las colonias caracterizadas en este ensayo agudo resultó ser L. delbrueckii subsp. bulgaricus o S. thermophilus. El análisis estadístico de los resultados no mostró diferencias significativas en el log UFC · g-1, de la microbiota intestinal de los cuatro grupos de animales en ninguno de los tiempos. (Nutr Hosp 2003, 18:207-214) Palabras clave: Lactobacillus. Streptococcus. Yogur. | COMPARATIVE MICROBIOLOGICAL STUDY OF FRESH AND HEAT-TREATED YOGHURT IN AN IN VIVO ANIMAL MODEL Abstract In an acute assay, rats fasted for 24 h were sounded with 2 ml of fresh yogurt, sterilised yogurt or distilled water, and sacrificed at 2, 4, 8 and 24 h. They were compared with non-sounded rats. The survival of the lactic bacteria of the yogurt administered in the animals stomach and intestines was determined, and the bacteria isolated were to the Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus profiles belonging to the strains isolated originally from the yogurt. Counts of the total number of microorganims that were grown in lactobacilli and lactic streptococci media were also made. Analyses of the different types of resulting colonies in the lactobacilli and lactic streptococci media was performed. No L. delbrueckii subsp. bulgaricus or S. thermophilus were characterized in this acute assay. The statistical analysis of the results did not show significant differences in the log UFC · g-1, of the intestinal microbiota microorganisms of the three groups of animals in any of the times. (Nutr Hosp 2003, 18:207-214) Keywords: Lactobacillus. Streptococcus. Yogurt. |
Correspondencia: José Esteban García de los Ríos.
Sección de Microbiología.
Facultad de Ciencias Experimentales y de la Salud.
Universidad San Pablo CEU.
Ctra. Boadilla del Monte, km. 5,3.
28668 Boadilla del Monte (Madrid).
Correo electrónico: jgarios@ceu.es
Recibido: 24-V-2002.
Aceptado: 20-VII-2002.
Introducción
El yogur es una leche fermentada consumida desde la antigüedad, y a la que siempre se le ha atribuido posibles efectos beneficiosos. Tras los trabajos de Metchnikoff (1907)1, los productos de leches fermentadas han ido rodeándose de una imagen casi mágica2, en cuanto a sus propiedades de alimentos relacionados con la vida sana. La creencia de que el consumo de yogur es beneficioso para la salud ha llegado a formar parte del folklore, pasando de generación en generación en muchas partes de Europa3. El yogur, en principio, fue un producto desarrollado para prolongar en el tiempo las características nutritivas de la leche. Además de ser rico en proteínas, vitaminas, y minerales, al igual que la leche de la que procede, desde hace tiempo se está tratando de comprobar si existe la posibilidad de que ejerza otro tipo de beneficios para la salud. Así, mientras que la evidencia sobre la mejora en la digestión de lactosa es bastante clara, y existe abundante bibliografía que apoya esta hipótesis2-7, para otros posibles efectos son necesarios más estudios que confirmen o rechacen las diferentes propiedades que se han sugerido.
Las características propias del yogur se deben al crecimiento en la leche de dos bacterias lácticas, L. delbrueckii subsp. bulgaricus y S. thermophilus. Estas bacterias son responsables de la acidificación del medio, las propiedades organolépticas y el desarrollo de la textura adecuada.
Lilly y Stillwell8 fueron los primeros en emplear el concepto de probiótico como organismo o sustancia producida por microorganismos que favoreciera el equilibrio microbiano intestinal. Posteriormente Fuller9, 10 los define como un suplemento alimentario vivo que afecta de forma ventajosa al huésped animal, mejorando su equilibrio intestinal microbiano.
Lee y Salminen11, en una revisión sobre la investigación en probióticos, propusieron las características que debía tener éstos, y que se resumen en los siguientes puntos:
1. Origen humano, ya que algunos de los efectos sobre la salud pueden ser dependientes de la especie.
2. Resistencia a ácido y bilis, al menos temporalmente, para poder colonizar el tracto intestinal por vía oral.
3. Presentar mecanismos de adherencia a las células intestinales humanas.
4. Ser antagonistas de microorganismos perjudiciales por la producción de alguna sustancia antimicrobiana o por competencia.
5. Ser inocuos para el consumo humano y tener validados clínicamente sus efectos sobre la salud.
Esto es sólo lo deseable en cuanto a las propiedades en relación con la salud. Si nos referimos a las características deseables desde el punto de vista industrial, habría que ampliar éstas a la capacidad para mantener la viabilidad y el mantenimiento de sus propiedades tras el procesado y almacenamiento.
Según la legislación española (Real Decreto 874/87, de 30 de abril de 1987), y al igual que ocurre en Europa12, el yogur debe estar hecho con L. delbrueckii subsp. bulgaricus y S. thermophilus, y no sólo es por una cuestión legal, sino porque los compuestos que condicionan el sabor son el resultado del metabolismo de los citados microorganismos sobre la lactosa: la fermentación láctica homofermentativa, en la que un 90% del producto de la fermentación de la glucosa es ácido láctico13.
Estos dos microorganismos citados, aunque cumplen con el gusto y la legislación europea, no cumplen las características que Lee y Salminen11 asignaban a los probióticos. Ninguna de las dos especies ha sido descrita como perteneciente a la microbiota humana normal.
Diversos experimentos, tanto in vitro como in vivo o modelos in vitro simulado, nos muestran la falta de resistencia al ácido y a la bilis de L. delbrueckii subsp. bulgaricus y S. thermophilus. Tras comparar muchas especies en su resistencia a la acidez gástrica, Gilliland14, llega a la conclusión de que L. bulgaricus no podría sobrevivir a la primera hora de exposición. Posteriormente, el mismo autor4, opinaba que las bacterias del yogur no sobrevivirían ni crecerían en el tracto intestinal por su falta de resistencia a las bilis. Además, la resistencia en el estómago debería extenderse a los 90 minutos, que es el tiempo medio de vaciado gástrico para los productos lácteos y resistir las bilis al llegar al intestino delgado15.
En estudios in vivo, la resistencia del L. bulgaricus en jugo gástrico solo ha llegado a los 40 minutos16.
En un modelo in vitro simulado se demostró17 que L. delbrueckii subsp. bulgaricus y S. thermophilus sobrevivían sólo brevemente en el compartimento gástrico, descendiendo por bajo del 1% del número ingerido de bacterias entre los 70 y 110 minutos.
Si L. bulgaricus y S. thermophilus no cumplen esta condición de llegar y asentarse en el tubo digestivo, el denominado yogur, no sería una leche fermentada por microorganismos probióticos.
El objetivo del presente trabajo es analizar la composición de la microbiota y la supervivencia de los microorganismos del yogur en animales alimentados con una dosis normal de yogur fresco y de yogur termizado.
Materiales y métodos
Materiales
Animales
Los animales, 70 ratas en el ensayo agudo y 30 en el crónico, se obtuvieron del Servicio de Animalario de la Facultad de CC Experimentales y de la Salud (Universidad San Pablo CEU), con un peso medio inicial de 160-180 g.
Dieta
Con la finalidad de someter a los animales a unas condiciones dietéticas controladas, se les alimentó con una dieta semisintética, basada en la utilizada por Munilla y Herrera, y Soria y cols.18, 19. La dieta semisintética, suplementada o no con 10% de yogur Danone fresco o termizado, estaba compuesta, en g · kg-1, por: caseína (170), sales minerales (35), vitaminas (10), colina (2), metionina (3), celulosa (100), almidón (630) y aceite de maíz (50).
Medios de cultivo y otros
Medio MRS de Man, Rogosa y Sharpe (Oxoid), para el cultivo de Lactobacillus. Para el recuento de Lactobacillus procedentes del yogur no necesitó ningún suplemento para hacerlo más selectivo, sin embargo para emplearlo en el recuento de microorganismos procedentes de las muestras del tubo digestivo se empleó suplementado con 16 mg · l-1 de metronidazol (Flagyl 250, Rône-Poulenc Rorer, S.A.) y 4 mg · l-1 de colistina (Colimicina oral forte, Syntex Latino, S.A). El primero por ser un antibiótico que actúa sobre la microbiota anaerobia del tubo digestivo y por haber resultado resistente la cepa de Lactobacillus del yogur empleado. El segundo por ser un antibiótico que actúa sobre los microorganismos gramnegativos en general.
Medio M17 (Oxoid), para la enumeración selectiva de S. termophilus a partir del yogur. Para el recuento de los estreptococos procedentes del yogur, se usó sin suplemento, y para el recuento de los microorganismos del tubo digestivo, suplementado, como el MRS, con 4 mg · l-1 de colimicina.
Agar para métodos estándar (Pronadisa), para el recuento de microorganismos aerobios y facultativos totales.
Agar anaerobio (Pronadisa), para el recuento de la microbiota anaerobia total.
Lactobacilli MRS Broth (Difco), empleado para hacer diluciones en el experimento agudo, en el que sólo se buscaba microbiota láctica.
Agua triptonada, usada como medio de dilución en el ensayo crónico.
Medio de Slanetz y Bartley (Oxoid), para diferenciar entre Enterococcus y Streptococcus.
Agar Mueller Hinton (Oxoid) para antibiograma por difusión.
Galerías de identificación RAPID ID 32 A y RAPID ID 32 STREP, antibiogramas automáticos ATB ANA y ATB STREP, generadores de anaerobiosis Generbox Anaer, Antimicrobial Susceptibility Test Disks y ONPG Disks, todos ellos de BioMérieux.
Métodos
Análisis microbiológico del yogur
La termización del yogur se realizó a 65° C durante 10 minutos en un baño de agua. El número de UFC · g-1 de lactobacilos y estreptococos fue determinado usando los medios MRS y M17 (ambos en atmósfera anaerobia), respectivamente, para probar que el yogur fresco contenía en el número mínimo de microorganismos requerido por la legislación española y que que el yogur termizado no contenía microorganismos. Se confirmó que las poblaciones de las dos especies de microorganismos lácticos no decrecían tras dos semanas de almacenamiento refrigerado20.
Toma de muestras
A partir de cada animal sacrificado se obtenían el estómago, intestino delgado e intestino grueso.
El contenido de cada muestra era pesado en condiciones de esterilidad en un contenedor estéril, en cabina de flujo laminar, y sometido a análisis microbiológico. Las diluciones que se hicieron dependían del órgano, el medio de cultivo considerado, y de si se trataba del experimento agudo o crónico, siendo las siguientes:
Para estómago (experimento crónico):
- Medio MRS, de 10-310-5.
- Medio M17, de 10-310-5.
- Agar métodos estándar, de 10-310-5.
- Agar anaerobio, de 10-310-7.
Para intestino delgado (experimento crónico):
- Medio MRS, de 10-310-7.
- Medio M17, de 10-310-7.
- Agar métodos estándar, de 10-510-10.
- Agar anaerobio, de 10-610-10.
Para intestino grueso (experimento crónico):
- Medio MRS, de 10-310-7.
- Medio M17, de 10-310-7.
- Agar métodos estándar, de 10-710-10.
- Agar anaerobio, de 10-710-10.
En el experimento agudo, sólo se empleó MRS y M17, porque solamente se trataba de cultivar microorganismos lácticos, y se emplearon las diluciones 10-2-10-6 en todos los casos.
Análisis microbiológico del tracto digestivo
Un gramo del contenido del tracto digestivo en 9 ml de agua triptonada era agitado 30 s en un vortex, se hacían diluciones seriadas en el mismo medio, o en Lactobacilli MRS Broth para el recuento de microbiota láctica en el experimento agudo, y se sembraba en placas de agar métodos estándar, agar anaerobio, MRS con metronidazol y colistina y M17 con colistina. Los últimos tres medios eran incubados en anaerobiosis. La temperatura de incubación fue de 37° C durante 72 h, en todos los casos.
Antibiogramas
Hechos por el sistema ATB de BioMérieux, empleando galerías ATB ANA para Lactobacillus, y por discos y difusión en placa en Lactobacillus y Streptococcus. El ATB STREP no se pudo emplear para Streptococcus porque no creció en este medio. Todas las incubaciones se hicieron en anaerobiosis.
Establecimiento de perfiles para la identificación
A partir de colonias aisladas del yogur, se procedió a la amplificación en los medios MRS y M17 de las colonias de Lactobacillus y Streptococcus, respectivamente. Tras la comprobación de la morfología por tinción de Gram, el establecimiento de perfiles para la identificación del contenido microbiano del yogur entre la microbiota del tubo digestivo se ha realizado mediante el sistema API de Biomerieux, empleando galerías RAPID ID 32A para Lactobacillus y RAPID ID 32 STREP para Streptococcus.
Todos los bacilos grampositivos, beta-galactosidasa +, eran sembrados en RAPID ID 32 A. La beta-galactosidasa se detectaba con discos ONPG.
Todos los estreptococos, beta-galactosidasa +, catalasa- y que no crecían en medio de Slanetz-Bartley, selectivo para enterococos, eran sembrados en RAPID ID 32 STREP.
Ensayo agudo
Se hizo sacrificando animales, tras 24 h en ayunas, a diversos tiempos, tras ser sondados con 2 ml de yogur, yogur termizado y agua destilada, mas un control de animales sin sondar.
Los animales empleados fueron:
- 10 animales sin sonda, sacrificados a t = 0.
- 5 animales con sonda de agua destilada, sacrificados a t = 2.
- 5 animales con sonda de yogur termizado, sacrificados a t = 2.
- 5 animales con sonda de yogur, sacrificados a t = 2.
- 5 animales con sonda de agua destilada, sacrificados a t = 4.
- 5 animales con sonda de yogur termizado, sacrificados a t = 4.
- 5 animales con sonda de yogur, sacrificados a t = 4.
- 5 animales con sonda de agua destilada, sacrificados a t = 8.
- 5 animales con sonda de yogur termizado, sacrificados a t = 8.
- 5 animales con sonda de yogur, sacrificados a t = 8.
- 5 animales con sonda de agua destilada, sacrificados a t = 24.
- 5 animales con sonda de yogur termizado, sacrificados a t = 24.
- 5 animales con sonda de yogur, sacrificados a t = 24.
En cada caso se determinó la supervivencia de las bacterias lácticas del yogur administrado, comparando las bacterias aisladas con el perfil de las cepas de L. delbrueckii subsp. bulgaricus y S. thermophilus aisladas originalmente del citado yogur. También se hizo un recuento del número de microorganismos totales que crecían en los medios para lactobacilos (MRS) y estreptococos lácticos (M17).
La supervivencia de las bacterias lácticas del yogur en estómago, intestino delgado e intestino grueso, fue determinada por comparación con los perfiles de las cepas de lactobacilos y estreptococos aisladas originalmente del yogur.
La identificacón de los posibles lactobacilos de las muestras se hizo basándonos, primero, en la morfología de las colonias en MRS, segundo, morfología a nivel microscópico con tinción de Gram, tercero, detección de beta-galactosidasa con ONPG y, finalmente, inoculando una galería RAPID ID32 A para comparar el perfil fenotípico. Los posibles estreptococos eran identificados por morfología de colonias en M17, tinción de Gram, inoculación en Slanetz Bartley para descartar enterococos que crecían en M17, beta-galactosidasa con ONPG y, finalmente, inoculando una galería RAPID ID 32 STREP, para verificar el perfil correspondiente.
Ensayo crónico
En el experimento crónico, los animales se mantuvieron durante 7 días con una dieta control semisintética. Todos eran de la misma edad y sexo y se sometieron a iguales condiciones ambientales. Se sacrificaron los siguientes grupos de animales, alojados en células individuales de metabolismo:
- 10 animales, tras 30 días de alimentación ad libitum con dieta semisintética.
- 10 animales, tras 30 días de alimentación ad libitum con dieta semisintética suplementada con 10% de yogur termizado.
- 10 animales, tras 30 días de alimentación ad libitum con dieta semisintética suplementada con 10% de yogur fresco.
La toma fue controlada cada dos días, como se muestra en la tabla I. De acuerdo con esta toma, la concentración de ambas bacterias lácticas que recibieron diariamente los animales alimentados con dieta semisintética suplementada con 10% de yogur fresco sería, aproximadamente, 1,8 x 107.
Se estudió el contenido del estómago, intestino delgado e intestino grueso. El contenido de cada órgano fue sometido a un análisis microbiológico cuantitativo y cualitativo en los medios y condiciones ya indicadas.
Análisis estadístico
Con el objetivo de averiguar si los tratamientos empleados son significativamente diferentes se empleó el análisis de la varianza con dos factores de variación (ANOVA), empleando el Programa SPSS para Windows, versión 6.1.
Resultados
Experimento crónico
En la tabla II se muestra el log UFC · g-1 de cada grupo de ratas alimentadas con las diferentes dietas.
En la tabla III vemos como el análisis de la varianza nos indica que no se encuentran diferencias significativas del log UFC · g-1 en función de la dieta en ninguno de los grupos de animales. Además, podemos observar que cuando se analiza la relación entre el log UFC · g-1 con el órgano, los resultados de este análisis de varianza indican que no se deben al azar, con una significación mayor de 99,9% (p = 0,000). Finalmente, esta tabla indica que no se encuentran diferencias significativas ni con los medios de cultivo generales ni con los medios para microorganismos lácticos.
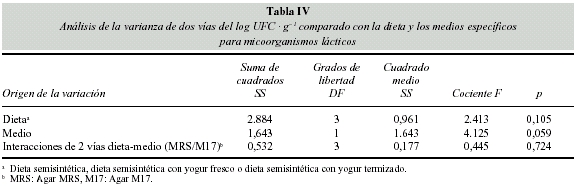
La tabla IV muestra que no hay diferencias significativas en el recuento del número de microorganismos, independientemente de la dieta o del medio de cultivo empleado (MRS o M17). Si ambos medios son evaluados independientemente, la diferencia observada es superior al 94% (p = 0,059).
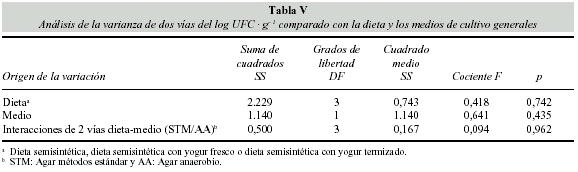
La tabla V indica que no se observan diferencias significativas en las relaciones entre la dieta y los dos medios de cultivo generales (Agar anaerobio y Agar métodos estándar). A pesar de ello, se observa un índice mas alto de microorganismos anaerobios que de aerobios totales en todos los animales y órganos.
Finalmente, en la tabla VI, analizando los recuentos con la dieta y el órgano, de nuevo se pone de manifiesto que la dieta no es un factor de variación significativo en la valoración del número de microorganismos.
No sucede lo mismo cuando el factor de variación es el órgano, cuya significación es mayor de 99,9% (p = 0,00). En efecto, las diferencias entre el log UFC · g-1 en estómago, intestino delgado e intestino grueso son significativas. Por otro lado no se encuentran diferencias significativas en la interacción dieta-órgano, es decir, todos los órganos se comportan de manera diferente entre si, pero de manera homogénea sea cual sea la dieta.
Experimento agudo
Se investigó la supervivencia en estómago, intestino delgado e intestino grueso, de las bacterias lácticas del yogur administrado, comparando las bacterias aisladas con el perfil de las cepas de L. delbrueckii subsp. bulgaricus y S. thermophilus aisladas originalmente del citado yogur. Tras el análisis de los diferentes tipos de colonias resultantes en los medios para lactobacilos y estreptococos lácticos, ninguna de las colonias caracterizadas en este ensayo agudo resultó ser L. delbrueckii subsp. bulgaricus o S. thermophilus. No se pudo demostrar la supervivencia de los microorganismos a ninguno de los tiempos establecidos (2, 4, 8 y 24 h).
Tampoco se encontraron los citados microorganismos en los órganos procedentes de animales sondados con yogur termizado o con agua destilada a los diferentes tiempos.
Discusión
Estos ensayos han sido realizados en condiciones cuidadosamente planificadas y controladas, evitando la administración de grandes cantidades de yogur en ayunas, bajo unas extremas y inusuales circunstancias. En efecto, muchos de los estudios que han demostrado diferencias estadísticamente significativas en algunas propiedades saludables de las leches fermentadas, han sido realizados tras la ingestión en ayunas de grandes cantidades del producto lácteo21. Pensamos que la cantidad de yogur en nuestros experimentos, 10% de yogur fresco o termizado, es suficiente para asegurar que los animales reciben una dieta representativa de las condiciones reales.
Nuestros resultados, en cuanto a la falta de supervivencia de la microbiota láctica del yogur en el estómago a partir de las 2 h, coinciden con los de otros autores4, 16, 17, que llegan a la conclusión de que estos microorganismos no podrían sobrevivir a la primera hora de exposición a las condiciones del estómago ni persistir y crecer en el tracto intestinal por su falta de resistencia a las bilis14. Efectivamente, en intestino delgado e intestino grueso se han detectado ninguna de las dos bacterias a ninguno de los tiempos.
Este hecho, de ninguna manera puede concluir que la alimentación con yogur que contiene microorganismos vivos tenga el mismo valor que la administración de yogur termizado. El citado daño que puede producir la bilis sobre los microorganismos lácticos puede tener consecuencias positivas, ya que podría liberar la beta-galactosidasa, y otros factores, al intestino delgado y facilitar la digestión de la lactosa, o promover alguna otra acción saludable.
Está claro que el principal efecto, fácilmente demostrable de la termización del yogur es la eliminación de los microorganismos, pero no es el único, puesto que el incremento de la temperatura puede conllevar la reducción de enzimas22-25, responsables de algunas de sus propiedades, y componentes aromáticos termolábiles, responsables de los caracteres organolépticos26. Concretamente, en lo que respecta al efecto beneficioso sobre la asimilación de la lactosa, la actividad beta-galactosidasa, podría reducirse notablemente o llegar a ser inhibida totalmente, según el método empleado23, 26, 27. No obstante, la discusión sobre los efectos beneficiosos del yogur fresco sobre el yogur termizado no es el objeto de este trabajo, aquí se ha tratado de demostrar sólo si los microrganismos procedentes del yogur fresco resisten el paso a través del tracto digestivo. Se demuestra en estos experimentos que L. delbrueckii subsp. bulgaricus y S. thermophilus, como sucede con otros muchos de los denominados probióticos que se usan actualmente28, no cumplen esta condición de llegar y asentarse en el tubo digestivo. Por tanto, el denominado yogur, al no cumplir con varios de los requerimientos que proponían Lee y Salminen11, no sería una leche fermentada por microorganismos probióticos.
En cuanto al ensayo crónico, se puede concluir que el análisis estadístico no mostró resultados significativamente diferentes en el log UFC · g-1 de los microorganismos de la microbiota intestinal de los cuatro grupos de animales en ninguno de los tiempos. Esto significa que los microorganismos del yogur no afectan al número de bacterias en el tracto digestivo. Y aún suponiendo que la pérdida de viabilidad que ocurre en el estómago y el intestino delgado por la acción del ácido y de la bilis, respectivamente, no existiera, ¿qué importancia tendría la aporte de 107 de los microorganismos del yogur, si en el intestino grueso contamos niveles de 1011 UFC · g-1, sin considerar la microbiota no cultivable? Es decir, aunque los microorganismos fueran auténticamente probióticos, es posible que, a dosis normales, no tuvieran la importancia que se les da, por su número irrelevante.
Agradecimientos
Este trabajo ha sido financiado por el Proyecto Estudio Microbiológico, Bioquímico y Nutricional del yogur fresco y termizado en un modelo experimental animal in vivo, de la Facultad de Ciencias Experimentales y de la Salud, Universidad San Pablo CEU, España.
Agradecemos a M. Achón, E. Amusquivar, J. M. Garrido, S. Martínez y R. Poo, por su ayuda fundamental en el manejo de los animales, y a T. Pérez de Sande, I. Rodríguez y E. Sánchez, por su importante ayuda en el procesado de las muestras.
Referencias
1. Metchnikoff E: The Prolongation of Life: Optimistic Studies, G.P. Putram and sons, The Kniclerbocker Press, 161-183, New York, 1907. [ Links ]
2. Gurr MI: Nutritional Aspects of Fermented Milk Productos. FEMS Microbiol Rev, 1987, 46:337-342. [ Links ]
3. Buttriss J: Nutritional Properties of Fermented Milk Productos. Int J Dairy Technol, 1997, 50(1):21-27. [ Links ]
4. Gilliland SE: Acidophilus Milk Products: A Review of Potential Benefits to Consumers. J Dairy Sci, 1989, 72:2483-2494. [ Links ]
5. Martini MC, Lerebours EC, Lin WJ, Harlander SK, Berrada NM, Antoine JM y DA Savaiano: Strains and species of lactic acid bacteria in fermented milks (yogurts): effect on in vivo lactose digestion. Am J Clin Nutr, 1991, 54(6):1041-1046. [ Links ]
6. Montes RG, Bayless TM, Saavedra JM y Perman JA: Effect of milks inoculated with Lactobacillus acidophilus or a yogurt starter culture in lactose- maldigesting children. J Dairy Sci, 1995, 78:1657-1664. [ Links ]
7. Jarvis J y G Miller: Overcoming the barrier of lactose intolerance to reduce health disparities. JAMA, 2002, 94:55-66. [ Links ]
8. Lilly DM y RH Stillwell: Probiotics: Growth Promoting Factors Produced by Microorganisms. Science, 1965, 147:747-748. [ Links ]
9. Fuller R: Probiotics in Man and Animals. A Review. J Appl Bacterol, 1989, 66:365-378. [ Links ]
10. Fuller R: Probiotics in Human Medicine. Gut, 1991, 32:439- 442. [ Links ]
11. Lee Y y Salminen S: The Coming of Age of Probiotics. Trends Food Sci Technol, 1995, 6:241-245. [ Links ]
12. Marshall VM y Tamine AY: Starter Cultures Employed in the Manufacture of Biofermented Milks. Int J Dairy Technol, 1997, 50(1):35-41. [ Links ]
13. Schlegel HG: Lactic Acid Fermentation and Lactobacteriaceae. En: Schlegel HG: General Microbiology, 7th Ed. Cambridge University Press, New York, 1993: 300-308. [ Links ]
14. Gilliland SE: Beneficial Interreleationships Between Certain Microorganisms and Humans: Candidate Microorganisms for use as Dietary Adjuncts. J Food Protection, 1979, 42:146- 167. [ Links ]
15. Symons H: Beneficios nutricionales de las leches fermentadas con bifidobacterias. Ibérica, 1995, 75(375):329-331. [ Links ]
16. Conway PL, Gorbach SL y BR Goldin: Acid Bacteria in the Human Stomach and Adhesion to Intestinal Cells. J Dairy Sci, 1987, 70:1-12. [ Links ]
17. Marteau P, Minekus M, Havenaar R y JHJ Huis in-t Veld: Survival of Lactic Acid Bacteria in a Dynamic Model of the Stomach and Small Intestine: Validation and the Effects of Bile. J Dairy Sci, 1997, 80:1031-1037. [ Links ]
18. Munilla MA y Herrera E: A cholesterol-rich diet causes a greater hypercholesterolemic response in pregnant than in nonpregnant rats and does not modify fetal lipoprotein profile. J Nutr, 1997, 127:2239-2245. [ Links ]
19. Soria A, Chicco A, Mocchiutti N, Gutman RA, Lombardo YB, Martin-Hidalgo A y Herrera E: A sucrose-rich diet affects triglyceride metabolism differently in pregnant and nonpregnant rats and has negative effects on fetal growth. J Nutr, 1996, 126:2481-2486. [ Links ]
20. Rybka S y Kailasapathy K: Effect of freeze drying and storage on the microbiological and physical properties of AB-yogurt. Milchwissenschaft, 1997, 52(7):390-394. [ Links ]
21. Marteau P y Rambaud JC: Potential of using lactic acid bacteria for therapy and immunomodulation in man. FEMS Microbiol Rev, 1993, 12:207-220. [ Links ]
22. Desmazeaud M: Influence des traitements technologiques sur les bactéries lactiques. Implications technologiques. En: Les laits fermentés. Actualité de la Recherche. John Libbey Eurotext Ltd., París, 1989: 119-126. [ Links ]
23. Negri R: Some aspects of the effects of heat-treatment on industrially manufactured cultured milks. En: Food Quality and Nutrition. Ed. W.K. Downey, Appl. Sci. Publishers, Oslo, 1978: 511-515. [ Links ]
24. Toba T, Tomita Y, Itoh I y S Adachi: â-galactosidase of lactic acid bacteria: characterization by oligosaccharides formed during hydrolysis of lactose. J Dairy Sci, 1981, 64:185-192. [ Links ]
25. Goodenough ER y Kleyn DH: Influence of viable yogurt microflora of lactose on digestion of lactose by the rat. J Dairy Sci, 1976, 59(4):601-605. [ Links ]
26. Tamime AY y Deeth HC: Yogurt: technology and biochemistry. J Food Protect, 1980, 43(112):939-977. [ Links ]
27. Savaiano DA, Abou El Anouar A, Smith DE y Levitt MD: Lactose malabsorption from yogurt, pasteurized yogurt, sweet acidophilus milk, and cultured milk in lactase-deficient individuals. Am J Clin Nutr, 1984, 40:1219-1223. [ Links ]
28. Madsen KL: The use of probiotics in gastrointestinal disease. Can J Gastroenterol, 2001, 15:817-822. [ Links ]