Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.23 no.5 Madrid sep./oct. 2008
Evaluación del riesgo nutricional e instauración de soporte nutricional en pacientes oncológicos, según el protocolo del grupo español de Nutrición y Cáncer
Nutritional risk evalution and establishment of nutritional support in oncology patients according to the protocol of the Spanish Nutrition and Cancer Group
M. M. Marín Caro1, C. Gómez Candela1, R. Castillo Rabaneda1, T. Lourenço Nogueira1, M. García Huerta1, V. Loria Kohen1, M. Villarino Sanz1, P. Zamora Auñón2, L. Luengo Pérez3 P. Robledo Sáenz4, C. López- Portabella5; A. Zarazaga Monzón6; J. Espinosa Rojas7, Raquel Nogués Boqueras8, L. Rodríguez Suárez9, S. Celaya Pérez10 y J. Pardo Masferrer11
1Nutrición Clínica y Dietética, Hospital Universitario La Paz, Madrid.
2Oncología Médica, Hospital Universitario La Paz, Madrid.
3Nutrición, Hospital Infanta Cristina, Badajoz.
4Dietética y Nutrición, MD Anderson International Cancer Center, Madrid.
5Suport Nutricional, Hospital de la Vall d'Hebrón, Barcelona.
6Cirugía, Hospital Universitario La Paz, Madrid.
7Cuidados Paliativos, AECC-H. San Pedro de Alcántara, Cáceres.
8Nutrición, Centro Médico TEKNON, Barcelona.
9Medicina Preventiva, Hospital Universitario La Paz, Madrid.
10Gerencia, Hospital Clínico Universitario Lozano Blesa, Zaragoza.
11Oncología Radioterápica, Hospital General de Catalunya, Barcelona. España.
Dirección para correspondencia
RESUMEN
Introducción: El cáncer, los tratamientos que lo acompañan y los síntomas consecuentes que a su vez generan, aumentan en los pacientes el riesgo de sufrir malnutrición. La cual produce un gran deterioro del estado de salud, con el consecuente aumento de complicaciones, disminución de la tolerancia al tratamiento oncológico y una disminución de la calidad de vida del paciente. Por este motivo, un grupo de profesionales sanitarios de diferentes puntos de España se reunieron con el objetivo de mejorar la intervención nutricional en pacientes oncológicos, con el apoyo de la Sociedad Española de Nutrición Básica y Aplicada (SENBA).
Metodología: Este grupo multidisciplinar de profesionales elaboró un documento de consenso basado en la literatura y en la experiencia personal, creando un protocolo de evaluación y de intervención nutricional en forma de algoritmos. Se clasifican los pacientes en tres pasos: 1. según el tipo de tratamiento oncológico que reciben, ya sea de tipo curativo o paliativo; 2. riesgo nutricional de la terapia antineoplásica (bajo, mediano, o alto riesgo), y 3. de acuerdo a la Valoración Global Subjetiva-Generada por el paciente (VGS-gp), que clasifica a los pacientes en: A. pacientes con adecuado estado nutricional, B. pacientes con malnutrición o a riesgo de malnutrición y C. pacientes con malnutrición severa. Durante un año el protocolo se puso en marcha en 226 pacientes mayores de 18 años de ambos sexos, escogidos al azar en las consultas externas de Radioterapia Oncológica y Oncología Médica.
Resultados: Más de la mitad sufren malnutrición (64%), y este valor se incrementa llegando hasta un 81% en pacientes con tratamiento paliativo. La mayoría de los pacientes tienen tratamiento de intención curativa (83%) y reciben tratamiento oncológico de intensidad moderada o de alto riesgo nutricional (69%). Un 68% de los pacientes tienen algún tipo de dificultad en la alimentación. La media en el porcentaje de pérdida de peso es del 6,64% ± 0,87 (min 0, máx 33%).
El 32% de la población presenta cifras de albúmina entre 3 y 3,5 g/dl, existiendo una correlación negativa entre ésta y las dificultades con la alimentación p = 0,001.
El IMC no mostró ser un parámetro significativo para detectar malnutrición (sólo un 10% se encontraba por debajo de 19,9 kg/m2), pero tiene una tendencia lineal significativa con las dificultades en la alimentación, de forma tal que a medida que disminuye el IMC aumentan las dificultades p = 0,001.
Más de la mitad de la población, requirió recomendaciones dietéticas específicas para el control de los síntomas que dificultaban la ingesta y una tercera parte de la población necesitó la indicación de suplementos nutricionales.
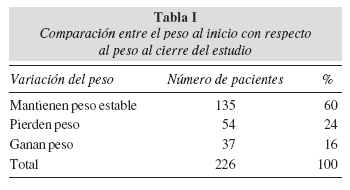
Tras la intervención nutricional más de la mitad (60%) mantuvo su peso y una sexta parte lo aumentó.
Conclusión: La aplicación de este protocolo es útil, sencillo y podría facilitar la detección de malnutrición en los pacientes oncológicos. Seleccionando a los pacientes que realmente se podrían beneficiar de una intervención nutricional específica, pero debería aplicarse al inicio coincidiendo si fuera posible con el diagnóstico de la enfermedad. El soporte nutricional resulta eficaz en la mayoría de los pacientes.
Palabras clave: Cáncer. Malnutrición. Evaluación nutricional. Intervención nutricional. Soporte nutricional. Valoración global subjetiva.
ABSTRACT
Introduction: Cancer and its oncological treatment cause symptoms which increase the patients risk to suffer from malnutrition. This affects the patients health status negatively by increasing the number of complications, reducing the tolerance to the oncology treatment and a decrease of the patients quality of life. Motivated by this, a group of health professionals from several spanish regions met with the backing of the Sociedad Española de Nutrición Básica y Aplicada (SENBA) to address strategies to improve the quality of nutritional intervention in cancer patients.
Methods: This multidisciplinary group developed a protocol describing nutritional assessment and intervention in form of algorithms based on literature and personal experience. The patients are classified in a three step process: 1. type of their oncology treatment (curative or palliative); 2. nutritional risk of the antineoplastic therapy (low, medium or high risk) and 3. depending on the Subjective Global Assessment patient-generated (SGApg). The patients are classified as: A. patients with adequate nutritional state, B. patients with malnutrition or risk of malnutrition and C. patients suffering from severe malnutrition. During one year, the protocol has been used for 226 randomly chosen female and male patients older than 18 years. They were treated by the Medical and Radiotherapy Oncology outpatient clinic.
Results: More than a half of the patients were suffering from malnutrition (64%) increasing up to 81% for patients undergoing palliative treatment. Most of them were treated curatively (83%) and received oncology treatment with moderate or high nutritional risk (69%). 68% of patients were affected by some feeding difficulty. The mean percentage of weight loss has been 6.64% ± 0.87 (min 0%, max 33%). Albumin values of 32% of the patients were between 3 and 3.5 g/dl and negatively correlated with feeding difficulties (p = 0.001).
The body mass index (BMI) has not found to be a significant parameter for detecting malnutrition (only in 10% of the patients, the value was below 19.9 kg/m2). But a significant linear tendency when compared to feeding problems could be shown, such that in patients with less feeding problems a higher BMI has been found (p = 0.001).
More than a half of the patients required nutritional counselling to control symptoms which made food intake difficult. One third of the patients needed oral nutritional supplementation. Following the nutritional intervention the weight of about 60% of the patients could be maintained and of one sixth it could be increased.
Conclusion: The application of this protocol is useful, easy and could help detecting malnutrition in oncology patients. It provides the possibility to select those patients who can benefit from a specific nutritional intervention. If possible, the application of the protocol should be started immediatly after cancer is diagnosed. Nutritional support proves efficient for most of the patients.
Key words: Cancer. Malnutrition. Nutritional intervention. Nutritional assessment. Nutritional support. Subjective global assessment.
Introducción
En los pacientes con cáncer existe una gran dificultad para mantener y/o mejorar su estado nutricional si no se toman medidas tempranas de soporte nutricional o de vigilancia, que puedan evitar un deterioro progresivo1,2. Debido a la enfermedad, por la alteración metabólica inducida por el tumor, los cambios fisiológicos producidos, los efectos del tratamiento oncológico3 y la presencia de síntomas (stress, depresión, anorexia, vómitos, diarrea, dolor, etc.4-7. Aparecerá una desnutrición calórica proteica severa, exacerbada por el incremento del gasto energético y la ingesta deficiente del paciente8. El paciente puede encontrarse de esta manera ante un síndrome de caquexia tumoral9, que reúne un complejo de interacciones entre citoquinas proinflamatorias y el metabolismo del huésped10 caracterizado por la pérdida de peso, la reducción de la masa grasa y muscular, anorexia con reducción de la ingesta, saciedad temprana, hipoalbuminemia, anemia, y debilidad progresiva11,12.
Esta situación va a repercutir en gran medida en la capacidad funcional, con un aumento de complicaciones, aumento de la tasa de infecciones, disminución de la tolerancia al tratamiento oncológico, al igual que una disminución de la calidad de vida del paciente13.
Para mejorar la situación nutricional de los pacientes oncológicos, y ante la creciente demanda debido al gran aumento en el número de diagnósticos14, a comienzos del año 2000 un grupo de profesionales sanitarios de diferentes puntos de España, se reunieron por primera vez con el objetivo de mejorar la intervención nutricional en éstos pacientes. Con el apoyo de la SENBA (Sociedad Española de Nutrición Básica Aplicada), elaboraron un documento de trabajo, consensuado y basado en la literatura, y en la experiencia personal. Diseñaron un protocolo de intervención nutricional en forma de algoritmos, que fuera de utilidad para todos aquellos profesionales que están implicados en el tratamiento y cuidado de éstos pacientes1.
Objetivos
Los objetivos generales que se plantearon para la implementación de dicho protocolo fueron los siguientes:• Definir el perfil nutricional de los pacientes oncológicos adscritos al Hospital Universitario La Paz, y que se evalúan en consulta externa o en Hospital de Día (diagnóstico, estado nutricional, tipo de terapia anti-neoplásica y extensión).
• Valorar la utilidad de éste protocolo de soporte nutricional generado por el grupo de trabajo de la Sociedad Española de Nutrición Básica Aplicada (SENBA).
• Organizar de manera integral el soporte nutricional de los pacientes que son tratados por los diferentes servicios del hospital: Oncología Médica y Radioterápica).
Los objetivos que se plantearon con el soporte nutricional a través del protocolo:
• Evaluar la utilidad de las diferentes modalidades de soporte nutricional: Previniendo y corrigiendo deficiencias nutricionales por medio de una alimentación adecuada que permita el mantenimiento de un estado nutricional óptimo, mediante recomendaciones dietéticas.
• Implementar el uso de suplementos hipercalóricos-hiperproteicos en las diferentes situaciones de riesgo nutricional que lo requieran.
• Poner en práctica el Soporte Nutricional Enteral o Parenteral a nivel Domiciliario en aquellos pacientes que lo requieran; tal como se venía haciendo con anterioridad.
Metodología
Durante un año en el Hospital Universitario La Paz de Madrid en las consultas externas de Radioterapia Oncológica y Oncología Médica, se procedió a ejecutar el protocolo en 226 pacientes (55% hombres), con una edad media de 63 ± 13 años (min 24, máx 95). Se incluyeron pacientes ambulatorios escogidos al azar con diagnóstico de cáncer, mayores de 18 años, que accedieron voluntariamente a participar en el estudio. La distribución por diagnóstico fue: 21% con cáncer de mama, 17% colon, 15% cáncer de cabeza y cuello, 14% pulmón, 13% gástrico, y otros 20% (páncreas, vejiga, próstata, LNH, hígado, vesícula). Un 34,5% de los pacientes presentaban metástasis.
Se analizaron las siguientes variables:
Antropometría: El peso y la talla son medidas sencillas de obtener. Mediante tablas específicas se puede obtener el peso ideal a través de la talla, sexo y la edad del paciente15. También se hace referencia al cambio de peso que se ha producido con respecto al habitual y su evolución en el tiempo. Una pérdida superior a 10% es un valor pronóstico en cáncer16. El Índice de Masa Corporal (IMC) o índice de Quetelet es una medida que relaciona el peso con la talla y se define por la siguiente ecuación: IMC = Peso/Talla2. Se consideran valores normales los comprendidos entre 20 y 25, definiéndose la malnutrición por defecto con valores inferiores a 20 y por exceso con valores por encima de 25 kg/m2.
Medición de Albúmina plasmática: Es una proteína de síntesis hepática que refleja el estado del compartimiento proteico visceral17. Se consideró normal entre 3,5-4,5 g/dl. Se valoró debido a su importancia para predecir complicaciones asociadas a la desnutrición. Cifras inferiores a 2,5 g/dl sugieren un elevado riesgo de complicaciones.
Valoración global subjetiva (VGS-gp): Utilizada como una herramienta sencilla para identificar precozmente a los pacientes malnutridos o en riesgo de estarlo18, identifica a los pacientes que requieren una intervención nutricional y cuales se beneficiarían de un soporte nutricional intensivo19,20. Interrelaciona datos de la evolución del peso, la ingesta dietética actual en relación con la ingesta habitual del paciente, los síntomas digestivos presentes en las últimas dos semanas, capacidad funcional y los requerimientos metabólicos21. Valora cada uno de los apartados como leve, moderado o severo. Esta clasificación valora si un paciente presenta riesgo de sufrir complicaciones derivadas de su inadecuado estado nutricional y si se beneficiaría de un tratamiento nutricional; por lo tanto, sirve para tomar decisiones sobre el seguimiento del estado nutricional y su tratamiento. En nuestro protocolo se realizaron varias modificaciones al formato original que elaboró Ottery22 y que incluyen:
a) Pérdida de peso anterior al tratamiento antineoplásico, que en la VSG original se valoraba en 1 mes (6 meses como alternativa) y que se situó en un término medio de 3 meses; perder > 10% del peso en este periodo de tiempo indica la necesidad de tratamiento nutricional.
b) Nivel de albúmina plasmática crítica que indicaría necesidad de tratamiento nutricional previo al inicio de una terapia antineoplásica agresiva (inferior a 3,0 g/dl).
c) Cifra de prealbúmina plasmática crítica que indicaría necesidad de tratamiento nutricional tras el comienzo de la terapia antineoplásica (inferior a 15,0 mg/dl).
Con la finalidad de poner en marcha el protocolo de intervención, los pacientes con cáncer se clasifican en tres pasos:
1. Según el tipo de tratamiento oncológico que reciben, ya sea de tipo curativo o paliativo (figs. 1 y 2).
2. Riesgo nutricional de la terapia antineoplásica (bajo, mediano, o alto riesgo) (figs. 3 y 4).
3. De acuerdo a la Valoración Global Subjetiva-Generada por el paciente (VGS-gp) (figs. 5 y 6), que clasifica a los pacientes en:
A. Pacientes con adecuado estado nutricional
B. Pacientes con malnutrición o a riesgo de malnutrición
C. Pacientes con malnutrición severa.
Se analizaron todas las variables con el programa informático SPSS (Versión 11.0). Los valores P se consideran estadísticamente significativos si P < 0,05.
Resultados
El 83% de los pacientes recibía un tipo de tratamiento de intención curativa. El 44% recibía quimioterapia, el 24% radioterapia, ambos tratamientos el 21%, ninguno 11%. Un 28% de los pacientes recibió una tipo de quimioterapia de bajo riesgo, y un 37% de riesgo medio.
El 68% recibió otros tratamientos concomitantes: 42% antieméticos, 37% analgésicos, un 20% estimulantes del apetito, 19,5% protectores gástricos, 16% vitaminas y/o minerales, 10% corticoides, 9% psicofármacos, 6% anti-estreñimiento, 4% antidiarreicos.
En relación a la clasificación por el método de la VGS-GP el 36% correspondieron al grupo A y tenía un estado nutricional adecuado, un 50% en el grupo B y tenían un riesgo de malnutrición o malnutrición moderada y un 14% C, con malnutrición severa. En el grupo A, el 58% son mujeres, y 42% hombres; en el grupo B: 63% hombres y 37% mujeres; en el grupo C: 56% hombres y 44% mujeres (figs. 7, 8, 9, 10 y 11).
Analizando las dificultades encontradas en la alimentación, un 68% tenía algún tipo de dificultad. De ellas, un 42,5% tuvo falta de apetito, el 40% náuseas, 35% estreñimiento, 31% plenitud gástrica, 27% vómitos, 21% disfagia, 21% depresión, 19% dolor, el 16% refirió olores desagradables, el 16% problemas dentales, el 13% refiere que los alimentos no tienen sabor, el 12% sienten sabores desagradables, 11% diarrea. Con una media de 4 síntomas por paciente, en el grupo B y 5 en el grupo C. Relacionando el tipo de tratamiento antineoplásico con respecto a las dificultades para la alimentación, no es significativo en ninguno de los 3 grupos.
La media del porcentaje de pérdida de peso en la población global, se sitúa en un 6,64% entre un valor de 0 y 33%, y una DS ± 8,07, para el grupo B la media se sitúa en un 8,13%, para el grupo C en un 17%. Para los pacientes en tratamiento paliativo se sitúa en un 10% (fig. 12).
La media para la albúmina es de 3,58 g/dl con una DS ± 0,34, mínimo 2,8 y máximo 4,54. El 32% del total de la población global, presenta unos valores de albúmina entre 3-3,5g/dl (fig. 13). Relacionando los valores de la albúmina y la presentación de dificultades en la alimentación, el 82% del grupo que presenta valores entre 3-3,5 tiene dificultades (p = 0,002). Existiendo una correlación negativa en cuanto a las dificultades de alimentación (p = 0,001).
En cuanto al IMC analizado en la población global el 10% tiene bajo peso (< 19,9 kg/m2), 56,5% tiene peso adecuado (20-25 kg/m2), un 23,5% sobrepeso (25- 29,9 kg/m2) y un 10% obesidad (≥ 30 kg/m2). El 25% del grupo B, tiene un IMC bajo.
El IMC en este estudio, no fue un parámetro significativo para detectar malnutrición (fig. 14). Si se relacionan las dificultades de la alimentación y el IMC, se encuentra una tendencia lineal significativa, que a medida que disminuye el IMC aumentan las dificultades (p = 0,000).
A todos los pacientes con un adecuado estado nutricional, clasificados en el grupo A, se les impartió educación nutricional sobre la base de una alimentación saludable (81 pacientes). También se elaboraron planes individualizados de alimentación para aquellos que necesitaban una alimentación más específica y calibrada en macro y micronutrientes.
En cuanto, a los pacientes clasificados en el grupo B y C en general, se hizo específicamente un soporte nutricional individualizado y ajustado a las necesidades de cada uno, con una alimentación específica, modulada, adaptada, con suplementación, nutrición enteral o parenteral si fuese necesario. Estas dosúltimas modalidades de soporte nutricional ya instaurados en la Unidad de Nutrición y Dietética (fig.15).
Además, a todos los pacientes clasificados en el grupo B, se les dio recomendaciones específicas para el control de síntomas que dificultaban la alimentación. Se efectuaron en total 292 revisiones para el grupo A y 425 para el grupo B.
Algunos pacientes, al terminar el tratamiento oncológico, siguieron requiriendo soporte nutricional, debido a condiciones especiales de su estado nutricional, y condiciones sociales de vida, como los pacientes que viven solos en su domicilio.
Las tablas I, II y III indican la evaluación de la intervención nutricional con la variable del peso, al inicio y al cierre del estudio. Además los tipos de suplementos y fórmulas de nutrición enteral utilizados.
Discusión
La población que se estudió era muy heterogénea en cuanto a: diagnóstico, estadio de la enfermedad y tiempo de tratamiento, pero nos permitió un primer acercamiento al perfil nutricional de los pacientes adscritos a los servicios de Oncología Médica y Radioterapia Oncológica del hospital.
En un 30% los pacientes tenían diagnósticos que se pueden considerar como de alto riesgo nutricional, un 83% tenía un tratamiento de intención curativa, un 21% estaba recibiendo ambos tratamientos (radioterapia y quimioterapia), y un 37% quimioterapia de riesgo moderado, lo que sugiere un riesgo alto y moderado para sufrir malnutrición. Entre los muchos tratamientos concomitantes que además recibían lo pacientes, un alto porcentaje (42%) ingería antieméticos.
El alto porcentaje de pacientes en tratamiento activo, nos sugirió la imperante necesidad de establecer medidas nutricionales tempranas para incrementar la respuesta al tratamiento, disminuir la tasa de complicaciones, y posiblemente reducir la morbilidad2,13,23.
La VGS-gp permitió establecer que más de la mitad de los pacientes presentan un riesgo latente de malnutrición, y en muchos casos, ya estaba instaurada. Un dato esencial que además se pudo establecer, son las dificultades que se encuentran en los pacientes que impiden el proceso de alimentación, que estuvieron presentes en más de la mitad de la población. Con un alto porcentaje de pacientes paliativos con desnutrición (81%) que es importante para tener en cuenta, justo cuando es prioritario mantener su bienestar, controlando los síntomas que deterioran su calidad de vida24-26.
De la población en general, un 42,5% tuvo falta de apetito y 40% náuseas, síntomas que interfieren enormemente con la ingesta de los pacientes27. En el grupo con riesgo de malnutrición o malnutrición moderada presentaban una media de 4 síntomas y en el grupo de pacientes con malnutrición grave 5 síntomas. Esto sumado al hecho que la media del porcentaje de pérdida de peso se situó en un 6,64%, y que el 32% presentó valores de albúmina entre 3-3,5g/dl. Fueron las variables determinantes, que nos permitieron tomar las pautas para una intervención nutricional oportuna e intensiva28.
El análisis de otras variables como el IMC29 no fue para nosotros de utilidad para tomar decisiones de intervención nutricional, porque la mitad presentaba un peso adecuado, aunque si se encontró que a medida que disminuía el IMC aumentaban las dificultades de la alimentación.
Teniendo en cuenta que las necesidades nutritivas se cubren mediante una dieta adecuada30 en macronutrientes (proteínas, carbohidratos y grasas), micronutrientes (electrolitos, vitaminas y oligoelementos) de acuerdo con las RDA, y agua por vía oral31; siempre y cuando la función digestiva sea la correcta y el apetito esté conservado32, se siguieron las recomendaciones de las guías alimentarias para la población española33,34, dependiendo de los requerimientos individuales de cada paciente32. Tomándose como base entre (30-35 kcal/kg/día), para este tipo de pacientes que eran ambulatorios28. Para los requerimientos proteicos, una cantidad mínima diaria de 1 g/kg/día, que se incrementó en función del grado de estrés entre 1,2 a 1,5 g/kg/día28.
Los pacientes recibieron recomendaciones nutricionales generales o específicas según los síntomas que presentaron, para mejorar el aporte nutricional. Esta intervención fue dirigida específicamente al grupo A con estado nutricional adecuado, y B para mejorar los síntomas que dificultaban la alimentación, y que además repercutían con el estado nutricional35. Estudios clínicos randomizados, indican la eficacia de un soporte nutricional de este tipo, en términos clínicos (peso, sintomatología) y calidad de vida del paciente36-39.
En otros casos cuando la anorexia, las náuseas y los vómitos, entre otras circunstancias, asociados al tratamiento, dificultaron la ingesta de alimentos, o el paciente ya presentaba indicios o riesgo de malnutrición o una malnutrición moderada ya instaurada, se intervino la dieta con una alimentación adaptada (modificando consistencia y textura) y con suplementos nutricionales40 empleados como estrategia simple y no invasiva, que tiene como propósito incrementar la ingesta de nutrientes2. Dependiendo de los resultados de la reevaluación posterior, hubo que instaurar una nutrición artificial, ya sea por vía digestiva, nutrición enteral41,42, o por vía endovenosa, nutrición parenteral43,44, está última solo en los casos donde la utilización del aparato digestivo era inadecuado45. En los pacientes con malnutrición grave se procedió inmediatamente a la intervención con nutrición artificial.
En general, más de la mitad de la población, requirió recomendaciones específicas para el control de síntomas que dificultaban la alimentación, y una tercera parte de la población global necesitó suplementación.
Se ha demostrado la utilidad del protocolo de intervención nutricional como instrumento para detectar malnutrición y definir los pacientes que se beneficiarían de un soporte nutricional adecuado. Se instauró el tratamiento nutricional más idóneo, de acuerdo a las características de cada paciente, teniendo en cuenta sus preferencias y su capacidad de tolerancia digestiva.
Algunos pacientes, cuando terminaron el tratamiento activo, continuaron requiriendo un soporte nutricional adecuado a sus condiciones específicas. Generalmente, coinciden con un diagnóstico de cáncer de cabeza y cuello, que quedan con grandes secuelas para tener una alimentación adecuada46.
Aunque los tiempos de revisión propuestos por el protocolo, trataron de seguirse en todo momento, es importante tener en cuenta, que en el paciente oncológico, se debe tratar de adaptar las revisiones o controles nutricionales, a los tiempos que coinciden con los tratamientos antineoplásicos. En algunas ocasiones el seguimiento, se hace difícil, por los períodos en que puede permanecer ingresado el paciente (para recibir tratamientos oncológicos, o por complicaciones de los mismos), por el tiempo en que no tiene previsto el tratamiento oncológico, o por deterioro de la propia enfermedad.
A pesar de haber instaurado un adecuado soporte nutricional en los pacientes que lo requirieron, a nivel global, más de la mitad mantuvo el peso estable, una sexta parte ganó peso, sin embargo una cuarta parte perdió. Esto se puede atribuir a la enfermedad de base, al tratamiento recibido, que en un alto porcentaje se situó entre moderado y alto riesgo para sufrir malnutrición, ya que la intervención que se llevó a cabo no fue precoz.
La aplicación de este protocolo es muy útil, para detectar malnutrición y seleccionar pacientes que se beneficiarán de una Intervención Nutricional Específica. Diseñar un tipo de intervención de este tipo, para los pacientes oncológicos, es a su vez un arduo trabajo que requiere mucho tiempo y dedicación, y que debe manejarse a través de equipos especializados de Nutrición con un alto grado de entrenamiento en oncología1. Se debe poner en marcha tan pronto como sea posible.
Conclusiones
En este estudio poniendo en práctica el protocolo de intervención en pacientes ambulatorios, más de la mitad sufren malnutrición, y este valor se incrementa llegando hasta un 81% en pacientes con tratamiento paliativo. La mayoría de los pacientes reciben un tratamiento de intención curativa, con una intensidad moderada o de alto riesgo nutricional (69%).
La aplicación de este protocolo es útil y podría fácilmente detectar malnutrición, seleccionando pacientes que realmente se podrían beneficiar de una intervención nutricional específica. Pero debería aplicarse al inicio coincidiendo si fuera posible con el diagnóstico de la enfermedad. El soporte nutricional resulta eficaz en la mayoría de los pacientes.
Agradecimientos
A la Sociedad Española de Nutrición Básica Aplicada (SENBA) y al departamento de Novartis Medical Nutrition por el apoyo en el desarrollo del grupo de Nutrición y Cáncer.
Bibliografía
1. Gómez-Candela C, Rodríguez L, Luengo L, Zamora P, Celaya S, Zarazaga A y cols. Intervención Nutricional en el Paciente Oncológico Adulto. Barcelona: Editorial Glosa; 2003. [ Links ]
2. Van Bokhorst-de Van der Schueren MA. Nutritional support strategies for malnourished cancer patients. Eur J Oncol Nurs 2005; 9(Supl. 2):S74-83. [ Links ]
3. Stone HB, Coleman CN, Anscher MS, McBride WH. Effects of radiation on normal tissue: consequences and mechanisms. Lancet Oncol 2003; 4(9):529-36. [ Links ]
4. Argiles JM. Cancer-associated malnutrition. Eur J Oncol Nurs 2005; 9(Supl. 2):S39-50. [ Links ]
5. Capra S, Ferguson M, Ried K. Cancer: impact of nutrition intervention outcome -nutrition issues for patients. Nutrition 2001;17(9):769-72. [ Links ]
6. Zackrisson B, Mercke C, Strander H, Wennerberg J, Cavallin-Stahl E. A systematic overview of radiation therapy effects in head and neck cancer. Acta Oncol 2003; 42(5-6):443-61. [ Links ]
7. Wiseman M. The treatment of oral problems in the palliative patient. J Can Dent Assoc 2006; 72(5):453-8. [ Links ]
8. Bosaeus I, Daneryd P, Svanberg E, Lundholm K. Dietary intake and resting energy expenditure in relation to weight loss in unselected cancer patients. Int J Cancer 2001; 93(3):380-3. [ Links ]
9. Delano MJ, Moldawer LL. The origins of cachexia in acute and chronic inflammatory diseases. Nutr Clin Pract 2006; 21(1):68-81. [ Links ]
10. Whitehouse AS, Smith HJ, Drake JL, Tisdale MJ. Mechanism of attenuation of skeletal muscle protein catabolism in cancer cachexia by eicosapentaenoic acid. Cancer Res 2001; 61(9):3604-9. [ Links ]
11. Laviano A, Meguid MM, Inui A, Muscaritoli M, Rossi-Fanelli F. Therapy insight: cancer anorexia-cachexia syndrome-when all you can eat is yourself. Nat Clin Pract Oncol 2005; 2(3):158-65. [ Links ]
12. Fearon KC, Moses AG. Cancer cachexia. Int J Cardiol 2002; 85(1):73-81. [ Links ]
13. Marín Caro MM, Laviano A, Pichard C. Nutritional intervention and quality of life in adult oncology patients. Clin Nutr 2007; 26(3):289-301. [ Links ]
14. Bray F, Sankila R, Ferlay J, Parkin DM. Estimates of cancer incidence and mortality in Europe in 1995. Eur J Cancer 2002; 38(1):99-166. [ Links ]
15. Alastrue Vidal A, Sitges Serra A, Jaurrieta Mas E, Sitges Creus A [Anthropometric parameters for a Spanish population (author's transl)]. Med Clin (Barc) 1982; 78(10):407-15. [ Links ]
16. Dewys WD, Begg C, Lavin PT, Band PR, Bennett JM, Bertino JR y cols. Prognostic effect of weight loss prior to chemotherapy in cancer patients. Eastern Cooperative Oncology Group. Am J Med 1980; 69(4):491-7. [ Links ]
17. Sitges-Serra A. Perioperative artificial nutrition in elective adult surgery. Clin Nutr 1996; 15(5):254-7. [ Links ]
18. Detsky AS, McLaughlin JR, Baker JP, Johnston N, Whittaker S, Mendelson RA y cols. What is subjective global assessment of nutritional status? JPEN J Parenter Enteral Nutr 1987; 11(1):8-13. [ Links ]
19. Gómez-Candela C, Luengo L, De Cos A, Martínez-Roque V, Iglesias C, Zamora P y cols. Subjective global assessment in neoplastic patients. Nutr Hosp 2003; 18(6):353-7. [ Links ]
20. Barbosa-Silva MC, Barros AJ. Indications and limitations of the use of subjective global assessment in clinical practice: an update. Curr Opin Clin Nutr Metab Care 2006; 9(3):263-9. [ Links ]
21. ASPEN Board of directors. Guidelines for the use of parenteral, enteral nutrition in adult and pediatric care. J Parenter Enteral Nutr 2002; 26:9SA-12SA. [ Links ]
22. Ottery FD. Definition of standardized nutritional assessment and interventional pathways in oncology. Nutrition 1996; 12 (1 Supl.):S15-9. [ Links ]
23. Marín Caro MM, Laviano A, Pichard C. Impact of nutrition on quality of life during cancer. Curr Opin Clin Nutr Metab Care 2007; 10(4):480-7. [ Links ]
24. Peltz G. Nutrition support in cancer patients: a brief review and suggestion for standard indications criteria. Nutr J 2002; 1:1. [ Links ]
25. Segura A, Pardo J, Jara C, Zugazabeitia L, Carulla J, De Las Penas R y cols. An epidemiological evaluation of the prevalence of malnutrition in Spanish patients with locally advanced or metastatic cancer. Clin Nutr 2005; 24(5):801-14. [ Links ]
26. Marín Caro MM, Laviano A, Pichard C, Gómez Candela C. Relationship between nutritional intervention and quality of life in cancer patients. Nutr Hosp 2007; 22(3):337-50. [ Links ]
27. Bergkvist K, Wengstrom Y. Symptom experiences during chemotherapy treatment-With focus on nausea and vomiting. Eur J Oncol Nurs 2006; 10(1):21-9. [ Links ]
28. Arends J, Bodoky G, Bozzetti F, Fearon K, Muscaritoli M, Selga G y cols. ESPEN Guidelines on Enteral Nutrition: nonsurgical oncology. Clin Nutr 2006; 25(2):245-59. [ Links ]
29. Weimann A, Braga M, Harsanyic L, Lavianod A, Ljungqvist O, Soeters P. ESPEN Guidelines on Enteral Nutrition: Surgery including Organ Transplantation. Clinical Nutrition 2006; 25:224-244. [ Links ]
30. Brown JK, Byers T, Doyle C, Coumeya KS, Demark-Wahnefried W, Kushi LH y cols. Nutrition and physical activity during and after cancer treatment: an American Cancer Society guide for informed choices. CA Cancer J Clin 2003; 53(5):268-91. [ Links ]
31. RDA. Recommended Dietary Allowances. National Academy Press ed. Washington: National Academy Press; 1989. [ Links ]
32. Nitenberg G, Raynard B. Nutritional support of the cancer patient: issues and dilemmas. Crit Rev Oncol Hematol 2000; 34(3):137-68. [ Links ]
33. Aranceta J, Serra-Majem L. Dietary guidelines for the Spanish population. Public Health Nutr 2001; 4(6A):1403-8. [ Links ]
34. Serra Majem L, García Álvarez A, Ngo de la Cruz J [Mediterranean diet. Characteristics and health benefits]. Arch Latinoam Nutr 2004; 54(2 Supl. 1):44-51. [ Links ]
35. Grant M, Kravits K. Symptoms and their impact on nutrition. Semin Oncol Nurs 2000; 16(2):113-21. [ Links ]
36. Ravasco P, Monteiro Grillo I, Camilo M. Cancer wasting and quality of life react to early individualized nutritional counselling! Clin Nutr 2007; 26(1):7-15. [ Links ]
37. Ravasco P, Monteiro-Grillo I, Camilo ME. Does nutrition influence quality of life in cancer patients undergoing radiotherapy? Radiother Oncol 2003; 67(2):213-20. [ Links ]
38. Ravasco P, Monteiro-Grillo I, Vidal PM, Camilo ME. Dietary counseling improves patient outcomes: a prospective, randomized, controlled trial in colorectal cancer patients undergoing radiotherapy. J Clin Oncol 2005; 23(7):1431-8. [ Links ]
39. Trabal J, Leyes P, Forga MT, Hervas S. Quality of life, dietary intake and nutritional status assessment in hospital admitted cancer patients. Nutr Hosp 2006; 21(4):505-10. [ Links ]
40. Stratton RJ. Summary of a systematic review on oral nutritional supplement use in the community. Proc Nutr Soc 2000; 59(3):469-76. [ Links ]
41. Lochs H, Allison SP, Meier R, Pirlich M, Kondrup J, Schneider S y cols. Introductory to the ESPEN Guidelines on Enteral Nutrition: terminology, definitions and general topics. Clin Nutr 2006; 25(2):180-6. [ Links ]
42. Schattner M. Enteral nutritional support of the patient with cancer: route and role. J Clin Gastroenterol 2003; 36(4):297-302. [ Links ]
43. Joque L, Jatoi A. Total parenteral nutrition in cancer patients: why and when? Nutr Clin Care 2005; 8(2):89-92. [ Links ]
44. Braunschweig C, Liang H, Sheean P. Indications for administration of parenteral nutrition in adults. Nutr Clin Pract 2004; 19(3):255-62. [ Links ]
45. Bozzetti F. Nutrition and gastrointestinal cancer. Curr Opin Clin Nutr Metab Care 2001; 4(6):541-6. [ Links ]
46. Cooper JS, Fu K, Marks J, Silverman S. Late effects of radiation therapy in the head and neck region. Int J Radiat Oncol Biol Phys 1995; 31(5):1141-64. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Carmen Gómez Candela.
Jefe Nutrición Clínica y Dietética.
Paseo de la Castellana, 261.
28046 Madrid.
E-mail: carmengomezcandela@telefonica.net
Recibido: 10-IX-2007.
Aceptado: 24-IV-2008.