Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.25 no.1 Madrid ene./feb. 2010
Ensayo clínico aleatorizado con una galleta enriquecida en inulina en el patrón de riesgo cardiovascular de pacientes obesos
Randomized clinical trial with a inulin enriched cookie on risk cardiovascular factor in obese patients
D. A. de Luis1, B. de la Fuente1, O. Izaola1, R. Conde1, S. Gutiérrez2, M. Morillo3 y C. Teba Torres3
1Instituto de Endocrinología y Nutrición. Facultad de Medicina y Unidad de Apoyo a la Investigación. Hospital Río Hortega. Universidad de Valladolid.
2División de Investigación Gullón, S. A.
3División de Alimentación. Centro de Automatización Robótica y Tecnologías de la Información y la Fabricación CARTIF. España.
Dirección para correspondencia
RESUMEN
Introducción: La inulina es un prebiótico con potenciales efectos beneficiosos a nivel cardiovascular. El objetivo de nuestro trabajo es evaluar la respuesta del perfil de riesgo cardiovascular en pacientes obesos tras la inclusión en la dieta de una galleta enriquecida en inulina.
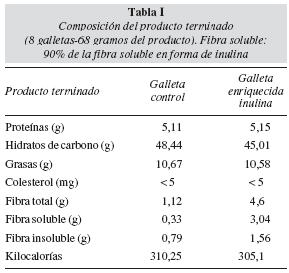
Material y métodos: Un total de 34 pacientes fueron randomizados a una de las siguientes ramas: galleta I (enriquecida con inulina, ver tabla I) y galleta II (galleta control, ver tabla I) (Gullón SL). Cada paciente recibió un total de 8 galletas al día (total de 68 gramos de producto). Antes de iniciar el tratamiento y al mes se realizóuna valoración nutricional y analítica.
Resultados: Finalizaron un total de 15 pacientes en cada grupo. En el grupo I se produjo un aumento significativo en la ingesta de fibra soluble (inulina). Se detectó en los pacientes con las galletas enriquecidas en inulina una disminución significativa de los niveles de colesterol total (223,1 ± 45,3 mg/dl vs 208,8 ± 33,1 mg/dl; p < 0,05) y LDL colesterol (142,9 ± 39,2 mg/dl vs 131,4 ± 28,6 mg/dl; p < 0,05). También se detectó una disminución de los niveles de insulina y resistencia a la insulina (HOMA), pero sin alcanzar la significación estadística. No existieron diferencias estadísticamente significativas en las variables antropométricas. El aumento de la ingesta de fibra soluble en los pacientes de grupo I no supuso ningún efecto secundario a nivel gastrointestinal.
Conclusión: El aumento en la ingesta de 3 gramos de inulina proveniente de una galleta enriquecida, reduce los niveles de colesterol LDL en pacientes obesos.
Palabras clave: Factores de riesgo cardiovascular. Galletas. Inulina. Obesidad.
ABSTRACT
Introduction: Inulin is a prebiotic with potential benefit in cardiovascular risk factors. The aim of our work is to evaluate in obese patients the effect of a inulin enriched cookie on cardiovascular risk factors.
Material and methods: 34 patients were randomized in both branches: group I (inulin enriched cookie) Gullon SL® and group II (control cookie). Previous and after 1 month of the treatment, a nutritional and biochemical study was realized.
Results: 15 patients finished the procotol in each group. In group I, an increase in soluble fiber intake (inulin) was detected. In this group a significant decrease of total cholesterol (223.1 ± 45.3 mg/dl vs 208.8 ± 33.1 mg/dl; p < 0.05) and LDL cholesterol (142.9 ± 39.2 mg/dl vs 131.4 ± 28.6 mg/dl; p < 0.05) was reached. A non significant improvement in insulin levels and HOMA was detected in inulin-enriched cookie group, too. Anthropometric parameters did not change in both groups. The increase in soluble fiber intake did not produce any gastrointestinal adverse effect.
Conclusion: The increase of fiber intake (3 g of inulin) from an enriched cookie reduced LDL cholesterol levels in obese patients.
Key words: Cardiovascular risk factors. Cookies. Inulin. Obesity.
Introducción
La obesidad representa en la actualidad una gran pandemia, con un origen multifactorial, presentando una asociación con diferentes factores de riesgo cardiovascular, altas tasas de morbimortalidad y elevados costes sanitarios. En nuestro país la prevalencia de obesidad se sitúa en el 13%, y el sobrepeso por encima del 30%1.
Las opciones terapéuticas para el tratamiento de la obesidad pasan por el tratamiento dietético2, el tratamiento farmacológico y la cirugía bariátrica3. Sin olvidar el amplio arsenal farmacológico disponible para tratar sus comorbilidades (diabetes mellitus, hiperlipemjia, hipertensión arterial, etc). A pesar de la amplia gama de tratamientos existentes, el primer escalón terapéutico es el tratamiento dietético. La dieta ha demostrado su eficacia en la perdida de peso, así como en la mejoría de los parámetros de riesgo cardiovascular. Uno de los problemas de las dietas es la falta de adherencia de los pacientes, así como la falta de percepción de los beneficios añadidos secundarios al control de los factores de riesgo cardiovascular. Una posibilidad es incluir en la dieta, alimentos que incluyan modificaciones cardiosaludables en su composición como son diferentes tipos de fibra, de grasas, de vitaminas, etc. Diversos estudios han demostrado la utilidad de estos alimentos, por ejemplo Romero y cols.4 han demostrado la utilidad en la disminución del colesterol de unas galletas enriquecidas en psyllium. Otros grupos han demostrado la mejoría de los factores de riesgo cardiovascular con la utilización de un pan y/o galletas enriquecidas en beta-glucanos5-6.
En la actualidad el interés se centra en la familia de los prebióticos tipo inulina, que incluyen los fructooligosacáridos (FOS), oligofructosa e inulina. Esta familia de prebióticos son poli- o oligosacáridos de moléculas de fructosa. Su interés se centra fundamentalmente porque son los prebióticos más extendidos comercialmente y los que presentan un mayor número de estudios que han evaluado sus acciones sobre la salud, pudiendo presentar un potencial papel en el control de determinados factores de riesgo cardiovascular del paciente obeso7.
El objetivo de nuestro trabajo es evaluar la respuesta del perfil de riesgo cardiovascular en pacientes obesos tras la inclusión en la dieta de una galleta enriquecida en inulina.
Material y métodos
Se estudio una muestra de 34 pacientes obesos (IMC > 30), iniciándose el reclutamiento en enero del 2009 y finalizándose el seguimiento de los pacientes en agosto del 2009. Estos pacientes fueron estudiados en una Unidad de Nutrición Clínica Hospitalaria, todos firmaron un consentimiento informado, siendo aprobado el protocolo por el Comité Etico del Centro. Los criterios de exclusión fueron; elevación de glucemia > 110 mg/dl, elevación del colesterol > 250 mg/dl, triglicéridos > 250 mg/dl, presión arterial > 140/90 mmHg, así como la toma de cualquiera de las siguientes medicaciones; estatinas, fibratos, resinas, sulfonilurea, biguanidas, tiazolidindionas, insulina, glucocorticoides, alfa bloqueantes, inhibidores de enzima convertidora de la angiotensina y antagonistas del receptor II de la angiotensina.
Procedimiento
Los pacientes fueron randomizados (tabla de números) a una de los siguientes dos grupos: galleta I (enriquecida con inulina, ver tabla I) y galleta II (galleta control, ver tabla I) (Gullón SL). Cada paciente recibió un total de 8 galletas al día (total de 68 gramos de producto), debiendo tomar los 3 primeros días 4 galletas y posteriormente aumentar la ingesta hasta 8 al día, completando un mes de tratamiento. Se realizó un seguimiento del número de galletas ingerida, mediante una planilla diaria y recogiendo al final del protocolo las galletas no utilizadas. La metodología de trabajo fue doble ciego, ni el paciente ni el investigador que seguía al paciente conocían el tipo de galleta que tomaba el paciente.
Antes de iniciar el tratamiento dietético y al mes de la intervención nutricional se determinaron la ingesta dietética, el peso, masa grasa, masa magra, la presión arterial, glucemia en ayunas, proteína C reactiva (PCR), insulina, resistencia a la insulina (HOMA), colesterol total, LDL-colesterol, HDL-colesterol y triglicéridos.
Determinaciones bioquímicas
Las concentraciones de colesterol y triglicéridos se determinaron mediante ensayos enzimocolorimétricos (Technicon Instruments, Ltd., New York, N.Y., USA). Los niveles de HDL colesterol se determinaron enzimáticamente en el sobrenadante tras precipitación con dextrano sulfato-magnésico.
Los niveles de glucosa se determinaron mediante un método automatizado de glucosa oxidasa (Glucose analyser 2, Beckman Instruments, Fullerton, California). La insulina fue medida mediante un ensayo enzimocolorimétrico (Insulina, WAKO Pure-Chemical Industries, Osaka, Japan) (coeficiente de variación 4,8%) y se determinó la resistencia a la insulina mediante el modelo "homeostasis model assessment for insulin sensitivity" (HOMA)8. La proteína C reactiva (PCR) de determinó mediante immunoturbimetría (Roche Diagnostics GmbH, Mannheim, Germany), con un rango de normalidad de (0-7 mg/dl) y una sensibilidad analítica de 0,25 mg/dl, el coeficiente de variación es del 3,4%.
Determinaciones antropométricas
El peso fue medido mediante una báscula con una precisión de 0,1 kg y el índice de masa corporal se calculó con la fórmula (Peso/talla2). Se determinó el perímetro de la cintura y de la cadera para calcular el índice cintura cadera (ICC). El perímetro de la cintura se determinó mediante una cinta métrica en la región equidistante desde la última costilla a la espina iliaca anterosuperior. El perímetro de la cadera se determinó mediante una cinta métrica a nivel del troncánter mayor. Se realizó una impedanciometría tetrapolar para determinar la composición corporal9 (Biodynamics Model 310e, Seattle, WA, USA). Se utilizaron la resistencia y la reactancia para calcular la grasa y la masa libre de grasa. La presión arterial fue determinada 2 veces con el paciente en reposo y sentado mediante un esfingomanómetro de mercurio con manguito especial para obeso (Omron, London, United Kingdom) y se realizó el promedio de las dos determinaciones.
Intervención dietética
Los pacientes fueron encuestados durante 3 días mediante un registro escrito de 24 horas para evaluar la ingesta basal y al mes de tratamiento para valorar el cumplimiento de la dieta y/o consejos nutricionales. A todos los pacientes se les instruyó en el seguimiento del tratamiento, incluyendo las galletas en la media mañana, merienda o recena. Los 3 primeros días se prescribió la toma de 4 galletas/día y los siguientes días de 8 galletas diarias. Los registros de ingesta, así como el consumo de galletas, fueron evaluados por una única dietista utilizando un software con bases de alimentos nacionales10. El ejercicio físico permitido fue el aeróbico, que realizaban previamente los pacientes antes de entrar en el estudio, fundamentalmente paseo.
Durante la intervención se pregunto a los pacientes si consideraban que su hábito intestinal hubiera variado con el que presentaban previamente de una manera cuantitativa y cualitativa. Desde el punto de vista cualitativo, se les preguntaba si consideraban que la introducción de la galleta en la dieta hubiera producido diarrea o estreñimiento. Desde el punto de vista cuantitativo se les preguntaba el número de deposiciones semana durante el mes anterior a la intervención y durante el mes de la intervención.
Análisis estadístico
El tamaño muestral fue calculado para detectar una diferencia en los niveles de colesterol tras el tratamiento de 10 mg/dl con un poder del 90% y un error alfa del 5% (n = 15, en cada grupo). Los resultados se expresaron como media (desviación estándar). La normalidad de las variables fue analizada mediante el test de Kolmogorov-Smirnov. Las variables cuantitativas con una distribución normal fueron analizadas con el test t de Student's pareada y no pareada. Las variables sin distribución normal fueron analizadas con los tests W-Wilcoxon test y U Mann Whitney. Las variables cualitativas fueron analizadas con el test de la chi-cuadrado, con la corrección de Yates cuando fue necesario y el test de Fisher. La estrategia de análisis ha sido por intención de tratar. Se consideró estadísticamente significativa una p inferior a 0,05.
Resultados
Se incluyeron en el protocolo 34 pacientes (fig. 1, Diagrama Consort), finalizando el estudio un total de 30 pacientes. Los 4 pacientes excluidos del análisis habían tomado menos del 90% de las galletas indicadas. No existieron diferencias en la distribución de sexos y edad de los pacientes. En el grupo de galleta 1 (2 varones y 13 mujeres) con una edad media de 55,1 ± 18,3 años y en el grupo galleta 2 (2 varones y 13 mujeres) con una edad media de 57,0 ± 17,0 años.
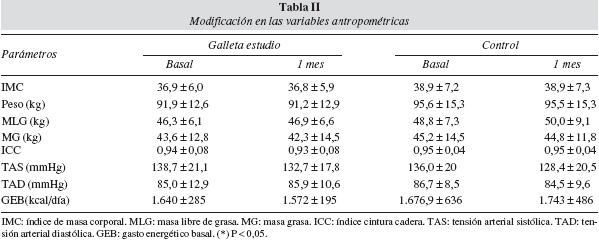
Con respecto a las variables antropométricas y control tensional no existieron diferencias estadísticamente significativas entre los valores basales del grupo I y II. Con respecto a los valores tras la introducción de las galletas en la dieta habitual del paciente, no se modificaron ninguno de los parámetros (tabla II). Este dato es lógico ya que la inclusión de los pacientes en el protocolo no supuso una modificación del aporte calórico total de su dieta.
En referencia a las variables bioquímicas no existieron diferencias estadísticamente significativas entre los valores basales de los dos grupos de galletas. Con respecto a los valores tras la introducción de las galletas en la dieta habitual del paciente, se detectó en los pacientes con las galletas enriquecidas en inulina una disminución significativa de los niveles de colesterol total y LDL colesterol. También se detectó una disminución de los niveles de insulina y resistencia a la insulina (HOMA), pero sin alcanzar la significación estadística (tabla III).
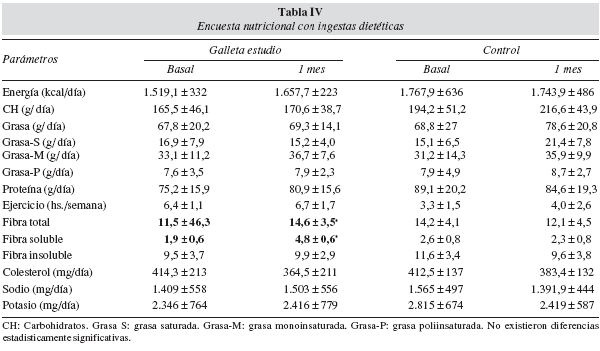
Con respecto a las variables de la ingesta dietética no existieron diferencias estadísticamente significativas entre los valores basales de los dos grupos de galletas. Con respecto a los valores tras la introducción de las galletas en la dieta habitual del paciente, se detectó en los pacientes con las galletas enriquecidas en inulina un aumento significativo en la ingesta de fibra total y fibra soluble. Con respecto a los pacientes que recibieron la galleta control no se detectó ningún cambio significativo en la ingesta (tabla IV).
El número de galletas indicadas al mes fue por paciente de 228 galletas. El numero de galletas tras un mes de intervención fue de 218,6 ± 14,7 (95,8%) en los pacientes del grupo galleta control y 212,6 ± 16,7 en los pacientes en el grupo galleta enriquecida en inulina (93,3%).
Podríamos resumir la mejoría en los parámetros bioquímicos en función de los gramos de fibra soluble que aumentaron con la ingesta de los 68 g de galleta tipo I, según las siguientes relaciones directas. Por cada 1 gramo de aumento de la ingesta de inulina sobre la ingesta basal del paciente se redujeron; 4,71 ± 8,6 mg/dl de colesterol total, 3,61 ± 7,8 mg/dl de LDL colesterol, 0,91 ± 3,8 UI/ml de insulina y 0,34 ± 1,27 Unidades HOMA, alcanzando solo la significación estadística los descensos de colesterol total y LDL colesterol.
Con respecto al control de los efectos sobre tubo digestivo, ningún paciente en los dos grupos de galletas presentó episodios de diarrea durante el mes de tratamiento y solo 1 paciente en el grupo de galleta control refirió presentar estreñimiento durante el mes de intervención. Sin embargo, comparando el número de deposiciones semanales promedio del mes anterior al estudio con el mes durante el estudio, no existieron diferencias estadísticamente significativas; galleta tipo I (8,2 ± 5 deposiciones/semana vs 8,1 ± 5,0 deposiciones/semana) y galleta tipo II (10,3 ± 4,9 deposiciones/semana vs 10,4 ± 6,7 deposiciones/semana).
Discusión
En nuestro trabajo se ha mostrado como la inclusión en la dieta de pacientes obesos de una galleta enriquecida en inulina, aportando aproximadamente 3 gramos al día, produce una disminución significativa de los niveles de LDL-colesterol al producirse un incremento en la ingesta diaria de fibra soluble.
Si analizamos la literatura nos encontramos con una serie de problemas al evaluar nuestros resultados así como los trabajos previamente realizados. Entre ellos podríamos citar, la heterogeneidad de las poblaciones estudiadas (obesos, diabéticos, hiperlipémicos, sujetos sano), en segundo lugar la cantidad diaria de fibra administrada y el tipo de inulina, que puede variar desde inulina pura hasta fructooligosacáridos (FOS), y en tercer lugar la variabilidad en el tiempo de intervención realizado. Por ejemplo, uno de los primeros trabajos fue realizado con 12 varones sanos, no encontrándose ningún efecto sobre el perfil lipídico al añadir a la dieta 20 g al día de FOS11. Del mismo modo en un estudio realizado también en 12 voluntarios sanos en varias etapas de intervención, con inulina, FOS y galactooligosacáridos (GOS), no se encontraron efectos sobre los niveles de colesterol total, LDL colesterol, apolipoproteína A-1 y B, triglicéridos, HDL colesterol12. En otro ensayo clínico frente a placebo con 75 pacientes normolipémicos realizado en dos fases (primera fase 10 g/día de oligofructosa y segunda fase 20 g/día)13, no se detectó ningún efecto significativo sobre el perfil lipídico.
Sin embargo los resultados si fueron significativos cuando se utilizó en los trabajos inulina. De este modo el trabajo de Letexier y cols.14, en el que también se evaluaron voluntarios sanos (n = 8), la administración de 10 g al día de inulina frente a placebo, mostró una disminución significativa de los niveles de triglicéridos. Esta vez ya en un ensayo clínico randomizado y controlado con placebo15, tras la administración de 7 g al día de inulina durante 4 semanas, produjo una disminución significativa en los niveles de triglicéridos, de colesterol total y de LDL colesterol. Con un diseño no controlado16, realizado con 8 g al día de FOS durante 14 días se detectó una disminución significativa de un 6% de los niveles de colesterol total y un 10% de los niveles de LDL colesterol, este trabajo a pesar de su pobre diseño y de la utilización de FOS, merece la pena citarlo ya que fue realizado en pacientes diabéticos con hiperlipemia, un colectivo por tanto de alto riesgo cardiovascular. Por otra parte, sorprendentemente en un ensayo clínico cruzado realizado en 30 pacientes con hiperlipemia, la administración de 10,6 g de FOS al día durante 3 meses, no produjo una disminución significativa de LDL colesterol, HDL colesterol, triglicéridos, apolipoproteína A-1, sino que produjo un inexplicable aumento de los niveles de lipoproteína (a) (33 mg/dl a 37 mg/dl)17.
Por tanto podríamos resumir este grupo de trabajos, señalando que en los pacientes normolipémicos la administración de prebióticos no inulina (FOS y GOS) no parece tener ningún efecto beneficioso sobre el perfil lipídico, detectándose en la literatura efectos beneficiosos sobre los niveles de triglicéridos y colesterol LDL al administrar inulina. Los mecanismos que pueden explicar la mejoría en el perfil lipídico al utilizar sobre todo inulina pueden ser diversos. La mayor parte del efecto puede ser debido al incremento en la pérdida de sales biliares por las heces, que puede oscilar entre un 20 y un 80%, produciendo secundariamente una disminución en la cantidad total de colesterol corporal18. Otro factor implicado es la disminución en la respuesta glucémica y secreción de insulina tras la administración de este tipo de fibra soluble19. Los niveles de insulina se relacionan con la activación del enzima Hidroxi-Metil-glutaril-coenzima A reductasa, el paso limitante en la síntesis de colesterol20. Nuestro trabajo mostró una tendencia no significativa a la disminución de los niveles de insulina y de resistencia a la insulina en el grupo que recibió la galleta enriquecida en inulina. Por último, la fermentación bacteriana de esta fibra aumenta la producción de ácidos grasos de cadena corta (AGCC). Uno de estos ácidos grasos, el propionato, es capaz de inhibir de manera aguda el incremento de colesterol inducido por acetato21.
En conclusión, el aumento en la ingesta de 3 gramos de inulina proveniente de una galleta enriquecida, mejora los niveles de colesterol LDL en pacientes obesos. La evaluación de estos protocolos de suplementación nutricional con alimentos enriquecidos es de alto interés al poder disminuir diferentes factores de riesgo cardiovascular presentes en la población obesa. En especial los alimentos enriquecidos en fibra pueden presentar múltiples efectos beneficiosos22-24.
Referencias
1. Aranceta-Bartrina J, Serra-Majem L, Foz-Sala M, Moreno-Esteban B; Grupo Colaborativo SEEDO. Prevalence of obesity in Spain. Med Clin (Barc) 2005; 125 (12): 460-6. [ Links ]
2. De Luis DA, Aller R, González Sagrado M, Izaola O, Conde R. The effects of a low fat versus a low carbohydrate diet on adipocytokines in obese adults. Hormone Research 2007; 67: 296-300. [ Links ]
3. De Luis DA, Pacheco D, Izaola O, Teroba M, Cuellar L, Martin T. Clinical Results and nutritional consequences of biliopancreatic diversion: Three years of follow up. Ann Nutr Metab 2008; 53: 234-238. [ Links ]
4. Romero AL, Romero JE. Cookies enriched with psyllium or oat bran lower plasma LDL cholesterol in normal and hypercholesteronemic men from northern mexico. J of American College of Nutrition 1998; 6: 601-608. [ Links ]
5. Kerkhoffs D, Hornstra G. Cholesterol-lowering effect of beta glucan from oat bran in mildly hypercholeteronemic subjects may decrease when beta glucan s incorporated into bread and cookies. Am J Clin Nutr 2003; 78: 221-227. [ Links ]
6. Keogh G, Cooper G, Mulvey T. Randomized controlled crossover study of the effect of a highly beta glucan enriched barley on cardiovascular disease risk factors in moldly hypercholesterolemic men. Am J Clin Nutr 2003; 78: 711-718. [ Links ]
7. Roberfroid M. Prebiotics: the concept revisited. 1. J Nutr 2007; 137: 830S-837S. [ Links ]
8. Mathews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher Df. Homeostasis model assessment: insulin resistance and beta cell function from fasting plasma glucose and insulin concentrations in man. Diabetología 1985; 28: 412-414. [ Links ]
9. Lukaski H, Johson PE. Assessment of fat-free mass using bioelectrical impedance measurements of the human body. Am J Clin Nutr 1985; 41: 810-7. [ Links ]
10. Mataix J, Mañas M. Tablas de composición de alimentos españoles. Ed: University of Granada, 2003. [ Links ]
11. Luo J, Rizkalla SW, Alamowitch C y cols. Chronic 23. consumption of short-chain fructooligosaccharides by healthy subjects decreased basal hepatic glucose production but had no effect on insulin-stimulated glucose metabolism. Am J Clin Nutr 1996; 63: 939-945. [ Links ]
12. Van Dokkum W, Wezendonk B, Srikumar TS, 18. van den Heuvel EG. Effect of nondigestible oligosaccharides on largebowel functions, blood lipid concentrations and glucose absorption in young healthy male subjects. Eur J Clin Nutr 1999; 53: 1-7. [ Links ]
13. Olesen M, Gudmand-Hoyer E. Efficacy, safety, and 38. tolerability of fructooligosaccharides in the treatment of irritable bowel syndrome. Am J Clin Nutr 2000; 72: 1570-1575. [ Links ]
14. Letexier D, Diraison F, Beylot M. Addition of inulin 19. to a moderately high-carbohydrate diet reduces hepatic lipogenesis and plasma triacylglycerol concentrations in humans. Am J Clin Nutr 2003; 77: 559-564. [ Links ]
15. Balcazar-Munoz BR, Martínez-Abundis 42. E, González-Ortiz M. Effect of oral inulin administration on lipid profile and insulin sensitivity in subjects with obesity and dyslipidemia. Rev Med Chil 2003; 131: 597-604. [ Links ]
16. Yamashita K, Kawai K, Itakura M. Effects of 25. fructooligosaccharides on blood glucose and serum lipids in diabetic subjects. Nutr Res 1984; 4: 961-966. [ Links ]
17. Giacco R, Clemente G, Luongo D y cols. Effects of 21. shortchain fructo-oligosaccharides on glucose and lipid metabolism in mild hypercholesterolaemic individuals. Clin Nutr 2004; 23: 331-340. [ Links ]
18. Malkki Y. Oat fiber. In Handbook of dietary fiber. Edited bu: Cha SS, Dreher ML, New Cork Macrel Dekker 2001; 497-512. [ Links ]
19. Jenkins DJA, Leeds AR, Gmull MA, Cochet B, Alberti KGMH, Decrease in pstprandial insulin and glucose concentrations by guar and pectin. Ann Int Med 1977; 86: 20-24. [ Links ]
20. Jenkins DJA, Wolever TMS; Ocana AM, Vuksan V. Metabolic effects of reducing rate of glucose ingestion by single bolus versus continuos sipping. Diabetes 1990; 39: 775-780. [ Links ]
21. Wolever TMS, Brighenti F, Jenkins DJA. Serum short Chain fatty acids alter rectal infusion of acetate and propionate in man. J Clin Nutr Gastroenterol 1988; 3: 42-46. [ Links ]
22. López Román J, Martínez Gonzálvez AB, Luque A, Pons Miñano JA, Vargas Acosta A, Iglesias JR, Hernández M, Villegas JA. [The effect of a fibre enriched dietary milk product in chronic primary idiopatic constipation]. Nutr Hosp 2008; 23: 12-9. [ Links ]
23. García Peris P, Velasco Gimeno C. [Evolution in the knowledge on fiber] Nutr Hosp 2007; 22 (Supl. 2): 20-5. [ Links ]
24. Lecumberri E, Mateos R, Ramos S, Alía M, Rúperez P, Goya L, Izquierdo-Pulido M, Bravo L. [Characterization of cocoa fiber and its effect on the antioxidant capacity of serum in rats] Nutr Hosp 2006; 21 (5): 622-???. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
D. A. de Luis.
Profesor Asociado de Nutrición.
Director del Instituto de Endocrinología y Nutrición.
Facultad de Medicina. Universidad de Valladolid.
C/ Los Perales, 16.
47120 Simancas. Valladolid.
E-mail: dadluis@yahoo.es
Recibido: 5-X-2009.
Aceptado: 6-X-2009.