INTRODUCCIÓN
Los pacientes con cáncer suelen presentar deficiencias nutricionales importantes que a menudo afectan significativamente a su calidad de vida. De hecho, la proporción de pacientes que, en el momento del diagnóstico, presentan pérdida de peso oscilan entre un 15 y un 40% en función del tipo de cáncer. Sin embargo, la incidencia de desnutrición aumenta conforme evoluciona la enfermedad hasta afectar a un 80% de los pacientes 1)( 2) (3.
La presencia de desnutrición afecta negativamente a la evolución de los pacientes cancerosos, aumentando la incidencia de infecciones, el tiempo de estancia hospitalaria y el riesgo de muerte 3) (4. Sin embargo, la información centrada en el paciente sobre las recomendaciones nutricionales a implementar es limitada, por lo que siguen existiendo una serie de dudas en relación al manejo nutricional del paciente con cáncer en la práctica clínica habitual.
El objetivo de este manuscrito es dar respuesta a las preguntas que los oncólogos se plantean a la hora de afrontar el manejo nutricional y establecer recomendaciones basadas en el consenso para proporcionar a los especialistas responsables del manejo de pacientes oncológicos un marco de referencia basado en la evidencia científica disponible y la experiencia clínica del grupo.
MÉTODOS
Un grupo multidisciplinar formado por especialistas de las áreas de Oncología Médica, Farmacia y Nutrición trabajando en colaboración, ha elaborado un documento de consenso sobre diferentes aspectos que afectan al estado nutricional del paciente oncológico. En esta primera reunión, el panel seleccionó y consensuó una primera lista de temas relacionados con el estado nutricional del paciente oncológico. Los diferentes bloques que centraron la atención del panel fueron: a) el soporte nutricional en el paciente oncológico; b) nutrición parenteral (NP) en el paciente oncológico; y c) nutrición parenteral domiciliaria (NPD) en el paciente oncológico. Los coordinadores del consenso elaboraron una primera lista de temas que se distribuyó a todos los expertos. Posteriormente, evaluaron los comentarios del panel y se realizaron las modificaciones necesarias en una reunión virtual celebrada en noviembre de 2016 en la que se definió la lista definitiva de preguntas.
Se realizó una revisión de la literatura en la base de datos MEDLINE mediante el proveedor PubMed que incluyó los diferentes artículos publicados en español, inglés y francés hasta abril de 2017. Esta búsqueda bibliográfica se complementó con las listas de referencias obtenidas de los artículos seleccionados, las bases de datos de organizaciones y de las sociedades de Oncología y Nutrición y las guías de práctica clínica de referencia.
El documento se estructuró como un cuestionario que incluyó aquellas preguntas que, desde el punto de vista de los miembros del panel, podrían generar mayor controversia o duda. Los coordinadores presentaron un primer documento que fue revisado por los miembros del grupo de expertos, evaluaron los comentarios del panel y modificaron el borrador cuando lo consideraron necesario. Las revisiones subsiguientes se basaron en la retroalimentación de los otros autores hasta que se alcanzó un consenso y el texto final fue validado (Fig. 1).
RESULTADOS
1. ¿CUÁL ES LA INCIDENCIA DE MALNUTRICIÓN SEGÚN LOS DISTINTOS TIPOS DE ENFERMEDAD NEOPLÁSICA Y TRATAMIENTOS ONCOLÓGICOS?
La incidencia es variable según el tipo de tumor y estadio. Por tipo de tumor, su prevalencia es de un 86% en cáncer de páncreas, de un 48-61% en linfomas de mal pronóstico y cáncer colorrectal, hasta el 46% en tumores urológicos y pulmonares; y 30-40% en linfoma de buen pronóstico, cáncer de mama y sarcomas 3) (4) (5. Por estadio, la malnutrición está presente hasta en el 15-20% de estadios iniciales, 80% en enfermedad avanzada y 80-90% en pacientes terminales 3) (4) (5.
El estudio español NUPAC 6, diseñado para determinar la prevalencia de la malnutrición en cáncer avanzado, confirmó un 52% de malnutrición moderada o grave, 57,7% en cáncer esofágico, 50% en gástrico, 47,1% en laríngeo y 17,6% en cáncer de próstata. Se observó una escasa concienciación de los médicos implicados y pocos pacientes con diagnóstico nutricional 6.
El estudio PREDyCES(r) encontró una asociación entre desnutrición y enfermedad, situación emocional reactiva, anorexia, exploraciones complementarias, dietas restrictivas impuestas por la enfermedad, cirugía, tratamientos con quimioterapia/radioterapia y, por último, con la alimentación. La desnutrición repercutía en la estancia hospitalaria y en costes, con un aumento medio de estancia de 3-4 días de los pacientes desnutridos en comparación con los bien nutridos y un incremento de los costes asociados a la hospitalización de un 20-25% 7.
2. ¿CÓMO INFLUYE EL PROCESO ONCOLÓGICO EN EL ESTADO NUTRICIONAL DEL PACIENTE?
Existen múltiples causas asociadas con la desnutrición en pacientes con cáncer (Tabla I).
3. ¿CÓMO INFLUYE EL ESTADO NUTRICIONAL DEL PACIENTE EN LA EVOLUCIÓN DEL PROCESO ONCOLÓGICO?
La caquexia asociada al cáncer produce: a) deterioro de la imagen corporal, el estado funcional y la calidad de vida, con mayor riesgo de toxicidad por los tratamientos oncológicos; b) pérdida de masa muscular con riesgo de insuficiencia cardiaca, respiratoria y úlceras de decúbito; c) retardo en la cicatrización que favorece las fístulas y dehiscencias; y d) deterioro del sistema inmune lo que favorece las infecciones y la disminución de las enzimas digestivas con riesgo de malabsorción 8. Además, la caquexia y desnutrición tiene un impacto pronóstico negativo y se asocia hasta con el 30% de las muertes por cáncer 1) (2 ) (3) (9) (10. En pacientes terminales, los síntomas anorexia, pérdida de peso, xerostomía y disfagia fueron considerados predictores negativos de supervivencia 1) (2) (3) (9) (10.
Una revisión retrospectiva multicéntrica del Eastern Cooperative Oncology Group (ECOG) observó que la pérdida de peso mayor del 5% previo al diagnóstico e inicio de tratamiento del cáncer, era predictora de mortalidad temprana independientemente del estadio, la histología y el estado general 11.
4. ¿CÓMO PODEMOS DETECTAR LA DESNUTRICIÓN EN EL PACIENTE ONCOLÓGICO?
Se recomienda realizar una valoración nutricional en todos los pacientes con cáncer al diagnóstico y durante el tratamiento con el fin de detectar aquellos pacientes malnutridos o en riesgo nutricional y llevar a cabo una intervención precoz dado que el diagnóstico tardío puede dificultar la recuperación y ganancia de peso 12.
El primer paso para detectar la desnutrición es mediante el uso rutinario de herramientas de cribado nutricional. Que estén ligados a protocolos de actuación posterior.
Las guías de la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) publicadas en 2017 (13), recomiendan evaluar periódicamente la ingesta de nutrientes, los cambios en el peso y el índice de masa corporal (IMC), desde el diagnóstico del cáncer y repetir la evaluación en función de la estabilidad de la situación clínica.
Existen numerosas herramientas de cribado nutricional; las más usadas serían: para paciente hospitalizado: Nutritional Risk Screening 2002 (NRS 2002), para la población en general: el Malnutrition Universal Screening Tool (MUST), para paciente anciano el Mini Nutritional Assessment (MNA) y el Malnutrition Screening Tool (MST), ha sido validado en pacientes oncológicos hospitalizados y ambulatorios en tratamiento con quimioterapia y radioterapia.
En las Guías Clínicas Multidisciplinares sobre el manejo de la nutrición del paciente con cáncer, publicada en España en 2008 14, donde participaron la SEOM (Sociedad Española de Oncología Médica), SEOR (Sociedad Española de Oncología Radioterápica) y la SENPE (Sociedad Española de Nutrición Enteral y Parenteral), se consensuó hacer uso del MST como cribado nutricional, para los pacientes adultos con cáncer, por su sencillez, fiabilidad y validez.
El MST se compone de dos preguntas: una relacionada con la pérdida de peso y la otra con la ingesta/apetito. Clasifica a los pacientes en dos grupos: con riesgo de desnutrición (resultado ≥ 2) y sin riesgo de desnutrición (resultado < 2).
Una vez detectado el riesgo de desnutrición se precisa de una valoración nutricional completa posterior. La valoración nutricional "gold standard" en el paciente oncológico es la VGS-GP (Valoración Global Subjetiva Generada por el Paciente) 15. Debe realizarla personal entrenado si hay unidades de nutrición por un especialista en Nutrición y, si no las hay, por un profesional bien formado. Esta tiene en cuenta la pérdida de peso, datos de la historia clínica como es el diagnóstico, tratamientos actuales y medicación recibida, y analíticos como la albúmina y prealbúmina. También se involucra al propio paciente quien completa la parte referente a los síntomas presentes, el tipo de alimentación y actividad cotidiana que realiza. Requiere de una exploración física exhaustiva para detectar disminución de masa muscular, grasa y presencia de edemas. Esta clasifica al paciente en A: normonutrido; B: riesgo nutricional o desnutrición moderada; y C: desnutrición grave.
5. ¿QUÉ PARÁMETROS (CLÍNICOS, ANALÍTICOS Y ANTROPOMÉTRICOS) SE DEBEN TENER EN CUENTA PARA VALORAR EL ESTADO NUTRICIONAL INICIAL Y DURANTE EL SEGUIMIENTO DEL PACIENTE ONCOLÓGICO?
No existe un único parámetro que nos informe sobre el estado nutricional, sino la combinación de varios (clínicos, analíticos, antropométricos y funcionales).
Parámetros clínicos como la localización del tumor y tratamiento realizado: existe mayor riesgo nutricional en localizaciones digestivas, así como tratamientos concomitantes. Sintomatología presente: se debe interrogar al paciente sobre la situación actual, detectando signos de riesgo nutricional que favorecen la pérdida ponderal o dificultan la ingesta y absorción de nutrientes, como, la presencia de anorexia, astenia, disminución de la actividad física, náuseas o emesis, diarrea, esteatorrea o estreñimiento, disgeusia, dolor, depresión o problemas socioeconómicos que dificulten el acceso a la comida.
Las guías ESPEN 13 recomiendan una valoración de la masa muscular y de las reservas de grasa que puede realizarse mediante absorciometría dual de rayos X (DEXA) o análisis de bioimpedancia (BIA), así como una evaluación del rendimiento físico utilizando diversas escalas como la ECOG, Karnofsky, dinamometría, velocidad de la marcha, etc. 13.
Los parámetros analíticos más asociados con el estado nutricional son la albúmina y la prealbúmina. Sin embargo, deben evaluarse en el contexto global puesto que pueden verse alterados por otros problemas intercurrentes y comunes en pacientes con cáncer (infecciones, enfermedades hepáticas, renales, deshidratación, anasarca, etc.).
Las guías ESPEN recomiendan, para medir la inflamación sistémica, el uso de la proteína C reactiva (PCR) sérica y la albúmina 13.
Entre los parámetros antropométricos la disminución de peso significativa, > 10% durante 6 meses o 5% durante 3 meses se considera el indicador más fiable de déficit nutricional. Otro indicador antropométrico accesible es la medida de la circunferencia braquial (como método para evaluar la pérdida de masa muscular) que si es < 20 cm o disminuye > 2 cm entre 2 determinaciones sugiere desnutrición. Existen otros más precisos que requieren equipamientos específicos y habitualmente no disponibles.
6. ¿CUÁLES SON LOS OBJETIVOS E INDICACIONES DE LOS DISTINTOS TIPOS DE SOPORTE NUTRICIONAL ESPECIALIZADO EN EL PACIENTE ONCOLÓGICO?
El soporte nutricional se clasifica según su agresividad y complejidad, y se incluyen 13) (14) (15:
Recomendaciones nutricionales y consejo higiénico-dietético.
Nutrición artificial:
La elección depende de la situación actual del paciente: diagnóstico oncológico, tratamiento oncoespecífico, pronóstico, estado nutricional, requerimientos nutricionales y de la duración del soporte nutricional 13) (14) (15. El algoritmo de soporte nutricional se muestra en la figura 2.
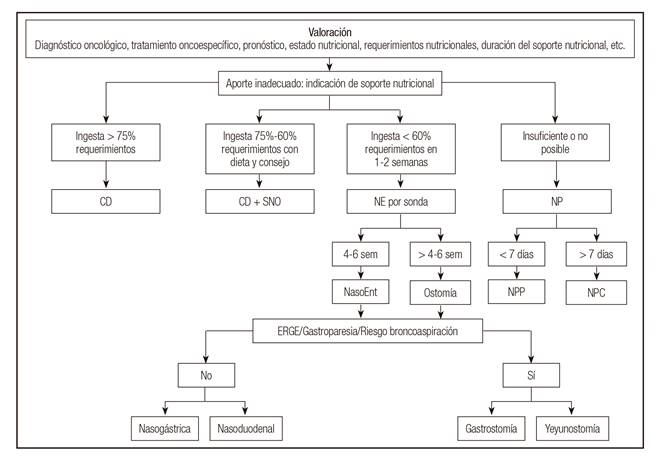
Figura 2 Algoritmo de soporte nutricional. Adaptado de Hernández y cols. 14 (CD: consejo dietético; SON: suplementos nutricionales orales; NE: nutrición enteral; NP: nutrición parenteral; sem: semana; NasoEnt: nasoenteral; NPP: nutrición parenteral periférica; NPC: nutrición parenteral central; ERGE: enfermedad por reflujo gastroesofágico).
Si la ingesta de alimentos por vía oral es insuficiente a pesar del consejo nutricional y los suplementos nutricionales orales, se recomienda iniciar nutrición enteral, para la que, según la previsión de duración del soporte y de situaciones del paciente, se escogerá el tipo de sonda y la forma de colocarla 13) (14) (15) (16 . Si el aporte enteral no es suficiente o posible, se indicará NP 13) (14) (15.
Se indica soporte nutricional en pacientes con cáncer cuando existe desnutrición, se espera que el paciente no pueda ingerir alimentos durante una semana o más o si su ingesta es inferior al 60% de sus necesidades durante más de 10 días (Grado de recomendación C) 13.
7. ¿CUÁLES SON LOS REQUERIMIENTOS NUTRICIONALES EN EL PACIENTE ONCOLÓGICO?
Los requerimientos energéticos de los pacientes oncológicos, en principio, y si no se realizan medidas individualizadas (calorimetría indirecta), se deben considerar semejantes a los de las personas sanas (25-30 Kcal/kg/día) 13.
Debemos tener en cuenta que esta aproximación se suele sobreestimar en las personas obesas y subestimar en las extremamente delgadas, al igual que algunas ecuaciones predictivas, como Harris-Benedict.
En cuanto a los requerimientos proteicos deberían ser de entre 1 (mínimo) y 1,2-1,5 g/kg/día y en el caso de existir catabolismo proteico podría aumentarse a 2 g/kg/día 13. En pacientes con insuficiencia renal aguda o crónica el suministro de proteínas no debe superar 1,0 o 1,2 g/kg/d, respectivamente. La relación entre el gasto energético y los requerimientos nitrogenados se recomienda entre 130-100 Kcal/g N 14) (15) (17.
La relación de lípidos/hidratos de carbono ideal vendrá determinada por los antecedentes patológicos o la situación clínica de cada paciente 17) (18. Conviene que esta relación se desplace a favor de los lípidos siempre que exista resistencia insulínica, oxidación aumentada de la glucosa y pérdida de peso 18.
Otro aspecto a tener en cuenta son las necesidades hídricas y de sodio de los pacientes, que deberemos recortar por debajo de la normalidad (30 ml/kg/día para el agua y 1 mmol/kg/día para el sodio) en el caso de carcinomatosis peritoneal si aparece obstrucción o ascitis para evitar la sobrecarga o tercer espacio 13.
Respecto al resto de componentes, sobre todo vitaminas y oligoelementos no se recomienda suplementar en cantidades mayores a las dosis diarias recomendadas (DDR) si no existen déficits específicos 13.
8. ¿EXISTEN NUTRIENTES ESPECÍFICOS QUE INFLUYEN SOBRE LA EVOLUCIÓN DEL PROCESO ONCOLÓGICO?
Los nutrientes específicos o "farmaconutrientes" son sustratos nutricionales que además de su valor nutricional tienen otros efectos beneficiosos para el organismo. Se utilizan con el objetivo de modular el curso de la enfermedad. Por ejemplo, los ácidos grasos omega 3, la arginina o la glutamina 19.
Respecto a los nutrientes específicos proteicos, la glutamina (oral y parenteral) es el más investigado en las últimas décadas junto con la arginina, pero existen pocos estudios exclusivos para pacientes oncológicos y los resultados no son concluyentes 13) (15) (17) (18. Sin embargo, en las recomendaciones de la ESPEN, se indica la preferencia de dietas inmunomoduladoras (enriquecidas en arginina, n-3, nucleótidos, con o sin glutamina) en la cirugía del cáncer de cabeza y cuello 20. Es más, los resultados de una revisión sistemática han mostrado que la administración de nutrición enteral enriquecida con arginina condujo a una reducción significativa, tanto de la incidencia de fístulas como de la estancia hospitalaria, en pacientes sometidos a cirugía de cáncer de cabeza y cuello 21.
Más recientes son los estudios con HMB (hidroxi-metil-butrirato, derivado de la leucina), utilizado como agente anti-catabólico para frenar la degradación proteica, pero tampoco los resultados, hasta la fecha, aconsejan extender su uso 13.
Con los lípidos, aunque bioquímicamente se conoce el beneficio de los ácidos grasos omega 3 respecto a los omega 6 en cuanto al descenso de la actividad proinflamatoria, tampoco existen estudios clínicos en pacientes oncológicos que lo demuestren, excepto en el caso de los pacientes oncológicos perioperatorios donde la respuesta inflamatoria es mucho más clara sobre todo en cáncer de cabeza y cuello y si centramos el tratamiento en los 5-7 días del perioperatorio 13) (15. Las fórmulas comercializadas para estos usos suelen estar suplementadas a la vez con nucleótidos y arginina.
El ácido graso omega 3, derivado del aceite de pescado, ácido eicosapentanoico (EPA), ha sido también probado como agente anticaquéctico principalmente, aunque la falta de adhesión al tratamiento suele asociarse con el fracaso de los resultados de la administración en cápsulas 13.
En los últimos años se han llevado a cabo muchos estudios sobre vitamina D y cáncer, relacionando niveles bajos e incidencia y/o pronóstico del mismo, fundamentalmente en el caso del cáncer de colon; pero la verdad es que, a fecha de hoy, se desconoce cómo puede influir la normalización de dichos niveles en el pronóstico del cáncer 13.
9. ¿CUÁNDO ESTÁ INDICADA UNA NUTRICIÓN PARENTERAL EN UN PACIENTE ONCOLÓGICO?
La NP como modalidad de soporte nutricional específico en el paciente oncológico está indicada principalmente cuando no es posible el uso del tubo digestivo y/o la alimentación oral y/o nutrición enteral no es suficiente o posible 13) (14) (16) (22:
Por contraindicación de acceso al tubo digestivo: ante una perforación, obstrucción intestinal o quilotórax.
Por imposibilidad de acceso al tubo digestivo: como ocurre en las fístulas enterocutáneas altas de alto débito en las que no se dispone de sondas para colocar distalmente a las mismas, en el íleo paralítico, hemorragia digestiva o ante insuficiente superficie absortiva por cirugía oncológica amplia.
Por tubo digestivo ineficaz: como sucede en el síndrome de intestino corto, fístulas de alto débito e insuficiencia intestinal por enteritis rádica.
Por bajo aporte oral y/o enteral: Cuando es inferior al 60% de las necesidades nutricionales durante más de 1-2 semanas y se prevé una mejora del estado nutricional y de calidad de vida, puede hacerse uso de la NP complementaria a la vía oral y/o enteral.
En pacientes incurables/paliativos el soporte nutricional debe realizarse cuando el beneficio esperado sea superior al riesgo potencial. Cuando la supervivencia estimada es superior a 1-3 meses, y en caso de insuficiencia intestinal, se puede ofrecer una NP, en caso de ser la vía oral/enteral insuficientes y existir expectativas de mejoría en la calidad de vida y funcionalidad del paciente y con un deseo expreso de este 13.
10. ¿CUÁLES SON LAS INDICACIONES DE NUTRICIÓN PARENTERAL COMPLEMENTARIA EN EL PACIENTE ONCOLÓGICO?
La NP complementaria a un soporte oral o enteral insuficiente estaría indicada en aquellos casos en los que se prevea una clara mejoría del estado nutricional o de la calidad de vida del paciente oncológico 13),(15) (23.
No se ha demostrado que la NP mejore el estado nutricional del paciente oncológico con anorexia y tracto intestinal funcionante y por ello, se debe dar siempre prioridad a la vía digestiva 13) (23. No obstante, la NP complementaria podría indicarse en aquellos pacientes en los que no se puedan cubrir un 60% de sus necesidades energéticas mediante la vía digestiva durante un periodo de 1 o 2 semanas 13.
La composición de la nutrición dependerá de la complementación necesaria en cada paciente 13) (15. Puede ser necesaria una suplementación completa o solo con alguno de sus componentes habituales (volumen, nitrógeno, glucosa, lípidos, micronutrientes). Puede elaborarse a la carta en el servicio de farmacia hospitalario o utilizar algún preparado comercial existente.
Cuando se puede realizar un adecuado aporte de nutrientes por vía oral o enteral no debe llevarse a cabo por vía parenteral ya que en este caso la NP no es efectiva y probablemente sí sea perjudicial (Grado de recomendación A). Se debería emplear una NP complementaria cuando el aporte enteral es insuficiente para cubrir la diferencia entre las necesidades calculadas y el aporte oral/enteral (Grado de recomendación C). Se recomienda NP en pacientes con mucositis o enteritis rádica grave a largo plazo (Grado de recomendación C) 24.
11. ¿CUÁLES SON LAS DIFERENTES VÍAS DE ADMINISTRACIÓN DE LA NUTRICIÓN PARENTERAL EN EL PACIENTE ONCOLÓGICO?
Las vías de administración de NP en el paciente oncológico son las mismas que en el resto de los pacientes. La selección de las diferentes vías disponibles dependerá del tiempo que se requiera el soporte, la frecuencia de utilización (intermitente o diaria), la actividad y el estilo de vida del paciente, los antecedentes quirúrgicos que afecten la zona de inserción, las características psicosociales y de la capacidad de cuidados del paciente (Tabla II).
Tabla II Diferentes vías de administración de la nutrición parenteral en el paciente oncológico. Adaptado de Derenski y cols. 25
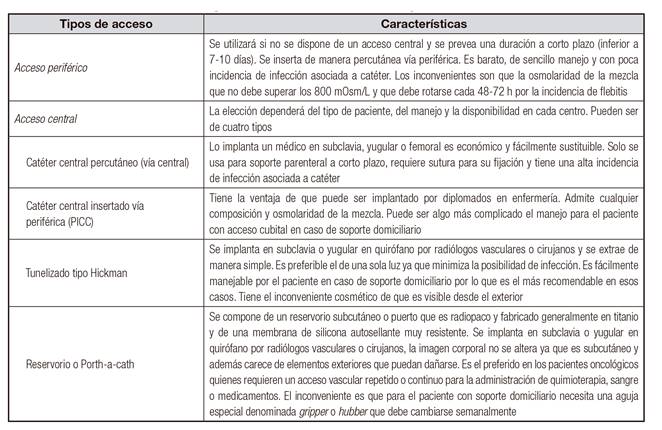
La NP complementaria puede realizarse por vía periférica o central mediante catéteres temporales o permanentes en el caso de que se prevea una duración de más de 15 días. También puede utilizarse la vía subcutánea en caso de aporte complementario de suero o algún micronutriente como el magnesio.
12. ¿QUIÉN DEBE/PUEDE REALIZAR EL SEGUIMIENTO NUTRICIONAL DEL PACIENTE ONCOLÓGICO (SERVICIO DE NUTRICIÓN, ONCÓLOGO, MÉDICO DE ATENCIÓN PRIMARIA, ETC.)?
El seguimiento nutricional del paciente oncológico debe ser multidisciplinar y adaptado a las características de cada centro.
El cribado nutricional debe estar incluido en la rutina de los cuidados del paciente oncológico y debe ser sencillo de realizar por cualquier miembro del equipo terapéutico ya sea por los diplomados en enfermería o médicos 13.
Una valoración nutricional simple con una historia clínica nutricional rápida, una antropometría que incluya el índice de masa corporal (IMC) y una determinación analítica básica que incorpore cifras de albúmina debe de ser factible para el oncólogo. Lo ideal es que el oncólogo tenga la suficiente formación en nutrición para derivar al paciente en riesgo nutricional o ya desnutrido al especialista en nutrición.
En el ambiente hospitalario debe haber una estrecha colaboración entre el servicio de oncología y la unidad de nutrición. El que exista una consulta de nutrición en oncología es una situación deseable.
En el paciente ambulatorio también se debe contar con la colaboración del médico de atención primaria para detectar los problemas nutricionales y derivar al especialista en nutrición cuando sea necesario.
El seguimiento del paciente oncológico con NPD también es multidisciplinar y requiere revisiones clínicas, analíticas inicialmente mensuales y luego trimestrales por la unidad de nutrición, así como controles analíticos básicos periódicos por el médico de atención primaria.
13. ¿CUÁNDO ESTÁ INDICADA LA RETIRADA DE UNA NUTRICIÓN PARENTERAL EN UN PACIENTE ONCOLÓGICO?
La retirada de la NP deberá atender el alcance de los objetivos planteados en cada caso además de las siguientes consideraciones:
Recuperación de la funcionalidad del tubo digestivo. Se debe monitorizar la transición de la terapia nutricional evaluando la recuperación funcional digestiva que permita incorporar al plan de atención nutricional con nutrición enteral, suplementación oral y/o alimentación natural 26. La transición se realizará de forma progresiva para lo cual se considerará por un lado su tolerancia y la cobertura de requerimientos de forma exclusiva por vía digestiva para poder retirar definitivamente la NP.
Por complicaciones graves asociadas. La aparición de infección asociada a catéter o complicaciones mecánicas como rotura de catéter, obstrucción, trombosis, etc. que no permitan mantener un acceso venoso adecuado, si bien no son complicaciones de la NP en sí, constituyen una limitación para la utilización de la misma como medida de soporte nutricional y obligan a plantear su retirada 27) (28.
En situación premortem de los pacientes terminales en programa de NP. En los pacientes con enfermedad neoplásica avanzada, fallo intestinal crónico y una expectativa de vida mayor de 1-3 meses, la NPD puede mejorar la calidad de vida y prolongar la supervivencia 29) (30) (31) (32. Sin embargo, cuando la situación clínica del paciente empeora y la muerte del paciente es inminente se deberá suspender la NP y aplicar medidas de confort ya que el soporte nutricional no ofrece beneficios en la mayoría de los casos 13) (33.
14. ¿CUÁLES SON LOS OBJETIVOS DE LA NUTRICIÓN PARENTERAL DOMICILIARIA EN UN PACIENTE ONCOLÓGICO?
Según la ESPEN, los objetivos generales del soporte nutricional en el paciente oncológico, NPD en este caso, son: mantener o mejorar el aporte nutricional, atenuar las alteraciones metabólicas, mantener o mejorar la masa muscular y la capacidad funcional, reducir las interrupciones del tratamiento oncológico programado y mejorar la calidad de vida de los pacientes 13.
Los objetivos específicos de la NPD en los pacientes con cáncer son prevenir y tratar la malnutrición y/o la caquexia, mejorar el cumplimiento del tratamiento oncológico programado, reduciendo sus interrupciones, disminuir los efectos adversos del tratamiento y mejorar la calidad de vida de los pacientes (Grado de recomendación C) 13) (24.
Se recomienda que antes del alta hospitalaria los pacientes estén estables metabólicamente, hayan recibido un entrenamiento centrado en el paciente con una aproximación multidisciplinar, se les den las recomendaciones por escrito, tengan acceso a recursos materiales seguros necesarios para la NPD, sean capaces física y emocionalmente de manejarla y tengan un entorno adecuado en sus domicilios (Nivel de evidencia muy débil, Grado de recomendación fuerte) 34) (35.
Así mismo, para indicar NPD, la duración prevista de la misma debe ser superior a 4 semanas, la expectativa de vida superior a 3 meses y el paciente debe aceptarlo mediante firma del consentimiento informado; el entorno familiar debe estar formado, capacitado y motivado para colaborar con el manejo de la NPD y debe haber un mínimo de condiciones higiénicas en su domicilio. En cuanto al sistema, debe haber un equipo multidisciplinar con experiencia en NPD y un equipo médico-enfermero de apoyo a domicilio 36.
15. ¿CUÁLES SON LAS COMPLICACIONES DE LA NUTRICIÓN PARENTERAL DOMICILIARIA EN EL PACIENTE ONCOLÓGICO?
Las complicaciones asociadas con la NPD pueden ser las mismas que aparecen cuando este tipo de nutrición se prescribe a corto plazo, pero existen otras complicaciones específicamente relacionadas con la administración prolongada de la NP. Se observan 4 grandes grupos de complicaciones que incluyen mecánicas, infecciosas, metabólicas y psicosociales 37) (38 (Tabla III).
Tabla III Complicaciones de la nutrición parenteral domiciliaria (NPD) en el paciente oncológico. Adaptado de Cuerda Compés MC (37) y Cuerda C et al. 38

16. ¿CUÁL ES EL SEGUIMIENTO NUTRICIONAL RECOMENDADO EN UN PACIENTE ONCOLÓGICO QUE RECIBE NUTRICIÓN PARENTERAL DOMICILIARIA?
Los pacientes con NPD requieren un seguimiento estrecho e individualizado con el objetivo de evaluar la eficacia y seguridad del tratamiento, así como poder detectar y resolver las complicaciones asociadas a esta modalidad terapéutica 43) (44. Este seguimiento será realizado por el equipo de profesionales que hayan indicado la NPD, habitualmente la unidad de Nutrición del hospital de referencia, en coordinación con los equipos médicos implicados en el control de la evolución del enfermo 45.
Se debe realizar por parte del paciente un control diario de parámetros clínicos como la temperatura, diuresis, vómitos, deposición, ingesta oral y punto de inserción del catéter 43) (45.
Según ESPEN, en cada visita a la unidad de nutrición se realizará una evaluación antropométrica y analítica que incluya evolución ponderal, electrolitos, función hepática, creatinina, glucosa, triglicéridos, hemograma, hierro, albumina y PCR con una periodicidad de 3 meses en pacientes estables y de 1-2 meses cuando exista inestabilidad clínica. También se recomienda solicitar una determinación de oligoelementos y vitaminas (A, D, E, B12, ácido fólico) semestralmente y medir la densidad mineral ósea mediante DEXA cada año (Grado de recomendación C) 41.
17. ¿QUÉ FUENTES DE INFORMACIÓN EXISTEN PARA MEJORAR EL CONOCIMIENTO DE LA IMPORTANCIA DEL SOPORTE NUTRICIONAL EN LOS PACIENTES ONCOLÓGICOS?
Las fuentes de información son muchas y variadas. Recientemente, se ha publicado una actualización de la Pirámide de Haynes, uno de los líderes naturales del Evidence-Based Medicine Working Group, que sintetiza en 5 estratos los recursos de información en base a su utilidad y propiedades en la toma de decisiones en la atención sanitaria 46) (47.
Nos puede servir de guía teniendo en cuenta que cuanto más arriba se obtenga la información estará más elaborada y existe un mayor riesgo de estar menos actualizada:
Estudios: originales publicados en revistas médicas indexadas a las que se accede directamente a través de las bases de datos (PubMed, EMBASE, WoS, etc.). Existen unas 194 revistas de oncología y 13 específicas de nutrición clinica algunos ejemplos de estas últimas son: Clinical Nutrition, Nutrition Clinical Practices, Journal Parenteral and Enteral Nutrition y Nutrition.
Síntesis (systematic reviews): recoge las revisiones sistemáticas: Cochrane Library y otras de calidad.
Sinopsis (systematically derived recommendations): revisiones críticas de artículos, boletines e informes de evaluación.
Sumarios (synthesised summaries for clinical reference): incluye las guías de práctica clínica basadas en la evidencia con temas actualizados y valorados críticamente. Por ejemplo: Up To Date, Clinical Evidence, Dynamed, BMJ Best Practice.
Sistemas: hace referencia a los sistemas de ayuda a la toma de decisiones clínicas.
CONCLUSIONES
Este consenso destaca diferentes elementos claves que ayudaran a los médicos a normalizar el manejo del estado nutricional del paciente oncológico en la práctica clínica, estableciendo pautas comunes de indicación, monitorización, requerimientos nutricionales y vías de acceso a la NP.
Las alteraciones del estado nutricional en el paciente oncológico son frecuentes e impactan negativamente en el pronóstico del proceso tumoral.
El panel de expertos recomienda hacer uso de un cribado nutricional rutinario, al diagnóstico y a lo largo de la enfermedad para detectar el riesgo de desnutrición y, si este es positivo, realizar posteriormente una valoración nutricional completa para poder diagnosticar la desnutrición.
Actualmente existen diferentes herramientas y métodos de cribado que nos permiten detectar el riesgo nutricional. El cribado validado a nivel ambulatorio y de hospitalización en el paciente oncológico es el MST. Parámetros antropométricos, como la disminución de peso significativa, y analíticos, como la albúmina valorada juntamente con la PCR, pueden aportar información del estado nutricional.
Las necesidades nutricionales de los pacientes oncológicos, salvo en aquellos casos en donde se requieran medidas individualizadas, han de considerarse semejantes a las personas sanas (25-30 Kcal/kg/día).
En el paciente oncológico, la NP total está indicada cuando no es posible el uso del tubo digestivo y/o la alimentación oral y/o nutrición enteral no es suficiente o posible.
La NP complementaria a un soporte oral o enteral insuficiente estaría indicada cuando se prevea una clara mejoría del estado nutricional o de la calidad de vida del paciente oncológico.
El seguimiento nutricional del paciente oncológico debe ser multidisciplinar y adaptado a las características de cada centro.
El objetivo de la NPD es mejorar o mantener, en el ámbito domiciliario, el estado de nutrición de un paciente y estaría indicada en pacientes cuyo sistema digestivo no garantice recibir los nutrientes necesarios para cubrir sus requerimientos nutricionales.
La NPD requiere una evaluación periódica y conocimientos en la técnica y su manejo.
















