INTRODUCCIÓN
Las enfermedades cerebrovasculares (ECV) son alteraciones encefálicas secundarias a un trastorno vascular (1). La Organización Mundial de la Salud (OMS) define con el término ictus su manifestación aguda, con una presentación súbita y violenta de desarrollo rápido de la disfunción cerebral, focal o global, con una duración superior a las 24 horas o con resultado de muerte (1,2). Además, el ictus es la primera causa de discapacidad permanente en la edad adulta. Las estimaciones de la OMS lo sitúan en unos 15 millones de casos al año, de los que un tercio fallecerán y otro tercio presentarán discapacidad permanente (1). En España, la mejora de distintos aspectos tanto de la prevención como del diagnóstico y el tratamiento han permitido que la mortalidad por ECV presente una disminución constante en los últimos 30 años. Sin embargo, continúa siendo la primera causa de muerte entre las mujeres y la tercera entre los hombres (3).
En el desarrollo de la ECV se han identificado diversos factores de riesgo en los que el estado nutricional y la alimentación tienen un papel relevante. La prevalencia de la desnutrición en estos pacientes se estima entre un 8 % y un 34 %, llegando hasta al 50 % en algunos estudios. Esta impacta drásticamente en el pronóstico clínico de la enfermedad y sus posibles complicaciones durante el proceso de hospitalización (3 4-5).
La nutrición enteral (NE) por sonda está indicada en todo paciente en el que se prevea que no podrá recibir alimentación oral al menos durante siete días (6,7); si el curso clínico no es favorable y esta se prolonga durante más de un mes, estaría indicada la colocación de una sonda de gastrostomía por vía endoscópica o radiológica (6,7). En la actualidad se han publicado resultados en ocasiones contradictorios en relación al tipo de soporte nutricional idóneo para los pacientes con ictus, así como con respecto al momento más apropiado para instaurarlo (4,5,8 9-10). El estudio de referencia por el número de pacientes evaluados es el estudio FOOD (8 9-10). Con respecto al análisis comparativo entre los pacientes con dieta oral y aquellos otros con dieta oral más suplementos orales nutricionales, no se encontraron diferencias entre ambos grupos en relación con las variables clínicas (mortalidad, complicaciones hospitalarias, calidad de vida al alta y destino) (9). Dentro del análisis del inicio del soporte nutricional que efectúa el estudio FOOD, el grupo de pacientes que recibió NE en los primeros siete días tras el ictus obtuvo una reducción de la mortalidad del 5,8 %, no siendo la diferencia significativa (10).
En este trabajo tratamos de aportar más información a este respecto y describir variables que puedan influir en el pronóstico clínico de estos pacientes que han sufrido un ictus recientemente.
MATERIAL Y MÉTODOS
Se realiza un estudio observacional, longitudinal y retrospectivo de pacientes con diagnóstico de ictus ingresados específicamente en la Unidad de Ictus del Servicio de Neurología durante el periodo comprendido entre enero de 2010 y octubre de 2014.
Se incluyen aquellos pacientes valorados por el Servicio de Nutrición que hayan precisado durante el ingreso tratamiento con nutrición enteral, siendo excluidos aquellos en los que la valoración nutricional no pudo completarse. Se recogen los datos epidemiológicos así como los parámetros nutricionales: parámetros antropométricos y ponderación con los percentiles correspondientes a la población española (11) –pliegue tricipital (PT), circunferencia del brazo (CB), circunferencia muscular del brazo (CMB)–, y datos analíticos de albúmina, prealbúmina, colesterol total y linfocitos. Además, se recoge el diagnóstico de diabetes mellitus (DM) a través de su presencia como antecedente personal en la historia clínica y/o la presencia de cifras de hemoglobina glucosilada superiores al 6,5 % (criterios de la American Diabestes Association) (12), el momento de inicio del soporte nutricional y la duración de este, el tipo de fórmula y el abordaje digestivo (sonda nasogástrica o nasoyeyunal). A los pacientes que presentaban síntomas clínicos con sospecha de disfagia se les realizó el método de exploración clínico de volumen-viscosidad (MECVV) (13).
Para obtener el grado de afectación neurológica (basal y al alta) se utilizó la escala National Institute of Health Stroke Scale (NIHSS) (14), clasificándose como ictus leves aquellos que tienen una puntuación de 0-5, como ictus moderados aquellos con puntuación de 6-15, como ictus importantes los casos con puntuación de 16-20 y como ictus graves aquellos cuya puntuación era mayor de 20 puntos. Se recogen también los datos de mortalidad precoz (< 30 días desde el evento) y mortalidad a largo plazo durante el seguimiento ( > 30 días).
Con el fin de identificar los posibles factores pronósticos de una evolución clínica tórpida, definida en este caso como la mortalidad en el primer mes tras el alta hospitalaria o la presencia de déficits neurológicos importantes al alta (NIHSS > 16), se compararon las variables nutricionales en función de si se habían producido o no dichos eventos.
MÉTODO ESTADÍSTICO
Se efectúa un análisis descriptivo de las variables descritas anteriormente. Los resultados de las variables de escala se expresan como media ± desviación estándar y los de las categóricas como frecuencias absolutas y relativas (%). Posteriormente se estudió la influencia de las variables nutricionales en función de si se habían producido o no los eventos descritos mediante la prueba chi cuadrado. El análisis estadístico se efectúo utilizando el programa SPSS versión 19.0 (en español).
RESULTADOS
Se incluyeron en el estudio un total de 43 pacientes (la descripción de los datos basales se encuentra en la Tabla I). El 67,7 % (n = 21) de los pacientes presentaban al ingreso un déficit neurológico importante o grave (NIHSS > 16), mientras que al alta lo presentaban un 35,48 % (n = 11).
Con respecto a la valoración nutricional, utilizando los parámetros de codificación de la SENPE-SEDOM (13) se detectó una prevalencia de desnutrición del 41,86 % (15 casos de desnutrición leve y 3 de desnutrición moderada). El 34,88 % (n = 15) de los pacientes presentaban diabetes mellitus, tratándose en todos los casos de una DM2. Se inició la NE precoz a los 4,3 ± 5,8 días del evento agudo en el 82,1 % de la muestra. Un 17,9 % de los pacientes comenzaron la NE de forma tardía ( > 7 días después del evento agudo), siendo la duración de esta de 17,8 ± 23,2 días. Los tipos de fórmula más ampliamente prescritos fueron: específica de la diabetes (31 %), hipercalórica (26,2 %), estándar (19 %), hiperproteica (14,3 %) e hipercalórica-hiperproteica (9,5 %). En cuanto al acceso nutricional, recibieron una sonda nasogástrica el 85 % y una sonda nasoyeyunal el 15 % de los casos. De los pacientes que superaron el proceso agudo (83,72 %), ocho requirieron soporte nutricional en el momento del alta hospitalaria (22,22 %), colocándose una gastrostomía endoscópica percutánea (PEG) en tres de ellos. En ocho pacientes (16,27 %) se detectaron síntomas de sospecha de disfagia, realizándose en ellos la prueba de volumen-viscosidad (MECVV), que arrojó un resultado positivo en el 71 % de los casos. De cara al alta hospitalaria solo uno de ellos requirió mantener el soporte nutricional por vía enteral. En el resto de los casos fue suficiente la adaptación a la dieta oral y la prescripción de un módulo de espesante. Del total de la muestra analizada, el 18,6 % de los pacientes fallecieron en el primer mes tras el ingreso y 4 (9,3 %) en un periodo de dos años posterior al mismo (mortalidad global del 27,9 %).
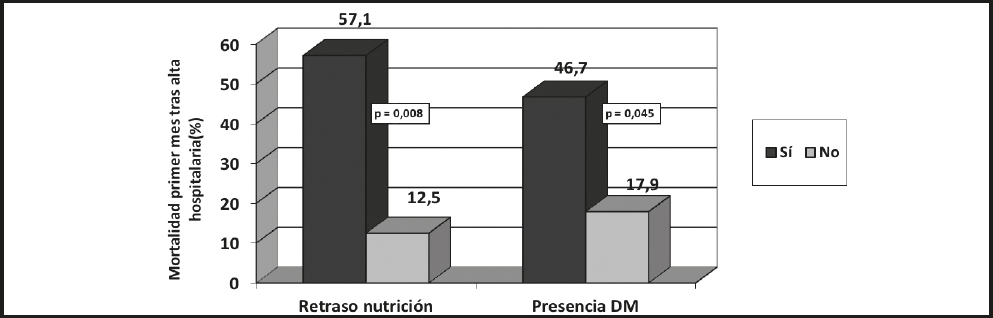
Se identificaron como marcadores de peor pronóstico clínico el retraso en el inicio del soporte nutricional durante > 7 días (riesgo de mortalidad precoz del 57,1 % frente al 12,5 %, p = 0,008) y la presencia de diabetes mellitus (riesgo de mortalidad precoz del 46,7 % frente al 17.9 %, p = 0.045) (Fig. 1). En cuanto a las otras variables nutricionales, no se correlacionaron de forma significativa ni con la mortalidad, ni con un mayor grado de déficit neurológico al alta.
DISCUSIÓN
La realización de una correcta valoración nutricional es fundamental tras el diagnóstico de ictus. Permite identificar a los pacientes desnutridos o con riesgo de desnutrición y cuantificar el grado de esta mediante medidas antropométricas y parámetros analíticos. Numerosos estudios muestran una prevalencia elevada de desnutrición durante el ingreso de estos pacientes (3 4-5), llegando hasta al 50 % con independencia de la presencia de disfagia (9,10,13,16). Es por ello por lo que en todas las guías clínicas recomiendan la valoración del estado nutricional en los primeros días de ingreso, pudiéndose anticipar un soporte nutricional de manera precoz para así mejorar el pronóstico clínico de estos pacientes (7,17 18 19 20-21). La asociación entre la mortalidad y el estado nutricional se analizó ampliamente en el estudio FOOD (Feed or Ordinary Food) (8) sobre una amplia cohorte de 3012 pacientes. En el estudio se comprobó que la mortalidad a los 6 meses era superior en el grupo con criterios de desnutrición. En nuestro estudio hemos analizado la prevalencia de la desnutrición a través de los parámetros diagnósticos del consenso SENPE-SEDOM para la codificación de la desnutrición hospitalaria (15). Los valores expuestos muestran consonancia con otros estudios publicados, aunque no existe homogeneidad en las herramientas diagnósticas empleadas (2,5,18). Si bien las guías clínicas no especifican la obligatoriedad de realizar técnicas para valorar la composición corporal, como la absorciometría dual por rayos X o la bioimpedanciometría, la ausencia de disponibilidad en nuestro centro podría considerarse un factor limitante del estudio. En la última guía clínica de la ESPEN, centrada en el paciente neurológico, se recomienda evaluar el riesgo de desnutrición en los pacientes con ictus utilizando la herramientaMalnutrition Universal Screening Tool(MUST) en las primeras 48 horas del ingreso (7).
El soporte nutricional debe adecuarse a las necesidades del paciente, diseñándose un plan terapéutico específico y reevaluándose este según la evolución clínica. El uso de suplementos orales no se recomienda de manera sistemática en los pacientes tras el diagnóstico de ictus (7,19 20-21) dado que no aporta beneficios clínicos al paciente (estudio FOOD1) (9). En nuestro estudio hemos analizado a pacientes con valoraciones nutricionales completas realizadas por personal experto en nutrición y que hubieran precisado soporte con nutrición enteral durante el ingreso hospitalario y/o al alta. Entre el 8 % y el 29 % de los pacientes requieren nutrición enteral por sonda tras sufrir un ictus (22). A pesar de los datos, no está tan claro qué pacientes mejoran su pronóstico con la nutrición enteral y cuándo debe iniciarse esta. En nuestro estudio, aquellos pacientes con inicio tardío del soporte nutricional presentaron peor pronóstico clínico y mayor mortalidad precoz. Estos datos parecen estar de acuerdo con los de otros estudios publicados con anterioridad, como el FOOD2 (16), donde la nutrición enteral por sonda instaurada de manera precoz (en las primeras 72 horas) redujo la mortalidad en el 5,8 % de los pacientes. Aunque esta diferencia no fuese estadísticamente significativa, su intervalo de confianza (IC 95 % -0,8 a 12,5 %) se considera suficientemente preciso para su asociación con un incremento relevante del riesgo. Diversas guías centradas en el paciente crítico recomiendan la nutrición temprana preferiblemente por vía enteral si no se logran los requerimientos nutricionales por vía oral en los primeros tres días después del evento desencadenante (23,24). Por tanto, el inicio precoz de dicho soporte es importante para mejorar el pronóstico clínico de estos pacientes, como también hemos observado en este trabajo, aunque son necesarios más estudios que permitan corroborar el efecto beneficioso sobre la mortalidad.
La vía de administración de elección para la nutrición enteral es la sonda nasogástrica (7,20,21). La disfagia es transitoria en un alto porcentaje de pacientes, por lo que se considera recomendable diferir los métodos invasivos a la espera de la evolución del paciente (22,25,26). En nuestro estudio solo tres pacientes requirieron la colocación de una PEG, lo que se llevó a cabo después de transcurrido un mes desde el ictus. La colocación temprana de gastrostomías no ha demostrado ventajas (estudio FOOD 3) (8), siendo muy recomendable (ESPEN 2018) su colocación en una fase clínica estable (después de 14 a 28 días) si la alimentación enteral es previsiblemente necesaria durante un periodo superior a 28 días (7). Cabe destacar la revisión sistemática de la Biblioteca Cochrane, donde se concluyó que la PEG se asocia a menor mortalidad y menos fracasos del tratamiento nutricional al compararla con la alimentación por SNG (26).
Durante la fase aguda del ictus se debe prevenir la aparición de hiperglucemia ya que puede aumentar la morbimortalidad y dificulta la recuperación funcional (27,28). Los resultados de nuestro estudio concuerdan con los publicados en la bibliografía, siendo la presencia de diabetes mellitus un marcador de peor pronóstico clínico. El estudio GLIAS (Glycemia in Acute Stroke) definió una glucemia ≥ 155 mg/dl en cualquier momento de las primeras 48 horas como punto de corte para pronosticar una mayor gravedad basal del ictus y un aumento del riesgo de muerte (29). En nuestro estudio, el 20 % del total de pacientes analizados mostraron cifras de glucemia superiores a dicho umbral, pero no se encontraron diferencias estadísticamente significativas con respecto a la gravedad del ictus basal. Esto se debe probablemente a que la medición de la glucemia se realizó únicamente a la llegada de los pacientes al servicio de urgencias y no se realizó un registro más amplio de las glucemias capilares. Si atendemos a las cifras analizadas de hemoglobina glucosilada, la media en los pacientes diabéticos no dista sobremanera de la hallada en los no diabéticos. Atendiendo a las consideraciones de la ADA (12), los pacientes no diagnosticados de diabetes con cifras de hemoglobina glucosilada entre el 5,7 % y el 6,4 % se consideran en estado de prediabetes. Así, podemos pensar que no solo la diabetes se comporta como factor de riesgo en la enfermedad vascular, sino que también los estados de prediabetes se asocian a una mayor incidencia de fenómenos cerebrovasculares. Los pacientes con nutrición enteral que desarrollan hiperglucemia se pueden beneficiar de fórmulas específicas de nutrición enteral para un mejor control glucémico durante la fase del ictus, si bien serían necesarios estudios que evaluasen su efectividad.
En conclusión, los resultados de este trabajo, con la limitación de ser retrospectivo y contar con una muestra limitada, respaldan la indicación de la nutrición enteral de inicio precoz en los pacientes con ictus recientes, así como el buen control de los pacientes diabéticos con el fin de mejorar su pronóstico clínico.