INTRODUCCIÓN
La visión actual del tejido adiposo es la de un órgano secretor activo que envía y responde a señales que modulan la situación inflamatoria, la inmunidad, el apetito, la sensibilidad a la insulina y el gasto energético (1). Estas señales son las moléculas llamadas adipocitoquinas, siendo una de ellas la resistina. La resistina se identificó como una molécula codificada por un gen cuya expresión es inducida por la diferenciación de los adipocitos e inhibida por ligandos de los receptores activados por proliferadores de peroxisomas en las células 3T3-L1 (2-3). Esta adipocitoquina es secretada por los adipocitos y los macrófagos en el tejido adiposo y el hígado. En los modelos animales, la sobreexpresión del gen de la resistina en el hepatocito aumenta la resistencia a la insulina, mientras que la supresión de dicho gen mejora la sensibilidad a la insulina y reduce la glucosa en sangre (4-5). En los seres humanos, los datos sobre el papel que desempeña la resistina en la sensibilidad a la insulina y la obesidad son controvertidos. De este modo, en algunos trabajos los niveles circulantes de resistina sérica están asociados a un aumento de la masa grasa total, la masa grasa visceral (6) y la presencia de diabetes mellitus de tipo 2 (7), mientras que otros estudios no muestran estas asociaciones (8).
El gen que codifica la resistina (RETN) se encuentra en el cromosoma 19p13. Se ha descrito una elevada heredabilidad de los niveles de resistina (9) y se estima que entre un 70 % y un 80 % de la variación de los niveles de resistina circulante puede explicarse por factores genéticos. En la literatura, algunos polimorfismos de un único nucleótido (SNP) en el gen RETN se han asociado con niveles elevados de resistencia a la insulina (10-11). El SNP 3'UTR C/T (rs10401670) es un polimorfismo que se ha asociado con la presencia de diabetes mellitus de tipo 2 en un único trabajo en la literatura, un análisis a posteriori del estudio Framingham (12). Por otra parte, existen trabajos que han mostrado la relación de este polimorfismo con el perfil lipídico de los pacientes no obesos (13) y, en algún diseño de intervención, se ha relacionado esta variante genética con la mejoría de la resistencia a la insulina tras la pérdida de peso por cirugía bariátrica en pacientes obesos (14).
El objetivo de diseñar este estudio fue evaluar la influencia del SNP rs10401670 del gen de la resistina sobre los niveles séricos de resistina, así como sobre la presencia de diabetes mellitus de tipo 2 y resistencia a la insulina en pacientes con obesidad.
MATERIAL Y MÉTODOS
PACIENTES
Se reclutaron un total de 653 pacientes de raza Caucásica. Estos pacientes fueron reclutados por el Servicio de Endocrinología y Nutrición, procedentes de consultas de Atención Primaria de nuestra Área de Salud, y el protocolo fue aprobado por el Comité de Ética. Todos los participantes firmaron un consentimiento informado. Los criterios de inclusión fueron los siguientes: edad superior a los 18 años, índice de masa corporal superior a 30 kg/ m2 y ausencia de realización de cualquier dieta durante los 6 meses previos al estudio. Los criterios de exclusión incluyeron los antecedentes de enfermedad cardiovascular o de accidente cerebrovascular durante los 24 meses anteriores, los tumores malignos o la cirugía mayor por cualquier causa en los 6 meses previos, y el uso actual de glucocorticoides o fármacos psicoactivos.
De todos los sujetos se obtuvieron muestras de sangre venosa en ayunas (12 h) por punción venosa. En esta muestra se determinaron los niveles de glucosa basal, el perfil lipídico (colesterol total, colesterol-LDL, colesterol-HDL, concentración de triglicéridos plasmáticos), los niveles de proteína C-reactiva (PCR) e insulina, la resistencia a la insulina determinada por el método HOMA-IR y los niveles de resistina. Se estudió el genotipo rs10401670 del gen RETN. En todos los sujetos se determinaron los siguientes parámetros: masa grasa por bioimpedancia tetrapolar, peso, altura, índice de masa corporal (IMC), circunferencia de la cintura y presión arterial. Estas medidas se realizaron a la misma hora del día (por la mañana). El diagnóstico de diabetes mellitus se realizó en todos los pacientes con glucemia basal en ayunas mayor o igual a 126 mg/dl en esta determinación analítica o que en el momento de la inclusión en el estudio ya hubieran sido diagnosticados previamente de diabetes mellitus de tipo 2 (15). También se registró el número de pacientes que recibían estatinas, antihipertensivos, fármacos para tratar la diabetes o insulina.
GENOTIPIFICACIÓN DEL POLIMORFISMO rs10401670 DEL GEN RETN
El ADN genómico se obtuvo a partir de leucocitos de sangre periférica con el kit comercial Vineo Extract DNA kit (Biorad (CA, LA, EUA) según las especificaciones del catálogo, analizándose la cantidad de ADN extraído con un espectrofotómetro (Fischer, Madrid, España). La reacción en cadena de la polimerasa (RCP) en tiempo real se realizó con un termociclador Biorad (LA, CA, EUA). En primer lugar se marcó el ADN amplificado (colorante fluorescente: 5'6-carboxifluoresceína (FAM) y 6-hexaclorofluoresceína (HEX)) y, posteriormente, se midió la cantidad de fluorescencia liberada durante la amplificación, que es directamente proporcional a la cantidad de ADN amplificado. Los cebadores oligonucleotídicos y las sondas se diseñaron con el Beacon Designer 5.0 (Premier Biosoft International®, LA, CA, EUA). La RCP se realizó con 50 ng de ADN genómico, 0,5 µl de cada cebador oligonucleotídico (cebador directo: 5'- ACGTTGGATGGCTGTTGACGTGCTAATGAG-3'; reverso: 5'- ACGTTGGATGAGCCACCCTCAGCGATCTAA-3'). El ADN se desnaturalizó a 95 ºC durante 3 minutos; se realizaron 45 ciclos de desnaturalización a 95 ºC durante 15 s y, posteriormente, a 59,3 ºC durante 45 s. La RCP se realizó en un volumen final de 25 µl que contenía 12,5 µl de IQTM Supermix (Bio-Rad®, Hercules, CA, EUA) con TAq ADN-polimerasa. Si en la muestra de un paciente crecieron ambas hebras, este paciente se clasificó como heterocigoto. Si en la muestra de un paciente solo creció una hebra, este paciente se clasificó como homocigoto. El software del termociclador clasifica a cada paciente como homocigoto salvaje (CC), heterocigoto (CT) y homocigoto mutante (TT).
DETERMINACIONES DE LABORATORIO
El perfil lipídico (colesterol total en suero y concentraciones de triglicéridos) se determinó mediante un ensayo colorimétrico enzimático (Technicon Instruments, Ltd., Nueva York, NY, EUA), mientras que el colesterol-HDL se determinó ezimáticamente en el sobrenadante después de la precipitación de otras lipoproteínas con sulfato de dextrano-magnesio. El colesterol-LDL se calculó utilizando la fórmula de Friedewald (16). Los niveles de glucosa en plasma en ayunas se determinaron utilizando un método automatizado de glucosa-oxidasa (Analizador de Glucosa 2, Beckman Instruments, Fullerton, CA, EUA). Los niveles de insulina se midieron mediante radioinmunoensayo (RIA) (RIA Diagnostic Corporation, Los Ángeles, CA, EUA) con una sensibilidad de 0,5 mUI/l (rango normal: 0,5-30 mUI/l) (17) y la evaluación de la resistencia a la insulina (HOMA-IR) se calculó utilizando estos valores mediante la siguiente formula (HOMA-IR = glucosaxinsulina/22,5) (18). Por último, los niveles de resistina se determinaron mediante ELISA (Biovendor Laboratory, Inc., Brno, República Checa) con una sensibilidad de 0,2 ng/ml y con un rango normal de 4-12 ng/ml (19).
PRESIÓN ARTERIAL, MEDIDAS ANTROPOMÉTRICAS Y ENCUESTA NUTRICIONAL
La presión arterial se midió dos veces, inicialmente y después de un tiempo de descanso de 10 minutos, con un esfingomanómetro de mercurio (Omrom, LA, CA, EUA), promediándose los resultados. El peso corporal se midió con una báscula con precisión de 100 g (Omrom, LA, CA, EUA) y el índice de masa corporal se calculó como peso (kg) dividido por la talla (m2), clasificándose como obesos los pacientes con índice de masa corporal superior a 30 kg/m2(20). También se midió la circunferencia de la cintura con una cinta métrica (Type SECA, SECA, Birmingham, Reino Unido) (diámetro más estrecho entre el proceso xifoides y la cresta ilíaca). La bioimpedancia eléctrica del cuerpo tetrapolar (EFG, Akern, Italia) se utilizó para determinar la composición corporal con una precisión de 50 g (21). Todos los sujetos recibieron instrucciones para registrar su ingesta dietética diaria durante tres días no consecutivos, incluido un día de fin de semana. Los registros se analizaron con un sistema de evaluación de datos por ordenador (Dietosource®, Ginebra, Suiza) (22).
ANÁLISIS ESTADÍSTICO
El tamaño de la muestra del estudio se calculó para detectar diferencias de un 5 % en la prevalencia de la diabetes mellitus de tipo 2 con una potencia del 90 % y un 5 % de significación (n = 630). La prueba de Kolmogorov-Smirnov se utilizó para determinar la distribución de las variables. Los resultados se expresaron como media +/- desviación estándar. Las variables numéricas cuantitativas con distribución normal se analizaron con una prueba t de Student de dos colas. Las variables no paramétricas se analizaron con la prueba U de Mann-Whitney. Las variables categóricas se analizaron con la prueba del chi cuadrado, con la corrección de Yates, y la prueba de Fisher. También se usó una prueba del chi cuadrado para evaluar el equilibrio de Hardy-Weinberg. Se determinó la razón de probabilidad u odds ratio (OR) con un intervalo de confianza del 95 % para valorar la influencia de este SNP sobre la presencia de DM2; posteriormente se realizó un análisis de regresión logística (método hacia adelante) con la variable dependiente dicotómica “DM2 = Sí/No” para evaluar la asociación con el polimorfismo rs10401670, ajustándola según la edad, el sexo, el peso y los niveles de resistina circulantes. El análisis estadístico se realizó para los genotipos CT y TT combinados como grupo (grupo mutante, alelo menor) y CC como genotipo salvaje, con un modelo dominante. Un valor de p < 0,05 se consideró estadísticamente significativo (SPSS 17.0, IL, EUA).
RESULTADOS
Se reclutaron un total de 653 sujetos con obesidad. Un 72,9 % fueron mujeres y un 27,1 % varones. La edad media del grupo fue de 45,9 ± 11,2 años, sin existir diferencias significativas de edad entre varones y mujeres (46,3 ± 10,2 años vs. 45,1 ± 8,2 años: no significativo). Teniendo en cuenta el polimorfismo rs10401670, la distribución del genotipo fue la siguiente: 212 sujetos con CC (32,4 %), 340 sujetos con CT (52,0 %) y 101 sujetos con TT (15,6 %). Esta variante génica estaba en equilibrio de Hardy Weinberg (p = 0,39).
Al agrupar a los sujetos para realizar un análisis dominante se obtuvieron las siguientes frecuencias: 212 sujetos con genotipo (salvaje) CC (32,4 %), con un total de 160 mujeres (75,4 %) y 52 varones (24,6 %), y 441 sujetos con genotipo mutante (CT + TT) (57,6 %), de los cuales 316 (71,7 %) fueron mujeres y 125 (28,3 %) varones.
En la tabla I se muestran los valores antropométricos en relación al polimorfismo rs10401670, sin existir diferencias significativas entre ambos genotipos (análisis dominante).
Tabla I. Parámetros antropométricos y presión arterial
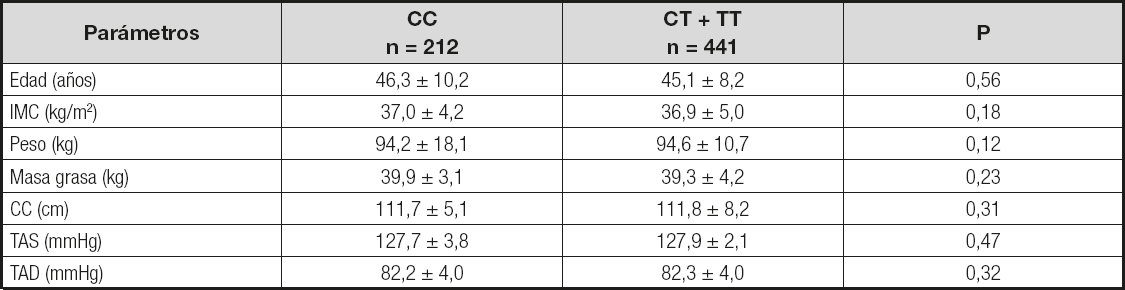
IMC: índice de masa corporal; TAS: tensión arterial sistólica; TAD: tensión arterial diastólica; CC: circunferencia de la cintura.
En la tabla II se muestran los valores bioquímicos en relación al polimorfismo rs10401670, sin existir diferencias significativas entre ambos genotipos en cuanto a perfil lipídico, glucosa basal y PCR, pero sí en los niveles séricos de resistina (delta: 1,0 ± 0,2 ng/ml; p = 0,02), insulina (delta: 1,3 ± 0,1 ng/ml; p = 0,02) y HOMA-IR (delta: 1,2 ± 0,2 ng/ml; p = 0,01), que fueron superiores en los pacientes portadores del alelo mutado T. Para evaluar la posible influencia de los factores dietéticos se comparó la ingesta de ambos grupos de sujetos, sin encontrar diferencias estadísticamente significativas ni en el aporte calórico, ni en la distribución de macronutrientes (análisis dominante) (tabla II).
Tabla II. Parámetros bioquímicos e ingesta (media ± DE)

PCR: proteína C-reactiva; HOMA-IR: homeostasis model assessment ; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
Con el objetivo de analizar la relación entre los niveles de resistina, el SNP rs10401670 del gen de la resistina y la presencia de DM2 se compararon las medias de resistina en los dos genotipos. Los niveles de resistina fueron superiores en los portadores del alelo T con DM2 (DM2: 7,2 ± 0,3 ng/ml vs. sin DM2: 4,6 ± 0,2 ng/ml; p = 0,02) y no se encontraron diferencias en los pacientes sin alelo T (DM2: 6,4 ± 1,3 ng/ml vs. sin DM2: 5,3 ± 0,9 ng/ml; p = 0,52).
La prevalencia global de la diabetes mellitus de tipo 2 (DM2) en la muestra fue del 21,8 %. En la tabla III se muestra cómo los valores de insulina, HOMA-IR, resistina y glucosa fueron superiores en el grupo de pacientes con DM2. En relación al tratamiento concomitante, en el grupo de DM2 un 25,2 % no recibían fármacos para su diabetes y solo seguían recomendaciones dietéticas (25,2 %); 80 pacientes recibían tratamiento con metformina (55,9 %), 10 pacientes con inhibidores de SGLT2 (7,0 %), 8 pacientes con inhibidores de DPPIV (5,6 %), 4 pacientes con análogos de GLP-1 (2,8 %) y 5 pacientes con insulina (3,5 %). Un total de 16 diabéticos recibían estatinas (11,2 %) y 26 pacientes recibían antihihipertensivos (18,2 %). El porcentaje de estos tratamientos fue similar en el grupo de los no diabéticos, con un total de 56 pacientes con estatinas (10,9 %) y 78 con antihipertensivos (15,2 %).
Tabla III. Características de las muestras de diabéticos de tipo 2 y no diabéticos

IMC: índice de masa corporal; TAS: tensión arterial sistólica; TAD: tensión arterial diastólica; CC: circunferencia de la cintura; PCR: proteína C-reactiva; HOMA-IR: homeostasis model assessment; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
Con respecto al polimorfismo rs10401670, entre los sujetos con genotipo CC, un total de 174 no presentaban DM2 (82,1 %) y 38 presentaban DM2 (17,9 %). Con respecto a los sujetos con el alelo T (CT + TT), un total de 336 no tenían DM2 (76,2 %) y 105 presentaban DM2 (23,8 %). Estos resultados mostraron una mayor frecuencia de DM2 entre los pacientes con alelo T: OR, 1,43 (IC 95 %: 1,03-3,12; p = 0,01). En el análisis de regresión logística, al analizar el efecto del polimorfismo rs10401670, ajustado según la edad, el sexo, los niveles de resistina circulante y el peso corporal, se obtuvo como variable independiente el alelo T del SNP rs10401670 sobre la presencia de DM2: OR, 2,27 (IC 95 %: 1,26-4,09; p = 0,01).
DISCUSIÓN
A pesar del aumento de la información sobre la asociación de la resistina con las alteraciones metabólicas (10-11), la relación entre diferentes polimorfismos de la resistina y la presencia de diabetes mellitus de tipo 2 es un área con pocos datos contrastados (12). En nuestro estudio, que analiza un polimorfismo común del gen RETN, el SNP 3'UTR C/T (rs10401670) en pacientes adultos obesos, hemos encontrado una asociación significativa entre el alelo T de este SNP y los niveles de resistina, insulina y resistencia a la insulina, con una mayor prevalencia de la diabetes mellitus de tipo 2 en los pacientes portadores del alelo T.
En un estudio previo (13) ya se había demostrado una relación entre la presencia del alelo T de la variante genética rs10401670 y unos niveles más elevados de resistina en los niños.Por otra parte, en un trabajo de intervención (14) se ha demostrado que, tras las pérdidas importantes de peso secundarias a una derivación biliopancreática, los pacientes con el alelo T no mostraban ninguna mejoría metabólica de parámetros tales como la insulina, la resistencia a la insulina y los niveles de resistina, a diferencia de los no portadores del alelo T, donde sí mejoraban todos estos parámetros. Parece, por tanto, que este alelo está implicado en la situación metabólica de los pacientes obesos, pudiendo ser la falta de genotipificación de las poblaciones evaluadas la explicación del porqué, en los estudios previos de la literatura, la relación de los niveles de resistina con las variables bioquímicas presentó datos contradictorios. El desequilibrio de esta variante en los grupos evaluados ha podido inducir un sesgo en los resultados. De este modo, existen trabajos con seres humanos que han demostrado que los niveles de resistina se correlacionan con la resistencia a la insulina (HOMA-IR) y la obesidad (1,23), mientras que otras investigaciones no pudieron observar estas relaciones metabólicas (24,25).
Con respecto a la asociación encontrada entre el alelo T de la variante genética rs10401670 y la presencia de DM2, los estudios son escasos (12). Sí que existen trabajos que han evaluado la relación de la resistina con el síndrome metabólico, encontrándose datos contradictorios. Existe un diseño (26) que ha demostrado que la resistina sérica se correlaciona positivamente con la acumulación de factores del síndrome metabólico en los pacientes con diabetes mellitus de tipo 2. En otro estudio, Menzaghi y cols. (27) también observaron correlaciones significativas entre los niveles de resistina y el peso, la circunferencia de la cintura, la resistencia a la insulina (HOMA-IR) y el puntaje del síndrome metabólico mediante el análisis de sujetos no diabéticos y sus familiares adultos. Sin embargo, en otros trabajos no se ha detectado estas asociaciones, mostrando los resultados cómo la resistina plasmática no se correlaciona con el número de criterios del síndrome metabólico (28). Probablemente, esta heterogeneidad de los resultados pueda estar en relación con diferentes genotipos del gen RETN que, como hemos visto en nuestro trabajo, modulan la concentración de resistina y, por ello, la presencia de DM2, no habiendo sido genotipadas las poblaciones de estos estudios mencionados.
Por último, en el estudio realizado por Hivert y colaboradores (12), se evaluaron en 2531 sujetos del estudio Framingham un total de 21 SNP del gen RETN, de los cuales solo 4 se relacionaron con los niveles de resistina, siendo uno de ellos el rs10401670. La hipótesis que manejan estos autores es que este polimorfismo está situado en la región 3' del gen RETN, postulándose que los SNP localizados fuera de la secuencia codificante del gen podrían influir en la transcripción o la estabilidad del ARNm, afectando de este modo de manera secundaria a los niveles del transcripto final. En este trabajo (12) también se demostró una relación directa entre el alelo T y los niveles elevados de insulina y glucemia basal y, por ende, la patofisiología de la diabetes mellitus de tipo 2, sin influir la ingesta nutricional ni la antropometría de los pacientes, como ha sucedido en la muestra estudiada por nosotros. Por otra parte, el rs10401670 se encuentra en el segundo intrón del gen MCEMP1 (proteína de membrana expresada en mastocitos 1), un gen que codifica una proteína de 186 aminoácidos, con un solo dominio transmembranoso, que se expresa principalmente en los monocitos y las líneas de mastocitos (29). Dado que la resistina es sintetizada principalmente por los macrófagos que se diferencian de los monocitos en el tejido adiposo, sería interesante investigar si el gen MCEMP1 y su producto activo se ven influidos funcionalmente por la variante rs10401670 o los SNP en su región génica, y si esta proteína está o no relacionada con el metabolismo de la glucosa.
Existen algunas limitaciones de nuestro estudio. Primero, solo se ha evaluado un SNP en el gen RETN, pudiendo otros SNP de este gen estar implicados en los parámetros metabólicos e interactuar con otros haplotipos. Segundo, un diseño trasversal como el nuestro invalida cualquier hipótesis de causalidad, siendo necesarios para ello los diseños prospectivos. En tercer lugar, son necesarios nuevos estudios para validar estos hallazgos en pacientes con sobrepeso, así como para controlar la actividad física con un cuestionario validado con el fin de analizar su influencia en los resultados obtenidos. Por último, nuestros datos son generalizables solo a los pacientes con obesidad, no siendo extrapolables a la población general ni a la población normopesa.
En conclusión, el alelo T de la variante genética rs10401670 se asocia con mayores niveles de resistina, insulina basal, resistencia a la insulina y prevalencia de diabetes mellitus de tipo 2 en los sujetos obesos. Sin embargo, se necesitan más estudios para confirmar nuestros resultados y explorar el efecto no solo sobre la presencia de diabetes mellitus de tipo 2, sino también sobre sus complicaciones micro y macrovasculares.














