INTRODUCCIÓN
La hipertensión arterial sistémica (HAS) es un problema de salud pública a nivel mundial y representa uno de los principales factores de riesgo para el desarrollo de enfermedades cardíacas, derrames cerebrales, insuficiencia renal, muerte prematura y discapacidad (1).
La hipertensión arterial resistente (HAR) se define como la presión arterial (PA) no controlada a pesar del uso de tres fármacos antihipertensivos a las dosis máximas recomendadas, incluido un diurético, o la controlada con el uso de cuatro o más fármacos antihipertensivos (2). El riesgo de eventos cardiovasculares, como infarto, accidente cerebrovascular, enfermedad renal terminal y muerte, puede ser de dos a seis veces mayor en los individuos con HAR que en los individuos hipertensos no resistentes (3).
Según el Estudio Longitudinal Brasileño de Salud de Adultos (ELSA), la HAR tiene una alta prevalencia en Brasil, habiendo sido encontrada en el 11 % de una cohorte de más de 15.000 funcionarios públicos de 35 a 74 años en 6 capitales brasileñas (4). Por lo tanto, se han buscado nuevos esquemas terapéuticos y terapias alternativas con el objetivo de lograr un control de presión más adecuado.
El desequilibrio entre los altos niveles de ERO y las defensas antioxidantes celulares puede estar implicado en la patogénesis de varias enfermedades (5), como la HAS, así como en muchos factores de eventos cardíacos patológicos, como la insuficiencia cardíaca, la hipertrofia de los cardiomiocitos, la viabilidad celular, las propiedades contráctiles, la función eléctrica y las anomalías en el manejo del calcio, la energía y el metabolismo del sustrato (6).
Rodrigo y cols. (7) informan que la relación entre el estrés oxidativo y la HAS está representada por la disminución de la capacidad antioxidante y la sobreproducción de especies reactivas de oxígeno (ERO), mediadores de los principales vasoconstrictores fisiológicos que conducen a una disminución de la biodisponibilidad de óxido nítrico (NO), acompañada de una mayor producción de factores de contracción derivados del endotelio, hecho que induciría un estado proinflamatorio y protrombótico que favorecería la disfunción endotelial y la relajación vascular alterada en la HAR (7).
En este contexto, la nutrición desempeña un importante papel por su capacidad de combatir el estrés oxidativo. Entre los micronutrientes que realizan tales funciones están la vitamina A, la vitamina C y la vitamina E, que constituyen importantes circuitos de defensa antioxidante no enzimáticos, y minerales como el zinc y el selenio, que actúan como cofactores o sitios activos de las enzimas superóxido-dismutasa (SOD) y glutatión-peroxidasa (GPx), respectivamente (8).
En el seno de la investigación científica ha aumentado el interés por la relación entre los antioxidantes y el desarrollo de diversas enfermedades (5,6,9), pero este es un tema qe sigue siendo controvertido. Sin embargo, no hay consenso sobre el uso de suplementos antioxidantes o la definición de la dosis ideal para la protección, sobre qué nutrientes se deben usar, ni sobre la duración del tratamiento. No obstante, la deficiencia de los micronutrientes mencionados puede comprometer la capacidad antioxidante del organismo, influyendo en la vulnerabilidad del individuo para desarrollar estrés oxidativo (10).
De esa manera, intentar conocer la ingesta de micronutrientes antioxidantes de los pacientes hipertensos resistentes puede generar conocimientos que ayuden a minimizar los efectos de esta enfermedad, que afecta directamente a la calidad de vida de estas personas, además de constituir elementos suficientes para mejorar la efectividad del tratamiento en sí. Paralelamente, poco se ha reportado sobre el perfil bioquímico y antropométrico de los pacientes con HAR.
Dada la escasez de estudios con pacientes hipertensos resistentes, el objetivo de este estudio fue analizar y correlacionar el perfil bioquímico y antropométrico, y la ingesta de micronutrientes antioxidantes (vitamina A, C, E, zinc y selenio) en pacientes con HAR.
MATERIAL Y MÉTODOS
DISEÑO
Este estudio observacional, de corte transversal, se realizó entre septiembre de 2017 y junio de 2019 con pacientes diagnosticados de HAR y atendidos en el ambulatorio de hipertensión del Hospital Universitario Antonio Pedro, ubicado en la ciudad de Niterói, provincia de Rio de Janeiro, Brasil.
CRITERIOS DE INCLUSIÓN Y EXCLUSIÓN
Se reclutaron adultos (45-59 años) de ambos sexos y ancianos (60-70 años); el índice de masa corporal (IMC) estaba entre 18,5 y 39,9 kg/m² para ambos sexos; tenían HAR según la VII Directriz brasileña para la hipertensión (2), cuyo diagnóstico fue realizado por un médico del equipo de investigación: PAS ≥ 140 mmHg y/o PAD ≥ 90 mmHg a pesar del uso de tres fármacos antihipertensivos a las dosis máximas recomendadas, incluido un diurético, o en caso de usar cuatro o más fármacos antihipertensivos estando el control de la presión dentro del rango perseguido (< 140/90 mmHg).
Los criterios de exclusión fueron: fumadores; tasa de filtración glomerular por la ecuación CKD-EPI ≤ 60 mL/min/m²; hepatopatías; presencia de ascitis o anasarca; síndrome inflamatorio intestinal; pacientes que hubieran utilizado suplementos que contuvieran los nutrientes estudiados en los 6 últimos meses.
CONSIDERACIONES ÉTICAS
El trabajo fue aprobado por el Comité de Ética de la Universidad Federal Fluminense.
EVALUACIÓN DE LA INGESTA DE MICRONUTRIENTES ANTIOXIDANTES
Las vitaminas y minerales presentados en este artículo se priorizaron debido a sus funciones antioxidantes. Las cuantificaciones de vitaminas (A, C y E) y minerales antioxidantes (zinc y selenio) se efectuaron utilizando una encuesta de frecuencia de consumo alimentario previamente validada y un recordatorio de 24 horas (11) con el objetivo de determinar la cantidad de antioxidantes consumidos por el paciente a través de los alimentos. La ingesta de estos nutrientes se comparó con los valores de ingesta diaria recomendados por el Institute of Medicine (12). Para calcular la ingesta de micronutrientes se utilizaron los valores informados en la tabla de composición de alimentos de Brasil (TACO) (13). Para reducir las fuentes de error (sesgo de memoria, tamaño de las medidas caseras y estimación de porciones de alimentos), el recordatorio de 24 horas se acompañó de fotografías, réplicas de alimentos y kits con medidas caseras, aparte de repetir la entrevista. Esta metodología tenía como objetivo, además de reducir el sesgo de memoria, estandarizar las medidas y reducir los errores de estimación de las porciones de alimentos.
EVALUACIÓN ANTROPOMÉTRICA
La evaluación antropométrica consistió en la medición del peso, la talla, el perímetro de la cintura (PCI) y el perímetro de la cadera (PCA). El índice de masa corporal se calculó según la fórmula IMC = peso (kg)/talla² (m), tomando los rangos definidos por la OMS (2000) (14). El PCI se midió en el punto medio entre la última costilla fija y la cresta ilíaca (15), tomándose como puntos de corte de riesgo cardiovascular > 80 cm en las mujeres y > 90 cm en los hombres, conforme a la American Heart Association (2009) (16). El índice cintura-cadera (ICC) se calculó dividiendo la medición del PCI en centímetros por la medición del PCA en centímetros. Para el riesgo cardiovascular determinado por la OMS se utilizó un punto de corte poblacional de 0,9 para los hombres y 0,85 para las mujeres (17). Las variables PCI e ICC se categorizaron como “presencia de riesgo” y “ausencia de riesgo”, dado que los puntos de corte son específicos para ambos sexos.
EVALUACIÓN BIOQUÍMICA
Para la extracción de sangre, los participantes recibieron instrucciones de ayunar 12 horas. Para evaluar el perfil lipídico se recolectaron los exámenes de laboratorio del paciente que contenían datos sobre colesterol total, triglicéridos, HDL-c y LDL-c utilizando el método enzimático colorimétrico, considerando los siguientes puntos de corte: < 200 mg/dL, < 150 mg/dL, > 40 mg/dL (para los hombres) y > 50 mg/dL (para las mujeres), y < 100 mg/dL, respectivamente (18). La evaluación del perfil glucémico se obtuvo a partir de la medición de la glucosa en ayunas, utilizando el método enzimático y considerando como normales los valores situados entre 70 y 99 mg/dL, y la hemoglobina glucosilada por turbidimetría, considerando como normal el valor < 5,7 % (19).
ANÁLISIS ESTADÍSTICO
Los datos se presentaron como media y desviación estándar. La normalidad de las variables se determinó mediante el test de Kolmogorov-Smirnov. Para comparar las variables continuas con distribución normal se aplicó el test de la “t” de Student, y para aquellas sin normalidad el test de Mann-Whitney. El grado de asociación entre las variables se analizó aplicando la correlación de Pearson para la muestra normal y la correlación de Spearman para la muestra no normal. Se consideró estadísticamente significativo el valor de p < 0,05. El análisis estadístico se realizó con el paquete SPSS Statistics 20.
RESULTADOS
Se incluyeron 60 pacientes con HAR, la media de edad fue de 62,83 ± 10,73 años, el 81,7 % (n = 49) fueron mujeres y el 18,3 % (n = 11) fueron varones. No se observaron diferencias significativas entre sexos, ni según la edad (ρ = 0,177) y el IMC (p = 0,269).
Se compararon los individuos diabéticos y los no diabéticos y no se encontraron diferencias significativas entre las variables analizadas (consumo de micronutrientes, bioquímicos, antropométricos y antioxidantes). De esta forma, los individuos se asignaron y estudiaron en un solo grupo.
Las características generales de la muestra se describen en la tabla I. La tabla II indica la distribución de los medicamentos en uso y el porcentaje de uso en la muestra de pacientes hipertensos resistentes. Se observó que el 68,33 % de los pacientes usaban estatinas, además de diuréticos, como parte del tratamiento de la HAR.
Tabla I. Características generales de la muestra
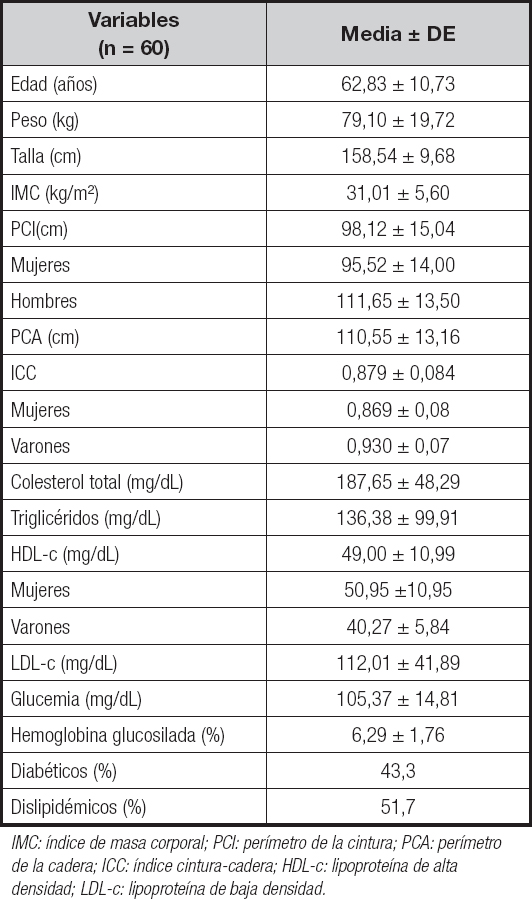
IMC: índice de masa corporal; PCI: perímetro de la cintura; PCA: perímetro de la cadera; ICC: índice cintura-cadera; HDL-c: lipoproteína de alta densidad; LDL-c: lipoproteína de baja densidad.
Tabla II. Medicamentos utilizados por los pacientes con hipertensión arterial resistente, atendidos en un hospital público de Niterói, RJ, en 2019
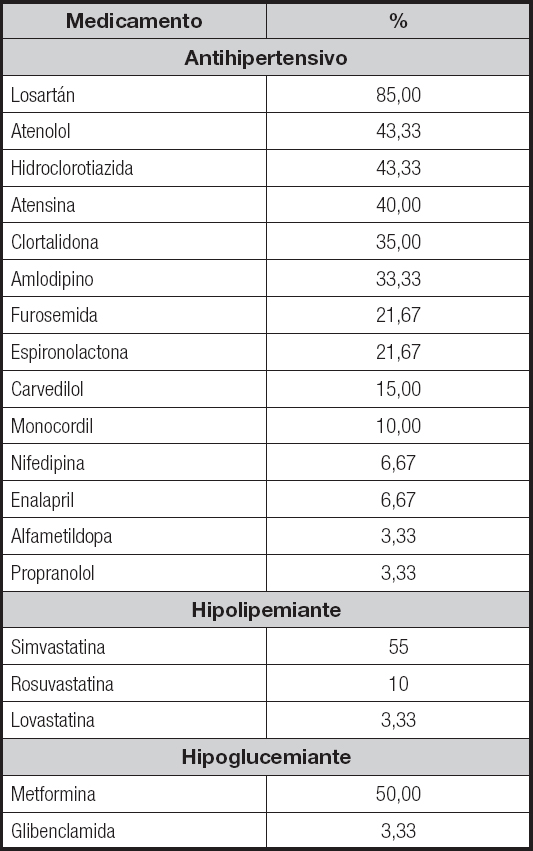
Con respecto al estado nutricional de la población, se identificó que solamente el 20 % (n = 11) eran eutróficos, mientras que el 21,82 % (n = 12) tenían sobrepeso, el 34,55 % (n = 19) obesidad de grado I, el 20 % (n = 11) obesidad de grado II y el 9,09 % (n = 5) obesidad de grado III. Por lo tanto, el 63,64 % (n = 35) de los pacientes tenían algún grado de obesidad.
La anomalía del PCI fue la más prevalente, con un total del 85,71 % de la muestra, seguida del ICC, con un 66,07 %. Cabe resaltar que ambos constituyen factores del riesgo cardiovascular, como se describe en la tabla III.
Tabla III. Riesgo cardiovascular según el perímetro de la cintura y el índice cintura-cadera de pacientes de hipertensión arterial resistente atendidos en un hospital público de Niterói, RJ, en 2019

PCI: perímetro de la cintura; ICC: índice cintura-cadera.
Con respecto a la ingesta de micronutrientes antioxidantes, hubo una alta prevalencia de insuficiencia de todos los antioxidantes estudiados, especialmente de las vitaminas A y E (Tabla IV).
Tabla IV. Ingesta media de micronutrientes antioxidantes por adultos y ancianos portadores de hipertensión arterial resistente, atendidos en un hospital público de Niterói, RJ, en 2019

*Según la DRI: Dietary Reference Intake; IOM/FNB: Institute of Medicine/Food and Nutrition Board, 2001.
Los resultados de las correlaciones entre variables antropométricas y bioquímicas, de acuerdo con la suficiencia de la ingesta de micronutrientes antioxidantes, se muestran en la tabla V.
Tabla V. Variables antropométricas y bioquímicas, según la suficiencia de la ingesta de micronutrientes antioxidantes, de los pacientes con hipertensión arterial resistente atendidos en un hospital público de Niterói, RJ, en 2019

PCI: perímetro de la cintura; ICC: índice cintura-cadera.
Al comparar individuos con concentraciones adecuadas e insuficientes de vitamina E y zinc, no se observaron diferencias estadísticas entre las variables estudiadas. Se identificó una correlación positiva y fuerte entre PCI e IMC (r = 0,888; p < 0,001), y una correlación positiva entre las concentraciones de vitamina A y vitamina E (r = 0,307; p = 0,023).
DISCUSIÓN
El efecto de la obesidad sobre el control de la HAR y la HAS se ha convertido recientemente en un tema importante, especialmente con el aumento global de la prevalencia de ambas enfermedades en las últimas décadas (20). Haddadin y cols. (20) observaron un aumento de la prevalencia de la HAR en los pacientes con mayor grado de obesidad, concluyendo que la obesidad es una comorbilidad importante que resulta en un control deficiente de la PA y en el desarrollo de HAR. Por lo tanto, mantener el peso dentro del rango de IMC adecuado (< 25 kg/m²) es un factor importante para la prevención y el tratamiento de la HAR. En nuestro estudio, aproximadamente el 64 % de la muestra estudiada tenía algún grado de obesidad.
PCI y ICC son indicadores ampliamente utilizados que evalúan la adiposidad visceral, fuertemente relacionada con el riesgo cardiovascular (21). Entre los factores de riesgo cardiovascular, el PCI alto fue el más prevalente en comparación con el ICC. Los resultados también mostraron que el PCI había indicado una fuerte correlación positiva con el IMC, lo que corrobora el estudio de Barbosa y cols. (22), quienes observaron una asociación lineal positiva entre el aumento del IMC y el PCI en la HAS. El tejido adiposo es un órgano dinámico que secreta adipocinas, incluidas citocinas proinflamatorias como la leptina, el factor de necrosis tumoral alfa (TNF-α) y la interleucina 6 (IL-6). Por esta razón, el exceso de adiposidad visceral implica una cascada de inflamación y estrés oxidativo, y es un determinante de la resistencia a la insulina, la rigidez vascular, la disfunción endotelial y la retención de sodio por los riñones (23,24), mecanismos por los cuales pueden proporcionar resistencia al tratamiento antihipertensivo (24). Por lo tanto, estos hallazgos son preocupantes en la HAR, ya que demuestran que estos individuos son más susceptibles a la resistencia al control de la PA y al estrés oxidativo. Además, al relacionar la ingesta de antioxidantes con los predictores de riesgo cardiovascular se observó que las personas con una ingesta insuficiente de vitamina A y vitamina C tenían valores más altos de PCI e ICC, lo que puede indicar una posible relación entre el riesgo cardiovascular y la ingesta insuficiente de estos micronutrientes antioxidantes.
La vitamina A es un micronutriente ampliamente estudiado debido a su función antioxidante y su papel protector contra el estrés oxidativo, y está involucrado en la etiología y la progresión de varias enfermedades crónicas, incluida la HAS (25). El mecanismo por el cual la vitamina A realiza su acción antioxidante se conoce gracias a su capacidad de actuar como desactivador de las ERO (peróxido de hidrógeno y oxígeno singlet) y eliminador de radicales libres (anión superóxido y radical hidroxilo), moléculas oxidantes promotoras del estrés oxidativo. Por consiguiente, la vitamina A puede detener la propagación de las reacciones en cadena nocivas que conducen a la peroxidación lipídica y al daño del ácido desoxirribonucleico (ADN) (7). La importancia de este nutriente en la fisiopatología de la HAS se atribuye a su papel en la regulación del tono vasomotor, la inhibición de las moléculas de adhesión y de la activación plaquetaria, y la reducción de la proliferación de las células del músculo liso vascular (26).
Engelhard y cols. (27) observaron que los individuos suplementados con carotenoides tuvieron una disminución significativa de los niveles de PA y estrés oxidativo no solo debido a los mecanismos vinculados a la oxidación del LDL-c sino también al aumento del HDL-c y la reducción de la proliferación de las células musculares lisas. En nuestro estudio, aunque no se encontró una correlación significativa entre la ingesta insuficiente de vitamina A y los parámetros bioquímicos, se observó una alta prevalencia de la ingesta insuficiente de vitamina A en el 91,38 % de la muestra, acompañada de niveles alterados de LDL-c (60,01 %) y HDL-c (53,33 %).
Con respecto a la antropometría, se observó que los individuos con ingesta inadecuada de vitamina A tenían un PCI y un ICC significativamente más altos. Los hallazgos en la literatura sugieren que la vitamina A interviene en la modulación de la adiposidad y el peso corporal. Los estudios in vivo e in vitro han demostrado que la deficiencia de vitamina A permite una mayor movilización preadipocitaria hacia los adipocitos maduros, además de la inhibición de la termogénesis y la apoptosis, lo que contribuye al aumento de la adiposidad corporal, especialmente retroperitoneal (28,29).
La vitamina A está presente, junto con la vitamina E, en el núcleo lipídico de las partículas de LDL-c, evitando la modificación de esas partículas por oxidación. Por esta razón, estos micronutrientes destacan en la prometedora terapia de la HAS (30). Se ha demostrado que esta vitamina media en los efectos antiinflamatorios además de poseer propiedades antioxidantes que están relacionadas con la reducción de la PA, la adhesión y agregación plaquetaria, la modulación del perfil lipídico y la inhibición de la actividad de la proteína-quinasa C, potencialmente activada por las LDL oxidadas (31), lo que demuestra su papel protector frente a la disfunción endotelial al actuar en contra de las ERO y las LDL oxidadas.
Se encontró una prevalencia significativa de insuficiencia de la vitamina E en la muestra, que indica una mayor alteración en comparación con los otros micronutrientes. También se observó una correlación positiva entre las concentraciones de vitamina A y vitamina E. Por lo tanto, la alta deficiencia de ambas vitaminas es relevante, puesto que estos dos micronutrientes pueden actuar sinérgicamente para proteger frente al daño oxidativo de las células y los tejidos, lo que resulta en una inhibición significativamente mayor de la peroxidación lipídica en comparación con la acción de estos compuestos solos (32).
Además, se observó que la mayoría de los individuos usan estatinas. Las estatinas son medicamentos utilizados para tratar las hiperlipidemias con el fin de reducir los niveles de lipoproteínas plasmáticas ricas en colesterol (33). Por lo tanto, estos medicamentos pueden interferir con los mecanismos fisiológicos de la absorción de las vitaminas liposolubles, incluidas las vitaminas A y E, reduciendo su disponibilidad (34).
De esa manera, el propio perfil de la enfermedad, sumada a la terapia con medicamentos, puede exacerbar el uso de micronutrientes antioxidantes, que es una razón más para que este grupo con HAR reciba la debida atención sobre el consumo de estos nutrientes, dado que las grasas de las fuentes de alimentos ayudan al organismo a absorber las vitaminas liposolubles (34).
Paralelamente a la evidencia sobre el papel de la vitamina E en el estrés oxidativo, también se debe prestar atención a su acción sinérgica con la vitamina C en la reducción de la PA (35). La vitamina C reacciona con el oxígeno antes de que comience el proceso oxidativo y participa en el sistema de regeneración de la vitamina E, siendo esencial para la preservación de la capacidad antioxidante de esta vitamina en las membranas biológicas (35). Se ha demostrado científicamente que la vitamina C mejora la respuesta vasodilatadora en los pacientes hipertensos, mecanismo que actúa en la pared vascular como administrador de enzimas, aumentando la actividad de la enzima NO-sintasa endotelial (eNOS) y disminuyendo la cantidad de fuentes de ERO, además de inhibir la NADPH-oxidasa, apoyando su efecto antihipertensivo (36).
Dada la importancia de la ingesta dietética de alimentos fuente de vitamina C, la prevalencia de una ingesta deficiente del 46,55 % de la muestra es preocupante, puesto que la vitamina C tiene como característica que es soluble en agua y el uso de diuréticos es parte del tratamiento de la HAR, favoreciendo la pérdida urinaria de este nutriente (37).
Nuestros resultados también mostraron que los individuos con una ingesta inadecuada de vitamina C tenían un PCI y un ICC significativamente más altos en comparación con los individuos con ingesta adecuada. Varios estudios han observado la relación entre la adiposidad central y la baja ingesta de vitamina C, señalando que la vitamina C está involucrada en importantes procesos metabólicos relacionados con la génesis y el control del sobrepeso (38,39). Por esta razón, la ingesta dietética adecuada se vuelve esencial como factor protector contra la obesidad y las enfermedades asociadas (39).
El selenio se ha relacionado con la regulación del sistema de defensa antioxidante pues, una vez incorporado a la selenocisteína, constituye la enzima glutatión-peroxidasa (GPx), una enzima antioxidante que combate la peroxidación lipídica, reduce la agregación plaquetaria, protege las células contra la apoptosis y ayuda a la desintoxicación de los peróxidos producidos por la célula o de fuentes exógenas.
Por lo tanto, la deficiencia de selenio puede favorecer la acumulación de hidroperóxidos, que inhiben la enzima prostaciclina-sintetasa, responsable de la producción de prostaciclinas vasodilatadoras por el endotelio, y estimula la producción de tromboxanos, asociada a la vasoconstricción y la agregación plaquetaria (40). En nuestro estudio, más de la mitad de la población tenía una ingesta de selenio inferior a la recomendada por la DRI (12), y los individuos que tenían esta ingesta insuficiente de selenio tenían niveles de glucemia más altos que los de aquellos que tenían una ingesta adecuada de selenio. Con base en esta evidencia, nuestros hallazgos corroboran el estudio de Beserra y cols. (41), quienes describen los efectos del selenio en la regulación del metabolismo de la glucosa, considerándose un agente mimético de la insulina cuya acción se asemeja a la de la insulina, favoreciendo la entrada de glucosa en los tejidos para que esta pueda convertirse en energía o almacenarse en forma de lípidos. Sin embargo, este estudio también reveló que la ingesta excesiva de selenio puede ser potencialmente dañina para el cuerpo, induciendo efectos adversos como la resistencia a la insulina y la hiperinsulinemia, y no se recomienda su suplementación indiscriminada (41).
Los efectos del zinc sobre el sistema de protección antioxidante se han estudiado ampliamente. Estos efectos consisten en la inhibición de la NADPH-oxidasa, enzima involucrada en la producción de ERO y que actúa como cofactor de la superóxido-dismutasa (SOD), enzima esta que forma parte del sistema antioxidante endógeno (8). El zinc también participa en la actividad de la tirosina-quinasa receptora de insulina, que posteriormente, a través de la estimulación posterior del receptor, parece aumentar la translocación de los transportadores de glucosa desde sus sitios intracelulares hacia la membrana plasmática. Aunque no se encontraron diferencias significativas en cuanto a la glucemia y las otras variables entre los individuos con consumo de zinc adecuado e insuficiente, la prevalencia de la insuficiencia fue alta y merece atención. Varios estudios destacan la importancia de poseer niveles adecuados de zinc en el suero como medio para controlar la glucemia, que es un factor de riesgo cardiovascular adicional y significativo en los pacientes con hipertensión, y que puede aumentar la aparición de DCV (42,43).
Es posible que las concentraciones de zinc varíen con la ingesta, sin reflejar su verdadero estado nutricional, debido a su regulación homeostática. Además, el uso de fármacos hipotensores afecta a la homeostasis del zinc, lo que conduce a una reducción de los niveles séricos de este mineral en los pacientes hipertensos (43).
En nuestro estudio también se observó que el 29,31 % de la muestra tenían una ingesta deficiente de todos los micronutrientes antioxidantes estudiados. Un estudio con 20 pacientes hipertensos y 21 en el grupo de control demostró una reducción de la enzima catalasa (CAT), el glutatión GSH y el MDA, y altos niveles de glutatión-peroxidasa (GPx) y ceruloplasmina (CER) en los pacientes hipertensos en comparación con el grupo de control, lo que sugiere que hay un aumento del estrés oxidativo en estos pacientes (9). Algunos estudios que evaluaron la CAT plasmática inmediatamente después del consumo de alimentos ricos en antioxidantes, encontraron una correlación significativa entre las dos medidas (44-46).
Existe una amplia variedad de sustancias en los alimentos que pueden actuar sinérgicamente para proteger las células y los tejidos, y son capaces de restringir la propagación de reacciones en cadena y de lesiones inducidas por ERO. Con base en las evidencias presentadas aquí sobre el papel de los micronutrientes antioxidantes en la lucha contra el estrés oxidativo y los posibles efectos hipotensores, es necesario reforzar la importancia de una ingesta adecuada de estos nutrientes en esta población con HAR, dado que el difícil control de la PA que presentan estos individuos se asocia a un mayor riesgo de eventos cardiovasculares en comparación con los pacientes hipertensos que alcanzan niveles adecuados de PA (3).
Como conclusión, los pacientes con HAR reflejan un perfil dietético deficiente en relación con los micronutrientes antioxidantes estudiados (vitamina A, vitamina C, vitamina E, selenio y zinc), lo que indica la necesidad de efectuar una planificación dietética adecuada para estos pacientes, considerando que la alta prevalencia de la obesidad, especialmente de la adiposidad visceral, y de las alteraciones del perfil lipídico que se observa en nuestro estudio favorece el estrés oxidativo y, en consecuencia, conduce a un mayor uso de micronutrientes antioxidantes.
Se cree que la educación nutricional es un factor indispensable para la prevención y el control de la HAR, un factor que contribuye a la prevención de las enfermedades asociadas y que mejora la calidad de vida y la respuesta al tratamiento antihipertensivo de estos individuos. Se sugiere que se precisan nuevas investigaciones para evaluar los efectos de la suplementación de micronutrientes antioxidantes para mejorar el pronóstico de estos pacientes.














