INTRODUCCIÓN
La importancia de la nutrición clínica ha aumentado en las últimas décadas. Los pacientes que no pueden recibir sus requerimientos a través de la dieta oral se benefician del uso de suplmentos orales nutricionales (SON). La administración de nutrición enteral se ha relacionado con una mejoría de las variables clínicas, así como con la prevencion de la pérdida de la integridad intestinal (1). Casi todos los nutrientes deben digerirse o descomponerse porque no pueden absorberse en su forma natural; por tanto, nuestro aparato digestivo debe poder convertir los macronutrientes de los alimentos en moléculas simples que posteriormente puedan ser transportadas a través de las membranas celulares del enterocito. Para ello son necesarias la integridad de la mucosa intestinal, la presencia de enzimas digestivas y una adecuada superficie de absorción, permitiendo que los alimentos se descompongan mecánica y enzimáticamente, y se solubilicen en productos finales para el proceso de absorción a través de la mucosa intestinal.
En la práctica clínica habitual existen multitud de situaciones y patologías que pueden interrumpir esta delicada secuencia de reacciones en la digestión y la absorción, pudiendo producir maldigestión o malabsorción, que resulta en la incapacidad de utilizar los nutrientes proporcionados al tracto gastrointestinal, conduciendo a la desnutrición (2-4). Estas entidades que pueden comprometer nuestro tubo digestivo son multiples: enfermedad celíaca, diarrea crónica, fibrosis quística, enfermedad inflamatoria intestinal (p. ej., enfermedad de Crohn y colitis ulcerosa), desnutrición severa, trastornos pancreáticos (por ejemplo, pancreatitis), procesos quirúrgicos del tubo digetsivo, etc. Sin olvidar que una nutrición enteral precoz en un paciente con tubo digestivo comprometido, o la utilización de nutrición parenteral durante un periodo de tiempo, sin utilizar el tubo digestivo, pueden producir también cuadros de malabsorción y maldigestión (3,4).
En este tipo de paciente comprometido se complica la tolerancia de una dieta oral completa, siendo necesario utilizar SON. No obstante, teniendo en cuenta la disfunción del tubo digestivo, estos pacientes a menudo no pueden tolerar la nutrición oral y en ocasiones tampoco los SON que contienen proteínas enteras o triglicéridos de cadena larga (5), y requieren una fórmula que contenga proteína hidrolizada y triglicéridos de cadena media, ya que estas fórmulas minimizan la necesidad de la hidrólisis de proteínas por las peptidasas del borde en cepillo de la luz intestinal (5,6) y se absorben más fácilmente (7).
Si bien se ha demostrado que los SON son clínicamente efectivos en el manejo de enfermedades relacionadas con la desnutrición, es fundamental lograr un buen cumplimiento de su toma para mejorar los resultados (8). Los estudios de intervención con estos SON predigeridos son escasos y resulta complicado realizar ensayos clínicos de intervención debido a problemas éticos en la rama comparadora. Por ello, los estudios en contextos de vida real (EVR) nos pueden proporcionar información adicional. Estos EVR, en medicina, generan evidencia a partir de datos del mundo real, es decir, de datos obtenidos fuera del contexto de los ensayos controlados aleatorios y generados durante la práctica clínica habitual (9). Para evaluar los resultados de los pacientes y garantizar que los pacientes reciban el tratamiento adecuado para ellos, es necesario utilizar datos del mundo real.
El objetivo de nuestro estudio fue evaluar, en un estudio de la vida real, el uso y el cumplimiento de un SON basado en péptidos en pacientes ambulatorios adultos desnutridos con compromiso intestinal tras mas de 14 días de nutrición parenteral.
MATERIAL Y MÉTODOS
SUJETOS
Los datos se recogieron de manera prospectiva y el estudio se realizó en un solo hospital con pacientes ambulatorios. Se incluyeron 44 pacientes desnutridos que requirieron nutrición parenteral total al menos 14 días, sin utilización de la vía oral durante su ingreso hospitalario. Antes de recopilar los datos clínicos y bioquímicos de los pacientes, se comprobaron los criterios de inclusión y se descartó la presencia de criterios de exclusión. Se incluyeron pacientes de ambos sexos de entre 40 y 80 años de edad, que estuvieran desnutridos o en riesgo nutricional, con indicación de nutrición parenteral (NP) como dieta completa durante al menos 14 días, y que aceptaran participar en el estudio y firmar el consentimiento informado. Se excluyeron los pacientes con contraindicación formal de la nutrición oral a partir de la suspensión de la NP, como puede ocurrir por: presencia de patología gastrointestinal severa, úlcera gástrica, diarrea persistente, gastroparesia, vómitos, reflujo gastroesofágico severo, trastorno neurológico o psiquiátrico significativo, o cualquier otra condición psicológica que pueda interferir con el consumo de los productos del estudio; obstrucción del tracto gastrointestinal que impida la ingestión o absorción del producto del estudio; alergia o intolerancia a alguno de los ingredientes de la fórmula, y cualquier otra patología o condición no especificada que el investigador considerara capaz de interferir con la evaluación de la fórmula o que pudiera poner en riesgo innecesario al paciente. El estudio fue aprobado por el Comité de Ensayos Clínicos del HCUV (pi16-495) y los pacientes firmaron un consentimiento informado antes de iniciar el protocolo del estudio.
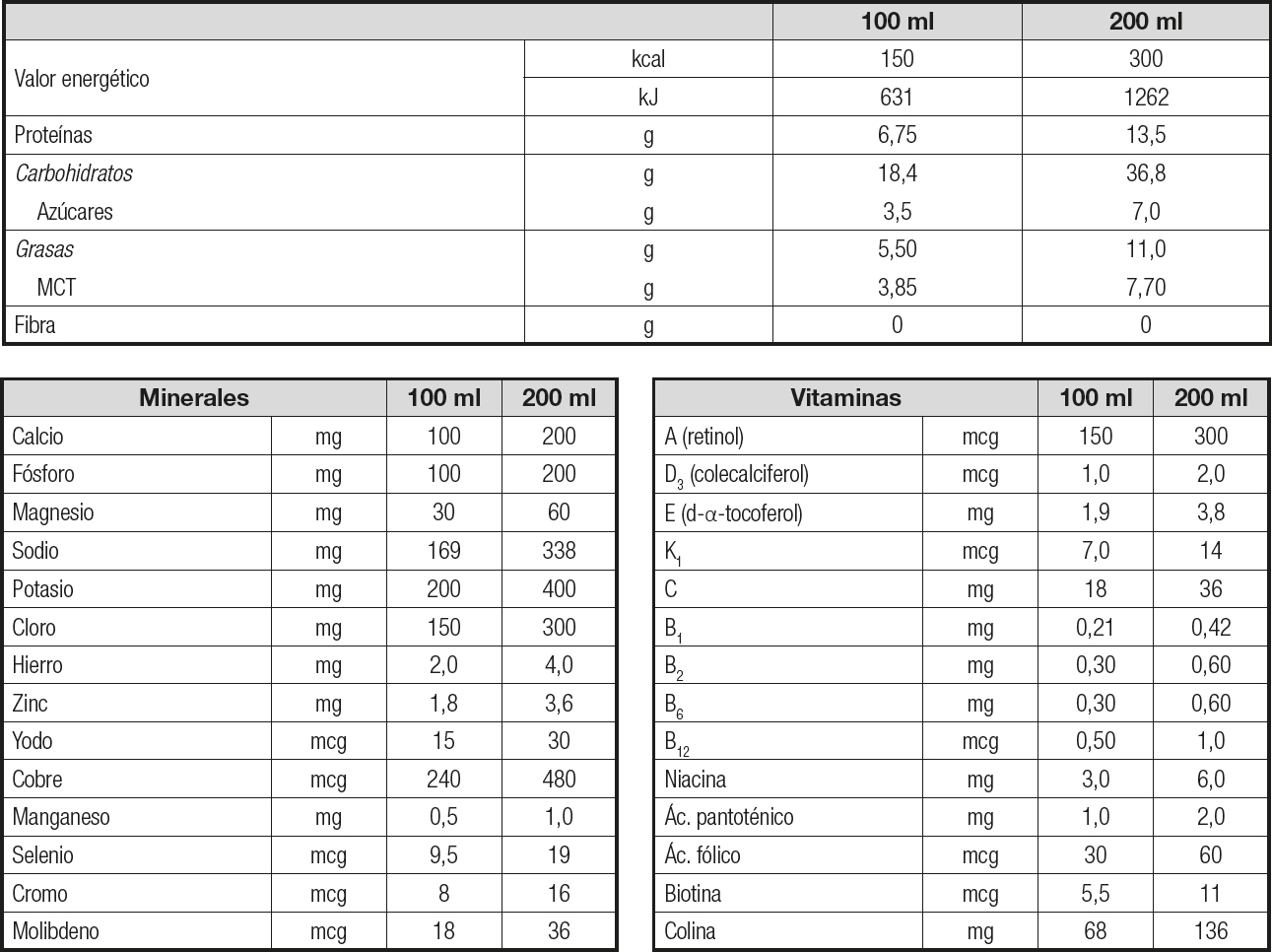
A todos los pacientes se les administró de manera ambulatoria 1 brik al día de Vital 1.5® (Abbott Nutrition, Columbus, Ohio, EE. UU.) (Tabla I) para su consumo durante 12 semanas. Este SON se comercializa en un formato listo para consumir. Las proteínas de este SON, basadas en péptidos, están formadas por un 70 % de proteína de suero hidrolizado y caseína hidrolizada al 30 %. La mezcla de grasas contiene un 70 % de triglicéridos de cadena media (MCT), una fuente de grasa de fácil digestión y buena absorción, y aceite de canola.
Al inicio del tratamiento, y tras el periodo de intervención evaluado, se recogieron las siguientes variables: peso, talla, índice de masa corporal (IMC), test de valoración subjetiva global (Fig. 1), bioquímica nutricional, encuesta nutricional de 3 días, efectos adversos generados por la fórmula y cumplimentación.
ANTROPOMETRIA Y VALORACIÓN NUTRICIONAL
A todos los pacientes se les pesó, talló (Modelo Omron®, LA, CA. EUA) y calculó el índice de masa corporal (IMC) con la siguiente fórmula: peso en kg / talla en m2. También se recogió el peso habitual y se administró el test de valoración nutricional subjetiva (VSG), clasificándose a los pacientes en: categoría A (buena situación nutricional), categoría B (riesgo nutricional o desnutrición moderada) y categoría C (desnutrición grave).
VALORACIÓN BIOQUÍMICA
En el momento basal y tras 12 semanas de intervención nutricional se extrajeron muestras de sangre en ayunas para determinar la glucosa, el sodio, el potasio, la creatinina, la albúmina, la prealbúmina y la transferrina (Hitachi, ATM, Manheim, Alemania).
INTERVENCIÓN NUTRICIONAL E INGESTA NUTRICIONAL
En el momento basal se indicó a los pacientes que consumieran dos envases al día del SON (Tabla I). Una dietista instruyó a los pacientes sobre cómo registrar la ingesta de alimentos y suplemento. Los diarios de ingesta dietética de tres días, completados al inicio del estudio y a la semana 12, se utilizaron para evaluar la ingesta del paciente. Se evaluaron dos días de la semana y un día de fin de semana para tener en cuenta los posibles efectos del día de la semana en la ingesta dietética. La ingesta media total de energía y macronutrientes se calculó utilizando el programa DietSource 3.0 (Nestle®, Suiza) con tablas de composición de alimentos nacionales (10). La ingesta dietética total se calculó sumando el consumo de suplementos orales a la ingesta espontánea de alimentos, solicitándose el registro del número de botes de suplementos o de partes de los mismos. El número de botes de SON se recogieron a diario por parte del paciente para evaluar la cumplimentación.
Durante el estudio, los eventos adversos (EA) se capturaron a través de un registro diario. También se registraron los problemas gastrointestinales relacionados con el consumo del SON (diarrea, náuseas y vómitos) de manera dicotómica.
ANÁLISIS ESTADÍSTICO
Se realizó un cálculo del tamaño muestral teniendo en cuenta una mejoría del peso de 1 kg, obteniéndose un tamaño muestral de n = 40, con un error de tipo I < 0,05 y una potencia estadística del 80 %. Las pruebas estadísticas fueron de dos colas y se realizaron al nivel de significación de 0,05. Las variables cuantitativas con distribución normal se analizaron con la prueba de la t de Student de dos colas emparejadas o no emparejadas. Las variables no paramétricas se analizaron con la prueba de Wilcoxon. El paquete estadístico utilizado fue el SPSS 23.0 (IBM, IL, EE. UU.).
RESULTADOS
En total se incluyeron 44 pacientes. La edad media era de 70,4 ± 10,4 años (20 mujeres y 24 hombres). Las patologías que indicaron la nutrición parenteral fueron: cirugía oncológica de tumores del tubo digestivo superior, 10 pacientes (22,7 %); cirugía de tumores del tubo digestivo inferior, 24 pacientes (54,5 %); patología no oncologica, 22,7 %.
La tabla II muestra la evolución de las variables antropométricas y bioquímicas tras la intervención nutricional. Con respecto a las variables antropométricas, aumentaron el IMC (0,51 ± 0,1 kg/m2; p = 0,02) y el peso (1,4 ± 0,3 kg; p = 0,03). Con respecto a las variables bioquímicas, aumentaron los niveles séricos de prealbúmina (3,5 ± 4,1 mg/dl; p = 0,01), albúmina (1,3 ± 0,1 mg/dl; p = 0,03) y transferrina (71,5 ± 24,1 mg/dl; p = 0,02), manteniéndose sin modificaicones el resto de los parámetros analizados.
En la tabla III se muestra la modificación de la ingesta tras la intervención nutricional en un registro de alimentos de 3 días. Esta valoración de la ingesta mostró un aumento significativo de la ingesta de calorías (590,1 ± 39,1 cal/día; p = 0,01), de la ingesta de hidratos de carbono (49,5 ± 11,1 g/día; p = 0,02), de la ingesta de proteínas (32,5 ± 8,1 g/día; p = 0,01) y de la ingesta de grasas (28,9 ± 7,1 g/día; p = 0,01). No existieron modificaciones en el porcentaje de calorías que representaba cada macronutriente en el aporte calórico total tras las 12 semanas de intervención. La toma del SON representó, a las 12 semanas, un 14,4 % del aporte calórico total de la dieta, un 17,5 % de los hidratos de carbono, un 12,9 % de las proteínas y un 12,3 % de las grasas.
Con respecto al cumplimiento de la toma del SON, el 100 % de los pacientes finalizaron el protocolo tomando el suplemento de manera diaria. Un 95,5 % (n = 42) tomó un suplemento al día y un 4,5 % (n = 2) tomó dos suplementos al día. La cumplimentación media del grupo fue de un 87,7 ± 7,2 % de las tomas prescritas para esas 12 semanas (84 envases).
En relacion a la situación nutricional, a la entrada del estudio, un 52,3 % (n = 23) de los pacientes presentaban en el test VSG la categoría B (malnutrición moderada o riesgo nutricional) y un 47,7 % (n = 21) la categoría C (desnutrición severa). Tras la intervención, un 75 % de los pacientes presentaban la categoría A (buena situación nutricional (n = 33), un 13,6 % (n = 6) de los pacientes presentaban en el test VSG la categoría B (malnutrición moderada o riesgo nutricional) y un 11,4 % (n = 5) la categoría C (desnutrición severa). De los 21 pacientes que habían presentado inicialmente una categoría C, solo permanecían al final del estudio en esa categoría 4 (19,05 %), y de los 23 pacientes que al inicio del estudio estaban en la categoría B, solo 5 (21,7 %) presentaban esa categoría al final del estudio.
La tolerancia gastrointestinal (diarrea, náuseas y vómitos) con esta fórmula fue buena. Solo 1 paciente (2,3 %) presentó durante el tratamiento náuseas y vómitos. Y ningún paciente presentó diarrea. No hubo abandonos por intolerancia.
DISCUSIÓN
Nuestro trabajo muestra cómo la suplementacion ambulatoria con un SON peptídico durante 12 semanas en pacientes que han recibido durante un ingreso nutrición parenteral produce ganancia de peso, aumento de las proteínas viscerales y mejoría del estado nutricional.
Los SON a base de péptidos contienen proteínas hidrolizadas o predigeridas en péptidos de diferentes longitudes, que incluyen dipéptidos y tripéptidos, y aminoácidos (5). La presencia de estas proteínas hidrolizadas en péptidos ayuda a mejorar la absorción y la tolerancia en comparación con los suplementos de proteínas intactas (11,12). Son muchos los factores que influyen en el cumplimiento de los SON por parte de los pacientes ambulatorios: por ejemplo, la palatabilidad del producto, el volumen, la densidad energética y el asesoramiento nutricional (13-17), sin olvidar el perfil de macronutrientes, siendo todos ellos factores clave que influyen en el cumplimiento de los SON. Por otra parte, cabe destacar que, habitualmente, los pacientes que reciben un SON peptídico presentan una adhesión baja (18). En algún trabajo se ha mostrado cómo más de un 15 % de los pacientes aleatorizados que reciben SON con fórmulas a base de péptidos suspenden la fórmula por su mala palatabilidad (19). Sin embargo, los resultados de nuestro estudio mostraron un buen cumplimiento de los participantes con la toma del producto (1 envase al día; 200 ml), realizando los pacientes más de un 87 % de las tomas durante las 12 semanas del estudio a nivel ambulatorio en la práctica clínica real. Esto sugiere que, aunque los pacientes presentaban una potencial situación clínica de mala digestión/malabsorción tras el ingreso hospitalario y la nutrición parenteral, finalmente fueron capaces de consumir con éxito el SON peptídico con una baja tasa de efectos grastrointestinales. Podemos hipotetizar con nuestros resultados y otros existentes en la literatura (5) que en estos pacientes los suplementos peptídicos con triglicéridos de cadena corta se toleran mejor que las fórmulas convencionales poliméricas y con triglicéridos de cadena larga (5). Además, los estudios han demostrado que las fórmulas a base de péptidos en ocasiones son más eficaces y se toleran mejor que las fórmulas de proteína entera en los pacientes severamente desnutridos (5,11). En nuestro estudio, los participantes, junto a la mejoría de los parámetros antropométricos y analíticos, presentaron un aumento de la ingesta total de energía, proteínas, carbohidratos y grasas. Estos datos demuestran que el suplemento nutricional oral utilizado en el estudio realmente complementaba la dieta. Las diferentes patologías, así como sus tratamientos, a veces pueden reducir la ingesta de alimentos. En los pacientes con desnutrición relacionada con la enfermedad y con una ingesta dietética inadecuada debido a falta de apetito, los SON ayudan a aumentarla (20). Una revisión sistemática y un metaanálisis de un amplio grupo de pacientes y entornos demostraron el beneficio clínico y económico de los SON (21). Se ha demostrado que los SON no suprimen la ingesta de alimentos y generalmente mejoran la ingesta nutricional en la mayoría de los grupos de pacientes; esto sin duda contribuye a los efectos beneficiosos que producen en los pacientes desnutridos (21), como ha sucedido en nuestro trabajo. Además, los SON ricos en proteínas y con nutrientes predigeridos tienen muy poco efecto sobre la cantidad de alimento consumido diariamente y, como con otros SON, no sustituyen una comida sino que se suman a la cantidad de nutrición consumida diariamente (20,22). Los resultados de estos estudios son similares a los que observamos en nuestro trabajo e indican que, cuando se consumen SON entre comidas, estos no afectan a la ingesta de nutrientes a partir de los alimentos (16,17,22,23). Por otra parte, utilizar SON peptídicos permite tener una fuente de nutrientes de fácil digestión y aumenta la digestibilidad, lo que facilita la absorción de nutrientes, protege la integridad de la mucosa y muestra un efecto antigénico bajo (24), habiéndose mostrado útiles incluso en modelos de malabsorción servera como son los pacientes oncológicos en tratamiento activo con quimioterapia y diarrea secundaria (25), desarrollándose un protcolo específico para esta situación (26).
Probablemente, uno de los principales factores que explican la efectividad encontrada en nuestro trabajo sobre la situación nutricional podría ser el cumplimiento con el tratamiento, que permite el óptimo efecto de este soporte nutricional. Por otra parte, el cumplimiento de la toma del SON, a su vez, es probable que esté influenciado por la mejora del estado de salud (nutricional, peso corporal), lo que estimula aun más a los pacientes a seguir cumpliendo. El mejor estado nutricional también es probable que se relacione con la mayor digestibilidad de la formulación a base de péptidos, que tiene el potencial de mantener la integridad de la mucosa gastrointestinal y facilitar la absorción de nutrientes (27,28).
Algunas limitaciones de nuestro estudio son el escaso tiempo de la intervención (12 semanas), la heterogeneidad de las patologías que indicaron la nutrición parenteral y la subjetividad a la hora de valorar la ingesta nutricional a través de encuestas de 3 días, así como la ausencia de un grupo comparador. No obstante, este estudio en condiciones de vida real nos muestra la efectividad de este suplemento peptídico, su buena tolerancia y su alta cumplimentación por parte de estos pacientes. Ello hace que sus datos sean fácilmente extrapolables a la práctica clínica habitual de nuestras consultas.
En resumen, la utilización de un suplemento peptídico con triglicéridos de cadena corta en pacientes ambulatorios tras haber recibido nutrición parenteral total durante el ingreso hospitalario muestra un efecto beneficioso sobre los parámetros bioquímicos y antropométricos, y mejora la situación nutricional de los pacientes, con una tasa alta de cumplimiento y buena tolerancia.