INTRODUCCIÓN
Es bien conocido que la nutrición tiene un papel pronóstico y terapéutico clave en el manejo de los pacientes con enfermedad hepática. Por lo tanto, la ESPEN ha producido guías científicas sobre este tema desde 1997. Para mejorar la implementación y difusión de estas guías en la práctica clínica, se ha creado una versión abreviada basada en la guía ESPEN más reciente sobre nutrición clínica en las enfermedades hepáticas (1). Además de acortar los comentarios, hemos agrupado las recomendaciones de manera diferente según las cinco principales enfermedades hepáticas con fuerte relación con la nutrición, incluidas la insuficiencia hepática aguda grave (IHAG), la esteatohepatitis alcohólica y no alcohólica (EHA y EHNA), la cirrosis hepática, el trasplante hepático (TxH) y otras cirugías. Además, el texto está complementado con diagramas de flujo que apoyan las decisiones sobre la terapia Nutricional y permite versiones en línea de la guía, como una aplicación y una versión web (Fig. 1). Esta guía tiene como objetivo abordar cuestiones clínicamente relevantes para el manejo Nutricional y metabólico de los pacientes adultos con enfermedad hepática. Los usuarios de la guía son todos aquellos proveedores de atención médica involucrados en el cuidado de pacientes con enfermedad hepática, como médicos especialistas involucrados en el manejo de enfermedades hepáticas, médicos de familia, farmacéuticos, enfermeras, dietistas y Nutriciónistas, así como líderes médicos y administradores de unidades hepáticas.
METODOLOGÍA
La presente guía práctica consta de 85 recomendaciones y 17 declaraciones, todas basadas en la actual Guía ESPEN sobre nutrición clínica en las enfermedades hepáticas, la versión práctica (2) y la versión científica (1). La guía original se ha acortado al restringir los comentarios a la evidencia recopilada y la literatura en que se basan las recomendaciones. Las recomendaciones no se han modificado pero tanto las recomendaciones como las declaraciones se han reordenado y agrupado por entidades patológicas. Lo más importante es que la presentación del contenido se ha transformado en una presentación gráfica basada en diagramas de flujo para la toma de decisiones siempre que ha sido posible. La guía original se ha desarrollado de acuerdo con el procedimiento operativo estándar (SOP, por sus siglas en inglés) para las guías ESPEN (3). Este SOP está basado en la metodología de la Scottish Intercollegiate Guidelines Network (SIGN). Se han realizado búsquedas en la literatura y se han clasificado del 1 al 4 de acuerdo con la evidencia; asimismo, las recomendaciones se han creado y clasificado en cuatro clases (A / B / 0 / GPP). Todas las recomendaciones no solo se basan en la evidencia sino que también se han sometido a un proceso de consenso, representado en un porcentaje de acuerdo (%). Siempre que ha sido posible, han participado representantes de diferentes profesiones (médicos, dietistas, enfermeras u otros profesionales) así como representantes de los pacientes. El proceso de la guía ha sido financiado exclusivamente por la ESPEN. La abreviación y difusión de la guía ha sido financiada en parte por la UEG (United European Gastroenterology) y también por la ESPEN. Para obtener más detalles sobre la metodología, consulte la versión completa de la guía ESPEN (1) y el SOP de la ESPEN (3).
1. RECOMENDACIONES GENERALES
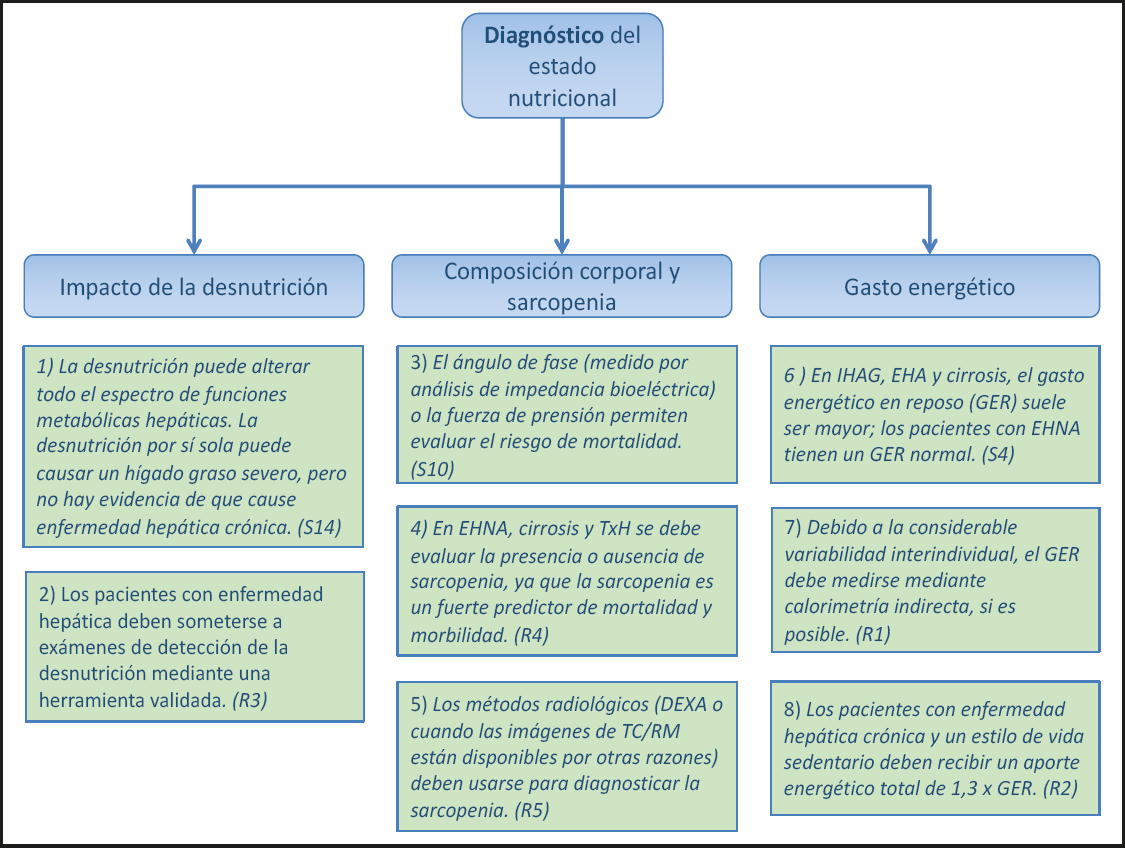
1.1. DIAGNÓSTICO DEL ESTADO Nutricional (Fig. 2)
1.1.1. Impacto de la nutrición
1) La desnutrición puede alterar todo el espectro de las funciones metabólicas hepáticas. La desnutrición puede por sí sola causar un hígado graso grave, pero no se conoce que cause enfermedad hepática crónica. (Declaración 14, consenso fuerte, 100 % de acuerdo.)
Comentario
La desnutrición severa en los niños puede causar un hígado graso que, en general, es completamente reversible con la realimentación. En los niños con kwashiorkor parece haber una mala adaptación asociada a una degradación menos eficiente de las grasas y la oxidación de los ácidos grasos en comparación con los niños con marasmo. No se ha podido observar ningún deterioro de la eliminación de ácidos grasos en el hígado.
2) Los pacientes con enfermedad hepática deben someterse a pruebas de cribado de desnutrición mediante una herramienta validada. (Recomendación 3, Grado B, consenso fuerte, 93 % de acuerdo.)
Comentario
NRS-2002 y MUST son herramientas validadas para detectar el riesgo de desnutrición en pacientes hospitalizados (4,5) y están recomendadas por la ESPEN. La herramienta de Priorización Nutricional del Royal Free Hospital se ha desarrollado como instrumento de cribado de la desnutrición en pacientes con enfermedades hepáticas. En una comparación directa, la herramienta de Priorización Nutricional del Royal Free Hospital fue más sensible que la NRS-2002 para identificar a los pacientes hepáticos en riesgo de desnutrición (6). La NRS-2002 se consideró útil para identificar a los pacientes cirróticos desnutridos con carcinoma hepatocelular (7). Según una revisión reciente, ninguna de las herramientas de detección disponibles se ha validado rigurosamente en pacientes con cirrosis, lo que deja la herramienta de Priorización Nutricional del Royal Free Hospital como la mejor opción disponible actualmente (8).
1.1.2. Composición corporal y sarcopenia
3) El ángulo de fase (medido por análisis de impedancia bioeléctrica) o la fuerza de prensión permiten evaluar el riesgo de mortalidad. (Declaración 10, consenso fuerte, 93 % de acuerdo.)
Comentario
La fuerza de prensión es un buen predictor de la tasa de complicaciones durante el año siguiente a la realización de la prueba (9). La fuerza de prensión parece ser una herramienta valiosa para medir la eficacia de la intervención Nutricional (10). Las lecturas de reactancia y resistencia de BIA se pueden usar para calcular el ángulo de fase o la masa celular corporal como una medida de la masa y la función celulares para la evaluación Nutricional. En los casos de cirrosis hepática, un ángulo de fase bajo se asocia a una mayor mortalidad, así como en muchas otras enfermedades (11).
4) En la esteatohepatitis no alcohólica (EHNA), la cirrosis y el TxH se debe evaluar la presencia o ausencia de sarcopenia, ya que la sarcopenia es un predictor fuerte de mortalidad y morbilidad. (Recomendación 4, Grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
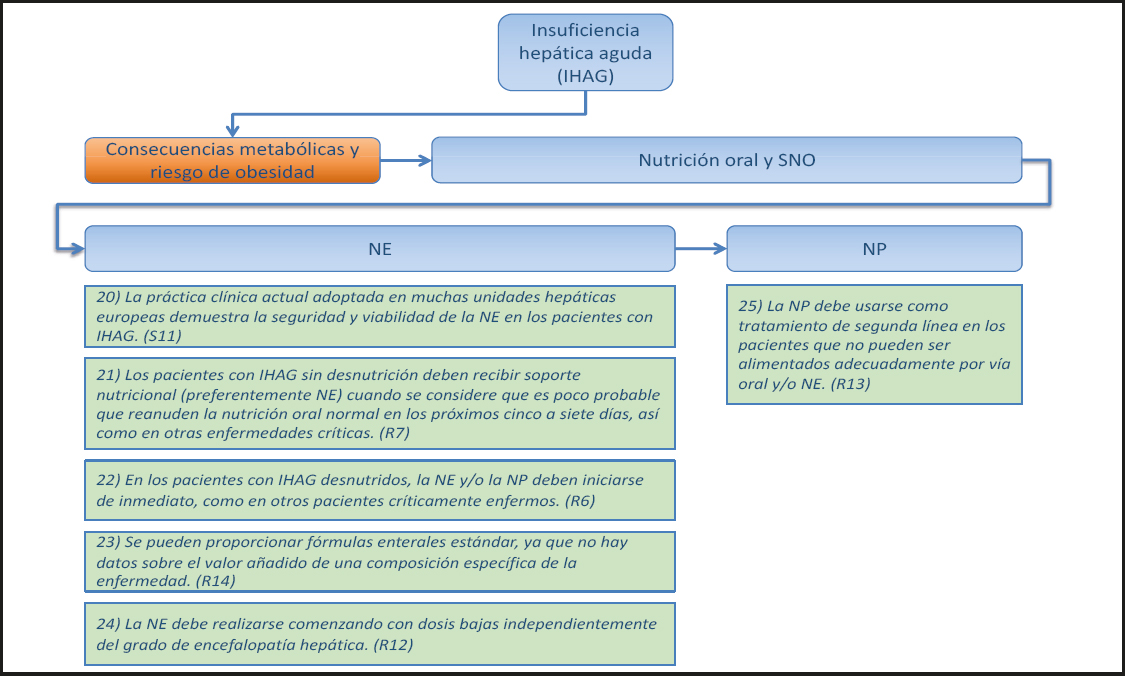
En los pacientes con cirrosis en lista de espera para trasplante, una función muscular deteriorada - evaluada con el test de la marcha de 6 minutos, la fuerza de prensión y la batería corta de rendimiento físico - pero sin pérdida de masa muscular - evaluada con el índice muscular esquelético medido con tomografía computarizada (TC) - , se ha asociado a un aumento de la mortalidad (12). En los pacientes con cirrosis se ha demostrado que la fragilidad expresada como una disminución funcional de la fuerza de prensión, la velocidad de la marcha, la prueba de levantarse y sentarse en la silla o la batería corta de rendimiento físico se asocian a un mayor riesgo de complicaciones que requieren hospitalización (13), de muerte en la lista de espera o de exclusión de la lista (14,15).
5) Los métodos radiológicos (absorciometría de rayos X de energía dual (DXA, por sus siglas en inglés) o las imágenes de TC o tomografía por resonancia magnética (RM) disponibles por otras razones) deben usarse para diagnosticar la sarcopenia. (Recomendación 5, Grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
La sarcopenia es la característica clave de la desnutrición en los pacientes con cirrosis y puede evaluarse mediante métodos radiológicos (DXA, TC) para detectar la pérdida de masa muscular, o mediante pruebas de función muscular como la prueba de esfuerzo o la distancia caminada en 6 minutos. La sarcopenia se puede diagnosticar cuando hay pérdida de masa o de función musculares. En las imágenes de TC a nivel de la vértebra lumbar 3 (16) o la vértebra lumbar 4 (17) se puede medir y normalizar el área de músculo esquelético en función de la estatura. Se ha demostrado que el área del músculo esquelético en L3 se correlaciona linealmente con la masa muscular del cuerpo entero (18). La pérdida de masa de músculo esquelético en la TC se ha asociado a un aumento de la mortalidad en los pacientes con cirrosis (16,17,19), los pacientes cirróticos con obesidad (20), los pacientes con cirrosis en lista de espera para trasplante (21) y los receptores de trasplante hepático ortotópico (22-24).
1.1.3. Gasto energético
6) En la insuficiencia hepática aguda grave (IHAG), la esteatohepatitis alcohólica (EHA) y la cirrosis, el gasto energético en reposo (GER) suele aumentar; los pacientes con enfermedad hepática grasa no alcohólica (EHGNA) presentan un GER normal. (Declaración 4, consenso, 90 % de acuerdo.)
Comentario
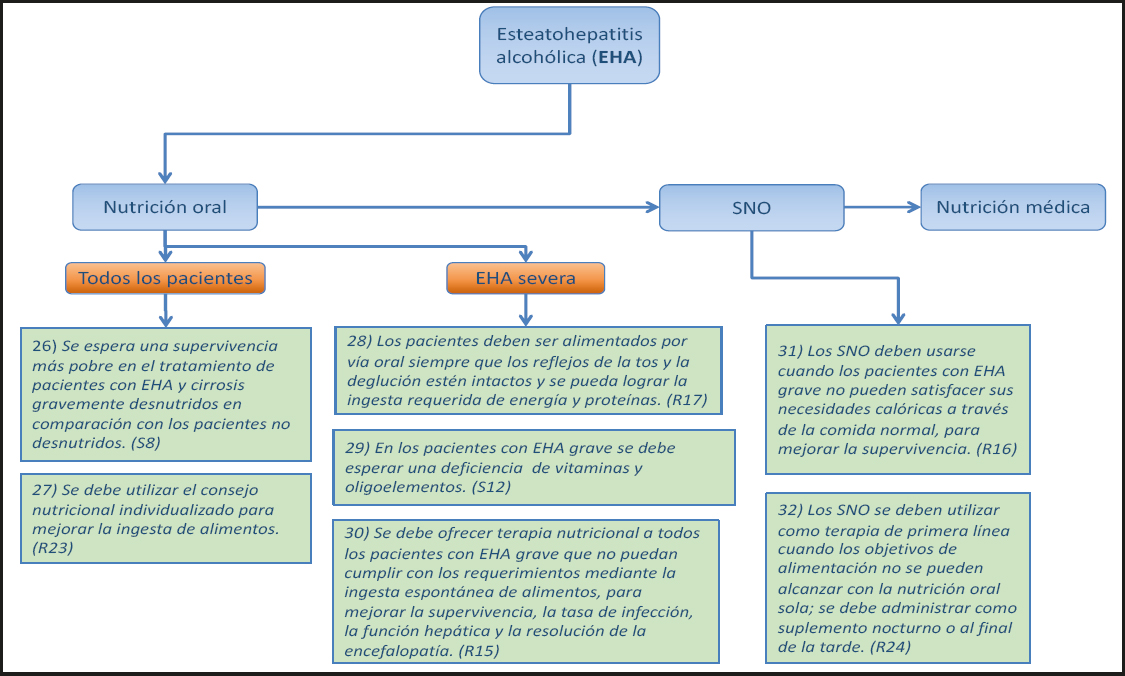
Los estudios en pacientes con IHAG que usaron la calorimetría indirecta muestran un aumento del GER de un 18 % o 30 %, respectivamente, en comparación con los controles sanos (25,26). Por tanto, en términos del GER, los pacientes con IHAG no son diferentes de los pacientes críticamente enfermos con otras etiologías. En los pacientes con EHA, la relación entre el GER medido y el estimado no ha sido diferente de la de los individuos sanos o los pacientes con cirrosis hepática. Sin embargo, cuando se relaciona con su masa muscular reducida, el GER de los pacientes con EHA es claramente más alto que el de los controles sanos. En los alcohólicos sin evidencia bioquímica de enfermedad hepática, pero no en los pacientes con cirrosis alcohólica, se observa un aumento del GER (25,8 vs. 20,8 kcal·kg-1·d-1) (27). Asimismo, en los alcohólicos con hígado graso, EHA o cirrosis, el consumo excesivo de alcohol se asocia a un aumento del GER (26 %). En la EHGNA o la EHNA es difícil trazar una imagen clara porque las poblaciones de pacientes estudiadas varían según la presencia o ausencia de sobrepeso u obesidad, inflamación crónica o síndrome metabólico.
7) Debido a la gran variabilidad interindividual, el GER debe medirse mediante calorimetría indirecta, si está disponible. (Recomendación 1, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Siempre que esté disponible, se debe utilizar la calorimetría indirecta para medir el GER ya que, en un paciente individual, el GER medido puede diferir considerablemente de los valores estimados (28). El GER medido es más alto que el estimado en hasta el 35 % de los pacientes cirróticos (hipermetabolismo) y se sitúa por debajo del valor estimado en el 18 % de los pacientes (29,30). En la cirrosis hepática, el hipermetabolismo se asocia con una reducción de la supervivencia libre de eventos y con un resultado desfavorable después del trasplante (29,31), y parece corregirse con la mejora de la composición corporal (32). Como alternativa menos costosa, válida y rápida, se ha propuesto la calorimetría portátil (33). Los calorímetros portátiles, que solo miden el consumo de oxígeno y calculan el gasto energético suponiendo un cociente respiratorio de 0,85, son más precisos que las ecuaciones predictivas para determinar el GER.
8) Los pacientes con enfermedad hepática crónica y estilo de vida sedentario deben recibir un aporte energético total de 1,3 · GER. (Recomendación 2, Grado B, consenso, 81 % de acuerdo.)
Comentario
Las estimaciones del gasto energético total (32 kcal·kg-1·d-1) indican que el requerimiento energético a lo largo de 24 horas de los pacientes con cirrosis asciende a, aproximadamente, 1,3 · GER medido (24 kcal·kg-1·d-1) (34,35). La termogénesis inducida por la dieta y el gasto energético de la actividad física definida en los pacientes con cirrosis estable no muestran diferencias con los valores obtenidos en individuos sanos. Sin embargo, el nivel de actividad física espontánea es considerablemente más bajo en los pacientes con cirrosis. Es probable que el aumento de las necesidades energéticas en una enfermedad avanzada se equilibre con la disminución de la actividad física, que refleja la mala condición física. En los cirróticos sin ascitis se debe utilizar el peso corporal real para calcular la tasa metabólica basal. En los pacientes con ascitis se debe utilizar el peso ideal según la altura corporal, a pesar del informe de un conjunto de diez pacientes con cirrosis - de los que solo cuatro se evaluaron por completo (36) - en el que se sugirió que no se debe omitir la masa de ascitis al calcular el gasto energético. Los pacientes con trasplante de hígado tienen, en promedio, necesidades energéticas similares a las de la mayoría de los pacientes sometidos a cirugía abdominal mayor (37).
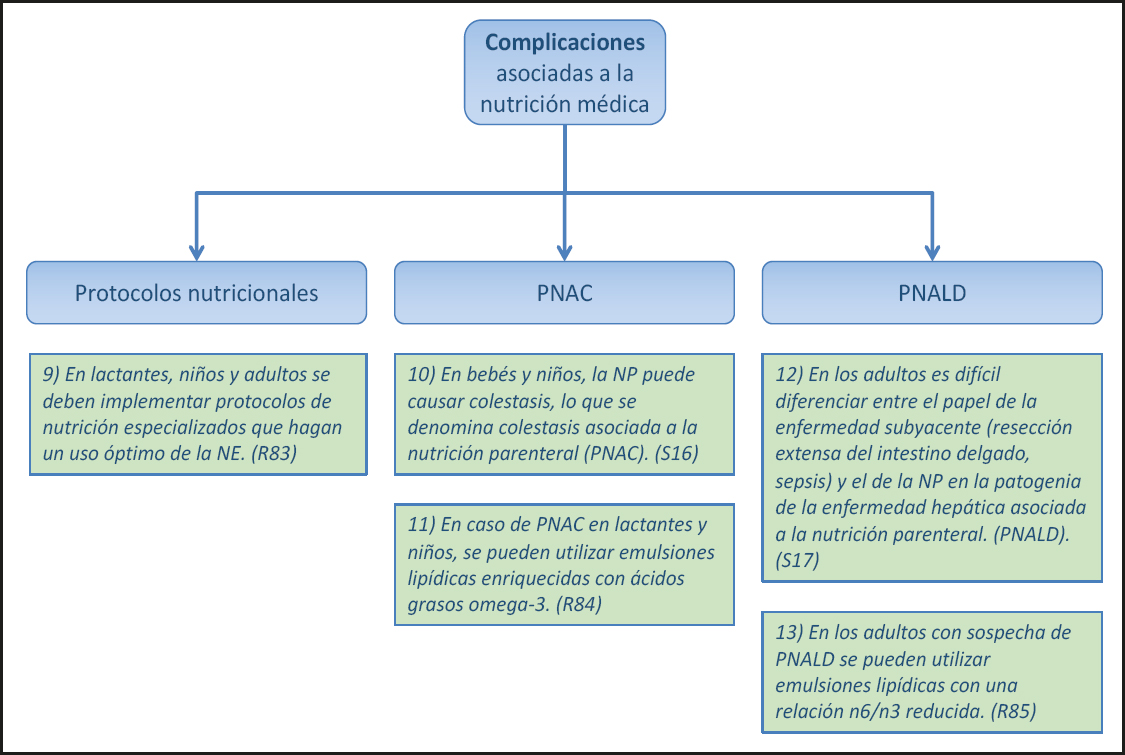
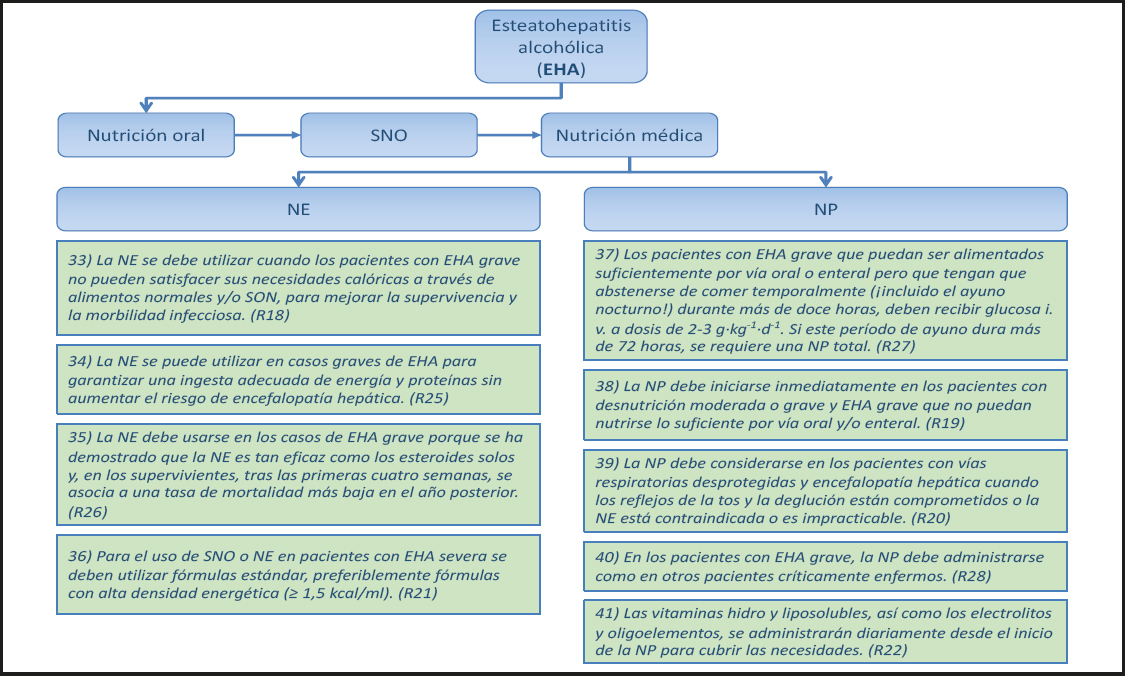
1.2. COMPLICACIONES ASOCIADAS A LA NUTRICIÓN MÉDICA (Fig. 3)
1.2.1. Protocolos Nutricionales
9) En bebés, niños y adultos se deben implementar protocolos de nutrición especializados que hagan un uso óptimo de la NE. (Recomendación 83, Grado B, consenso fuerte, 92 % de acuerdo.)
Comentario
En lactantes y recién nacidos, varios trabajos sugieren que la institución de protocolos de nutrición especializados es beneficiosa para lograr la rehabilitación intestinal. Dichos protocolos tienen como objetivo limitar la infusión de lípidos a base de soja y maximizar la estimulación oral y enteral, así como la administración de la nutrición parenteral (NP) cíclica. Un estudio retrospectivo mostró que la implementación de las pautas de alimentación dio como resultado una disminución de los tiempos sin nutrición, una duración más corta del soporte con NP y una cantidad significativamente menor de lactantes que desarrollaron enfermedad hepática asociada a la NP (PNALD) después de la implementación de las guías (38). En un análisis multivariante, los episodios sépticos (odds ratio: 3,23), los días de lípidos > 2,5 g·kg-1·d-1 (odds ratio: 1,04) y los 60 días con lípidos máximos (odds ratio: 10) fueron elementos clave para el desarrollo de la colestasis asociada a la NP (PNAC) (39).
1.2.2. Colestasis asociada a la NP (PNAC)
10) En bebés y niños, la nutrición parenteral (NP) puede causar colestasis, por lo que se denomina colestasis asociada a la NP (PNAC). (Declaración 16, consenso fuerte, 92 % de acuerdo.)
Comentario
Debido a las diferentes características de la PNAC en recién nacidos y lactantes y la enfermedad hepática asociada a NP (PNALD) en adultos, la PNAC se aborda como una excepción en estas guías sobre nutrición de pacientes hepáticos adultos. El efecto beneficioso de los protocolos de nutrición especializados, los cuales limitan la cantidad de lípidos infundidos en los recién nacidos y lactantes, así como en los adultos, apunta al papel patogénico de la NP en el desarrollo de la colestasis (véanse también los puntos 11-13). Un segundo factor independiente que causa daño hepático es la extensión de la pérdida de masa intestinal, tal y como se muestra en el artículo original de Stanko y colaboradores, que muestra una asociación entre la lesión hepática y la extensión de la resección intestinal, pero no con la NP (40). Por lo tanto, la enfermedad hepática asociada a insuficiencia intestinal (IFALD, por sus siglas en inglés) y la PNALD son difíciles de separar en el paciente individual y ocurren en hasta el 60 % de los lactantes y el 85 % de los recién nacidos que requieren NP a largo plazo por insuficiencia intestinal (41,42). Mientras que los adultos tienen más probabilidades de desarrollar esteatosis únicamente, los lactantes y los recién nacidos son más susceptibles a la lesión hepatocelular o la colestasis, probablemente debido a la inmadurez del metabolismo y transporte de la bilis. Esto se refleja en el término PNAC, que se utiliza con frecuencia en la literatura pediátrica (43), mientras que el término PNALD se utiliza para pacientes tanto adultos como pediátricos. En los lactantes y recién nacidos, la mortalidad es alta, de hasta el 40 %, y la PNAC se ha convertido en una indicación importante de TxH pediátrico (43). En los adultos, la incidencia de la IFALD/PNALD avanzada varía del 0% al 50 % y la mortalidad varía del 0 % al 22 % (42). La IFALD/PNALD progresiva es una indicación aceptada para el trasplante de intestino delgado en el momento oportuno para salvar la vida (44).
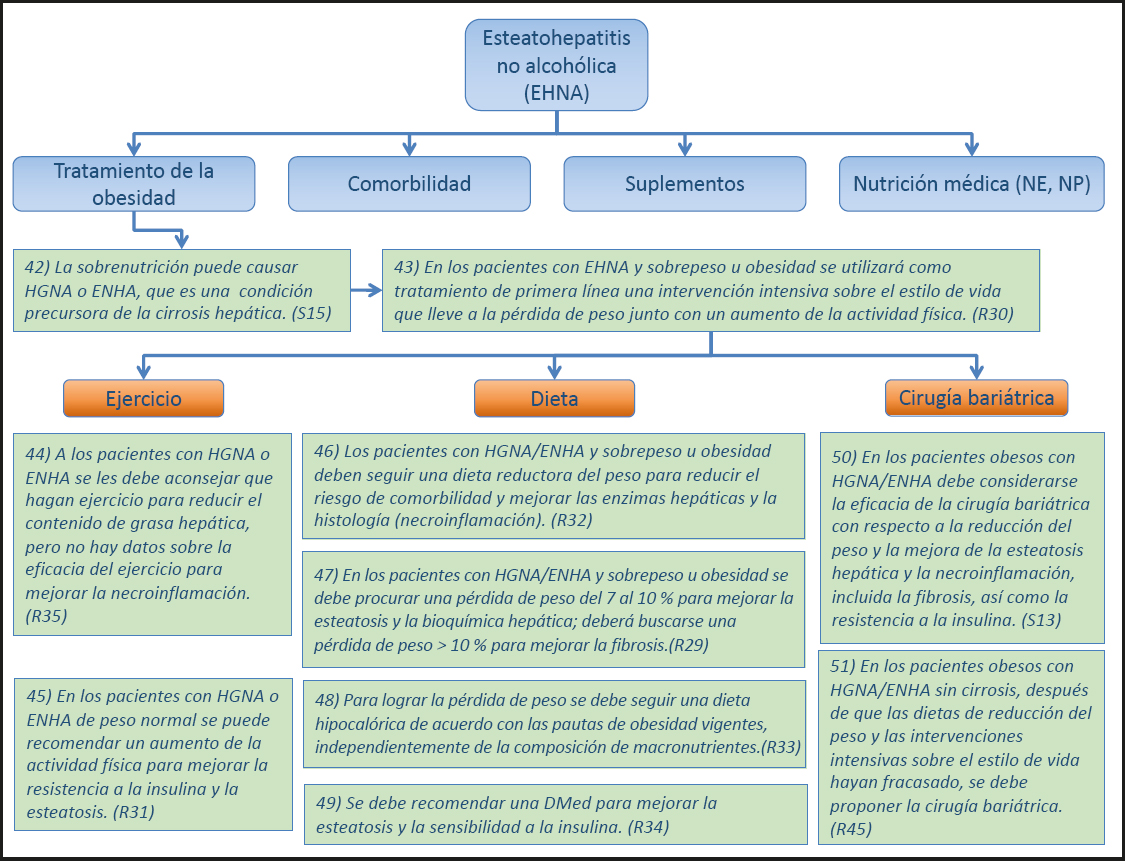
11) En el caso de la PNAC en lactantes y niños, se pueden utilizar emulsiones lipídicas enriquecidas con ácidos grasos omega-3. (Recomendación 84, Grado 0, consenso fuerte, 100 % de acuerdo.)
Comentario
Se ha propuesto que las emulsiones lipídicas que contienen aceite de pescado como fuente de triglicéridos pueden ser protectoras en la PNAC/PNALD. Esto se ha evaluado en una serie de publicaciones en las que se infundió una emulsión de aceite de pescado al 100 %, a una velocidad limitada y a dosis 1,0 g·kg-1·d-1, mientras que la emulsión de soja se administró a dosis de hasta 4,0 g·kg-1·d-1 y, por lo tanto, no se puede excluir que la cantidad de lípidos infundidos, en lugar de su composición, determinara el mejor resultado observado (45,46). En un análisis retrospectivo de 51 pacientes pediátricos con PNALD y cirrosis, el uso de una emulsión lipídica basada en aceite de pescado se acompañó de una resolución de la colestasis en el 76 % (47). En un ensayo controlado aleatorio que comparó una emulsión de aceite de pescado al 100 % con una emulsión de lípidos de soja, ambas a una dosis de 1,0 g·kg-1·d-1, se finalizó tempranamente el ensayo debido a una incidencia inesperadamente baja de PNAC (48). Ningún paciente desarrolló deficiencia de ácidos grasos y ambos regímenes se toleraron bien y fueron seguros.
En un enfoque diferente, la reducción de lípidos a base de soja se ha logrado mediante la adición de una emulsión de aceite de pescado (49), o el uso de emulsiones de lípidos que consisten en una mezcla de lípidos a base de soja y triglicéridos de cadena media (TCM) (50), o una mezcla de una emulsión de aceite de pescado y una emulsión de aceite de oliva y soja (51), o lípidos a base de soja y aceite de oliva, y TCM y aceite de pescado (50). En ensayos controlados aleatorizados que compararon una emulsión SMOF (lípidos derivados de la soja, aceite de oliva, TCM y aceite de pescado) con una emulsión a base de soja, la emulsión SMOF que contiene aceite de pescado resultó ser segura y más eficaz para reducir los niveles de bilirrubina y el estrés oxidativo (52).
1.2.3. Enfermedad hepática asociada a la NP (PNALD)
12) En adultos, es difícil diferenciar entre el papel de la afección subyacente (resección extensa del intestino delgado, sepsis) y el de NP en la patogenia de la PNALD. (Declaración 17, consenso fuerte, 100 % de acuerdo.)
Comentario
La lesión hepática colestásica ocurre en aproximadamente el 50 % de los pacientes con NP domiciliaria a largo plazo. En 1985, Bowyer y cols. (53) describieron la esteatohepatitis en 9 de 60 pacientes con NP a largo plazo. La lesión hepática persistió durante una mediana de 15 meses y progresó a cirrosis en tres pacientes. Stanko y sus colaboradores (40) estudiaron a adultos que habían estado con NP durante un año. Encontraron enzimas hepáticas normales en aquellos que no tenían o solo tenían una pérdida escasa de intestino, mientras que 4/6 pacientes con pérdida masiva de intestino desarrollaron colestasis progresiva y esteatohepatitis entre cuatro y diez meses después del inicio de la NP. Su observación demostró que la lesión hepática puede ocurrir no solo como secuela de la NP - la denominada PNALD - sino también por insuficiencia intestinal, denominándose IFALD. En la práctica clínica, a menudo es difícil una distinción clara entre IFALD y PNALD. Se cree que la patogenia de la IFALD/PNALD es multifactorial, incluyendo factores como la alteración del ciclo enterohepático de reabsorción de los ácidos biliares, la infección sistémica, el sobrecrecimiento bacteriano, la ausencia de nutrientes enterales y la composición de la NP. Tanto la falta como el exceso de componentes específicos de NP se están discutiendo como causales en la PNALD. La composición de ácidos grasos de las emulsiones lipídicas, así como la deficiencia de colina y la toxicidad del manganeso, se han relacionado con la aparición de esteatosis hepática y colestasis en adultos y niños.
13) En adultos con sospecha de PNALD se pueden usar emulsiones lipídicas con una relación n6/n3 reducida. (Recomendación 85, Grado 0, consenso fuerte, 92 % de acuerdo.)
Comentario
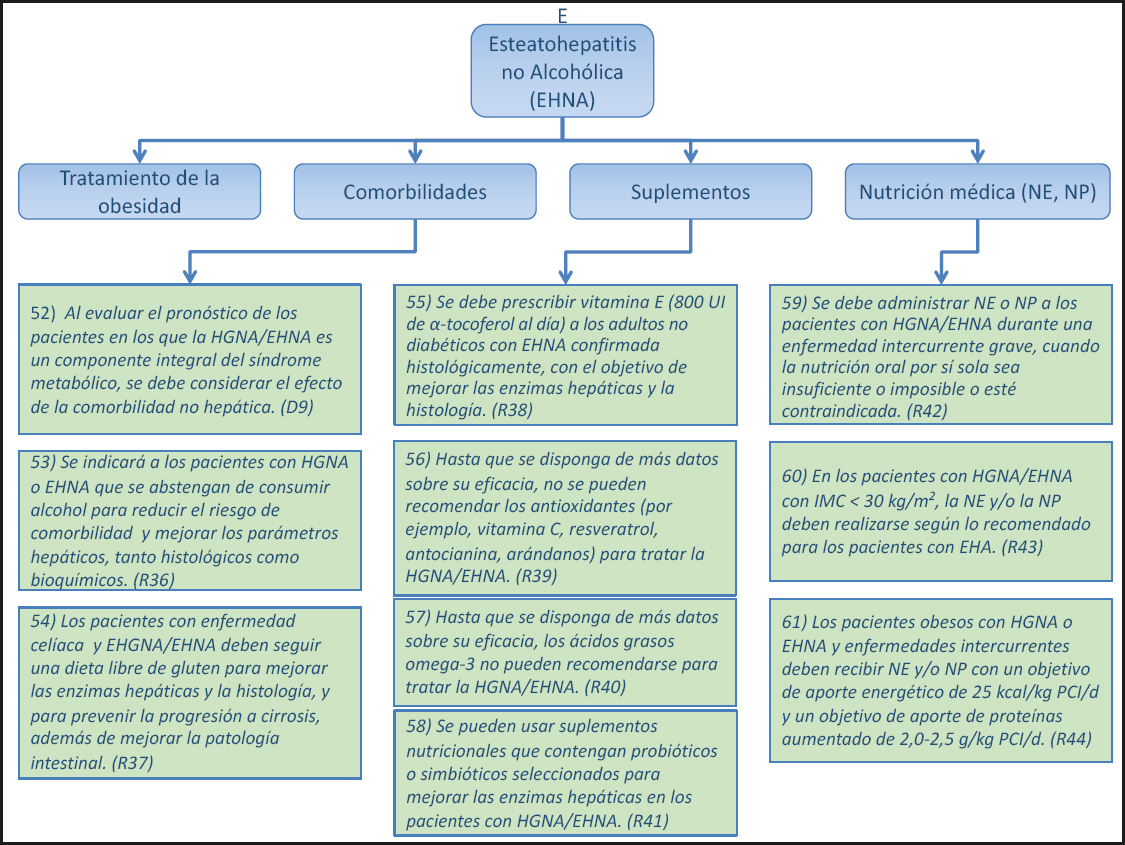
En adultos, se dispone de datos limitados sobre el efecto de modificar la cantidad y/o composición de los lípidos parenterales en el curso de la PNALD. También se ha sugerido limitar en los adultos los lípidos a base de soja a ≤ 1,0 g·kg-1·d-1 (54). Se ha reportado que el cambio de lípidos a base de soja por una emulsión de aceite de pescado al 100 % es eficaz en la PNALD (55,56). En una serie de 15 pacientes, la adición de una emulsión de aceite de pescado a una emulsión de lípidos a base de soja se asoció con la reversión de una PNALD comprobada por biopsia (57). En un caso, el uso de una emulsión de aceite de pescado junto con un régimen de NP a base de aceite de oliva se asoció a una reducción de la esteatosis y la inflamación hepáticas (58). En conjunto, se necesitan más datos antes de que se pueda recomendar el uso rutinario de las emulsiones grasas que contienen aceite de pescado para el tratamiento de la PNALD.
2. RECOMENDACIONES ESPECÍFICAS DE CADA ENFERMEDAD
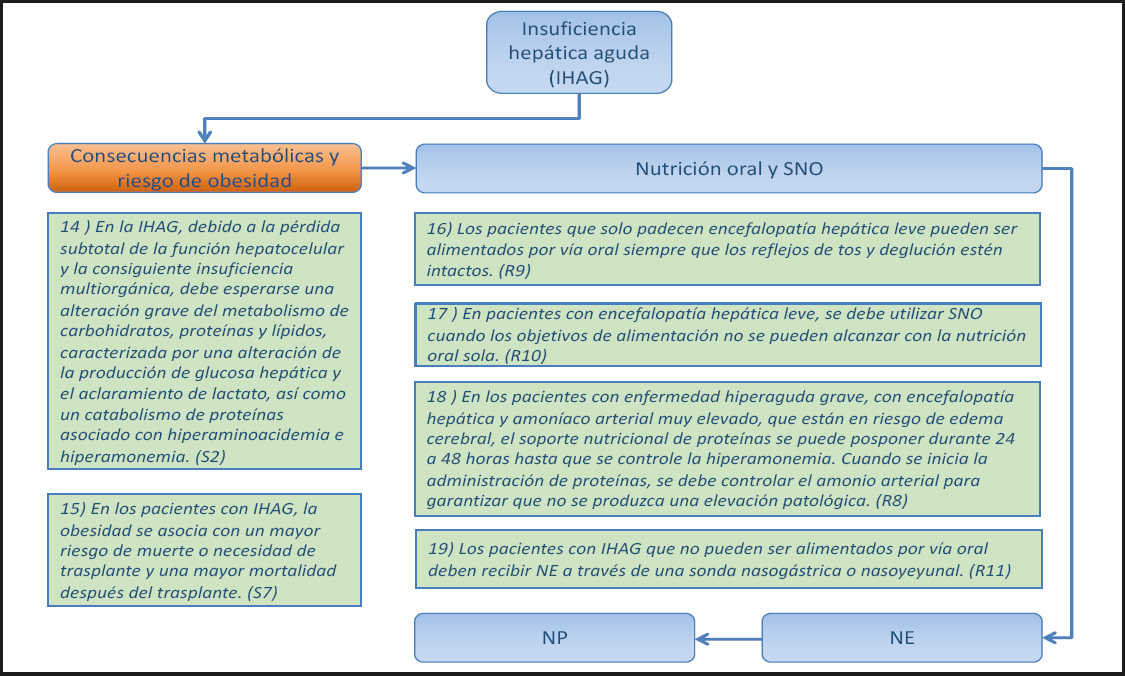
2.1. INSUFICIENCIA HEPÁTICA AGUDA GRAVE (IHAG) (Figs. 4 y 5)
2.1.1. Consecuencias metabólicas y riesgo de obesidad
14) En la IHAG, debido a la pérdida subtotal de la función hepatocelular y la consiguiente insuficiencia multiorgánica, se debe esperar una alteración grave del metabolismo de carbohidratos, proteínas y lípidos, caracterizada por una alteración de la producción de glucosa hepática y el aclaramiento de lactato, así como un catabolismo de proteínas asociado con hiperaminoacidemia e hiperamonemia. (Declaración 2, consenso fuerte, 100 % de acuerdo.)
Comentario
Los niveles plasmáticos de aminoácidos aumentan de 3 a 4 veces en la IHAG. El patrón de aminoácidos se caracteriza por una disminución de los aminoácidos de cadena ramificada (AACR) y un aumento del triptófano y de los aminoácidos aromáticos, así como los aminoácidos sulfurados. La hipoglucemia es una característica ominosa de la IHAG y se cree que es el resultado de: a) una depleción del glucógeno hepático, b) una alteración de la gluconeogénesis debido a la pérdida de hepatocitos y c) hiperinsulinemia debida al aumento de la secreción y reducción de la degradación. En la IHAG, los tejidos esplácnicos muestran una alteración desde la liberación neta de glucosa hasta la absorción neta de glucosa (59). Estos cambios se acompañan de una intolerancia a la glucosa caracterizada por una disminución del 50 % en la tasa de eliminación de la glucosa corporal, una disminución grave (hasta el 15 % en los controles) de la sensibilidad a la insulina y un aumento de los niveles de glucagón en la sangre (60). En contraste con las observaciones en pacientes con sepsis, en la IHAG, los tejidos esplácnicos no extraen sino que liberan ácidos grasos libres y la cetogénesis se reduce (61).
15) En los pacientes con IHAG, la obesidad se asocia a un mayor riesgo de muerte o necesidad de trasplante y a una mayor mortalidad después del trasplante. (Declaración 7, consenso fuerte, 96 % de acuerdo.)
Comentario
En la IHAG solo hay datos muy limitados disponibles con respecto al efecto del estado Nutricional sobre su curso y pronóstico. La obesidad y la obesidad severa tienen un riesgo entre 1,6 y 1,9 veces mayor de trasplante o muerte por IHAG. Los pacientes obesos tienen un riesgo 3,4 veces mayor de morir después del trasplante. En una pequeña serie retrospectiva se encontró que los pacientes con sobrepeso son más susceptibles a la IHAG (62).
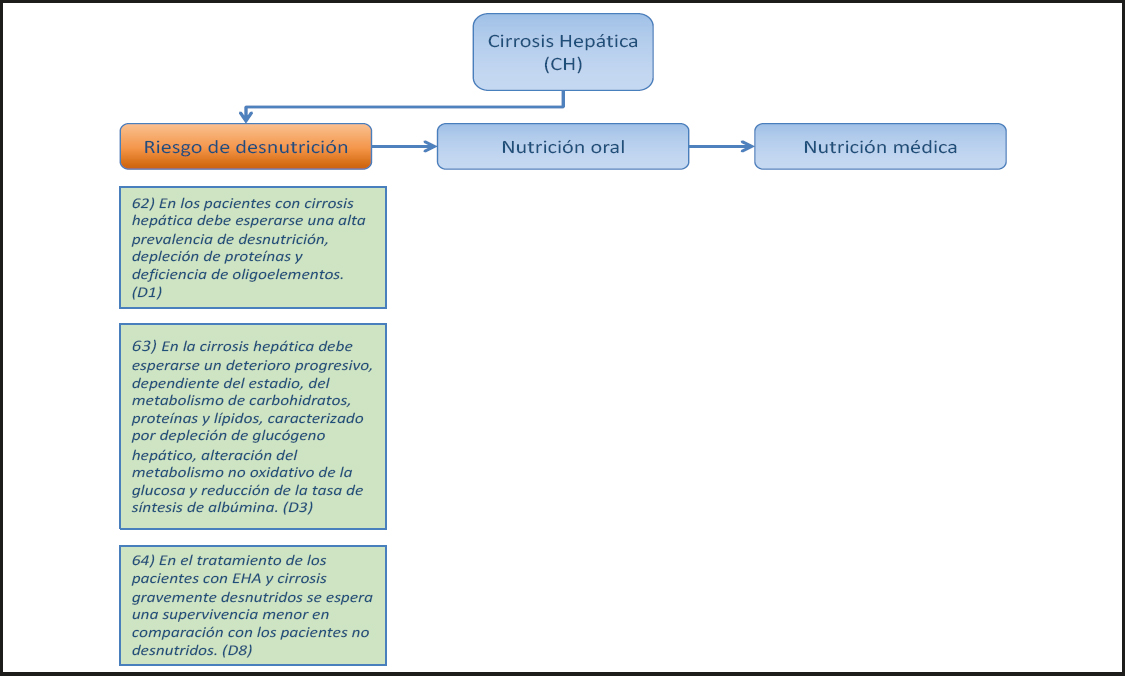
2.1.2. Nutrición oral y suplementos Nutricionales orales
16) Los pacientes que solo padecen encefalopatía hepática (EH) leve pueden ser alimentados por vía oral siempre que los reflejos de tos y deglución estén intactos. (Recomendación 9, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
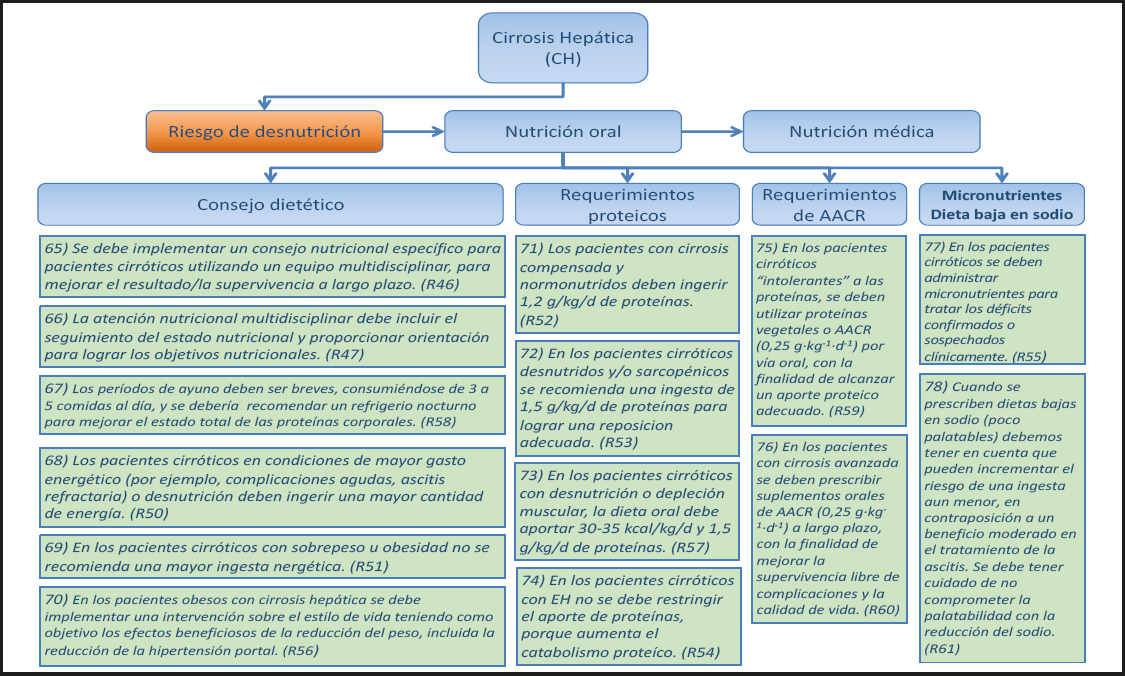
No hay datos de ensayos clínicos controlados sobre la IHAG para informar esta recomendación.
17) En los pacientes con encefalopatía hepática leve se deben utilizar suplementos Nutricionales orales (SNO) cuando los objetivos Nutricionales no se pueden alcanzar con la nutrición oral sola. (Recomendación 10, Grado GPP, consenso, 85 % de acuerdo.)
Comentario
No hay datos de ensayos clínicos controlados sobre la IHAG para informar esta recomendación.
18) En los pacientes con enfermedad hiperaguda grave, encefalopatía hepática y amonio arterial muy elevado que tienen riesgo de edema cerebral, el aporte Nutricional de proteínas se puede aplazar durante 24 a 48 horas hasta que se controle la hiperamonemia. Cuando se inicia la administración de proteínas, se debe monitorizar el amonio arterial para garantizar que no se produzca una elevación patológica. (Recomendación 8, Grado GPP, consenso, 90 % de acuerdo.)
Comentario
Los pacientes con IHAG hiperaguda y niveles de amonio arterial elevados y sostenidos (> 150 µmol/L) pueden tener un mayor riesgo de edema cerebral y desarrollo de hipertensión intracraneal (63,64). En esta situación específica, en donde puede haber un deterioro breve pero profundo de la función hepática, la administración de proteínas puede elevar aun más los niveles de amonio y aumentar el riesgo de edema cerebral. Su administración puede posponerse solo por un período corto (24-48 horas) a medida que mejora la función hepática y, cuando se inicia, se debe monitorizar el amonio arterial.
19) Los pacientes con IHAG que no pueden ser alimentados por vía oral deben recibir NE por sonda nasogástrica o nasoyeyunal. (Recomendación 11, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
De acuerdo con las Guías ESICM (65), la NE debe iniciarse en dosis bajas cuando los trastornos metabólicos agudos que ponen inminentemente en peligro la vida se controlan con o sin estrategias de soporte hepático, independientemente del grado de encefalopatía. Se deben monitorizar los niveles de amonio arterial.
2.1.3. Nutrición enteral (NE)
20) La práctica clínica actual adoptada en muchas unidades hepáticas europeas demuestra la seguridad y viabilidad de la NE en los pacientes con IHAG. (Declaración 11, consenso fuerte, 100 % de acuerdo.)
Comentario
Véase el comentario del punto 19.
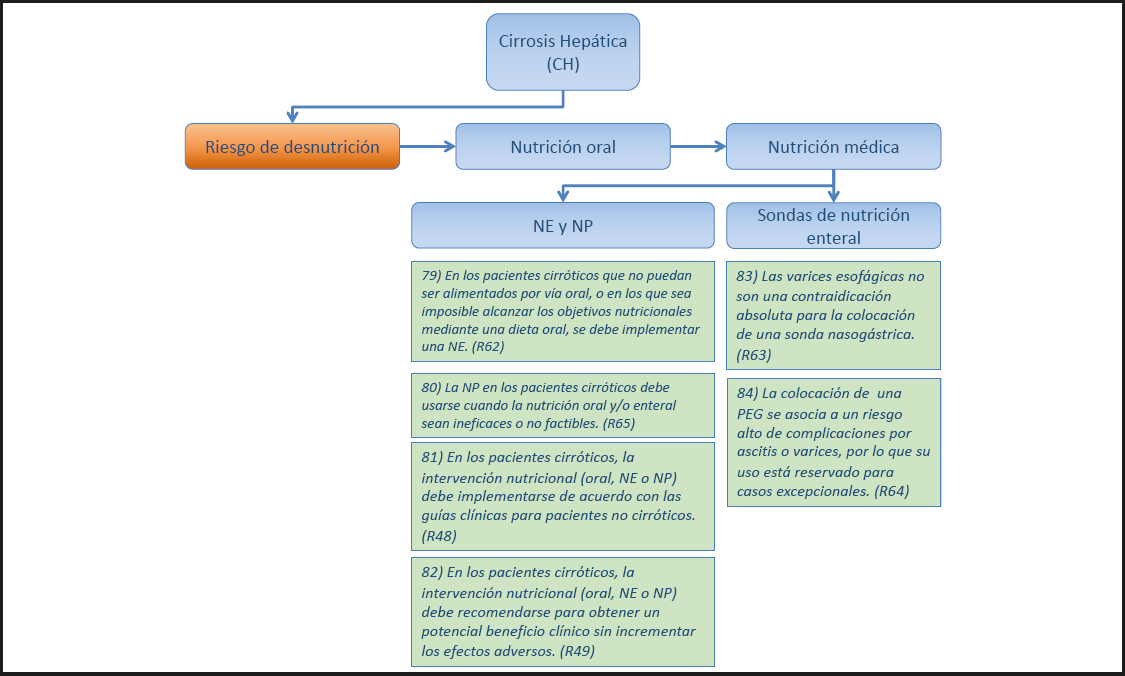
21) Los pacientes con IHAG sin desnutrición deben recibir soporte Nutricional (preferentemente NE) cuando se considere que es poco probable que reinicien la nutrición oral normal en los próximos cinco a siete días, como en otras enfermedades críticas. (Recomendación 7, Grado GPP, consenso fuerte, 96 % de acuerdo.)
Comentario
Véase el comentario del punto 19.
22) En los pacientes desnutridos con IHAG, la nutrición enteral (NE) y/o la NP deben iniciarse de inmediato, como en otros pacientes críticamente enfermos. (Recomendación 8, Grado GPP, consenso fuerte, 96 % de acuerdo.)
Comentario
En general, las decisiones sobre cuándo iniciar el soporte Nutricional y qué vía utilizar se toman de acuerdo con las recomendaciones de soporte Nutricional para otros pacientes críticos. Se pueden clasificar tres subtipos de IHAG según su curso clínico. En la insuficiencia hepática hiperaguda, la encefalopatía hepática se produce dentro de los siete días posteriores a la aparición de la ictericia y los pacientes suelen recuperarse rápidamente con tratamiento médico únicamente o después del trasplante, o mueren poco después del inicio de la enfermedad. Debido a la corta duración de la enfermedad en la mayoría de los pacientes, se cree que el soporte Nutricional juega un papel relativamente menor: el pronóstico es más favorable en este subtipo. En la insuficiencia hepática aguda, el intervalo entre el inicio de la encefalopatía hepática después de que el paciente presenta ictericia es de 8 a 28 días, y en la insuficiencia hepática subaguda este intervalo es de 29 a 72 días. En estos dos últimos subtipos de IHAG, el soporte Nutricional precoz es más a menudo necesario.
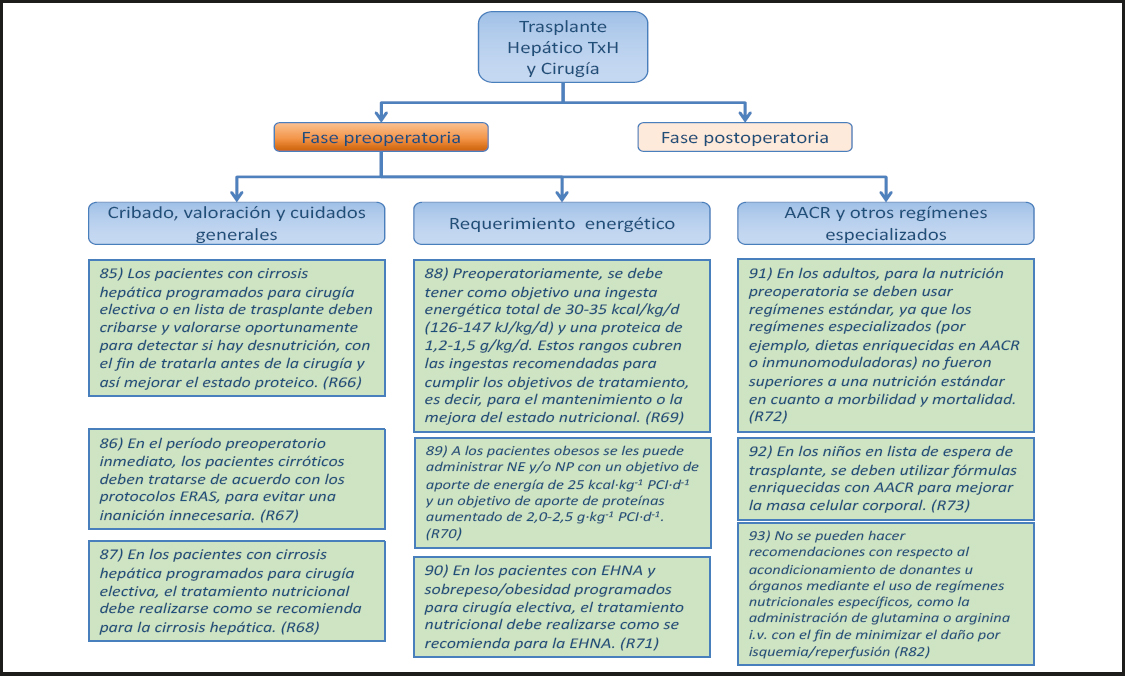
23) Se pueden administrar fórmulas enterales estándar, ya que no hay datos sobre el valor de una fórmula específica de la enfermedad. (Recomendación 14, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
No hay estudios publicados que comparen fórmulas enterales en pacientes con IHAG. Con respecto a otros pacientes críticamente enfermos, se recomienda evitar el uso de todas las fórmulas especiales en aquellos que están en un entorno de UCI médica y las fórmulas específicas de la enfermedad si están en la UCI quirúrgica. No hay evidencia de que el uso de la NE enriquecida con AACR mejore los resultados de los pacientes en comparación con las formulaciones estándar con proteína completa en otros pacientes críticamente enfermos con enfermedad hepática. Rara vez se usan en el tratamiento de pacientes con IHAG (66,67).
24) La NE debe realizarse comenzando con dosis bajas independientemente del grado de EH. (Recomendación 12, Grado GPP, consenso, 80 % de acuerdo.)
Comentario
Véase el comentario del punto 19.
2.1.4. Nutrición parenteral (NP)
25) La NP debe utilizarse como tratamiento de segunda línea en los pacientes que no pueden ser alimentados adecuadamente por vía oral y/o con NE. (Recomendación 13, Grado GPP, consenso, 90 % de acuerdo.)
Comentario
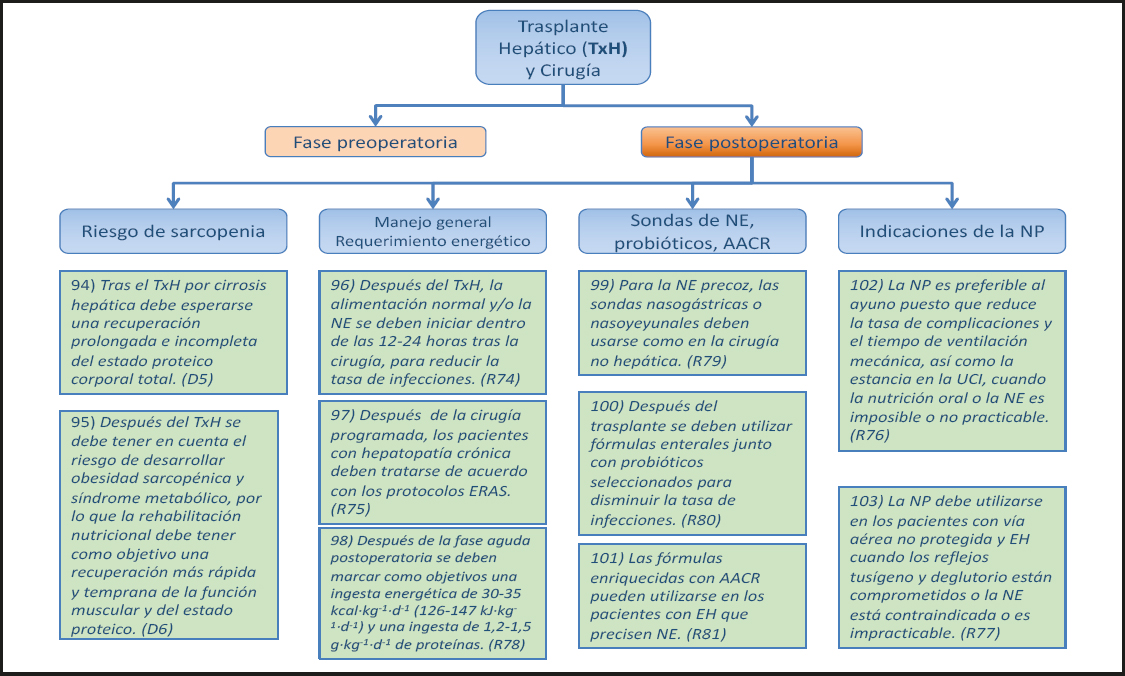
No hay evidencia procedente de ensayos en pacientes con IHAG para informar estas recomendaciones, y la práctica adoptada refleja la de otras formas de enfermedad hepática y enfermedad crítica. En la mayoría de los pacientes con IHAG es práctico y seguro usar la NE, y las fórmulas pueden administrarse en cantidades comparables a las utilizadas en otras enfermedades críticas. Como se ha documentado anteriormente (véase el punto 22), un pequeño subgrupo de pacientes hiperagudos pueden tener un riesgo transitorio de empeoramiento de la hiperamonemia con las cargas proteicas elevadas y, por tanto, podrían no tolerar la dosis completa de NE en la fase inicial de su enfermedad. En otros pacientes críticamente enfermos que requieren terapia de soporte Nutricional, la NP no tiene ninguna ventaja clara sobre la NE y puede aumentar las complicaciones infecciosas: lo mismo puede ser el caso de la IHAG.
2.2. ESTEATOHEPATITIS ALCOHÓLICA (EHA) (Figs. 6 y 7)
2.2.1. Nutrición oral
2.2.1.1. Todos los pacientes
26) En el tratamiento de pacientes con EHA gravemente desnutridos se prevé una peor supervivencia en comparación con los pacientes no desnutridos. (Declaración 8, consenso fuerte, 100 % de acuerdo.)
Comentario
Los pacientes con EHA desnutridos tienen una mayor tasa de morbilidad y mortalidad en los trabajos con los datos agregados del estudio American Veteran Affairs (68-70). Los datos del estudio del Veteran Affairs muestran una clara asociación entre una baja ingesta de alimentos normales y una alta mortalidad (68), y este hallazgo se ha confirmado recientemente (71).
27) Se debe utilizar el consejo Nutricional individualizado para mejorar la ingesta de alimentos. (Recomendación 23, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
No hay estudios para evaluar el beneficio de la terapia Nutricional individualizada en comparación con la alimentación libre o la suplementación Nutricional con 30-35 kcal·kg-1·d-1 y 1,2-1,5 g·kg-1·d-1 de proteína. Sin embargo, dadas las sugerencias sobre la restricción de sodio, líquidos y otros sustratos dependiendo de condiciones comórbidas tales como la insuficiencia renal o la diabetes mellitus, es probable que un programa Nutricional estructurado e individualizado sea más beneficioso que la alimentación libre.
2.2.1.2. EHA grave
28) Los pacientes deben ser alimentados por vía oral siempre que los reflejos de tos y deglución estén intactos y se puedan alcanzar los objetivos de ingesta de energía y proteínas. (Recomendación 17, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
La alimentación suplementaria en pacientes con EHA grave se basa en datos casi universales de que estos pacientes tienen una ingesta oral deficiente, así como una ingesta menor de calorías y proteínas, que contribuyen a la mortalidad y la morbilidad (68,69). Por lo tanto, existe una justificación convincente para proporcionar una nutrición suficiente. Sin embargo, cuando se logra una ingesta oral adecuada, no parece haber una ventaja específica en la vía de administración. De hecho, la NP se asocia a un mayor riesgo de complicaciones, incluida la infección (72). También existen ventajas de la alimentación oral con una dieta regular sobre la NE o la NP en cuanto a la integridad de la mucosa intestinal y, según datos más recientes, con respecto al mantenimiento del microbioma intestinal protector, brindando beneficios en términos de tasas de infección que podrían afectar la mortalidad.
29) En los pacientes con EHA grave se debe esperar una deficiencia de oligoelementos y vitaminas. (Declaración 12, consenso fuerte, 100 % de acuerdo.)
Comentario
Hay diversos estudios observacionales que muestran deficiencias de micronutrientes en los pacientes con trastornos por consumo de alcohol y enfermedad hepática alcohólica, y estudios muy limitados en el caso de la EHA (73-75). Debido a la mala ingesta oral que precede a la enfermedad aguda, se debe esperar y reponer la deficiencia de micronutrientes en los pacientes con EHA grave. No se puede responder con base a la evidencia si todos los pacientes deben someterse a un cribado del riesgo de desnutrición o si debe haber un reemplazo universal de micronutrientes. Basándonos en la frecuencia del déficit de vitamina B, zinc y vitamina D, la reposición de estas puede ser beneficiosa. La administración oral de preparados multivitamínicos y de zinc es razonable en la EHA grave porque la deficiencia es frecuente y la suplementación oral empírica es menos costosa que las mediciones de laboratorio para establecer el déficit antes de reponer los micronutrientes individuales. La suplementación con tiamina se utiliza de forma rutinaria en la práctica clínica para prevenir la encefalopatía de Wernicke y la psicosis de Korsakoff.
30) Se debe ofrecer la terapia Nutricional a todos los pacientes con EHA grave que no puedan cumplir con los requerimientos mediante la ingesta espontánea de alimentos, para mejorar la supervivencia, la tasa de infección, la función hepática y la resolución de la encefalopatía. (Recomendación 15, Grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Datos consistentes han demostrado que la desnutrición, definida por una serie de herramientas de medición, es prevalente en la mayoría (50-100 %) de los pacientes con EHA grave (68,69,76). La presencia de desnutrición es un predictor independiente de mortalidad y afecta negativamente a la respuesta a los corticosteroides y la oxandrolona solo en la EHA moderada pero no en la grave (68,77,78). En la EHA grave, la ingesta calórica reducida se asocia a una mayor mortalidad y mayores tasas de complicaciones. La ingesta oral está disminuida en estos pacientes y, por lo tanto, es necesaria la suplementación para mantener una ingesta adecuada de calorías y proteínas. La suplementación Nutricional, en múltiples estudios aleatorizados, para mantener la ingesta calórica requerida reduce la incidencia de infecciones y facilita una resolución más rápida de la encefalopatía hepática, así como la mejora de la función hepática. En el estudio multicéntrico más reciente, independientemente del tratamiento, una menor ingesta de calorías (21,5 kcal·kg-1·d-1) se asoció con peores resultados clínicos (71,79). La ingesta calórica se reduce significativamente incluso en los pacientes con EHA abstinentes y el aumento de la ingesta calórica mejora los resultados (68,80), pero no hay ensayos controlados y aleatorizados que comparen directamente la nutrición suplementaria sola con la ingesta oral libre sola y que apoyen una mejor supervivencia con la nutrición adicional.
2.2.2. SNO
31) Se debe utilizar el SNO cuando los pacientes con EHA grave no puedan alcanzar sus necesidades calóricas a través de la alimentación convencional, para mejorar la supervivencia. (Recomendación 16, Grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
En los pacientes con hepatitis alcohólica grave, la ingesta oral se reduce constantemente (68,69,76). Cuando los tratamientos son comparables entre los grupos, la nutrición suplementaria sí mejora la infección y la mortalidad aguda, específicamente las muertes hospitalarias, frente a la ingesta dietética oral libre (81-83). Se han evaluado la alimentación enteral o la suplementaria en la hepatitis alcohólica grave, pero no se ha hallado ningún beneficio sobre la mortalidad de forma consistente. Sin embargo, estos datos deben ser atenuados por la existencia de trabajos que indican reiteradamente que la ingesta calórica < 21,5 kcal·kg-1·d-1 se asocia a una mayor mortalidad (71), y existe un fuerte consenso entre los expertos de que la suplementación Nutricional debe ofrecerse a los pacientes con ingesta oral deficiente ya que puede proporcionar una ventaja en cuanto a supervivencia (83).
32) El SNO se debe usar como terapia de primera línea cuando los objetivos Nutricionales no se puedan alcanzar con la nutrición oral sola, debiéndose administrar como suplemento nocturno o al final de la tarde. (Recomendación 24, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
La ingesta oral reducida se asocia a una mayor mortalidad y es probable que la suplementación Nutricional resulte en una resolución más rápida de la encefalopatía hepática y la bilirrubina sérica elevada, y en un menor riesgo de infección; la EHA grave también es un estado hipermetabólico. Estos datos apoyan el uso de una ingesta adecuada de calorías y proteínas mediante la suplementación. Dado que se han informado datos convincentes sobre un refrigerio nocturno en la cirrosis hepática, incluida la cirrosis alcohólica (84), es razonable ampliar estos datos para respaldar el uso de suplementos antes de la noche o nocturnos para reducir la duración del ayuno.
2.2.3. Nutrición médica
2.2.3.1. Nutrición enteral (NE)
33) La NE debe utilizarse cuando los pacientes con EHA grave no pueden alcanzar sus necesidades calóricas mediante la alimentación normal y/o el SNO, para mejorar la supervivencia y la morbilidad infecciosa. (Recomendación 18, Grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Cuando se reduce la ingesta calórica, la mortalidad es mayor en la EHA grave (71). Si bien la suplementación con calorías adicionales no mejora la supervivencia en la mayoría de los estudios aleatorizados, en los pacientes con desnutrición se han documentado tasas de infección más bajas (83). A pesar de una serie de estudios negativos, el consenso entre los expertos es que, en los pacientes con EHA grave que no pueden ingerir las calorías adecuadas por vía oral, la nutrición suplementaria puede proporcionar una ventaja de supervivencia, especialmente en el grupo con desnutrición moderada (68). La resolución de la infección es mejor con la nutrición suplementaria, pero no se sabe si es menor la tasa de aparición de nuevas infecciones. Dado que, en los pacientes no alcohólicos con enfermedad hepática, la mala ingesta oral y la desnutrición se asocian con un mayor riesgo de infección, se puede considerar que una mejor ingesta oral podría reducir el riesgo de infección en la EHA grave, aunque no se han obtenido datos publicados que apoyen esta afirmación.
34) La NE se puede utilizar en la EHA grave para garantizar una ingesta adecuada de energía y proteínas sin aumentar el riesgo de EH. (Recomendación 25, Grado 0, consenso fuerte, 92 % de acuerdo.)
Comentario
La NE ha demostrado su eficacia para proporcionar una nutrición adecuada a los pacientes con cirrosis alcohólica (85) o cirrosis con encefalopatía hepática de grado I-III (86). En un estudio, diez pacientes recibieron una solución enriquecida con AACR que equivalía a 70 g de proteína por día y su estado mental mejoró (86). En otro estudio, 16 pacientes recibieron 1,5 g·kg-1·d-1 de proteína utilizando una fórmula enteral basada en la caseína (85). Asimismo, en 136 pacientes, la baja ingesta de proteínas se asoció con un empeoramiento de la encefalopatía hepática, mientras que los pacientes con una mayor ingesta de proteínas mostraron una mejoría del estado mental (87).
35) La NE debe usarse en la EHA grave porque se ha demostrado que es tan eficaz como los esteroides solos y, en los supervivientes de las primeras cuatro semanas, se asocia a una tasa de mortalidad más baja al año siguiente. (Recomendación 26, Grado B, consenso, 85 % de acuerdo.)
Comentario
Un estudio aleatorizado que comparó los esteroides solos con la NE total no mostró diferencias en cuanto a mortalidad pero sí una mortalidad más temprana en los sujetos tratados con esteroides (79). Aunque la mortalidad en los pacientes con encefalopatía hepática fue similar en los brazos tratados con NE y con esteroides, no se informó de si la resolución de la encefalopatía hepática fue diferente (79). Otros estudios sobre la NE tampoco informaron de beneficios de supervivencia, pero la NE dio como resultado una mayor mejora de la encefalopatía hepática y una reducción de la bilirrubina (85). Aunque se ha cuestionado el beneficio de los esteroides en la EHA grave (88), un ensayo controlado y aleatorizado mostró que la mortalidad en la EHA grave con NE total fue similar a la de la EHA grave tratada con esteroides durante 28 días. Sin embargo, los pacientes con NE murieron antes y los que recibieron esteroides murieron más tarde durante el tratamiento a lo largo de 28 días. El seguimiento a más largo plazo mostró una mayor mortalidad en el grupo tratado con esteroides, relacionada con la infección (79). Los autores concluyeron que es necesario evaluar el efecto sinérgico de los esteroides y la NE en la EHA grave. En un estudio reciente, la comparación específica de la NE con esteroides y la nutrición convencional con esteroides no mostró ningún beneficio de supervivencia de la NE sobre los esteroides (71). Sin embargo, una ingesta calórica más baja aumentó la mortalidad en ambos grupos, lo que sugiere que la NE podría proporcionar una ventaja de supervivencia precoz en la EHA (71,79).
36) En pacientes con EHA grave se deben utilizar formulas estándar tanto para el SNO como para la NE, preferiblemente fórmulas de alta densidad energética (≥ 1,5 kcal·ml-1). (Recomendación 21, Grado GPP, consenso fuerte, 92 % de acuerdo.)
Comentario
No existen estudios directos que evalúen en ensayos aleatorizados los protocolos de nutrición específicos para la EHA grave. Dichos protocolos incluyen el uso de mezclas de AACR, dietas con proteínas vegetales e inmunonutrición con suplementos de arginina. Los datos publicados solo evalúan los aminoácidos intravenosos, lassoluciones parenterales comerciales o la glucosa intravenosa, que no muestran ningún beneficio de mortalidad en los pacientes críticamente enfermos (89). Se ha informado que la inmunonutrición no proporciona ninguna ventaja terapéutica específica en un ensayo controlado y aleatorizado en pacientes sometidos a TxH (90). En la EHA grave no hay ensayos controlados que muestren beneficios de la fórmula específica sobre la fórmula estándar. El uso de suplementos de alta densidad calórica puede reducir la administración de líquidos en los pacientes con restricción de líquidos. Estos suplementos también reducen el tiempo durante el cual se administran.
2.2.3.2. Nutrición parenteral (NP)
37) Los pacientes con EHA grave que puedan ser alimentados suficientemente por vía oral o enteral pero que tengan que abstenerse de comer temporalmente (¡incluido el ayuno nocturno!) durante más de doce horas, deben recibir glucosa endovenosa a dosis de 2-3 g·kg-1·d-1. Cuando este período de ayuno dura más de 72 horas, se requiere la NP total. (Recomendación 27, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
En los pacientes cirróticos, después del ayuno nocturno, las reservas de glucógeno se agotan y las condiciones metabólicas son similares a la inanición prolongada en los individuos sanos. Se ha demostrado que un refrigerio de carbohidratos a última hora de la tarde o una toma nocturna de SNO se asocian a un mejor metabolismo de las proteínas en los pacientes cirróticos (91,92). No hay datos correspondientes de pacientes con EHA grave, pero parece seguro asumir que existe también una depleción similar de glucógeno, con todas sus consecuencias sobre el metabolismo de las proteínas, en los pacientes con EHA grave. Por lo tanto, recomendamos a los pacientes con EHA grave que eviten ayunar durante más de doce horas e instituir oportunamente la infusión de glucosa o una NP periférica hipocalórica. Se recomienda la NP estándar en los pacientes que necesiten tal intervención pero es probable que la mortalidad no mejore, según la mayoría de los datos publicados.
38) La NP debe iniciarse inmediatamente en los pacientes EHA grave y desnutrición moderada o grave que no puedan nutrirse lo suficiente por vía oral y/o enteral. (Recomendación 19, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
La suplementación Nutricional con mezclas de aminoácidos o con calorías reduce las tasas de infección y facilita la resolución de la encefalopatía hepática, pero los efectos beneficiosos sobre la supervivencia solo se documentaron en pacientes con EHA moderada, no en aquellos con EHA grave (77,78,80,82,83,85). La NP puede incluir aminoácidos y/o la infusión de glucosa, por vía periférica o central, para apoyar la ingesta dietética en los pacientes cuya ingesta oral es insuficiente. Varios estudios han evaluado diferentes suplementos parenterales, en su mayoría infusiones de aminoácidos o glucosa; siete de estos suplementos se aleatorizaron en un estudio de pacientes con EHA. Un estudio mostró una ventaja de supervivencia con los aminoácidos intravenosos, pero esto nunca se ha reproducido en ningún otro estudio (80). Hay datos limitados sobre el impacto de la intervención Nutricional sola sobre la histología hepática en la EHA grave. Ningún estudio ha evaluado la progresión a cirrosis, pero los aminoácidos intravenosos solos, o junto con glucosa, se asociaron a una mayor resolución de la infiltración grasa (82) o de los cuerpos de Mallory (93). La mejoría o reversión de los cuerpos de Mallory puede predecir una menor tasa de progresión. Las revisiones sistemáticas y los metaanálisis también sugieren que la suplementación Nutricional mejora las tasas de resolución de la encefalopatía hepática (82,83).
39) La NP debe considerarse en los pacientes con vías respiratorias desprotegidas y encefalopatía hepática cuando los reflejos de tos y deglución estén comprometidos o la NE esté contraindicada o sea impracticable. (Recomendación 20, Grado GPP, acuerdo mayoritario, 72 % de acuerdo.)
Comentario
No hay evidencia directa que evalúe el papel de la NP en el subgrupo de pacientes con encefalopatía hepática y/o vías respiratorias desprotegidas con reflejos protectores deteriorados. Aunque algunos (94) recomiendan el uso de la NP en los pacientes encefalopáticos o críticamente enfermos con tos o reflejo nauseoso (94), hay otros que no creen en el uso de la NP para la EHA (95).
40) En los pacientes con EHA grave, la NP debe administrarse como en los demás pacientes críticamente enfermos. (Recomendación 28, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Aunque no existen ensayos aleatorizados que comparen diferentes fórmulas, tasas o componentes de la NP, se pueden sacar algunas conclusiones del uso de la NP en los pacientes críticos. Es probable que un enfoque multidisciplinario pueda proporcionar beneficios y no hay evidencia que respalde el papel beneficioso de las fórmulas con nutrientes específicos en la EHA grave. No hay ventajas asociadas al tipo de soluciones parenterales utilizadas y, por lo tanto, se recomienda la práctica de la NP estándar en los pacientes con EHA grave.
41) Las vitaminas hidro y liposolubles, así como los electrolitos y los oligoelementos, se deben administrar diariamente desde el inicio de la NP para cubrir los requerimientos. (Recomendación 22, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
En los pacientes con EHA grave, dada la reducción casi universal de la ingesta alimentaria, existe una alta prevalencia de la deficiencia de micronutrientes, que tiene efectos adversos sobre las respuestas fisiológicas al estrés y la infección. Por lo tanto, se deben administrar vitaminas y oligoelementos para proporcionar, al menos, las cantidades diarias recomendadas. En este grupo de pacientes de alto riesgo parece prudente administrar una primera dosis de tiamina antes de comenzar la NP, para prevenir la encefalopatía de Wernicke o el síndrome de realimentación. Se debe considerar la reposición en todos los pacientes con NP, aunque no se haya documentado ninguna deficiencia. Dado que es probable que la NP se administre a corto plazo, el riesgo de eventos adversos debido a la reposición de vitaminas y micronutrientes a largo plazo es bajo, incluso sin cuantificar las concentraciones séricas. Se deben administrar vitaminas específicas, incluidas las vitaminas A, D y K junto con tiamina, ácido fólico y piridoxina, para corregir los déficits.
2.3. ESTEATOHEPATITIS NO ALCOHÓLICA (EHNA) (Figs. 8 y 9)
2.3.1. Tratamiento de la obesidad
42) La sobrenutrición puede causar EHGNA o EHNA, que es una afección precursora de la cirrosis hepática. (Declaración 15, consenso fuerte, 100 % de acuerdo.)
Comentario
La evidencia disponible se revisa en los puntos 43-61 del capítulo 2.3 sobre la EHNA.
43) En pacientes con EHNA con sobrepeso u obesidad, se utilizará como tratamiento de primera línea una intervención intensiva en el estilo de vida que lleve a la pérdida de peso junto con un aumento de la actividad física. (Recomendación 30, Grado A, consenso fuerte, 100 % de acuerdo.)
Comentario
Se ha demostrado que todo cambio de estilo de vida que conlleve una pérdida de peso moderada (< 5 %) mejora la acumulación de grasa hepática solo cuando se utilizan una dieta hipocalórica y ejercicio, pero no cuando se aplica una dieta hipocalórica sola (96,97). Se ha demostrado que todo cambio de estilo de vida que produzca una pérdida de peso del 5-10 % mejora la histología cuando se emplean la dieta hipocalórica y el ejercicio (98-102). Los análisis de subgrupos indican que el grado de pérdida de peso parece estar correlacionado con el grado de mejoría histológica. Se ha observado una mejora profunda de la esteatosis, la inflamación y la balonización cuando se logra una pérdida de peso > 7-9 % (98,100,101), mientras que únicamente la pérdida de peso > 10 % se asocia a una mejoría de la fibrosis (102). En un ensayo sistemático, la misma modificación del equilibrio energético bien mediante una ingesta reducida sola o bien mediante una restricción calórica menor combinada con un mayor gasto energético (ejercicio) produjo la misma pérdida de peso (-10 %) y la misma mejora de la grasa hepática, la ALT y la sensibilidad a la insulina (103). Sin embargo, la predisposición a cambiar de estilo de vida es baja en los pacientes con sobrepeso/obesidad y EHGNA, y solo el 10 % trabajan activamente o se preparan para cambiar Ejercicio
2.3.1.1. Ejercicio
44) Se debe recomendar a los pacientes con hígado graso no alcohólico HGNA/EHNA que hagan ejercicio para reducir el contenido de grasa hepático, pero no hay datos sobre la eficacia del ejercicio para mejorar la actividad necroinflamatoria. (Recomendación 35, Grado A, consenso fuerte, 100 % de acuerdo.)
Comentario
Las mediciones no invasivas demuestran de manera convincente una reducción de los triglicéridos intrahepáticos y viscerales en los sujetos que simplemente hacen ejercicio sin perder peso (104-106). Tres meses de entrenamiento de resistencia mejoraron el índice ultrasónico hepatorrenal como una lectura de esteatosis hepática, pero no afectaron a las enzimas hepáticas, los triglicéridos séricos, ni el HOMA-IR (107). Recomendar hacer ejercicio parece valioso y efectivo en los pacientes motivados, ofreciendo una verdadera opción para el manejo de los pacientes delgados con EHGNA, en quienes no se puede recomendar una gran pérdida de peso. Hasta la fecha, no hay datos sobre el efecto del ejercicio solo sobre las características histológicas de la EHNA, la balonización, la inflamación y, sobre todo, la fibrosis.
45) En los pacientes con HGNA/EHNA con normopeso se puede recomendar un aumento de la actividad física para mejorar la resistencia a la insulina y la esteatosis. (Recomendación 31, Grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Para la pequeña proporción de pacientes con HGNA/EHNA que tienen normopeso, no se pueden hacer recomendaciones basadas en ensayos de intervención. Dado que se ha demostrado que el ejercicio solo mejora el contenido de grasa hepática y la resistencia a la insulina en los pacientes con HGNA/EHNA con sobrepeso u obesidad (104-107), parece plausible recomendar el ejercicio a las personas con peso normal para mejorar la esteatosis y la resistencia a la insulina. Asimismo, se debe considerar una reducción del consumo de refrescos edulcorados con fructosa.
2.3.1.2. Dieta
46) Los pacientes con HGNA/EHNA y sobrepeso u obesidad deben seguir una dieta para bajar de peso con el fin de reducir el riesgo de comorbilidad y de mejorar las enzimas hepáticas y la histología (actividad necroinflamatoria). (Recomendación 32, Grado A, consenso fuerte, 100 % de acuerdo.)
Comentario
En un estudio aleatorizado multicéntrico, las dietas bajas en calorías fueron eficaces y seguras para reducir el peso corporal y mejorar la EHGNA en doce semanas (108). Asimismo, una dieta baja en calorías fue eficaz para lograr una pérdida de peso de al menos un 5 % y una mejoría de la EHGNA (103,109,110). Los datos de dos ensayos sugieren que la restricción de carbohidratos en la dieta es más efectiva que la restricción calórica general sobre la pérdida de peso a corto plazo (dos semanas) y la reducción de los triglicéridos hepáticos (111,112), mientras que Kirk y cols. reportaron la misma disminución de lípidos intrahepáticos después de 11 semanas con una dieta baja o alta en carbohidratos (113). Otro ensayo mostró los mismos efectos beneficiosos independientemente de si la dieta era baja en grasas o baja en carbohidratos (114). Dos ensayos han reportado también los efectos beneficiosos de una dieta baja en grasas saturadas (115,116). En un estudio prospectivo de diabéticos obesos que comparó dietas isocalóricas ricas en proteínas animales o vegetales, se observó una disminución de la grasa intrahepática y la resistencia a la insulina después de 6 semanas (117). Véase también el punto 48.
47) En los pacientes con HGNA/EHNA con sobrepeso u obesidad se debe buscar una pérdida de peso del 7-10 % para mejorar la esteatosis y la bioquímica hepática; deberá buscarse una pérdida de peso > 10 % para mejorar la fibrosis. (Recomendación 29, Grado A, consenso fuerte, 96 % de acuerdo.)
Comentario
La pérdida de peso generalmente reduce la esteatosis hepática independientemente de cómo se logre. Los resultados de la evaluación de biopsias pareadas de pacientes con EHNA que lograron perder peso indican que solo una pérdida de peso sustancial (> 9-10 %) se acompaña de una mejoría de la fibrosis e incluso una resolución completa de la EHNA (98,102,121-127). La pérdida de peso se asocia a una mejora de la esteatosis, la inflamación y las enzimas hepáticas, pero no de la fibrosis (101,102,114,128,129). El potencial de la cirugía bariátrica para mejorar la fibrosis de la EHNA se subraya en dos metaanálisis (130,131). Véanse también los puntos 50 y 51.
48) Para lograr la pérdida de peso se debe seguir una dieta hipocalórica de acuerdo con las pautas de obesidad vigentes, independientemente de la composición de macronutrientes. (Recomendación 33, Grado A, consenso fuerte, 93 % de acuerdo.)
Comentario
El asesoramiento Nutricional de los pacientes con EHGNA y sobrepeso u obesidad debe realizarse de acuerdo con las pautas actuales para el tratamiento dietético de la obesidad. No existe evidencia sólida que respalde alguna composición particular de la dieta hipocalórica única para su uso en pacientes con HGNA/EHNA. Sin embargo, parece más probable que el consumo de café beneficie a la salud, no que la perjudique, y las estimaciones resumidas indican que la mayor reducción del riesgo para varios resultados de salud se produce con tres o cuatro tazas al día. Los pacientes con enfermedad hepática crónica parecen ser los más beneficiados. Se ha planteado la hipótesis de que la creciente prevalencia de la obesidad en las últimas cuatro décadas se relaciona con un mayor consumo de fructosa en la dieta y de jarabe de maíz con alto contenido de fructosa como edulcorante en refrescos y otros alimentos (132). Se ha observado un mayor consumo de fructosa y una mayor concentración de fructoquinasa hepática y de ARNm de sintasa de ácidos grasos en los pacientes con EHGNA en comparación con los controles (133). El consumo elevado de fructosa puede aumentar el riesgo de EHNA y fibrosis avanzada, aunque la asociación puede confundirse con la ingesta excesiva de calorías o con los estilos de vida poco saludables y el comportamiento sedentario, que son más comunes en la EHGNA (118,134). Sin embargo, la evidencia disponible no es lo suficientemente sólida para sacar conclusiones sobre los efectos promotores de la EHGNA específicos de la fructosa cuando esta se consume como ingrediente de una dieta normocalórica (135,136). Véase también el punto 46.
49) Se debe recomendar una dieta mediterránea (DMed) para mejorar la esteatosis y la sensibilidad a la insulina. (Recomendación 34, Grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Existen numerosos estudios intervencionistas (137-139) y observacionales (140,141) que sugieren que la DMed tiene efectos beneficiosos sobre el peso corporal, la sensibilidad a la insulina y la esteatosis y fibrosis hepáticas, pero sin evidencia clara con respecto a la prevención de la aparición de la EHGNA. Sin embargo, existe una sólida evidencia clínica que respalda el efecto beneficioso de la DMed en términos de reducir el riesgo de enfermedades cardiovasculares y el desarrollo de la diabetes, afecciones que comparten factores etiológicos comunes con la EHGNA como son la resistencia a la insulina y la obesidad (142). Una mayor adherencia a la DMed no se asocia a una menor probabilidad de tener EHGNA, pero sí se asocia a un menor grado de resistencia a la insulina y a una menor gravedad de la enfermedad hepática entre los pacientes con EHGNA (140). Incluso sin pérdida de peso, la DMed redujo la esteatosis hepática y mejoró la sensibilidad a la insulina en una población resistente a la insulina con EHGNA, en comparación con los consejos dietéticos actuales (143).
2.3.1.3. Cirugía bariátrica
50) En los pacientes obesos con HGNA/EHNA se debe considerar la eficacia de la cirugía bariátrica en términos de reducción del peso, de mejora de la esteatosis hepática y la actividad necroinflamatoria, incluida la fibrosis, y de resistencia a la insulina. (Declaración 13, consenso fuerte, 100 % de acuerdo.)
Comentario
El efecto de la cirugía bariátrica sobre la histología hepática en biopsias pareadas se ha reportado en varios estudios (121-123,125,126,144). Claramente, la profunda pérdida de peso lograda con este enfoque tiene el potencial de resolver la EHNA hasta en un 80-100 % de los casos, y de mejorar sustancialmente la fibrosis, siendo este último el resultado más relevante con respecto a la supervivencia del paciente (145). Además, mejora la sensibilidad a la insulina y una proporción considerable de pacientes diabéticos no necesitarán más tratamiento antidiabético.
51) En los pacientes obesos con HGNA/EHNA sin cirrosis, una vez que las dietas de reducción del peso y las intervenciones intensivas sobre el estilo de vida hayan fracasado, se debe proponer la cirugía bariátrica. (Recomendación 45, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
La intervención sobre el estilo de vida, aunque es eficaz en algunos pacientes, a menudo no es suficiente para lograr la pérdida de peso a largo plazo y la resolución de la EHNA. Actualmente, ningún tratamiento farmacológico ha demostrado ser eficaz, aunque muchos compuestos están bajo investigación. La cirugía bariátrica es una posible opción de tratamiento para la EHGNA, en particular para su forma progresiva, la EHNA. No hay ensayos sistemáticos, controlados y aleatorizados que evalúen ningún procedimiento quirúrgico bariátrico para tratar específicamente la EHGNA o la EHNA. Una revisión sistemática y un metaanálisis de 15 estudios, que informaron sobre 766 biopsias hepáticas pareadas, mostraron que la proporción combinada de pacientes con mejoría o resolución de la esteatosis era del 92 %. La mejoría de la esteatohepatitis fue del 81 %, la de la fibrosis fue del 66 % y la resolución completa de la EHNA fue del 70 % (130). La mortalidad perioperatoria de la cirugía bariátrica es menor en los pacientes sin cirrosis en comparación con los pacientes con cirrosis compensada o descompensada (0,3 % frente a 0,9 % y 16,3 %) (146). Las guías europeas conjuntas de EASL, EASD y EASO establecen que, en los pacientes que no responden a los cambios de estilo de vida y la farmacoterapia, la cirugía bariátrica es una opción para reducir el peso y las complicaciones metabólicas, con resultados estables en cuanto a los efectos a largo plazo (118).
2.3.2. Comorbilidades
52) Al evaluar el pronóstico de los pacientes en los que la EHGNA/EHNA es un componente integral del síndrome metabólico, se debe considerar el efecto de la comorbilidad no hepática. (Declaración 9, consenso fuerte, 100 % de acuerdo.)
Comentario
En la EHGNA, la mortalidad general y cardiovascular aumenta en comparación con la población general. La EHGNA se asocia con una mayor tasa de mortalidad estandarizada en comparación con la población general, y la enfermedad hepática se sitúa ahora después de la enfermedad cardiovascular y el cáncer como principal causa de muerte. La obesidad grave antes del TxH se asocia con una mayor prevalencia de comorbilidades (diabetes, hipertensión), cirrosis criptogénica y mayor mortalidad por complicaciones infecciosas, enfermedades cardiovasculares y cáncer (147,148). El riesgo de diabetes y de diabetes de tipo 2 manifiesta se asocia con la EHGNA más grave, la progresión a EHNA, la fibrosis avanzada y el desarrollo del carcinoma hepatocelular (149,150), independientemente de las transaminasas séricas. Los pacientes con EHGNA también tienen un mayor riesgo (hasta 5 veces mayor) de desarrollar diabetes de tipo 2 después de ajustar los diversos factores de confusión metabólicos y de estilo de vida (151). Por lo tanto, las directrices europeas recomiendan que las personas con EHGNA se sometan a pruebas de detección de la diabetes y que los pacientes con diabetes de tipo 2 se evalúen para detectar la presencia de EHGNA, independientemente de las transaminasas séricas (118).
53) Se indicará a los pacientes con HGNA/EHNA que se abstengan de consumir alcohol para reducir el riesgo de comorbilidad y mejorar los parámetros hepáticos tanto histológicos como bioquímicos. (Recomendación 36, grado A, consenso fuerte, 100 % de acuerdo.)
Comentario
Al abordar la pregunta de si existen un patrón continuo de dosis-respuesta, un valor umbral, un efecto de género o desenlaces finales (morbilidad frente a mortalidad) del consumo de alcohol, Rehm y sus colaboradores analizaron 17 estudios en su revisión sistemática y metaanálisis (152). Concluyeron que existe un umbral para la morbilidad por cirrosis, pero no para la mortalidad, independientemente del sexo. Una vez que existen signos de enfermedad hepática de cualquier etiología, proponen abstenerse debido al mayor riesgo relativo de cualquier consumo asociado con la mortalidad (152). Además, en la HGNA/EHNA, los riesgos pueden verse agravados por la interacción con los fármacos tomados en asociación con entidades del síndrome metabólico. A diferencia de la población general, es posible que el consumo de alcohol no reduzca el riesgo de enfermedad cardiovascular en los pacientes con EHGNA (153).
54) Los pacientes con enfermedad celíaca y EHGNA/EHNA deben seguir una dieta libre de gluten para mejorar las enzimas hepáticas y la histología, y para prevenir la progresión a cirrosis, además de mejorar la patología intestinal. (Recomendación 37, grado B, consenso fuerte, 96 % de acuerdo.)
Comentario
Los pacientes con enfermedad celíaca tienen un mayor riesgo de enfermedad hepática antes o después del diagnóstico de la enfermedad. Según un análisis sistemático (154), la razón de riesgos (HR) de la HGNA/EHNA es de 2,8 (IC del 95 %: 2,0-3,8) en los pacientes con enfermedad celíaca e incluso mayor en el subgrupo de los niños (HR: 4,6; IC del 95 %: 2,3-9,1). Hay varios informes de la mejoría o incluso la normalización de las transaminasas, con tasas de respuesta de hasta el 75 % a 100 %, al instaurar una dieta libre de gluten (155-159). Un estudio de casos de Finlandia informó sobre cuatro pacientes con enfermedad hepática grave remitidos al centro de trasplantes, en los que se les diagnosticó una enfermedad celíaca durante la evaluación. Todos los pacientes respondieron a la dieta sin gluten y, en dos pacientes, la enfermedad hepática se resolvió por completo (160). De cinco pacientes estadounidenses con cirrosis hepática y enfermedad celíaca, la ALT, la AST y la bilirrubina mejoraron en los cuatro pacientes que cumplieron con la dieta; la puntuación MELD empeoró en un paciente con cirrosis por EHGNA pero mejoró en los tres restantes (161). Existe una asociación entre la enfermedad celíaca y la enfermedad hepática autoinmune (hepatitis autoinmune, colangitis biliar primaria). Asimismo, la restricción del gluten parece tener un papel en la reducción del riesgo de complicaciones (malabsorción, osteoporosis, malignidad) en este grupo de pacientes.
2.3.3. Suplementos
55) Se debe prescribir vitamina E (800 UI de α-tocoferol al día) a los adultos no diabéticos con EHNA confirmada histológicamente, con el objetivo de mejorar las enzimas hepáticas y la histología. (Recomendación 38, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
La eficacia de la vitamina E como antioxidante para mejorar las anomalías bioquímicas y/o histológicas de la EHNA se ha investigado en varios ensayos (100,162,163). Sin embargo, existe una gran heterogeneidad entre estos ensayos en cuanto a potencia estadística, criterios de inclusión, dosis de vitamina E, formulaciones de vitamina E utilizadas, uso adicional de otros antioxidantes u otros fármacos y datos histológicos para evaluar los resultados. A pesar de estas limitaciones, se pueden sacar las siguientes conclusiones con respecto a los adultos con EHNA: 1) el uso de la vitamina E se asocia a una mejora de las enzimas hepáticas (disminución de ALT y AST); 2) los ensayos que evalúan las características de la EHNA en biopsias hepáticas pareadas muestran una mejora de la esteatosis y la inflamación, y la resolución de la esteatohepatitis en los pacientes tratados con vitamina E en comparación con los controles; 3) la vitamina E tiene un efecto limitado o nulo sobre la fibrosis hepática. En el ensayo clínico aleatorizado (ECA) más grande (ensayo PIVENS), el criterio de valoración principal predefinido se logró en un número significativamente mayor entre los participantes que recibieron vitamina E oral (800 UI/d durante dos años) en comparación con el placebo (42 % frente a 19 %, p < 0,001, número necesario a tratar (NNT) = 4,4) (163). El reanálisis del ensayo PIVENS mostró que las respuestas de la ALT fueron más frecuentes en los receptores de vitamina E y se asociaron a una mejoría de la puntuación del índice de actividad de la EHGNA (NAS), pero no de las puntuaciones de fibrosis (164). Curiosamente, la vitamina E tuvo un efecto adicional en la mejora de las puntuaciones de ALT, índice de actividad de la EHGNA (NAS) y fibrosis obtenidas por una pérdida de peso > 2,0 kg (164).
56) Hasta que se disponga de más datos sobre su eficacia, no se pueden recomendar los antioxidantes (por ejemplo, vitamina C, resveratrol, antocianina, arándanos) para tratar la HGNA/EHNA. (Recomendación 39, grado 0, consenso fuerte, 100 % de acuerdo.)
Comentario
El resveratrol oral (3000 mg) durante ocho semanas no tuvo ningún efecto sobre la resistencia a la insulina, la esteatosis, la distribución de la grasa abdominal y los lípidos plasmáticos o la actividad antioxidante. Los niveles de ALT y AST, sin embargo, aumentaron significativamente en el grupo del resveratrol (165). En otro ensayo, se observó que 2 · 150 mg de resveratrol v.o. durante tres meses mejoraban los niveles de AST, ALT, LDL, colesterol total, HOMA-IR y mediadores de la inflamación (166). Una cápsula de 500 mg de resveratrol junto a una intervención sobre el estilo de vida fueron más eficaces que la intervención sobre el estilo de vida en solitario en pacientes con sobrepeso en términos de mejora de la ALT, las citocinas inflamatorias y la esteatosis hepática (167,168). El zumo de arándano, que contiene altos niveles de polifenoles, no tuvo ningún efecto sobre las medidas antropométricas y el HOMA-IR en pacientes chinos con normopeso y EHGNA en la ecografía (169). En un ensayo piloto controlado y aleatorizado, el flavonoide antocianina (320 mg v.o. durante doce semanas) disminuyó la ALT y el nivel de glucosa a las 2 horas de la carga (170). Se ha reportado que la suplementación con coenzima Q10 oral reduce la circunferencia de la cintura, los niveles séricos de AST y la capacidad antioxidante total de la sangre (171). En estudios epidemiológicos de pacientes con EHGNA se ha descrito una ingesta de vitamina C por debajo de la cantidad diaria recomendada, lo que sugiere una asociación entre los hábitos alimentarios, la enfermedad y la deficiencia de vitamina C. Los ECA actualmente disponibles no han encontrado ningún efecto de la vitamina C superior al del placebo. Por lo tanto, el papel de la vitamina C en la EHGNA debe investigarse en futuros ECA adecuadamente controlados. Se han implicado niveles anormalmente bajos de colina en la patogenia de la enfermedad hepática asociada a la nutrición parenteral, algunas de cuyas características morfológicas se asemejan a la EHGNA/EHNA (172). Un análisis secundario de los cuestionarios de alimentos de 664 participantes de tres ensayos de la Red de Investigación Clínica de EHNA mostró que, en las mujeres posmenopáusicas, una menor ingesta de colina se asoció con un aumento de la fibrosis (173). En esta línea, los datos sugieren que una mayor ingesta de colina en la dieta puede estar asociada con un menor riesgo de EHGNA. Por otro lado, en la EHNA se ha observado una estrecha relación entre los niveles plasmáticos de colina libre y el grado de esteatosis y fibrosis hepática (174). No hay datos de los ensayos de intervención con colina. En comparación con el placebo, la suplementación oral de L-carnitina (1 g dos veces al día durante 24 semanas) fue eficaz para reducir el TNF-α y la PCR, y para mejorar la función hepática, el nivel de glucosa en plasma, el perfil de lípidos, el HOMA-IR y las manifestaciones histológicas de la EHNA (175). En pacientes diabéticos con EHNA, el orotato de carnitina oral (3 · 824 mg durante doce semanas) se asoció a una mejoría significativa de la ALT, la esteatosis hepática y la HbA1c en un ensayo doble ciego controlado con placebo (176). Estos son resultados preliminares y, por lo tanto, todavía no se puede recomendar la L-carnitina.
57) Hasta que se disponga de más datos sobre su eficacia, los ácidos grasos omega-3 no pueden recomendarse para tratar la HGNA/EHNA. (Recomendación 40, grado 0, consenso fuerte, 100 % de acuerdo.)
Comentario
En pacientes con solo EHGNA, hubo una tendencia hacia la mejora de la esteatosis hepática en los casos tratados con 4 g de ácidos grasos omega-3 (177). Sin embargo, un ensayo multicéntrico que comparó dos regímenes de dosis de ácido etil-eicosapentanoico (1800 mg/d o 2700 mg/d) con placebo no encontró efecto alguno sobre las enzimas hepáticas, la resistencia a la insulina, la adiponectina, la queratina 18, la proteína C-reactiva, el ácido hialurónico o la histología hepática en 243 pacientes con EHNA comprobada por biopsia (178). En un ensayo controlado más pequeño, 3 g de ácidos grasos omega-3 mejoraron el contenido de grasa hepático, pero fallaron en mejorar la histología de la EHNA (mejoría ≥ 2 puntos del NAS) (179). En un ensayo que comparó el efecto de 4 g de ácidos grasos omega-3 y de la dapagliflozina, sola o en combinación, solo la combinación fue más efectiva que el placebo para reducir los lípidos intrahepáticos (180). Los autores de una revisión sistemática y un metaanálisis concluyeron que, en los pacientes con EHGNA, los ácidos grasos omega-3 reducen la grasa hepática, pero no se determinó la dosis óptima, por lo que se necesitan estudios controlados de mejor calidad (181). Sin embargo, en una revisión sistemática reciente, los autores concluyen que es probable que los AGPI n-3 marinos sean una herramienta importante para el tratamiento de la EHGNA, aunque se necesitan más estudios para confirmarlo (182). Los autores de otro metaanálisis concluyeron que los AGPI de cadena larga omega-3 son útiles en el tratamiento dietético de los pacientes con EHGNA, pero son ineficaces sobre los hallazgos histológicos de los pacientes con EHNA (183).
58) Se pueden usar suplementos Nutricionales que contengan probióticos o simbióticos seleccionados para mejorar las enzimas hepáticas en los pacientes con HGNA/EHNA. (Recomendación 41, grado 0, consenso, 89 % de acuerdo.)
Comentario
Una revisión sistemática identificó nueve artículos de texto completo sobre ensayos clínicos aleatorizados que habían evaluado probióticos, prebióticos o simbióticos en el tratamiento de la EHGNA en adultos; de ellos, seis fueron excluidos debido a deficiencias metodológicas (184). Un ensayo controlado, aleatorizado y doble ciego de 30 pacientes con EHGNA comprobada por biopsia mostró una disminución significativa pero muy modesta de ALT, AST y GGT después de tres meses de tratamiento con el probiótico, pero no con placebo (185). Una comparación de los probióticos frente a la atención estándar mostró una disminución de los triglicéridos intrahepáticos (espectroscopía de RM) y de la AST sérica en los diez pacientes del grupo con probióticos (186). En pacientes con EHNA comprobada por biopsia, el tratamiento con Bifidobacterium longum, con fructooligosacáridos y con modificación del estilo de vida durante 24 semanas, en comparación con la modificación del estilo de vida sola, redujeron los niveles de AST, los marcadores de inflamación, el HOMA-IR, la endotoxina sérica y la histología de la EHNA en ambos grupos, pero más en el grupo tratado con simbiótico (187). En un ensayo clínico aleatorizado, doble ciego y controlado con placebo, 52 pacientes con EHGNA fueron aleatorizados para tomar dos veces al día, durante 28 semanas, una cápsula de simbiótico o placebo, además de la modificación del estilo de vida. En el grupo del simbiótico, los niveles de ALT, AST, GGT, PCR y citocinas inflamatorias disminuyeron en mayor grado que en el grupo del placebo (188). Se ha informado de que el consumo diario de 300 g (8 semanas) de yogur con probióticos mejora las enzimas hepáticas en los pacientes con EHGNA en comparación con el yogur convencional (189).
2.3.4. Nutrición médica (NE, NP)
59) Se debe administrar NE o NP a los pacientes con HGNA/EHNA durante una enfermedad intercurrente grave, cuando la nutrición oral por sí sola sea inadecuada o imposible o esté contraindicada. (Recomendación 42, grado GPP, consenso fuerte, 96 % de acuerdo.)
Comentario
No hay datos de ensayos formales de terapia Nutricional que aborden estas preguntas. Un análisis que utilizó la base de datos de la Encuesta Nacional de Examen de Salud y Nutrición de Corea encontró que el 12 % de los sujetos con EHGNA eran sarcopénicos y, curiosamente, su IMC era significativamente más alto que el de los individuos no sarcopénicos (190). Además, la sarcopenia se asoció sistemáticamente con una fibrosis hepática significativa. Basándose en los numerosos informes sobre el papel pronóstico del mal consumo de alimentos entre los pacientes hospitalizados en general y entre pacientes con EHA o cirrosis hepática en particular, los expertos recomiendan el soporte Nutricional también en los pacientes con EHGNA/EHNA que no pueden lograr una ingesta adecuada de alimentos mientras padecen enfermedades intercurrentes graves. Además, en este grupo de pacientes se recomienda la detección del riesgo de desnutrición y una evaluación Nutricional adecuada.
60) En los pacientes con HGNA/EHNA y un IMC < 30 kg/m2, la NE y/o la NP deben realizarse según lo recomendado para los pacientes con EHA (Recomendación 43, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Véanse el comentario del punto 59 y los comentarios de los puntos 33, 34, 38 y 40 sobre la NE/NP en pacientes con EHA.
61) Los pacientes obesos con HGNA/EHNA y enfermedades intercurrentes deben recibir NE y/o NP con un objetivo de aporte energético de 25 kcal·kg-1 de peso corporal ideal (PCI)·d-1 y un objetivo de aporte de proteínas aumentado de 2,0-2,5 g·kg-1 PCI·d-1. (Recomendación 44, grado GPP, acuerdo mayoritario, 71 % de acuerdo.)
Comentario
Un número creciente (30-35 %) de pacientes adultos en las UCI son obesos, y al menos el 5 % son obesos mórbidos. El soporte Nutricional de estos pacientes es un desafío y uno de los aspectos más difíciles de la nutrición clínica. La obesidad repercute sobre la incidencia y la gravedad de las comorbilidades y el resultado final del paciente. De acuerdo con las pautas de la ASPEN, estos pacientes deben ser atendidos de acuerdo con los principios básicos de la nutrición de cuidados intensivos, con el objetivo de un aporte alto de proteínas (2,0-2,5 g·kg-1 PCI·d-1) para la preservación de la masa corporal magra pero un régimen hipocalórico (25 kcal·kg-1 PCI·d-1) destinado a reducir la masa grasa y la resistencia a la insulina (191). Entre el grupo de consenso, el acuerdo sobre esta recomendación fue limitado debido a la débil evidencia disponible. Sin embargo, ante el creciente número de pacientes obesos con HGNA/EHNA, se consideró apropiada la referencia a la guía de cuidados críticos de la ASPEN.
2.4. CIRROSIS HEPÁTICA (Figs. 10-12)
2.4.1. Riesgo de desnutrición
62) En los pacientes con cirrosis hepática debe esperarse una alta prevalencia de la desnutrición, la depleción de proteínas y la deficiencia de oligoelementos. (Declaración 1, consenso fuerte, 100 % de acuerdo.)
Comentario
En la cirrosis hepática, la prevalencia y la gravedad de la desnutrición proteico-energética de tipo mixto están relacionadas con la etapa clínica de la enfermedad hepática crónica, aumentando del 20 % en los pacientes con enfermedad compensada a más del 60 % en aquellos otros con cirrosis avanzada. La etiología de la enfermedad hepática per se no parece influir en la prevalencia y el grado de desnutrición y depleción de proteínas, y la prevalencia más alta y el grado más profundo de desnutrición en los alcohólicos probablemente sean el resultado de factores adicionales que incluyan un estilo de vida poco saludable y carencias socioeconómicas. La composición corporal de los cirróticos se altera profundamente y se caracteriza por la depleción de proteínas y la acumulación de agua corporal total, que puede manifestarse incluso en los pacientes con enfermedad en fases tempranas, Child-Pugh clase A (192-194). Esto es paralelo a la retención de sodio y, por lo tanto, rara vez se asocia con hipernatremia. Con frecuencia se produce una depleción de potasio, magnesio, fosfato y otros minerales intracelulares. La deficiencia de vitaminas hidrosolubles, principalmente del grupo B, es común en la cirrosis, especialmente en la de origen alcohólico. Se ha observado deficiencia de vitaminas liposolubles en la esteatorrea relacionada con la colestasis, en la deficiencia de sales biliares y en los alcohólicos. En la cirrosis, la desnutrición se asocia con una mayor prevalencia de la ascitis y el síndrome hepatorrenal, una mayor duración de la estancia y los costes hospitalarios (195), y una mayor mortalidad (194). En varios estudios descriptivos se reportan tasas más altas de morbilidad (23,196,197) y mortalidad (24,31,197-199) en los pacientes con desnutrición preoperatoria y/o sarcopenia que se someten a trasplante por enfermedad hepática crónica en etapa terminal.
63) En la cirrosis hepática debe esperarse un deterioro progresivo, dependiente del estadio, del metabolismo de carbohidratos, proteínas y lípidos, caracterizado por depleción del glucógeno hepático, alteración del metabolismo no oxidativo de la glucosa y reducción de la tasa de síntesis de albúmina (Declaración 3, consenso fuerte, 100 % de acuerdo.)
Comentario
En la cirrosis, en el estado postabsortivo, la tasa de oxidación de la glucosa se reduce y la tasa de producción de glucosa hepática es baja, a pesar del aumento de la gluconeogénesis, debido a la depleción del glucógeno hepático (200). Por lo tanto, después de una noche de ayuno, las condiciones metabólicas son similares a las del ayuno prolongado en los individuos sanos (201). La resistencia a la insulina afecta al metabolismo del músculo esquelético: la captación de glucosa, la eliminación no oxidativa de la glucosa y la síntesis de glucógeno se reducen, mientras que la oxidación de la glucosa y la producción de lactato son normales después del suministro de glucosa. Entre el 15 % y el 37 % de los pacientes desarrollan diabetes, lo cual se asocia con un pronóstico desfavorable (202,203). La utilización de combustibles oxidativos se caracteriza por una mayor tasa de oxidación de lípidos en ayunas y la aparición frecuente de resistencia a la insulina (incluso en pacientes Child-Pugh A) (201,204).
Los niveles plasmáticos de ácidos grasos esenciales y poliinsaturados disminuyen en la cirrosis, y esta reducción se correlaciona con el estado Nutricional y la gravedad de la enfermedad hepática (205,206). En la cirrosis se ha observado un recambio de proteínas normal o aumentado debido a una mayor degradación de las proteínas y/o una menor síntesis de proteínas. Las tasas de síntesis de albúmina, pero no de fibrinógeno, se correlacionan con las pruebas cuantitativas de la función hepática y las etapas clínicas de la cirrosis. Sin embargo, los cirróticos estables aparentemente son capaces de una retención eficiente de nitrógeno y una formación significativa de masa corporal magra a partir del aumento de la ingesta de proteínas durante la realimentación oral (34).
64) En el tratamiento de los pacientes con cirrosis gravemente desnutridos se espera una supervivencia menor, en comparación con los pacientes no desnutridos. (Declaración 8, consenso fuerte, 100 % de acuerdo.)
Comentario
En los pacientes con cirrosis gravemente desnutridos, varios estudios reportaron una mayor morbilidad y mortalidad (194,207), así como una mayor mortalidad después del TxH (31,196,199,207-210). Los datos son controvertidos con respecto a la mayor prevalencia de la encefalopatía hepática en los pacientes desnutridos con cirrosis (204,211).
2.4.2. Nutrición oral
2.4.2.1. Consejo dietético
65) Se debe implementar un consejo Nutricional específico para los pacientes cirróticos, utilizando un equipo multidisciplinar para mejorar el resultado/la supervivencia de los pacientes a largo plazo. (Recomendación 46, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
La terapia Nutricional debe incluirse en el tratamiento de los pacientes con cirrosis ya que tiene el potencial de alterar el comportamiento de los pacientes. Debe incluir la educación de los pacientes acerca de los beneficios de una dieta saludable adaptada a la condición clínica, así como orientada a abordar necesidades específicas. Cuando es necesario cambiar las prescripciones Nutricionales en respuesta a la gravedad de la enfermedad, el consejo Nutricional puede facilitar la forma de afrontar estos cambios. Un pequeño estudio retrospectivo unicéntrico mostró un beneficio sobre la supervivencia cuando los pacientes con cirrosis recibieron consejo Nutricional especializado en comparación con ningún consejo (212). Los autores también informaron de que el asesoramiento en el que participa un equipo multidisciplinar, con médicos, enfermeras, farmacéuticos y dietistas, se asoció con una mejor supervivencia, frente al asesoramiento por una sola profesión (212).
66) La atención Nutricional multidisciplinar debe incluir el seguimiento del estado Nutricional y proporcionar orientación para lograr los objetivos Nutricionales. (Recomendación 47, grado GPP, consenso fuerte, 95 % de acuerdo.)
Comentario
Véase el comentario del punto 65.
67) Los períodos de ayuno deben ser breves, consumiéndose de tres a cinco comidas al día, y se debería recomendar un refrigerio por la noche para mejorar el estado total de las proteínas corporales. (Recomendación 58, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Según los datos publicados disponibles, los pacientes deben tener una ingesta energética de 30-35 kcal·kg-1·d-1 y una ingesta de proteínas de 1,2-1,5 g×kg-1·d-1. En un ensayo prospectivo bien realizado, que mide el nitrógeno corporal total, se ha demostrado que la administración nocturna de suplementos Nutricionales orales (SNO) es más eficaz para mejorar el estado de las proteínas corporales totales que la administración diurna (91). Anteriormente, se había demostrado que un refrigerio con carbohidratos al final de la noche mejoraba el metabolismo de las proteínas en la cirrosis (92,213). En su revisión sistemática, Tsien y colaboradores (84) demostraron que un refrigerio al final de la noche mejora el balance de nitrógeno, independientemente de la composición o el tipo de formulación utilizada. Llegan a la conclusión de que acortar los períodos de ayuno mediante un refrigerio nocturno es un concepto prometedor para revertir la resistencia anabólica y la sarcopenia de la cirrosis.
68) Los pacientes cirróticos en condiciones de mayor gasto energético (es decir, complicaciones agudas, ascitis refractaria) o desnutrición deben ingerir una mayor cantidad de energía. (Recomendación 50, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
En general, los requerimientos energéticos de los pacientes con cirrosis compensada no son mayores que los de los individuos sanos (ver puntos 8 y 10). Además, los pacientes con cirrosis tienen un nivel de actividad física reducido (33) y, por tanto, un gasto energético reducido debido a la actividad física. Los pacientes cirróticos, durante el curso natural de la enfermedad, tienden a disminuir espontáneamente su ingesta dietética (85,214). Esto es de especial relevancia en el subgrupo de pacientes con cirrosis hipermetabólica (hasta el 35 % de los pacientes con cirrosis) (29,30) o en aquellos con cirrosis avanzada con complicaciones, cuando el gasto energético puede aumentar. Por lo tanto, se recomienda medir el gasto energético siempre que sea posible (ver la recomendación 1). La nutrición oral, la NE y la NP se han utilizado en estudios a corto y largo plazo en pacientes cirróticos descompensados y/o desnutridos con algunas ventajas en términos tanto de morbilidad como de mortalidad.
69) En pacientes cirróticos con sobrepeso u obesidad no se recomienda una mayor ingesta energética (Recomendación 51, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
La proporción de pacientes con cirrosis y sobrepeso u obesidad ha aumentado incluso en las cohortes en lista de espera para trasplante (12,215,216). En la enfermedad hepática crónica, la obesidad se ha identificado como un factor de riesgo independiente de peor resultado clínico (217,218). Se ha propuesto que la obesidad podría promover la hipertensión portal. La hipertensión portal podría mejorarse mediante una intervención sobre el estilo de vida durante 16 semanas, mediante una dieta hipocalórica y un aumento del ejercicio en los pacientes con cirrosis (219). Por tanto, no se recomienda una mayor ingesta energética en los pacientes cirróticos obesos.
70) En los pacientes obesos con cirrosis hepática se debe implementar una intervención sobre el estilo de vida, teniendo como objetivo los efectos beneficiosos de la reducción del peso, incluida la reducción de la hipertensión portal. (Recomendación 56, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
En un reciente estudio multicéntrico no controlado (219) se valoró la respuesta a una dieta hipocalórica normoproteica más actividad física supervisada de 60 min/semana, durante 16 semanas, en pacientes con cirrosis compensada y con sobrepeso/obesidad (IMC ≥ 26 kg/m2), demostrándose que la intervención sobre el estilo de vida redujo significativamente el peso corporal (media: -5,0 ± 4,0 kg). Estos pacientes también presentaron una disminución significativa de la hipertensión portal, determinada mediante la medición del gradiente de presión portal. Aunque no se reportaron otros resultados, de confirmarse, estos hallazgos apoyan fuertemente la intervención sobre el estilo de vida de los pacientes cirróticos con obesidad u sobrepeso.
2.4.2.2. Requerimientos proteicos
71) Los pacientes con cirrosis compensada y normonutridos deben ingerir 1,2 g·kg-1·2d-1 de proteínas. (Recomendación 52, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Los pacientes cirróticos sarcopénicos y desnutridos presentan depleción proteica tanto por una elevada degradación de las proteínas corporales como por la disminución de su síntesis en los músculos (192,220). El incremento de la ingesta de proteínas se tolera generalmente bien y es seguro, habiéndose demostrado en estudios previos que mejora el anabolismo proteico (34,221). En un pequeño grupo de pacientes desnutridos, seguidos cuidadosamente, se demostró que una realimentación adecuada es capaz de inducir un incremento significativo de la síntesis proteica (222). Véase también el punto 72.
72) En los pacientes cirróticos desnutridos y/o sarcopénicos se recomienda una ingesta de 1,5 g·kg-1·d-1 de proteínas para una reposición adecuada. (Recomendación 53, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Los pacientes cirróticos sarcopénicos, incluidos aquellos con obesidad sarcopénica, pueden necesitar una ingesta mayor de proteínas junto con ejercicio para lograr la recuperación muscular. En los estudios de intervención que implementaron un protocolo con un aporte elevado de proteínas se observó una mejora de la circunferencia braquial, de la fuerza prensil de la mano y de los niveles de albúmina (10,223-226). Así mismo, se observó una mejoría del estado proteico cuando los SNO se administraron en horario nocturno (91), lo que refuerza las observaciones previas que apuntaban a un efecto beneficioso de la administración de un refrigerio nocturno de carbohidratos o proteínas en los pacientes cirróticos (92,213,221).
73) En los pacientes cirróticos con desnutrición o depleción muscular, la dieta oral debe aportar 30-35 kcal·kg-1·d-1 y 1,5 g·kg-1·d-1 de proteínas. (Recomendación 57, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Véase el comentario del punto 67.
74) En los pacientes cirróticos con encefalopatía hepática no se debe restringir el aporte de proteínas porque aumenta el catabolismo proteico. (Recomendación 54, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Hay un subgrupo seleccionado de pacientes cirróticos, los denominados "intolerantes a las proteínas", que desarrollan encefalopatía hepática con la dieta normoproteica, pero esto parece ser un fenómeno histórico puesto que, en la actualidad, rara vez vemos estos pacientes. En base a una serie de ensayos, se sugirió que la restricción de proteínas podría no ser necesaria para la prevención de la encefalopatía hepática (85,87,222). Finalmente, Córdoba y colaboradores, en un ECA (227), demostraron que la restricción de proteínas no tiene ningún beneficio sobre el curso de la encefalopatía hepática y puede empeorar el catabolismo proteico. Tras este estudio se abandonó definitivamente el dogma de prescribir la restricción proteica a los pacientes cirróticos con encefalopatía hepática, centrándose todos los esfuerzos en conseguir una ingesta adecuada de proteínas en este grupo de pacientes.
2.4.2.3. Requerimientos en AACR
75) En los pacientes cirróticos "intolerantes" a las proteínas se deben utilizar proteínas vegetales o AACR (0,25 g·kg-1·d-1) por vía oral con la finalidad de alcanzar un aporte adecuado de proteínas. (Recomendación 59, grado B, consenso, 89 % de acuerdo.)
Comentario
En un metaanálisis que excluyó los ensayos con SNO enriquecidos con AACR, en el análisis de un subgrupo de estudios se demostró una reducción de la mortalidad de los pacientes suplementados con SNO (228). Después del tratamiento exitoso de la hipertensión portal mediante derivación percutánea portosistémica intrahepática (DPPI), los pacientes cirróticos con alimentación normal (según las recomendaciones de la ESPEN) mejoraron su composición corporal (32,229).
En el caso muy raro de un paciente cirrótico "intolerante a las proteínas" que desarrolle encefalopatía hepática con una ingesta normal de proteínas mixtas, una dieta con proteínas vegetales puede ser beneficiosa. Aunque se ha abordado este problema en algunas revisiones (230), no hay datos de ensayos controlados y aleatorizados que comparen regímenes normocalóricos y normoproteicos. Un estudio no era controlado y en uno más reciente se comparó el soporte Nutricional con una dieta con proteínas vegetales frente a ningún soporte (232).
76) En los pacientes con cirrosis avanzada se deben prescribir suplementos orales de AACR (0,25 g·kg-1·d-1) a largo plazo, con la finalidad de mejorar la supervivencia libre de complicaciones y la calidad de vida. (Recomendación 60, grado B, consenso, 89 % de acuerdo.)
Comentario
No hay datos disponibles de ensayos que comparen una fórmula enteral estándar con fórmulas enriquecidas con AACR en pacientes cirróticos. Sin embargo, existen ensayos en los que se demuestra una mejoría de la supervivencia en pacientes severamente desnutridos con EHA o cirrosis (68,69,233,234) o del estado mental en un grupo muy seleccionado de pacientes cirróticos con encefalopatía hepática e intolerancia a las proteínas (235). En los dos ensayos más grandes (174 y 646 pacientes), la suplementación oral con AACR (12 y 24 meses) fue útil para prevenir la insuficiencia hepática progresiva y mejorar los marcadores indirectos, así como la calidad de vida relacionada con la salud (236,237). En pacientes cirróticos, después de un episodio de EH, la suplementación con AACR durante doce meses mejoró la encefalopatía hepática mínima y la masa muscular, pero no disminuyó la recurrencia de la encefalopatía hepática clínica o manifiesta en comparación con el grupo de control (238). En los ensayos en los que se informó de efectos beneficiosos sobre el estado mental y/o el metabolismo proteico, los AACR se administraron en una dosis de 0,20-0,25 g·kg PCI-1·d-1 (236,237,239,240) o 30 g·d-1 (235,238). En un metaanálisis de la Cochrane se encontró un efecto beneficioso de los AACR sobre la encefalopatía hepática (241), aunque la calidad metodológica de los estudios incluidos es baja (242,243). Además, hay que tener en cuenta que los suplementos orales de AACR en muchos países no están financiados, lo que, unido a la palatabilidad, puede afectar al cumplimiento de los tratamientos.
2.4.2.4. Micronutrientes/dieta baja en sal
77) En los pacientes cirróticos se deben administrar micronutrientes para tratar los déficits confirmados o sospechados clínicamente. (Recomendación 55, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Los pacientes cirróticos pueden presentar déficit de vitaminas hidrosolubles, en particular de tiamina, y de vitaminas liposolubles como la vitamina D (244,245). Aunque no existen estudios que evalúen sistemáticamente la necesidad de micronutrientes de los pacientes cirróticos, igual que en otras patologías, no se ha probado el efecto beneficioso de su administración aparte de la prevención o corrección de estados carenciales ya probados. Algunos estudios señalan que los suplementos de zinc y vitamina A, al mejorar la disgeusia, pueden mejorar indirectamente la ingesta y el estado Nutricional (246,247). En los pacientes con hepatopatía alcohólica y no alcohólica se han observado déficits de zinc y selenio, y en series de casos se ha descrito una asociación importante entre la encefalopatía hepática y el déficit de zinc. Sin embargo, los ensayos clínicos controlados y aleatorizados no mostraron ningún efecto beneficioso de la administración de suplementos de zinc sobre la encefalopatía hepática (250-252). La suplementación con zinc puede aumentar la producción de urea cuando se normalizan los niveles previamente bajos (253). En un enfoque pragmático, se recomienda una suplementación libre en las dos primeras semanas de soporte Nutricional, porque el diagnóstico de déficit de un oligoelemento específico o vitamínico puede ser costoso y puede retrasar el inicio de la suplementación. Debido a la alta prevalencia de la desnutrición, los pacientes cirróticos tienen riesgo de desarrollar síndrome de realimentación y déficit de tiamina.
78) Cuando se prescriben dietas bajas en sodio (poco palatables), debemos tener en cuenta que pueden incrementar el riesgo de una ingesta aun menor de alimentos, en contraposición a un beneficio moderado en el tratamiento de la ascitis. Se debe tener cuidado de no comprometer la palatabilidad de la dieta tras la reducción del sodio. (Recomendación 61, grado GPP, consenso, 78 % de acuerdo.)
Comentario
Basándonos en la fisiopatología de la ascitis, generalmente se recomienda una ingesta moderada de sodio (60 mmol/día). El efecto beneficioso de la restricción de sodio puede verse contrarrestado por una ingesta calórica y proteica disminuida debido a la palatabilidad de dicha dieta (254,255). Por lo tanto, se debe tener mucho cuidado y procurar garantizar una nutrición adecuada al prescribir dietas con restricción de sodio. En un estudio de pacientes cirróticos con ascitis refractaria se demostró que las tasas de morbilidad y mortalidad fueron menores en quienes recibieron una dieta equilibrada con AACR, con o sin aporte de NP complementaria, en comparación con un grupo de pacientes que solo recibieron una dieta baja en sodio (256).
2.4.3. Nutrición médica
2.4.3.1. NE y NP
79) En los pacientes cirróticos que no puedan ser alimentados por vía oral o en los que sea imposible alcanzar los objetivos Nutricionales mediante una dieta oral, se debe utilizar la NE. (Recomendación 62, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Existe una amplia evidencia que indica que asegurar una ingesta de nutrientes cuantitativamente adecuada debería ser el objetivo principal (85,233). Si los requerimientos Nutricionales no se pueden alcanzar mediante una nutrición oral sola o en combinación con SNO, debemos recurrir a la NE. Se ha demostrado que la NE mejora la función hepática y la supervivencia (85,233). Un reciente ensayo controlado, aleatorizado y multicéntrico no mostró ningún beneficio ni sobre la función hepática ni sobre la supervivencia tras un año de seguimiento, utilizando una fórmula estándar de NE durante un promedio de 2,8 semanas seguido de SNO durante 2 meses (257). Los autores no proporcionan datos sobre la adherencia al tratamiento con SNO. La ingesta total de energía durante la NE solo se evaluó en un subgrupo de pacientes y superó la ingesta recomendada en un 28 % (3292 +/- 781 kcal/d), por lo que se plantea un interrogante sobre los efectos perjudiciales de la sobrealimentación. En un metaanálisis, Ney y colaboradores (228), al analizar un subgrupo de 3 de los 4 estudios con SNO incluidos, encontraron una reducción de la mortalidad, pero no para el grupo completo de 6 estudios incluidos en dicho metaanálisis. Además, los resultados se ven ensombrecidos por incluirse un estudio en el que el tratamiento con NE era solo durante 3 días (258) y por no incluir 2 ensayos controlados relevantes sin motivos justificables (85,233).
80) La NP, en los pacientes cirróticos, debe usarse cuando la nutrición oral y/o enteral son ineficaces o no factibles. (Recomendación 65, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
La indicación de la NP en los pacientes cirróticos que no pueden ser alimentados por vía oral o mediante NE mantiene las mismas recomendaciones que la de los pacientes no cirróticos (94). Hay que tener cuidado para evitar infecciones de las vías de acceso parenteral, ya que estos pacientes son más propensos a las infecciones y la sepsis. Hay que mencionar dos aspectos específicos de la cirrosis: en la cirrosis, los lípidos infundidos se eliminan del plasma y se oxidan a velocidades similares a las observadas en los individuos sanos. En lactantes y niños, las emulsiones que contienen aceite de pescado parecen estar asociadas con un menor riesgo de colestasis y daño hepático (véanse los puntos 10 y 11). Sin embargo, hasta el momento no hay resultados de ensayos clínicos que muestren un beneficio de tales emulsiones en pacientes cirróticos adultos. En cuanto a la composición de las soluciones de aminoácidos, se puede usar una solución estándar en los pacientes con cirrosis compensada. Las soluciones específicas hepáticas ("fórmula hepática") de aminoácidos, destinadas a la corrección del desequilibrio de aminoácidos plasmáticos, son soluciones completas con alto contenido de AACR (35-45 %) pero bajo de triptófano, aminoácidos aromáticos y aminoácidos azufrados, y se han desarrollado para pacientes cirróticos con encefalopatía hepática clínica. La eficacia de los AACR o las soluciones enriquecidas con AACR se ha investigado en ensayos controlados, aunque estos son muy heterogéneos (259,260) y sus resultados, contradictorios. Los metaanálisis de estos estudios mostraron una mejora de la encefalopatía hepática en el grupo con soluciones enriquecidas con AACR, pero no demostraron beneficio alguno sobre la supervivencia (242,261).
81) En los pacientes cirróticos, la intervención Nutricional (oral, NE o NP) debe implementarse de acuerdo con las guías de práctica clínica vigentes para pacientes no cirróticos. (Recomendación 48, grado A, consenso, 89 % de acuerdo.)
Comentario
En principio, las indicaciones diferenciales de la nutrición oral, la NE y la NP en los pacientes cirróticos no son distintas de las recogidas en las guías de práctica clínica para los pacientes no cirróticos. Sin embargo, cabe señalar que los pacientes cirróticos suelen presentar depleción de glucógeno hepático y recurren al catabolismo proteico para la gluconeogénesis mucho antes que los pacientes no cirróticos; por ejemplo, tan pronto como después de un ayuno nocturno (véase el Capítulo 1, Recomendaciones generales). Por lo tanto, la instauración oportuna del soporte Nutricional es de primordial importancia para proporcionar combustible metabólico y sustrato al anabolismo proteico.
82) En los pacientes cirróticos, la intervención Nutricional (oral, NE o NP) debe recomendarse para obtener un posible beneficio clínico sin que se incrementen los efectos adversos. (Recomendación 49, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Como se ha comentado previamente, varios estudios de terapia Nutricional en pacientes cirróticos han mostrado beneficio en los resultados clínicos, incluso en la supervivencia. Sin embargo, los recientes metaanálisis no confirman el beneficio sobre la supervivencia (81-83,228). Metodológicamente, estos metaanálisis adolecen de varios defectos, como incluir pacientes cirróticos y con esteatohepatitis alcohólica (EHA), incluir estudios con solo 3 días de tratamiento Nutricional o excluir ensayos adecuados sin una razón obvia.
2.4.3.2. Sondas de nutrición enteral
83) Las varices esofágicas no son una contraindicación absoluta para la colocación de una sonda nasogástrica. (Recomendación 63, grado 0, consenso fuerte, 100 % de acuerdo.)
Comentario
En 10 pacientes con encefalopatía hepática aguda de grado I-II, la alimentación por sonda nasogástrica usando una fórmula enriquecida con AACR fue beneficiosa con respecto a la recuperación de la encefalopatía hepática, sin complicaciones por hemorragia varicosa (86). No hay evidencia en la literatura actual (85,233,258,262) que indique que las varices esofágicas representan un riesgo inaceptable para el uso de sondas de alimentación de pequeño calibre para la NE.
84) La colocación de una PEG (gastrostomía endoscópica percutánea [por sus siglas en inglés]) se asocia a un riesgo alto de complicaciones por ascitis o varices, por lo que su uso está reservado para casos excepcionales. (Recomendación 64, grado 0, consenso fuerte, 100 % de acuerdo).
Comentario
En cuanto a la colocación de una sonda de gastrostomía, la guía europea (263) establece como contraindicaciones las alteraciones graves de la coagulación (INR > 1,5, TTP > 50 s, plaquetas < 50.000/mm3) y la ascitis severa. De acuerdo con esas guías, no se observó ningún incremento de la morbilidad cuando se colocó una PEG en presencia de ascitis leve a moderada. Sin embargo, en una serie de 26 pacientes se produjeron 2 fallecimientos como consecuencia directa de la colocación de la PEG (264). Debe tenerse en cuenta que, en la cirrosis, la hipertensión portal puede conducir a un aumento del número y el calibre de los vasos en la pared gástrica, que en caso de ser lesionados durante la colocación de la PEG pueden convertirse en causa de hemorragia significativa.
2.5. TRASPLANTE HEPÁTICO (TXH) Y CIRUGÍA (Figs. 13 y 14)
2.5.1. Fase preoperatoria
2.5.1.1. Cribado, valoración y cuidados generales
85) Los pacientes con cirrosis hepática programados para cirugía electiva o en lista de trasplante deben ser cribados y valorados oportunamente para detectar si existe desnutrictición, con el fin de tratarla antes de la cirugía y así mejorar su estado proteico. (Recomendación 66, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
En los pacientes cirróticos desnutridos, el riesgo de morbilidad y mortalidad está incrementado tras la cirugía abdominal (265,266). Numerosos estudios descriptivos han demostrado una mayor morbilidad y mortalidad en los pacientes cirróticos con desnutrición proteica cuando se someten a TxH (31,199,208-210,267-269). Recientemente, se ha demostrado que la sarcopenia y la fragilidad conllevan un mayor riesgo de morbilidad y mortalidad tanto en la lista de espera de trasplante como después del trasplante (12,13,15,16,21-24,197,216,234). Los pacientes en lista de espera están en riesgo debido a una ingesta alimentaria inadecuadamente baja, y los que consumen una dieta baja en proteínas (< 0,8 g·kg-1·d-1) tienen un riesgo incrementado de mortalidad en lista de espera (270). Los resultados de un estudio piloto sugieren que el soporte Nutricional preoperatorio mejora el estado proteico y disminuye las tasas de infección postoperatoria (271), pero no hay ensayos controlados que demuestren que la intervención Nutricional mejore los resultados clínicos.
86) En el periodo preoperatorio inmediato, los pacientes con cirrosis hepática deben ser tratados de acuerdo con los protocolos ERAS, para evitar una inanición innecesaria. (Recomendación 67, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
El glucógeno hepático está deplecionado en los pacientes con cirrosis. Por ello se recomienda acortar lo máximo posible los periodos sin ingesta de nutrientes, para evitar la neoglucogénesis a partir de proteínas musculares en individuos que basalmente ya presentan depleción proteica. En la cirugía hepática, la adopción de protocolos ERAS mejora la morbilidad y la estancia media hospitalaria cuando, entre otras medidas, los pacientes reciben carbohidratos en forma de líquidos claros hasta dos horas antes de la cirugía, así como alimentación y movilización precoz (37,272,273).
87) En los pacientes con cirrosis hepática programados para cirugía electiva, el tratamiento Nutricional debe realizarse como se recomienda para la cirrosis hepática. (Recomendación 68, grado GGP, consenso fuerte, 100 % de acuerdo.)
Comentario
Los pacientes con cirrosis hepática programados para cirugía electiva deben ser tratados como pacientes cirróticos no obesos, utilizando los mismos objetivos de ingesta de energía y proteínas. Tanto la desnutrición (IMC < 18,5 kg·m-2) como la obesidad de grado III (BMI > 40 kg·m-2) antes del TxH se asocian a un incremento de las tasas de mortalidad y morbilidad (147,148).
2.5.1.2. Requerimiento energético
88) Preoperatoriamente, se debe tener como objetivo una ingesta energética total de 30-35 kcal·kg-1·d-1 (126-147 kJ·kg-1·d-1) y proteica de 1,2-1,5 g·kg-1·d-1. Estos rangos cubren las ingestas recomendadas para cumplir los objetivos de tratamiento, es decir, para el mantenimiento o mejora del estado Nutricional. (Recomendación 69, grado GGP, consenso fuerte, 100 % de acuerdo.)
Comentario
Véanse los comentarios de los puntos 71-73.
89) A los pacientes obesos se les puede administrar NE y/o NP con un objetivo de aporte de energía de 25 kcal·kg-1 PCI·d-1 y un objetivo de aporte de proteínas aumentado de 2,0-2,5 g·kg-1 PCI·d-1. (Recomendación 70, grado GPP, consenso fuerte, 93 % de acuerdo.)
Comentario
La obesidad severa antes del TxH se asocia a una alta prevalencia de comorbilidades (diabetes mellitus, hipertensión arterial), a la cirrosis criptogénica y a un aumento de la mortalidad por complicaciones infecciosas, enfermedades cardiovasculares y cáncer (147,148). En este grupo de pacientes, la presencia y el grado de ascitis parecen aumentar con el grado de obesidad, por lo que la sustracción de la cantidad de líquido ascítico extraído puede usarse para calcular el "IMC seco". Algunos autores encontraron que la obesidad grave se asocia a mayor morbilidad y mortalidad incluso cuando los pacientes se clasifican según el "IMC seco" (147,274), mientras que otros estudios señalan que es la cantidad de ascitis la que aumenta el riesgo de mortalidad y no el IMC (147) y otros más no abordaron directamente este problema (274,148). También hay que señalar que, en la hepatopatía crónica, la obesidad es un factor de riesgo de peores resultados clínicos (217,218).
90) En los pacientes con EHNA y sobrepeso/obesidad programados para cirugía electiva, el tratamiento Nutricional debe realizarse como se recomienda para la EHNA. (Recomendación 71, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Véase el comentario del punto 89.
2.5.1.3. AACR y otros regímenes especializados
91) En los pacientes adultos, para la nutrición preoperatoria se deben usar regímenes Nutricionales estándar, ya que los regímenes especializados (como, por ejemplo, las dietas enriquecidas con AACR o inmunomoduladoras) no fueron superiores a la nutrición estándar en cuanto a morbilidad y mortalidad. (Recomendación 72, grado A, consenso fuerte, 100 % de acuerdo.)
Comentario
El consejo Nutricional más el SNO y el consejo Nutricional solo fueron igual de efectivos en los pacientes cirróticos en lista de espera de trasplante (225). En un ensayo clínico controlado y aleatorizado de pacientes cirróticos sometidos a trasplante, el uso de suplementos orales inmunomoduladores no aportó ninguna ventaja con respecto a los suplementos estándar dentro del soporte Nutricional preoperatorio (90). Sin embargo, en un ensayo clínico controlado y aleatorizado, el uso de probióticos desde la inclusión en lista hasta el trasplante se asoció con menos infecciones, un descenso más rápido de ALT y AST, y menores niveles de bilirrubina en el postoperatorio, en comparación con los controles (275). Kaido y colaboradores mostraron en sus trabajos, aunque estos no fueron aleatorizados, que los pacientes que recibieron fórmulas de SNO enriquecidas con AACR en la fase preoperatoria presentaron menos infecciones postoperatorias (276,277). Un estudio retrospectivo concluye que los pacientes suplementados con AACR por vía oral en el preoperatorio presentaban menores tasas de bacteriemia en el postrasplante (278).
92) En los pacientes pediátricos en lista de espera de trasplante se deben utilizar fórmulas enriquecidas con AACR para mejorar la masa celular corporal. (Recomendación 73, grado B, consenso fuerte, 93 % de acuerdo.)
Comentario
Los pacientes pediátricos trasplantados, afectados predominantemente de enfermedades hepáticas colestásicas, mejoraron su masa celular corporal al recibir fórmulas enriquecidas con AACR (279).
93) No se pueden hacer recomendaciones con respecto al acondicionamiento de donantes u órganos mediante el uso de regímenes Nutricionales específicos, como la administración de glutamina o arginina i.v., con el objetivo de minimizar el daño por isquemia/reperfusión. (Recomendación 82, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Los estudios en animales indican que una nutrición equilibrada de los donantes de hígado en muerte cerebral, usando una moderada cantidad de carbohidratos, lípidos (ácidos grasos de cadena larga y posiblemente aceite de pescado) y aminoácidos, se asocia a un mejor funcionamiento del órgano trasplantado (280). No obstante, actualmente se desconoce el impacto que puede tener el acondicionamiento de donantes u órganos con la finalidad de disminuir el daño de isquemia-reperfusión mediante la administración de altas dosis de arginina o glutamina.
2.5.2. Fase postoperatoria
2.5.2.1. Riesgo de sarcopenia
94) Tras el TxH por cirrosis hepática debe esperarse una recuperación prolongada e incompleta del estado proteico corporal total. (Declaración 5, consenso fuerte, 100 % de acuerdo.)
Comentario
Plank y colaboradores informaron de una pérdida de 1,0 kg de proteína corporal total (equivalente a 5 kg de músculo esquelético), principalmente a partir del músculo esquelético, inmediatamente después de la cirugía, y que esta pérdida no se recuperaba hasta doce meses después del TxH (281). En un estudio que empleó la medición del potasio corporal total, con seguimiento de 24 meses tras el trasplante, se observó una pérdida postoperatoria inicial que no se siguió de una recuperación de la masa celular corporal (282). Desde el punto de vista fisiológico, Selberg y colaboradores (283,284) demostraron que la captación de glucosa y la eliminación no oxidativa de glucosa por el músculo esquelético no se habían normalizado hasta doce meses después del TxH. Como era de esperar, la función de los músculos respiratorios no volvió a la normalidad hasta 12 meses después del trasplante (281).
95) Después del TxH, se debe tener en cuenta el riesgo de desarrollar obesidad sarcopénica y síndrome metabólico, por lo que la rehabilitación Nutricional debe tener como objetivo una recuperación más rápida y temprana de la función muscular y del estado proteico. (Declaración 6, consenso fuerte, 100 % de acuerdo.)
Comentario
Después del trasplante, muchos pacientes desarrollan obesidad sarcopénica y síndrome metabólico. Algunos estudios mostraron un aumento de la masa grasa y persistencia de la sarcopenia y alteraciones de la eliminación de glucosa por parte del músculo esquelético. Estos hallazgos demuestran que el trasplante por sí solo no es capaz de revertir la disfunción metabólica en este grupo de pacientes (285). Los pacientes cirróticos en lista de espera de TxH presentan fatiga crónica y, dependiendo del estadio de la enfermedad, pérdida de capacidad física, empeoramiento de su calidad de vida, niveles muy bajos de actividad física (215) y pérdida progresiva de la masa muscular. En un estudio se demostró que el ejercicio estructurado durante 12 semanas mejoró los resultados del test de la caminata de 6 minutos y la calidad de vida (286). Después del trasplante, el nivel de actividad, la calidad de vida y la capacidad de ejercicio en general no se normalizan; sin embargo, los pacientes trasplantados que participaron en un protocolo estructurado de ejercicio y nutrición presentaron niveles significativamente superiores de VO2 máxima y mejor calidad de vida (287).
2.5.2.2. Manejo general/requerimiento energético
96) Después del TxH, la alimentación normal y/o la NE se deben iniciar dentro de las 12 a 24 horas siguientes a la cirugía para reducir la tasa de infecciones. (Recomendación 74, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
El inicio precoz de la NE, incluso 12 horas después de la cirugía, se asoció a una menor tasa de infecciones que la obtenida con la ausencia de soporte Nutricional (288). En una comparación directa entre la NP y la NE precoz, ambas estrategias se mostraron igualmente efectivas para mantener el estado Nutricional de los pacientes (289). En el postoperatorio hay una pérdida considerable de nitrógeno y los pacientes tienen un balance nitrogenado negativo durante períodos prolongados (90,281,290), por lo que requieren un aporte alto de proteínas y aminoácidos. Se han reportado aportes de proteínas o aminoácidos de 1,2-1,5 g·kg-1·d-1 (290).
97) Después de la cirugía programada, los pacientes con hepatopatía crónica deben tratarse de acuerdo con los protocolos ERAS. (Recomendación 75, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Véanse los comentarios de los puntos 86 y 96.
98) Después de la fase aguda postoperatoria se debe marcar como objetivo una ingesta energética de 30-35 kcal·kg-1·d-1 (126-147 kJ·kg-1·d-1) y una ingesta de 1,2-1,5 g·kg-1·d-1 de proteínas. (Recomendación 78, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Véanse los comentarios de los puntos 71 a 73.
2.5.2.3 Sondas de NE, probióticos, AACR
99) Para la NE precoz, las sondas nasogástricas o nasoyeyunales deben usarse como en la cirugía no hepática. (Recomendación 79, grado B, consenso fuerte, 100 % de acuerdo.)
Comentario
Los pacientes trasplantados que reciben NE precoz, doce horas después de la cirugía, desarrollan menos infecciones virales y tienen un mejor balance nitrogenado que aquellos que no reciben soporte Nutricional (288). En comparación con la NP, la NE reduce las tasas de complicaciones y los costos en los pacientes trasplantados (289). Para la NE precoz de los trasplantados hepáticos adultos se han utilizado tanto fórmulas poliméricas (291-294), con y sin prebióticos y probióticos, como fórmulas peptídicas (288,295,296). Las fórmulas se administraron mediante sondas nasogástricas o nasoyeyunales (288,289,293,295) o bien mediante sonda de yeyunostomía colocada durante la cirugía (291).
100) Después del trasplante se deben utilizar fórmulas enterales junto con probióticos seleccionados para disminuir la tasa de infecciones. (Recomendación 80, grado B, consenso, 86 % de acuerdo.)
Comentario
La administración perioperatoria de una mezcla de pre y probióticos (Lactobacillus spp. y otras bacterias metabolizadoras de ácido láctico) dio lugar a la reducción de las complicaciones infecciosas, comparada con la administración de prebióticos (293). Un metaanálisis reciente (297) que incluía ese estudio y dos estudios aleatorizados en los que usaron un solo Lactobacillus sp. (292) y dos Lactobacillus spp. y un Bifidobacterium sp. (291) mostró una reducción de la tasa de infecciones en el grupo de pacientes que recibieron prebióticos y probióticos.
101) Las fórmulas enriquecidas con AACR pueden utilizarse en los pacientes con encefalopatía hepática que precisen NE. (Recomendación 81, grado 0, acuerdo mayoritario, 79 % de acuerdo.)
Comentario
Un metaanálisis reciente (241) mostró que el uso de AACR por vía oral o enteral, comparado con los controles, tiene un efecto beneficioso en los pacientes cirróticos con encefalopatía hepática. Hasta la fecha no se ha abordado en estudios bien diseñados si las fórmulas enriquecidas con AACR u otros componentes Nutricionales especiales pueden prevenir la obesidad sarcopénica en los supervivientes a largo plazo de un TxH.
2.5.2.4 Indicadores de la NP
102) La NP es preferible al ayuno ya que reduce la tasa de complicaciones y el tiempo de ventilación mecánica, así como la estancia en la UCI, cuando la nutrición oral o la NE es imposible o impracticable. (Recomendación 76, grado B, consenso, 86 % de acuerdo.)
Comentario
Después del trasplante, la NP postoperatoria es superior a la infusión de fluidos y electrolitos en materia de reducción del tiempo de ventilación mecánica y estancia en la UCI (298). Después de la cirugía abdominal (no del trasplante), los pacientes cirróticos tienen una menor tasa de complicaciones y un mejor balance nitrogenado si reciben soporte Nutricional en lugar de solo fluidos y electrolitos (299,300). La NE (vía yeyunostomía) se ha asociado con un mejor balance del nitrógeno a los 7 días, comparada con la NP/NE secuencial (300).
103) La NP debe utilizarse en los pacientes con vía aérea no protegida y encefalopatía hepática cuando los reflejos tusígeno y deglutorio están comprometidos o bien la NE está contraindicada o es impracticable. (Recomendación 77, grado GPP, consenso fuerte, 100 % de acuerdo.)
Comentario
Véase el comentario del punto 39.