INTRODUCCIÓN
El término sarcopenia, del griego sarx, carne, y penia, pobreza (“pobreza de carne”), se definió por primera vez por Irwrin Rosenberg como el desgaste muscular relacionado con la edad, el cual destacó que “ninguna disminución asociada con la edad es más dramática o potencialmente más significativa desde el punto de vista funcional que la disminución de la masa corporal magra” (1). Aunque esta pérdida de masa muscular asociada a la edad tiene consecuencias para la salud, investigaciones posteriores indican que la pérdida de fuerza muscular durante el envejecimiento supera la pérdida de masa muscular hasta en cinco veces (2), y que una baja fuerza muscular se asocia más consistentemente con el deterioro funcional que la reducción de masa muscular (3). En consecuencia, actualmente la sarcopenia se describe como una afección multidimensional que requiere la evaluación de la masa muscular, la fuerza muscular y el rendimiento físico.
En los últimos años, se ha dirigido la atención a la coexistencia de la sarcopenia con otra enfermedad crónica frecuente, la diabetes mellitus tipo 2 (DM2) (4), ya que la prevalencia de sarcopenia en personas con diabetes es muy superior a la de la población general, incluso en las primeras fases de la enfermedad (4-6). De hecho, la sarcopenia, y la fragilidad en general, han surgido como una categoría más de complicaciones en la DM2, además de las ya conocidas, como las enfermedades micro y macrovasculares (7). Existen varias vías por las cuales la sarcopenia puede contribuir a la resistencia a la insulina. El músculo esquelético es el tejido sensible a la insulina más grande del cuerpo y representa el 80 % de la captación de glucosa en condiciones de hiperinsulinemia euglucémica. La resistencia a la insulina del músculo esquelético es un proceso clave en el desarrollo de la DM2, que puede observarse décadas antes de que se desarrolle el fallo de las células beta pancreáticas y la hiperglucemia (8). Por otro lado, la sarcopenia y la fragilidad comparten diversos mecanismos patológicos y la DM2 puede acelerar su progresión (9).
Puesto que la sarcopenia se acompaña de rendimiento físico deficiente y deterioro funcional, se asocia además con un riesgo significativamente mayor de caídas, fracturas, hospitalización e incluso de muerte (10,11). La sarcopenia en las personas mayores y en pacientes con diabetes es una causa importante de eventos adversos, lo que aumenta sustancialmente el riesgo de diversas lesiones, el reposo prolongado en cama y la discapacidad, lo que tiene un gran impacto en su calidad de vida y en su recuperación (12,13). Unos hábitos dietéticos pobres, especialmente una baja ingesta de proteínas, se asocian con mayor riesgo de sarcopenia en personas mayores (14), mientras que se ha observado una alta prevalencia de sarcopenia en individuos con DM2 con un estado nutricional deficiente (15). Tanto la sarcopenia como la desnutrición son condiciones susceptibles de intervención para mejorar el pronóstico clínico (16), por lo que es imperativo identificar a los pacientes con diabetes que las sufren y tratarlos adecuadamente durante su hospitalización. A continuación, se presentan los resultados del consenso de expertos y las respuestas de los panelistas sobre el manejo en el día a día de los pacientes con diabetes/hiperglucemia hospitalizados en planta (no críticos) con sarcopenia concurrente.
RESULTADOS
FACTORES DE RIESGO Y CRIBADO DE LA DESNUTRICIÓN
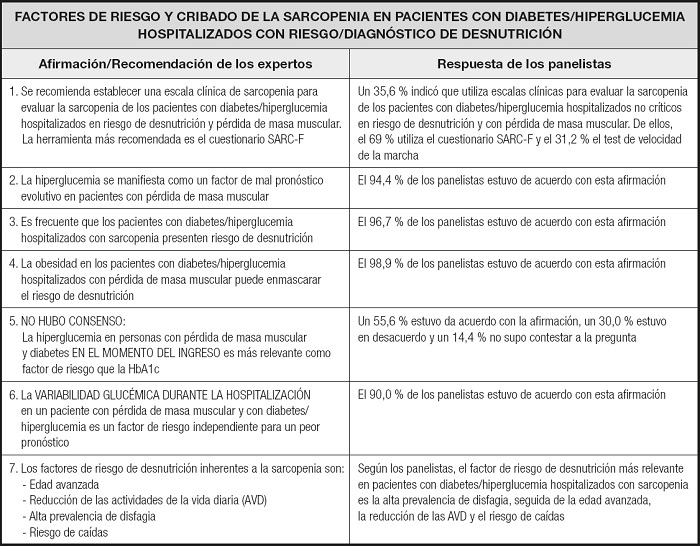
En la tabla I se muestran las recomendaciones consensuadas por el comité científico en relación con los factores de riesgo y el cribado de la sarcopenia, y las respuestas de los panelistas a cada afirmación. Los expertos consideraron la necesidad de utilizar una escala de valoración de la sarcopenia, en particular el cuestionario SARC-F (17). El 69 % de los panelistas informó que utilizaba dicha escala clínica. En general, tanto la hiperglucemia como la variabilidad glucémica durante la estancia hospitalaria se consideraron factores de mal pronóstico evolutivo.
REQUERIMIENTOS DE ENERGíA Y NUTRIENTES
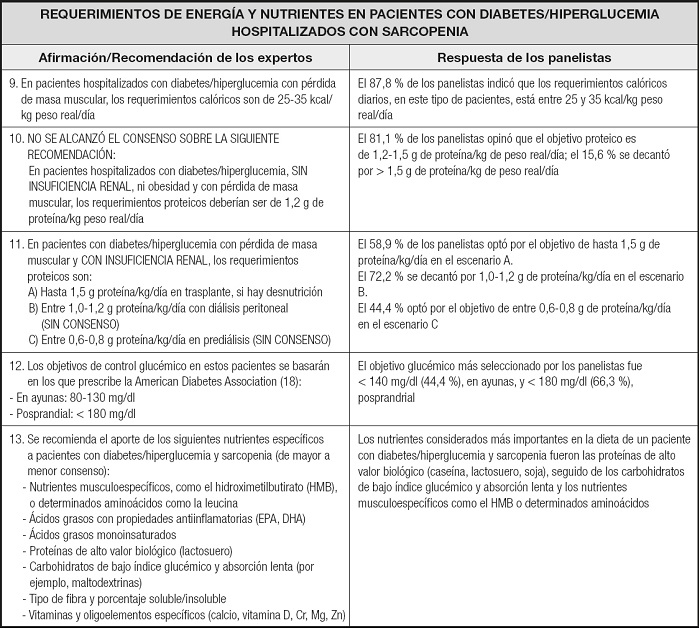
Como se muestra en la tabla II, los requerimientos calóricos, según la práctica clínica de los panelistas, coincidieron en general con los recomendados por los expertos. No hubo consenso entre los expertos sobre los requerimientos proteicos en pacientes sin insuficiencia renal, mientras la mayoría de los panelistas se decantó por altos requerimientos 1,2-1,5 g de proteína/kg de peso real/día. Los expertos recomendaron los objetivos glucémicos prescritos por la Asociación Americana de Diabetes para personas con diabetes (18); sin embargo, la opinión predominante entre los panelistas fue mantener una glucemia en ayunas por debajo de 140 mg/dl. En general, los expertos y los panelistas coincidieron en los nutrientes más importantes que hay aportar en la dieta de los pacientes con diabetes/hiperglucemia y sarcopenia, aunque los expertos dieron más importancia a los ácidos grasos con potencial antiinflamatorio que a las proteínas de alto valor biológico.
PLAN DE CUIDADO NUTRICIONAL (ORAL Y POR SONDA)
Los expertos recomendaron establecer una dieta individualizada y específica para diabetes desde el ingreso del paciente, con enriquecimiento proteico y adaptada en gran medida para facilitar su ingesta y buena digestión (Tabla III). Solo el 61,1 % de los panelistas informó de que practicaba esta medida, dándole la mayor importancia al enriquecimiento proteico. Hubo consenso entre los expertos y los panelistas sobre la idoneidad de la suplementación oral con una fórmula polimérica, hipercalórica e hiperproteica específica para diabetes para pacientes con diabetes/hiperglucemia y sarcopenia, ya que mejoran el control glucémico y lipídico. También hubo coincidencia sobre la importancia del ejercicio de fuerza y aeróbico, con una duración recomendada de 3 meses.
Tabla III. Comparativa de los cuidados óptimos según las recomendaciones de los expertos y la práctica clínica habitual de los panelistas respecto al plan de cuidados nutricionales enterales.

DISCUSIÓN
Tanto la sarcopenia (primaria) como la DM2 se vuelven más prevalentes con el envejecimiento y predisponen a los pacientes a complicaciones a largo plazo, fragilidad, hospitalizaciones y muerte prematura (13,19). La pérdida de masa muscular se acompaña con frecuencia con la acumulación de masa grasa, lo que resulta en obesidad sarcopénica (20), que tiene consecuencias adversas más allá de la obesidad y sus efectos metabólicos (21).
Además de evitar la variabilidad glucémica durante la hospitalización, que se asocia con un peor pronóstico (22), la identificación de la sarcopenia concurrente, junto con el riesgo asociado de desnutrición, tiene un papel clave en el manejo óptimo de los pacientes con el fin de evitar o ralentizar su deterioro funcional y acelerar su recuperación. Una forma rápida de identificar a los sujetos con riesgo de sarcopenia es utilizar el cuestionario SARC-F (17). Este cuestionario está validado en español (23) y puede ser contestado por el mismo paciente. Tiene una puntuación máxima de 10 puntos. Una puntuación < 4 indica un estado de salud aceptable, mientras que una puntuación ≥ 4 indica riesgo de sarcopenia (Fig. 1). Aunque no existen criterios de detección de la sarcopenia específicos para el paciente diabético, muchos panelistas indicaron que utilizan el test de velocidad de la marcha para evaluar la función física, y la fuerza de prensión de la mano ha demostrado ser un buen marcador pronóstico de complicaciones en pacientes desnutridos (24).

Figura 1. Cuestionario SARC-F. Cribado para evaluar el riesgo de sarcopenia. Modificado de Malstrom et al., 2016 (17).
Una ingesta proteica inadecuada puede disminuir la síntesis de proteínas musculares, la cual es vital para mantener y recuperar la masa muscular en la sarcopenia. La evidencia sugiere que la terapia nutricional juega un papel integral en la prevención y el tratamiento de la sarcopenia, pero no existe un porcentaje ideal de calorías provenientes de carbohidratos, proteínas y grasas igual para todos los pacientes; por lo tanto, la distribución de macronutrientes en la planificación de comidas debe ser individualizada y tener en cuenta si existe disfunción renal. La recomendación sobre la ingesta dietética de proteínas no alcanzó el consenso entre los expertos, mientras que la mayoría de los panelistas estableció un objetivo de 1,2 a 1,5 g/kg/día en pacientes sin insuficiencia renal. De hecho, se han sugerido cantidades diarias de 1,2 a 1,5 g/kg para personas mayores con enfermedades agudas o crónicas y hasta de 2,0 g/kg de peso corporal y día en caso de enfermedad grave, lesión o desnutrición (25), de acuerdo con la premisa de que se debe priorizar el músculo frente al riñón. Históricamente, se recomendaban dietas bajas en proteínas para personas con enfermedad renal. Sin embargo, la evidencia reciente indica que esta medida puede aumentar el riesgo de desnutrición, sin mejorar el control glucémico ni la función renal (26). En caso de terapia de reemplazo renal, habría que adaptar los requerimientos proteicos a cada estatus del paciente, y si existe uremia, limitar la ingesta y el aporte proteico.
Las proteínas de alta calidad como el lactosuero y otras proteínas animales pueden ser beneficiosas para prevenir o revertir la sarcopenia (27). Especialmente las proteínas ricas en el aminoácido leucina juegan un papel importante porque tienen propiedades anabólicas (28,29). El β-hidroxi-β metilbutirato (HMB), el metabolito activo de la leucina, activa la vía mTOR que conduce a un aumento en la síntesis de proteínas y, al mismo tiempo, reduce la vía de la ubiquitina, lo que provoca una disminución de la degradación de proteínas, mientras que a través del colesterol muscular proporciona más sustrato para la reparación de la membrana celular (30). Se ha visto que suplementación con leucina, y por tanto con HMB, aumenta la tasa de síntesis de proteínas, la masa corporal y la masa magra en los ancianos (28).
Se recomienda suplementar con una fórmula polimérica, hipercalórica e hiperproteica específica para la diabetes, ya que se asocia con un mejor control glucémico y lipídico, y menores variabilidad glucémica y requerimiento de insulina, que las fórmulas estándar (31,32). Para la nutrición enteral por sonda, el objetivo de la velocidad/tipo a utilizar es optimizar la tolerancia y el control glucémico, siendo varias las opciones empleadas en la práctica clínica: con bomba de nutrición/gravedad, por bolos o mediante administración continua. La European Society for Clinical Nutrition and Metabolism (ESPEN) recomienda la administración continua frente a la intermitente (33), pero en caso de pacientes con sarcopenia tal vez interese más la administración intermitente, que parece mejorar la síntesis de proteínas (34).
Más allá de la terapia nutricional y los esfuerzos para un adecuado control glucémico de los pacientes con diabetes/hiperglucemia y sarcopenia, la actividad física y el fortalecimiento muscular ayudan a prevenir tanto la disminución de la masa muscular como de la fuerza (35), mejorando la calidad de vida y mostrando, además, efectos beneficiosos en pacientes con diabetes (36). Así, los expertos y los panelistas pusieron en valor los ejercicios de fuerza y aeróbicos como parte del manejo de la sarcopenia. El deterioro funcional es frecuente después de un ingreso hospitalario debido a la presencia de la enfermedad aguda, la polifarmacia, la baja actividad física y el encamamiento prolongado. La rehabilitación posaguda tiene como función mantener los objetivos de la atención aguda, a través de una estrategia multidisciplinar continua que evite la dependencia prematura y reduzca los reingresos hospitalarios (37).
En conclusión, las personas con DM2 muestran una pérdida acelerada de masa y función muscular que puede aumentar el riesgo de deterioros metabólico y funcional adicionales, así como ralentizar su recuperación durante una hospitalización. La sarcopenia y la desnutrición producen un deterioro funcional que va a afectar a la realización de las actividades de la vida diaria y a la dependencia, así como a la calidad de vida. Las intervenciones dirigidas a tratar la sarcopenia, así como evitar la desnutrición, en pacientes con diabetes/hiperglucemia tienen importantes beneficios para la salud. Aparte de la suplementación nutricional, con aporte de proteínas de alta calidad y aminoácidos musculoespecíficos, se debe considerar la inclusión del entrenamiento de resistencia en los programas de recuperación/rehabilitación. Cabe destacar la importancia de la coordinación asistencial entre la Atención Especializada y la Atención Primaria. Un modo de facilitar este proceso es que consten en el informe de alta los diagnósticos de desnutrición y/o sarcopenia, para garantizar la continuidad de los cuidados.