INTRODUCCIÓN
La genisteína es una isoflavona de soya (Glycine max) que forma parte de los compuestos bioactivos, no nutritivos, de naturaleza fenólica, no esteroidal (1,2). Su estudio ha llamado la atención de la comunidad científica por sus efectos anticancerígenos y antioxidantes en la prevención y el tratamiento no solo de varios tipos de cáncer, sino también en diversas enfermedades relacionadas con el estilo de vida (2-4). Se ha observado que inhiben la acción de enzimas involucradas en la proliferación de células cancerosas en tejido mamario, próstata, colon, hígado y ovario (5,6). Presentan actividad estrogénica débil y promueven la proliferación de células óseas (5,7). Las isoflavonas son capaces de unirse a los receptores de estrógenos debido a su similitud estructural con el 17ß-estradiol, por lo que también se les clasifica como fitoestrógenos (8). Aunque la genisteína se encuentra inactiva en la soya por estar en su forma glicosilada (unidas a azúcares), una vez ingeridas, son hidrolizadas (mediante enzimas intestinales β-glucosidasas) a su forma activa aglicona (9). Si bien las isoflavonas de la soya presentan una visión mecanicista que incluye la inducción apoptótica, la detención del ciclo celular, así como efectos antiangiogénicos, antimetastásicos y antiinflamatorios (6), no existen estudios que exploren sus efectos sobre el daño genotóxico inducido por metales con potencial cancerígeno como los compuestos de cromo hexavalente (Cr[VI]).
La exposición a compuestos del Cr(VI) representa un problema de salud para las poblaciones humanas. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH, por sus siglas en inglés) y la Agencia Internacional para la Investigación del Cáncer (IARC, por sus siglas en inglés) han considerado a los compuestos de Cr(VI) como carcinógenos para humanos (10,11). Los compuestos de Cr(VI) pueden encontrarse de forma natural en el medio ambiente como resultado de la erosión de los depósitos crómicos naturales o generarse de forma natural como consecuencia de la transformación del cromo trivalente (Cr[III]) bajo las condiciones adecuadas, por ejemplo, exposición a luz UV, altas temperaturas, niveles reducidos de humedad, valores de pH bajos o agentes oxidantes. Los compuestos de Cr(VI) también pueden generarse artificialmente durante procesos industriales como la galvanoplastia, la metalurgia, el curtido de cuero, la producción textil, la fabricación de pigmentos y la preservación de madera, entre otras, o pueden ser liberados al ambiente al quemar gas natural, petróleo o carbón (10-12). Diversos estudios han mostrado que la exposición in vivo a compuestos de Cr(VI) induce daño genotóxico mediante el incremento en la frecuencia de aberraciones cromosómicas, así como de rompimientos de cadena sencilla y doble del ADN y de mutaciones puntuales (12,13). Se ha relacionado la carcinogenicidad de los compuestos de Cr(VI) con el estrés oxidativo generado durante su reducción intracelular (12), por lo que compuestos como las isoflavonas de la soya, al presentar en su estructura grupos OH, podrían contrarrestar su efecto oxidativo. De ahí que el consumo de alimentos ricos en antioxidantes como la soya y, en particular, sus isoflavonas, como la genisteína, podría ser una alternativa tanto en la protección como en la modulación del daño al material genético inducido por metales con potencial cancerígeno, tomando en consideración que la carcinogénesis inducida por metales como Cr(VI) puede ser iniciada y promovida por el daño al material genético (13). Con base en lo señalado anteriormente, el objetivo de este estudio fue evaluar el efecto antigenotóxico de la isoflavona de soya genisteína en ratones expuestos a compuestos cancerígenos de Cr(VI).
MATERIAL Y MÉTODOS
REACTIVOS
Los reactivos empleados en el estudio se obtuvieron de Sigma Aldrich Chemicals Co. (St. Louis, MO, USA): 5,7-dihydroxy-3- (4-hydroxyphenyl)-4H-1-benzopyran-4-one, 4′,5,7-trihydroxyisoflavone (genisteína, isoflavona de soya [Glycine max], grado de pureza ~98 % [HPLC]; CAS No. 446-72-0), trióxido de cromo ([CrO3], grado de pureza 99,9 %; CAS No. 1333-82-0), naranja de acridina ([NA] 75 %; CAS No. 10127-02-3), bromuro de etidio ([BE] 75 %; CAS No. 1239-45-8) y vehículo para compuestos liposolubles (aceite de maíz; CAS No. 8001-30-7).
ANIMALES
Los animales se obtuvieron del Centro UNAM Harlan® para la Producción de Animales de Laboratorio con sede en la Facultad de Química, Universidad Nacional Autónoma de México-UNAM. Se desarrolló un pie de cría en el bioterio de la Facultad de Estudios Superiores “Zaragoza”, UNAM. Los ratones se mantuvieron en jaulas de plástico a temperatura ambiente controlada (22 ± 2°C), ciclos de luz-oscuridad de 12 horas (las luces se encendían a las 7:00 a.m. y se apagaban a las 7:00 p.m.) y tuvieron libre acceso al alimento (comida para roedores pequeños Purina-México®) y al agua.
DISEÑO EXPERIMENTAL
El estudio se realizó en un grupo de 25 ratones Hsd:ICR machos adultos con una edad de ocho a 12 semanas y un peso variable de entre 28 y 35 g. Se conformaron grupos al azar de cinco ratones distribuidos de la siguiente forma: a) grupo testigo 1: se le administró el vehículo 1 (agua destilada estéril) por vía intraperitoneal (i.p.); b) grupo testigo 2: se le administró el vehículo 2 (aceite de maíz para compuestos liposolubles) por vía oral (sonda intragástrica); c) grupo genisteína: se trató con una sola dosis de 15 mg/kg vía oral (sonda intragástrica); d) grupo CrO3: se trató por vía i.p. con una sola dosis de 20 mg/kg; y e) grupo genisteína+CrO3: recibió el tratamiento de 15 mg/kg por vía oral (sonda intragástrica) de genisteína cuatro horas antes de la inyección i.p. de CrO3 (20 mg/kg).
Se emplearon ratones macho, ya que en estudios previos no se han reportado diferencias genotóxicas entre hembras y machos tratados con CrO3 por vía i.p. (12,14,15). La dosis de 20 mg/kg de CrO3 se seleccionó con base en estudios anteriores en los que esta dosis administrada por vía i.p. indujo la formación de MN en sangre periférica de ratones (14,15). Aunque la ruta i.p. es una ruta de exposición artificial, es útil para detectar daños genotóxicos en protocolos a corto plazo, como el ensayo de MN, por lo que es recomendada para estudiar compuestos con propiedades clastogénicas potenciales, como es el caso de los compuestos de Cr(VI) (16). La dosis de 15 mg/kg de genisteína administrada por vía oral (intragástrica) se seleccionó con base en los efectos positivos beneficiosos en los que dosis similares e incluso mayores administradas por la misma vía no presentaron efectos tóxicos ni genotóxicos (17,18). El estudio se desarrolló siguiendo las guías para la prueba de químicos de la Organización para la Cooperación y el Desarrollo Económicos (OCDE) y de la Agencia de Protección Ambiental (EPA) (16,19). El Comité de Bioética de la Facultad de Estudios Superiores “Zaragoza”, UNAM, aprobó las condiciones y protocolos experimentales (Código: FESZ/DEPI/363/14; FESZ/DEPI/CE/016/21).
ENSAYO DE MICRONÚCLEOS
Las evaluaciones se llevaron a cabo en sangre periférica obtenida de la vena caudal, ya que al no requerir el sacrificio de los animales se pudieron obtener muestras secuenciales de sangre periférica (5 µl) de los mismos individuos (0-72 h) para realizar la cinética de micronúcleos (MN). Las muestras fueron colocadas directamente en portaobjetos previamente tratados con NA de acuerdo con la técnica descrita por Hayashi y cols. (20). Se prepararon dos portaobjetos por cada ratón y se almacenaron en la oscuridad a 4 °C durante 24 horas. Las evaluaciones se realizaron mediante la identificación de eritrocitos policromáticos (EPC), eritrocitos normocromáticos (ENC) y MN en EPC utilizando un microscopio de fluorescencia (Nikon OPTIPHOT-2; Tokio, Japón) con excitación azul (480 nm) y una barrera de emisión de filtro (515-530 nm) con un aumento de 100×. El análisis de MN se basó en 4,000 EPC por ratón, donde se consideró que la presencia de MN indicaba daño genotóxico. La proporción relativa de EPC y ENC también se analizó para 2,000 eritrocitos (daño citotóxico). Las muestras de las 0 horas se designaron como testigo negativo.
En las muestras obtenidas a las 48 horas también se evaluaron apoptosis, necrosis y viabilidad celular, ya que estos procesos pueden estar involucrados en la prevención del daño del ADN inducido por Cr(VI), y en ese tiempo se ha observado el mayor daño genotóxico inducido por Cr(VI) (14).
APOPTOSIS Y VIABILIDAD CELULAR
Para evaluar la apoptosis, la necrosis y la viabilidad celular, se realizó una tinción diferencial con naranja de acridina/bromuro de etidio (NA/BE) mediante una técnica previamente adaptada para sangre periférica (15). Se centrifugaron muestras de 10 µl a 4,500 x g durante cinco minutos. El sedimento celular se resuspendió en 20 µl de la mezcla de colorantes NA/BE y se colocó en portaobjetos limpios para ser analizado inmediatamente. Se prepararon dos laminillas por ratón. Las células apoptóticas, necróticas, viables y no viables se identificaron utilizando un microscopio de fluorescencia OPTIPHOT-2 con excitación azul (480 nm) y una emisión de filtro de barrera (515-530 nm) con un aumento de 40×. Las evaluaciones se basaron en 300 células por ratón.
ANÁLISIS ESTADÍSTICO
Cada ratón se consideró una repetición independiente de acuerdo con las guías de la OCDE y la EPA (16,19). Se promediaron las evaluaciones de los cinco ratones de cada grupo experimental. Las frecuencias de MN, la relación PCE/NCE, la viabilidad (células viables/no viables) y el número de células apoptóticas y necróticas se expresan como la media ± desviación estándar (DE). Una vez verificada la normalidad de los datos mediante la prueba de Shapiro-Wilk, estos fueron analizados empleando un análisis de varianza (ANOVA). La significancia estadística para los MN y la relación de EPC/ENC se determinaron mediante el uso de ANOVA para medidas repetidas de dos vías (RM-ANOVA). Para los otros parámetros, se utilizó ANOVA de una sola vía. Las ANOVA fueron seguidas del post-hoc de Tukey. Se utilizó GraphPad Prism 8.0 (GraphPad Software, San Diego, CA, Estados Unidos) para todos los análisis. Las diferencias se consideraron significativas para p < 0,05.
RESULTADOS
La evaluación del daño genotóxico de Cr(VI) se realizó mediante el ensayo de MN en eritrocitos de sangre periférica. Se utilizó la tinción diferencial de NA, que permitió distinguir a los EPC de los ENC, ya que los EPC, al contener aún ARN ribosómico, se tiñeron de color naranja fluorescente, mientras que en los ENC el ARN ya fue degradado y por lo tanto no se tiñeron (sombra) (Fig. 1A). El NA también permitió la identificación de los MN, que se tiñeron de color amarillo fluorescente por estar conformados de ADN (Fig. 1A). Para estudiar la cinética de la inducción de MN, los datos se analizaron con una RM-ANOVA de dos vías porque los MN dependían de dos factores (tratamiento y tiempo). El tratamiento es independiente, mientras que las evaluaciones en cada tiempo se consideraron dependientes al obtenerse las muestras del mismo ratón. En la figura 1B se muestra el análisis por tratamiento y por tiempo de la cinética de MN. En el grupo CrO3 se observaron incrementos a las 24 y 48 horas, que fueron significativos en comparación con sus respectivos grupos testigo (p < 0,0001) y con el grupo genisteína+CrO3 (p < 0,0001). El mayor incremento de MN se observó a las 48 horas y fue significativo al compararse con las muestras tomadas a las 0, 24 y 72 horas (p < 0,0001). El incremento observado a las 72 horas ya no resultó significativo al compararse con su grupo testigo (p > 0,05). Cuando se administró la genisteína previamente al tratamiento con CrO3 (genisteína+CrO3), se redujeron los MN en todos los tiempos evaluados después de los tratamientos en comparación con el grupo tratado solo con el CrO3, siendo mayor este efecto a las 48 horas (reducción del 84 %). No se observaron efectos significativos en los MN cuantificados entre el grupo genisteína+CrO3 y los grupos testigo (p > 0,05). De igual manera, el tratamiento de la genisteína sola no presentó efectos significativos sobre los MN al comparase con sus testigos ni con los diferentes tiempos de medición (p > 0,05).

Figura 1. Efecto de la genisteína y el CrO3 sobre la frecuencia de MN evaluados en la sangre periférica de los ratones. A. Microfotografía fluorescente (100×) de células de sangre periférica utilizando el método de recubrimiento de NA. Los eritrocitos policromáticos (EPC) se tiñen de naranja fluorescente, los eritrocitos normocromáticos (ENC) no se tiñen (sombra) y los micronúcleo (MN) se tiñen de amarillo fluorescente. B. Promedios de MN a las 0, 24, 48 y 72 horas. Los MN disminuyeron en el grupo de genisteína+CrO3 en un 76, 84 y 50 % a las 24, 48 y 72 horas, respectivamente, en comparación el grupo tratado solo con CrO3. Se evaluaron un total de 4.000 EPC en cada ratón (cinco ratones/grupo). Las diferencias estadísticas se determinaron utilizando una ANOVA de dos vías para medidas repetidas, seguida de la prueba post-hoc de Tukey: *p < 0,0001 vs. testigo 1 (24 h); †p < 0,0001 vs. testigo 1 (48 h); ‡p < 0,0001 vs. genisteína+CrO3 (24 h); §p < 0,0001 vs. genisteína+CrO3 (48 h); ‖p < 0,0001. Testigo 1, vehículo 1 (agua destilada estéril); testigo 2, vehículo 2 (aceite de maíz para compuestos liposolubles). CrO3: trióxido de cromo; MN: micronúcleo.
La evaluación de las células apoptóticas y necróticas, así como la viabilidad celular, se realizaron mediante tinción diferencial NA/BE (Fig. 2A). El ensayo dual con los fluorocromos permitió distinguir entre las células viables y las no viables en función de la integridad de la membrana. Cuando la célula era viable, solo el NA se intercaló en el ADN, lo que hizo que el núcleo emitiera una fluorescencia verde (Fig. 2A, sana y apoptótica temprana). Cuando la célula era no viable, el BE también se intercaló en el ADN, lo que hizo que el núcleo emita una fluorescencia roja, ya que el BE supera la tinción del NA (Fig. 2A, necrótica y apoptótica). De ahí que el color del núcleo dependió de la viabilidad de la célula y no del estado del núcleo. Las células apoptóticas con membranas intactas pero en las que el ADN había comenzado a fragmentarse aún exhibieron núcleos verdes porque el BE no pudo ingresar a la célula, pero la condensación de cromatina fue visible como parches de color verde brillante en los núcleos (Fig. 2A, apoptótica temprana). A medida que la célula avanzó a través de la vía apoptótica y comenzaron a formarse ampollas en la membrana, el BE ingresó en la célula y el ADN se tiñó de rojo. Las células apoptóticas tardías mostraron manchas rojas brillantes de la cromatina condensada en los núcleos (Fig. 2A, apoptótica tardía); esto las distinguió de las células necróticas, que se tiñeron uniformemente de rojo (Fig. 2A, necrótica). Los análisis de las células apoptóticas, la viabilidad celular y la relación de EPC/ENC se realizaron mediante una ANOVA de una sola vía porque las evaluaciones dependían de un solo factor (es decir, el tratamiento). En la figura 2B, se muestran los resultados obtenidos en las evaluaciones de apoptosis realizadas en células nucleadas de sangre periférica. Se observaron incrementos significativos en el número de células apoptóticas con los tratamientos por separado de genisteína y CrO3 en comparación con sus testigos (p < 0,01 y p < 0,0001, respectivamente), siendo mayor el efecto del CrO3. En los ratones tratados con ambos tratamientos de genisteína y CrO3, se redujeron las células apoptóticas significativamente al compararse con el grupo tratado solo con CrO3 (p < 0,0001), las cuales no resultaron significativas al compararse con los grupos testigo (p > 0,05). En las evaluaciones de la relación de los EPC/ENC (Tabla I) no se observaron efectos significativos en ninguno de los grupos de estudio (p > 0,05). Sin embargo, al evaluar la viabilidad celular empleando el ensayo dual con los fluorocromos NA/BE, se observó que los tratamientos solos con la genesteína y el CrO3 incrementan las células no viables (p < 0,045 y 0,0001, respectivamente), siendo más significativo este último. En el grupo al cual se le administraron los dos tratamientos (genisteína+CrO3) se redujeron las células no viables, ya que no resultaron significativas al compararse con los grupos testigo (p > 0,05) (Fig. 2C). No se observaron incrementos mayores a dos células necróticas en ninguno de los grupos de estudio, ni se presentaron muertes en los ratones. Solo algunos de los ratones del grupo tratado con CrO3 mostraron signos clínicos de toxicidad como el pelo erizado, disminución de la movilidad y pérdida del apetito. Sin embargo, estos efectos no repercutieron en su peso, ya que el promedio del peso inicial del grupo tratado con CrO3 fue de 31,3 ± 1,1 y el final, de 30,8 ± 1,5, mismos que no resultaron significativos al compararse con los pesos iniciales y finales de su grupo testigo (30,0 ± 2,2 y 29,8 ± 2,4, respectivamente).
Tabla I. Relación EPC/ENC en sangre periférica de ratones tratados con genisteína y CrO3.
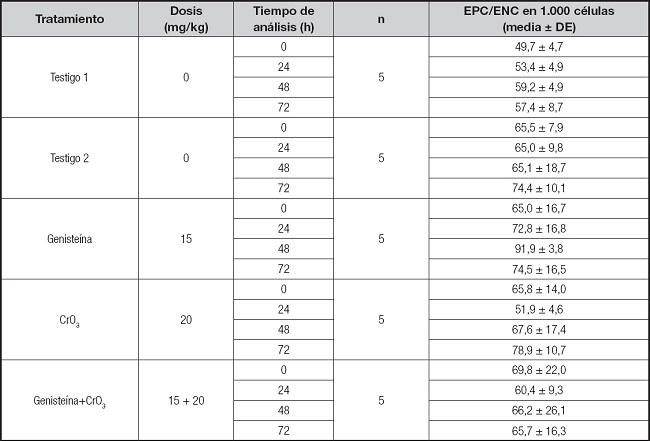
EPC: eritrocitos policromáticos; ENC: eritrocitos normocromáticos.
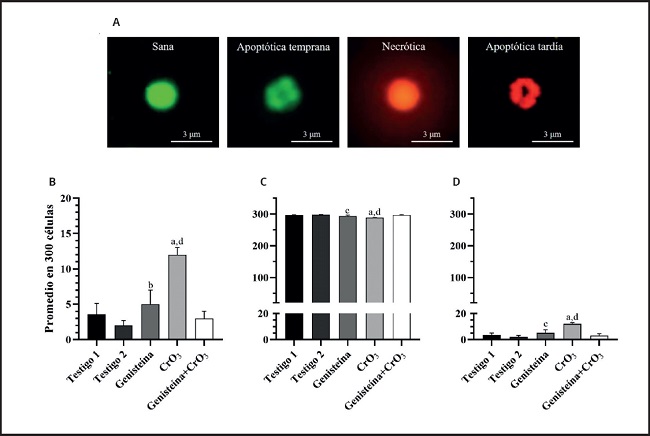
Figura 2. Efecto de la genisteína y el CrO3 evaluado en sangre periférica de los ratones. A. Microfotografía fluorescente (40×) de células nucleadas utilizando la tinción diferencial con NA/BE en muestras de sangre periférica obtenidas a las 48 horas después de los tratamientos. Cuando la célula es viable, solo el NA se intercala en el ADN, lo que hace que el núcleo emita una fluorescencia verde (sana y apoptótica temprana). Cuando la célula es no viable, el BE también se intercala en el ADN, lo que hace que el núcleo emita una fluorescencia roja (necrótica y apoptótica tardía). Las células apoptóticas con membranas intactas muestran parches de color verde brillante en los núcleos (apoptótica temprana), mientras que cuando la célula avanza a través de la vía apoptótica los parches se observan de color rojo fluorescente (apoptótica tardía); esto las distingue de las células necróticas, que se tiñen uniformemente de rojo. Las células no viables incluyen células apoptóticas (tempranas y tardías) y necróticas. B. Promedios de células apoptóticas. C. Promedios de células viables. D. Promedios de células no viables. Se evaluaron 300 células nucleadas en cada ratón (cinco ratones/grupo). Las diferencias estadísticas se determinaron utilizando la ANOVA de una sola vía seguida de la prueba post-hoc de Tukey: *p < 0,0001 vs. testigo 1; †p < 0,014 vs. testigo 2; ‡p < 0,045 vs. testigo 2; §p < 0,0001 vs. genisteína+CrO3. CrO3: trióxido de cromo; NA: naranja de acridina; BE: bromuro de etidio.
DISCUSIÓN
Se corroboró el daño genotóxico reportado para los compuestos de Cr(VI) al observar un incremento significativo en los promedios de MN (10,14). La inducción del daño genotóxico del Cr(VI) se ha relacionado con la generación de especies reactivas de oxígeno y radicales libres producidos durante su reducción intracelular a Cr(III). El Cr(VI), al reaccionar con el peróxido de hidrógeno, produce el tetraperoxo-Cr(V), que genera al radical hidroxilo (•OH), el cual, al interactuar con el ADN, induce rompimientos de cadena doble (21). El hecho de que el tratamiento de la genisteína previo a la aplicación del CrO3 disminuyó los MN, confirma que la genisteína disminuye el daño genotóxico inducido por el CrO3. Considerando que la genisteína presenta actividad antioxidante y el Cr(VI) puede inducir daño genotóxico mediante el estrés oxidativo generado durante su reducción intracelular a Cr(III), se sugiere que la disminución de MN observada podría estar relacionada con la inhibición del daño oxidativo del ADN. En estudios previos in vivo con ratas Wistar se ha observado que la genisteína administrada por vía oral es capaz de disminuir el daño oxidativo del ADN inducido por el N-nitrosodimetilamina (22). De Jesus y cols. (18) mostraron que el pretratamiento con dosis de hasta 20 mg/kg de genisteína disminuye la genotoxicidad inducida por el antimoniato de meglumina al modular las especies reactivas de oxígeno. De ahí que la actividad antigenotóxica de la genisteína puede estar correlacionada con su capacidad para capturar los radicales libres generados por los agentes inductores de estrés oxidativo como los compuestos de Cr(VI), protegiendo así el material genético del daño oxidativo. Por otra parte, la antigenotoxicidad de la genisteína también puede estar relacionada con la regulación del sistema antioxidante endógeno, que inhibe el efecto de las especies reactivas de oxígeno y de los radicales libres sobre el ADN. Se ha observado que la genisteína puede activar la expresión de genes antioxidantes aumentando la actividad del glutatión, la catalasa y la superoxido dismutasa (23,24). La protección del daño oxidativo se ha observado incluso con metales como el cadmio, en donde la administración de la genisteína en ratones Wistar puede disminuir el daño neurotóxico mediante su capacidad para mantener el equilibrio redox (25). También, aunque ha sido poco explorada, no se debe descartar la posibilidad de que la genisteína contribuya en la reparación del daño al ADN. Se ha reportado que la genisteína puede estimular la expresión de genes implicados en la reparación del ADN, como BCRA1, hHR23A, HUS1, RAD1, RAD9, ATM y p53 (26-28), por lo que se necesitan más investigaciones in vivo para determinar si esta vía está implicada en la disminución del daño genotóxico.
Si bien la apoptosis es otra vía por la cual la genisteína podría eliminar las células con daño en el ADN, en el presente estudio se observó que cuando se administró previamente a la aplicación del CrO3 las células apoptóticas se disminuyeron en comparación con el grupo tratado solo con el metal cancerígeno. El hecho de que se hayan incrementado las células apoptóticas con el tratamiento solo del CrO3, pero que se hayan disminuido cuando la genisteína se administró antes del tratamiento de CrO3, sugiere que la genisteína pudo haber inhibido el daño oxidativo del ADN inducido por el Cr(VI), por lo que, al no haber células dañadas, ya no se activaron las vías apoptóticas y por lo tanto, se disminuyó el número de células apoptóticas en este grupo. Esta sugerencia concuerda con la disminución de MN observada también en este grupo. Sin embargo, es necesario ampliar estos estudios, midiendo específicamente determinados puntos en la señalización de la apoptosis, ya que el daño genotóxico de Cr(VI) puede activar la apoptosis mediante las vías dependientes e independientes de p53. Los intermedios reactivos de Cr(VI) pueden formar interacciones covalentes con el ADN dañándolo e induciendo la expresión de p53, lo que conlleva a la expresión de BAX y la inhibición de Bcl-2. Posteriormente, se induce la liberación del citocromo c al citosol, que se une a Apaf-1 y activa a la procaspasa 9, formándose el complejo denominado apoptosoma, que activa la caspasa-9. Esta, a su vez, activa a la caspasa-3, la cual se encarga de activar una desoxirribonucleasa que conduce a la fragmentación del ADN y, por lo tanto, la apoptosis. Sin embargo, los radicales libres generados durante la reducción intracelular de Cr(VI) también causan daño al ADN, lo que puede conducir a la apoptosis antes de la activación de p53 (29). Además, aunque a la apoptosis se la ha relacionado con el daño al ADN, también la alteración de los estados oxidativos intracelulares tiene el potencial para desencadenar o sensibilizar una célula a la apoptosis (15,30).
Aunque la administración por vía oral de 15 mg/kg de genisteína incrementó las células apoptóticas, no se incrementaron las frecuencias de MN al compararse contra su testigo y contra su propia hora 0 (muestra tomada cuando aún no se administraba el tratamiento). Se ha documentado que la genisteína induce apoptosis mediante diferentes cascadas de señalización, desde la activación de las caspasas hasta la inducción del estrés en el retículo endoplásmico, y por la vía de los receptores activados por proliferadores de peroxisomas (6,31). También se ha reportado actividad antiapoptótica en linfocitos humanos de sangre periférica, al observar que la genisteína protege a las células normales contra el daño al ADN inducido por agentes citotóxicos como el cisplatino y la mitomicina-C, así como quimioprotección durante el tratamiento de cáncer (32). Estas observaciones podrían estar relacionadas con los hallazgos del presente estudio, ya que la combinación de los tratamientos (genisteína+CrO3) disminuyó las células apoptóticas y el incremento en la apoptosis del grupo tratado solo con la genisteína no fue tan considerable. Record y cols. (33) ya habían reportado que dosis incluso mayores (20 mg/kg) de genisteína, administrada por vía oral, no inducen MN en ratones. Ellos cuantificaron concentraciones plasmáticas mucho mayores (9.200 nM) que las más altas reportadas para humanos que consumen habitualmente alimentos a base de soya (276 nM) (34). Recientemente, se observó que la genisteína, además de presentar actividad estrogénica, no induce genotoxicidad en células de adenocarcinoma de glándula mamaria humana, sugiriendo que su consumo podría mejorar el desarrollo de tumores dependientes de estrógenos (35). Sin embargo, los efectos de la genisteína en cuanto a la genotoxicidad aún son limitados, ya que a pesar de que en varios estudios no se presentan efectos genotóxicos (22,36,37), como también se observó en este trabajo, en otros estudios in vitro sí se han reportado efectos genotóxicos (36,38), de ahí la importancia de profundizar estos estudios.
En cuanto a la relación EPC/ENC, ninguno de los tratamientos la modificó de forma significativa. La evaluación de relación EPC/ENC se sugiere con el ensayo MN porque es un indicador de citotoxicidad (16,19). Sin embargo, los resultados negativos deben interpretarse con precaución porque, cuando ocurre toxicidad durante la eritropoyesis, los mecanismos de división celular pueden activarse y enmascarar el efecto (15,16). Por esta razón, también se evaluó la viabilidad celular en células de sangre periférica nucleadas utilizando la técnica de tinción diferencial con los fluorocromos NA/BE. El ensayo de fluorocromo dual es un indicador del metabolismo celular y la muerte causada por la lesión de la membrana celular (15). Al evaluar la viabilidad celular mediante la tinción diferencial con NA/BE, se observó un ligero incremento en las células no viables, que concuerda con el incremento de las células apoptóticas observadas en este grupo. En estudios que han utilizado líneas celulares como la V79 se ha observado que la genisteína disminuye la viabilidad celular mediante el ensayo de MTT (39) y la prueba de exclusión con colorante azul tripán (40). En otros estudios también se habían reportado ligeros efectos citotóxicos que, al igual que en el presente estudio, se relacionaron con la inducción de apoptosis (35). La citotoxicidad observada con el tratamiento de CrO3 concuerda con lo reportado para los compuestos de Cr(VI) (12,11,15).
Cabe señalar que la literatura sobre los efectos de los antioxidantes aún es controvertida, por lo que se necesitan más investigaciones in vivo para comprender mejor la interacción entre estos y los agentes con potencial cancerígeno como los compuestos de Cr(VI), con la finalidad de plantear las vías mecanicistas intracelulares de forma más precisa. Los resultados obtenidos aportan evidencia científica de la importancia del consumo de alimentos ricos en antioxidantes como las isoflavonas de la soya. Estas, además de jugar un papel importante en el tratamiento de algunos tipos de cáncer mediante la eliminación de las células cancerígenas en pulmón (A549), cuello uterino (HeLa), cerebro y glándula mamaria (6,30,40), también pueden participar en la protección y modulación de la genotoxicidad de agentes con potencial cancerígeno, como los compuestos de Cr(VI), con lo que se podría maximizar la eficacia de la genisteína como fármaco terapéutico.
CONCLUSIÓN
La administración de la genisteína previa al tratamiento del CrO3 reduce el daño en el ADN (MN). Los datos aquí presentados apoyan la hipótesis de que los compuestos de Cr(VI) causan daño en el ADN por oxidación de sus bases nitrogenadas, y que este daño fue probablemente reducido por la genisteína mediante su actividad antioxidante. El hecho de que la administración de la genisteína cuatro horas antes de la aplicación del CrO3 redujera las células apoptóticas al igual que los MN sugiere que la genisteína pudo haber inhibido el daño oxidativo del ADN inducido por el Cr(VI) ya que, al no haber células dañadas, las vías apoptóticas no se activaron en este grupo. Estos hallazgos abren perspectivas para plantear nuevas estrategias terapéuticas con la finalidad de minimizar los efectos secundarios causados por la exposición a compuestos con potencial cancerígeno, incluida la protección contra el daño genotóxico. Además, el estudio de las isoflavonas de la soya como la genisteína puede generar las bases para el planteamiento de alternativas en la prevención, así como coadyuvante en el tratamiento de enfermedades crónicas-degenerativas relacionadas con el estrés oxidativo y con el daño genotóxico.














