Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.22 no.2 feb. 2005
| Infección nosocomial por gérmenes multirresistentes durante 1 año en un hospital de segundo nivel: análisis clínico y microbiológico A. JOVER-SÁENZ1,2, F. BARCENILLA GAITE1, E. BARBÉ ILLA1, M. GARCÍA GONZÁLEZ3, R. LÓPEZ SALCEDO1, D. CASTELLANA PERELLÒ1, S. GARRIDO-CALVO4, J. M. PORCEL-PÉREZ2 1Unidad Funcional para el Control de la Infección Nosocomial. 2Servicio de Medicina Interna y 3Microbiología. Hospital Universitario Arnau de Vilanova. 4Medicina de Familia. Cruz Roja-L’Eixample. Lleida
|
| NOSOCOMIAL INFECTION BY MULTIRESISTANT PATHOGENS DURING ONE YEAR IN A SECONDARY HOSPITAL: CLINICAL AND EPIDEMIOLOGICAL ANALYSIS
| ||
| RESUMEN Fundamento: Dada la gran relevancia actual, médica y social, de la infección nosocomial por gérmenes multirresistentes (INGM), se pretendió determinar su incidencia, nosología, formas de presentación en las áreas de ingreso y mortalidad en un hospital de 2º nivel en Lleida (España). Método: Se utilizó la experiencia de una unidad para el control de la Infección Nosocomial (IN), en su primer año de funcionamiento en este hospital. Por medio de la unidad, se practicó un estudio descriptivo prospectivo sobre todos los pacientes ingresados, en el Hospital Universitario Arnau de Vilanova, entre enero y diciembre de 2000 en los que se detectó una INGM. Resultados: En total fueron 79 pacientes los que presentaron una INGM. La tasa de incidencia global anual de INGM fue de 4,0 por 103 pacientes ingresados. A. baumannii fue el germen que obtuvo la tasa de incidencia individual más elevada, y en especial en la Unidad de Cuidados Intensivos (15,4 por 103 pacientes ingresados; p < 0,001). Por nosologías, la infección predominó sobre la colonización (69,6 frente 30,4%; p < 0,001). En general, se observó una estancia media más prolongada en los pacientes colonizados 38,9 días. Por último, la mortalidad total fue elevada (29,1%), destacando de nuevo A. baumannii, como el agente más frecuentemente detectado en los pacientes que fallecieron (66,6%; p < 0,001). Conclusiones: En la prevención de la INGM son necesarias medidas de vigilancia y control. Los estudios de incidencia como éste, pueden ser útiles a la hora de establecer una base de datos con la que observar la distribución y ocurrencia de la IN, incluyendo la detección de brotes epidémicos por gérmenes multirresistentes. PALABRAS CLAVE: Infección nosocomial. Gérmenes multirresistentes. Incidencia. Mortalidad. Epidemiología. | ABSTRACT Background: Currently growing medical and social significance of nosocomial infection by multiresistant pathogens (NIMP) prompted us to establish its incidence, nosology, presenting forms in admission areas, and mortality in a secondary hospital, Lleida (Spain). Method: For that purpose, we analyzed the first year experience of a unit for the control of nosocomial infection (NI) created in our hospital. From January to December 2000, 79 patients with a NIMP admitted to the University Hospital Arnau de Vilanova entered in this prospective, descriptive study. Results: The overall annual incidence of NIMP was 4.0 per 103 patients admitted. Acinetobacter baumannii showed the highest individual rate of incidence, particularly, at the Intensive Care Unit (15.4 per 103 patients admitted; p < 0.001). By nosologies, infection prevailed over colonization (69.6% vs 30.4%; p < 0.001). Mean hospital stay length increased in colonized patients (38.9 days). Finally, overall mortality was high (29.1%); again, A. baumannii was the agent most frequently detected in death cases (66.6%; p < 0.001). Conclusions: Surveillance and control measures are required for the prevention of NIMP. Incidence studies how this, can be useful to create a database to establish the distribution and occurrence of NI, including the detection of multiresistant pathogen outbreaks. KEY WORDS: Nosocomial infection. Multiresistant pathogens. Incidence. Mortality. Epidemiology. |
Jóver Saénz A, Barcenilla Gaite F, Barbé Illa E, García González M, López Salcedo R, Castellana Perelló D, Garrido Calvo S, Porcel Pérez JM.Infección nosocomial por gérmenes multirresistentes durante 1 año en un hospital de segundo nivel: análisis clínico y microbiológico
Trabajo aceptado: 3 de noviembre de 2004
Correspondencia: Alfredo Jover Sáenz. Unidad Funcional para el control de la Infección Nosocomial (UFIN). Hospital Universitario Arnau de Vilanova. Alcalde Rovira Roure, 80. 25198 Lleida. e-mail: alfredojover@hotmail.com
INTRODUCCIÓN
La infección nosocomial (IN) constituye uno de los mayores problemas de la asistencia médica hospitalaria debido a su considerable morbi-mortalidad y elevado coste económico (1). Este ha sido el motivo por el que, desde mediados de los años 70, se vienen adoptando en nuestro país métodos específicos en su prevención impulsados desde programas de vigilancia y control (2). El beneficio práctico de estos programas, se apoya en los datos ofrecidos por estudios epidemiológicos rigurosos, principalmente americanos, que han demostrado una evidencia científica (3). Entre los principales trabajos destaca, con mayor referencia bibliográfica, el denominado proyecto SENIC (Study of Efficacy of Nosocomial Infection Control), el cual demostraba como la simple cuantificación de la IN lograba disminuir ésta en más de un 30% (4).
Por otra parte, los programas de prevención de la IN son variados, y salvo algunos requisitos comunes no son exportables, debiendo en cada caso adaptarse al medio y las disponibilidades sanitarias locales. Con este sentido se crea en nuestro hospital la UFIN (Unidad Funcional para el control de la IN) cuyos objetivos principales son, la vigilancia de la IN, la introducción y aplicación continuada de las medidas de control (lavado de manos, protocolos de asepsia en las intervenciones médicas y de enfermería, desinfección, realización de programas educativos en la reducción de sus riesgos), el fomento de una política de antibióticos institucional y la detección, tratamiento e investigación de los brotes epidémicos por organismos multirresistentes.
Dado el interés que suscita en la actualidad la infección intrahospitalaria, se pretende determinar la incidencia, formas de presentación y la mortalidad por gérmenes multirresistentes utilizando la experiencia de esta unidad en su primer año de funcionamiento.
PACIENTES Y MÉTODOS
CARACTERÍSTICAS DE LA UNIDAD
La UFIN se encuentra ubicada en el Hospital Universitario Arnau de Vilanova en Lleida (España). Este hospital es el centro asistencial de referencia de la provincia, dispone de 435 camas y ofrece cobertura sanitaria a una población de 383.108 habitantes. Todo el hospital ocupa un único edificio y está comunicado ampliamente en su interior. En él, se realizan las actividades médicas y quirúrgicas propias de un hospital de 2º nivel. Asimismo, dispone de una Unidad de Cuidados Intensivos (UCI) con 14 camas ubicadas en distintos espacios físicos (unidad coronaria y polivalente). La UFIN por su parte, se encuentra situada en una zona no asistencial de una planta general, que está compartimentada en 4 despachos y una sala común de reuniones. Entre otras cosas, dispone de varios ordenadores con bases de datos diseñadas para estudios epidemiológicos y de un archivo bibliográfico completo. La unidad está formada por un equipo multidisciplinario de profesionales que se encargan de realizar las actividades relacionadas con la prevención y el control de la IN.
Los miembros que forman el equipo son:
-Un médico clínico responsable de la unidad.
-Un médico becario y una enfermera epidemióloga.
-Una enfermera supervisora de higiene.
-Tres profesionales no clínicos (microbiólogo, medicina preventiva y farmacéutico) y una secretaria.
El equipo detecta la presencia de gérmenes multirresistentes revisando a diario los cultivos bacteriológicos facilitados por el microbiólogo. A continuación, los resultados son comunicados al personal sanitario implicado indicando, el tipo de aislamiento, las diferentes pruebas que se precisan para el diagnóstico de infección/colonización, el tratamiento y los exámenes microbiológicos de control. Una mayor presencia de lo que cabría esperar (según la cifra endémica del centro) en el tiempo y lugar de un microorganismo resistente se considera un brote. De esta manera, se establece un estado de alerta que da lugar al inicio de medidas preventivas extraordinarias de control.
DISEÑO DEL ESTUDIO
El estudio epidemiológico que se presenta es de carácter descriptivo. Se investigaron prospectivamente a todos los pacientes mayores de 15 años que fueron ingresados, en cualquiera de las salas del hospital, desde el 1 de enero al 31 de diciembre de 2000 y en los que se estableció la presencia de IN por gérmenes multirresistentes (INGM), a partir de su aislamiento en el resultado de cualquier cultivo solicitado por un clínico. Aquellos pacientes con reingresos en ese año y que se les detectase previamente un organismo multirresistente sólo contabilizaron su primera estancia. Cuando coincidieron dos o más gérmenes multirresistentes en un mismo paciente, cada uno de ellos se consideró como caso independiente en el cómputo final. En todos los enfermos, se recogieron los datos administrativos y de filiación (edad, sexo, días de ingreso), época estacional, área de ingreso (sala médica, quirúrgica o UCI), tipo de patología y método diagnóstico (cultivos de exudado de herida, sangre, orina, esputo y broncoaspirado -BAS-).
DEFINICIÓN, CRITERIOS DE INCLUSIÓN Y MÉTODOS DE LABORATORIO
Siguiendo las recomendaciones de los CDC (Centers for Disease Control and Prevention) (5) y del Grupo de Estudio de Infección Hospitalaria de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (6), los casos con INGM se dividieron en dos grupos nosológicos: infectados y colonizados. La diferenciación entre ambos se basó en la presencia o ausencia de síntomas clínicos respectivamente. No se contabilizaron aquellos casos con más de un patógeno en los que no se pudo saber cuál era su clasificación nosológica.
Se consideraron como multirresistentes para el estudio los siguientes organismos: Staphylococcus aureus resistente a meticilina (SARM), Pseudomonas aeruginosa, Acinetobacter baumannii y Stenotrophomonas maltophilia. El concepto de resistencia múltiple enP. aeruginosay A. baumanii se basó en una resistencia por antibiograma a 3 o más grupos de antimicrobianos a los que habitualmente son sensibles. En el caso de S. maltophilia cuando sólo era sensible al cotrimoxazol. Para la identificación fenotípica de cada uno de los gérmenes en los diferentes cultivos, se utilizaron las técnicas microbiológicas habituales del laboratorio. La susceptibilidad microbiana a los antibióticos como meticilina, sulbactam, piperacilina, cefazolina, cefuroxima, ceftazidima, cefotaxima, gentamicina, tobramicina, amikacina, imipenem, aztreonam, cotrimoxazol y ciprofloxacino se realizó usando el aparato Microscan Walk-Away de la marca Baxter Healthcare Corporation.
ANÁLISIS DE DATOS
La tasa de incidencia anual de gérmenes multirresistentes se calculó por cada 1.000 pacientes ingresados en cada unidad del hospital, usando como referencia los datos facilitados por la Unidad de Documentación. En dicho cálculo, no se incluyeron 8 pacientes con INGM e ingresos previos con iguales organismos y 3 pacientes con diversos multirresistentes e imposibilidad de diferenciación nosológica en los mismos. A pesar de que se declaró un brote por A. baumannii en la UCI desde el mes julio hasta septiembre (6 semanas), los datos analíticos que se obtuvieron fueron con relación al cómputo de casos de todo el año.
Los grupos de edad que se consideraron en el cálculo de las tasas de incidencia fueron: 15-54 años, 55-64 años, 65-74 años, 75-84 años y 85 o más años. A efectos del presente estudio clasificamos el tipo de patología en 2 grupos: médica, propia de las secciones de Medicina Interna, y quirúrgica (cirugía abdominal, vascular, traumatología, ginecología, urología y otorrinolaringología). Cuando la clasificación hizo referencia al área de ingreso se añadió además el grupo de UCI. El análisis de los datos se efectuó con el paquete estadístico SPSS (versión 10.0). Con el mismo, se obtuvo la estadística descriptiva univariante (recuentos y porcentajes), y la bivariante aplicando el test de comparación de proporciones de la χ2 y el test de la T de Student en la comparación de medias. La significación estadística se estableció a partir de una p < 0,05.
RESULTADOS
INCIDENCIA
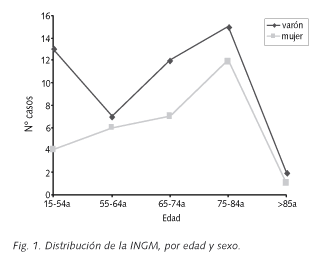
Del periodo señalado se revisaron 79 pacientes con INGM: 49 varones (62,0%) y 30 mujeres (38,0%) con una edad media (DE) de 66,4 (16,1) años (extremos 21-89 años). La figura 1 muestra la distribución de los enfermos por edad y sexo, destacando la INGM en ambos sexos entre los 75-84 años (34,2% de los casos; p < 0,001).
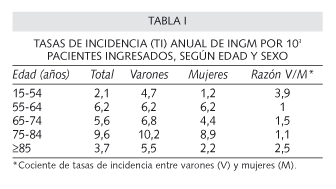
La incidencia en la INGM fue de 4,0 por 103 pacientes ingresados. En el sexo masculino, se observó un aumento progresivo de la tasa de incidencia con la edad (p < 0,05), siendo además este carácter, el que predominó en la mayoría de las edades y en especial las límites (15-54 y ≥ 85; p < 0,001) como refleja la tabla I.
Por gérmenes, A. baumannii fue el que obtuvo una incidencia mayor (2,1 por 103 pacientes ingresados) siguiéndole en frecuencia SARM, P. aeruginosay S. maltophilia con 1,0, 0,7 y 0,2 por 103 pacientes ingresados, respectivamente. Este orden siguió un patrón parecido en la UCI donde destacó una tasa de incidencia para A. baumannii de 15,4 por 103 pacientes ingresados frente a 2,4 para SARM y P. aeruginosay 1,2 en la S. maltophilia.
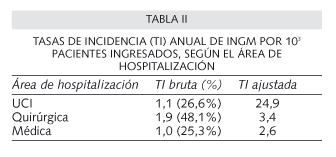
La incidencia según el área de ingreso aparece recogida en la tabla II. El área médica y UCI mostraron las menores tasas de incidencia, mientras que cirugía tuvo las más altas (48.1%; p < 0,001). No obstante, una vez ajustadas las tasas por el total de ingresos anuales de cada área destacó la de UCI (24,9 por 103 pacientes ingresados). En cuanto a la incidencia estacional no hubo diferencias significativas globalmente. Sin embargo, desglosada por gérmenes se observó un predominio de A. baumannii en el periodo estival (p < 0,001), justificado por un brote epidémico acaecido por este germen en la UCI.
NOSOLOGÍA DE LOS CASOS CON INGM
Como se aprecia en la tabla III, la infección por gérmenes multirresistentes (69,6%) predominó sobre la colonización (30,4%) (p < 0,001). El sexo masculino fue mayoritario tanto en ambas formas de presentación como entre los diferentes microorganismos si bien, no de forma significativa, debido probablemente al escaso número de pacientes en los dos grupos. Por otra parte, la frecuencia media con que se presentó la infección respecto de la colonización según el área de hospitalización fue: cirugía (52,7% frente 37,5%), medicina (20% frente 37,5%) y UCI (27,3% frente 25%).
Algo más de la mitad del total de casos con INGM estuvieron provocados por A. baumannii (51,9%; p < 0,001), predominio que se mantuvo en los enfermos infectados de la UCI (p < 0,001). Por el contrario, la infección por SARM se presentó más en el área quirúrgica aunque sin significación estadística.
PATOLOGÍA CLÍNICA Y EXÁMENES DIAGNÓSTICOS
El tiempo medio (DE) transcurrido desde que se hizo el diagnóstico de infección/colonización hasta que el paciente fue dado de alta fue de 34,9 (24,9) días (extremos 2-113 días), sin evidenciarse significación estadística en la duración del ingreso según el tipo de patógeno, área de hospitalización o enfermedad médica. Por otra parte, se observó una estancia más prolongada en la colonización frente a la infección (38,9 días frente 33,2 días), aunque de nuevo sin evidencia estadística (p=0,059).
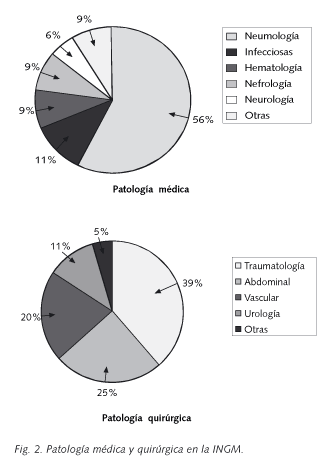
En la figura 2, se expone la INGM en las diversas patologías clínicas. Globalmente, sólo la infección y no la colonización, se presentó con una frecuencia mayor en la enfermedad quirúrgica (55,7% frente 13,9%; p < 0,001); independientemente del tipo de patógeno. Sin embargo, esta relación nada más fue significativa en las cirugías abdominal (22,7% frente 2,3%; p=0,007) y vascular (18,2% frente 2,3%; p=0,020) en el primer grupo.
La figura 3 refleja los diferentes cultivos microbiológicos en la detección e INGM según su nosología. El método principal de diagnóstico fue el cultivo del exudado de la herida (p < 0,001), aunque fue en la infección provocada por SARM y P. aeruginosa donde se obtuvo una rentabilidad diagnóstica mayor (43,1%; p=0,014). Con el resto de cultivos no se observó ninguna significación estadística diagnóstica.
MORTALIDAD Y AISLAMIENTOS
Durante el año de estudio fallecieron 23 pacientes (29,1%), 9 (39,1%) en los primeros 15 días desde la detección del germen. Por frecuencias, se murieron más los pacientes infectados que colonizados (38,2% frente 8,3%; p < 0,001) siendo A. baumannii en los primeros, el germen que más frecuentemente se detectó en el fallecimiento (66,6%; p < 0,001). Por lo tanto, el riesgo global estimado de muerte del paciente infectado fue 6,8 veces superior al colonizado (IC del 95%:1,44-31,8). Del total del enfermos infectados por A. baumannii sólo el 50% sobrevivió, lo que supuso un riesgo estimado de muerte por este germen 2,8 veces superior al resto (IC del 95%:1,0-8,0). Por último de los 79 pacientes recogidos, en 15 (18,9%) no se les practicó el aislamiento cutáneo por motivos diversos; ninguno de los cuales perteneció a la UCI.
DISCUSIÓN
En este estudio epidemiológico realizado en nuestro centro, la tasa global anual de incidencia de INGM ha sido de 4,0 por 103 pacientes ingresados. Esta cifra no se puede comparar con la de otros trabajos de parecida metodología debido a la diferente presencia y variedad de estos organismos entre los hospitales. Sin embargo en el análisis individual, las tasas de incidencia observadas en el caso de SARM y P. aeruginosa han sido inferiores a las registradas en otros estudios de nuestro medio (7). Estos datos contrastan con el incremento declarado de la IN por estos gérmenes en la última década (8,9), siendo una posible explicación, que el mayor riesgo de adquisición de estos microorganismos se produzca en los hospitales docentes con más de 500 camas (2,10,11). En cuanto a la cifra de incidencia de la infección por A. baumanii es difícilmente comparable ya que la mayoría de centros donde se han realizado los trabajos, su presencia, más que esporádica, es endémica (12). No hay que olvidar además, que las tasas de infección por todos estos gérmenes también pueden ser variables dependiendo del periodo de monitorización del estudio (13,14) y del área del hospital donde se lleven a cabo (10). De hecho, a pesar de presenciarse en los últimos años un descenso progresivo en la prevalencia general de la IN en los hospitales de nuestra red sanitaria (9,9% en 1990 frente al 7,9% en 1999) (15), esta tendencia no se ha correlacionado en las UCI (16). Esto es consecuencia de una mayor presencia de brotes epidémicos en ellas, lo que ha motivado que la mayoría de estudios sobre INGM se centren en estas unidades sin hacer referencia al resto de salas del hospital.
La edad media elevada de nuestros pacientes (66,8 años) y la mayor presencia de INGM en el grupo de edad entre 75-84 años es similar a la establecida en otros trabajos (17,18). Tal vez, la edad avanzada en la comunidad y la mayor importación de ancianos, colonizados o portadores de cepas resistentes, que son trasladados entre hospitales o centros de larga estancia sean los principales motivos, como han sugerido algunos autores (19,20). En cuanto al predominio estival de infección observado por A. baumanii, se conoce que su tasa de incidencia es al menos dos veces mayor al final del verano que en invierno (21). Este patrón estacional se viene observando desde hace años en diferentes centros y zonas geográficas del mundo, en las cuales se han producido cambios ambientales llamativos de temperatura y humedad (22).
Muchos de los factores de riesgo asociados con el desarrollo de una INGM están correlacionados. En el caso de las UCI estos factores suelen ser, la práctica de procedimientos invasivos (catéteres venosos centrales, ventilación mecánica asistida, etc.), la administración de antibióticos de amplio espectro (23), la proximidad con pacientes infectados o colonizados (24), incluyendo la transformación de estos últimos en los primeros y la transmisión cruzada a través de las manos del personal sanitario (25), lo que conlleva la aparición de brotes epidémicos de difícil erradicación. Sin duda en nuestro estudio, la elevada tasa de infección por A. baumannii en los pacientes de UCI estuvo motivada por el brote que existió en verano, si bien dicho brote no ha sido motivo de análisis en este estudio. Por el contrario, una elevada proporción de los pacientes del área quirúrgica desarrolló una infección por SARM en la herida operatoria. Seguramente la prolongada colonización que sufren las heridas por este germen, a diferencia de lo que sucede con Staphylococcus aureus sensible a meticilina (26,27), y su fácil accesibilidad a los tejidos subyacentes a partir de las pieles lesionadas, explicaría la rápida aparición de estas infecciones locales o diseminadas.
Como esperábamos, la estancia media de nuestros ingresos por INGM ha sido prolongada y no difiere de las observadas en la mayoría de series hospitalarias (28,29). Sin embargo, este incremento en la permanencia nada más se ha producido en los pacientes colonizados. Las explicaciones a este hallazgo pueden ser diversas. Primero, la elevada mortalidad observada de los enfermos con infección (38,2%) ha podido minimizar el número total de los días de ingreso en este grupo. Segundo, la aparición de un microorganismo resistente justifica muchas veces la realización de nuevos procedimientos diagnósticos, para definir precisamente su naturaleza, lo que incrementaría la estancia del enfermo (30). Tercero, la presencia de un organismo multirresistente por lo general, incrementa el riesgo de presentar otra infección concomitante y por tanto su diagnóstico y tratamiento (31).
La mortalidad real de la INGM es un tema debatido en el momento actual. En nuestro estudio, la mortalidad ha sido elevada (29,1%) y en especial la asociada con A. baumannii (66,6%; p < 0,001)). A pesar de que estos datos globales puedan ser parecidos a series recientes de otras comunidades de nuestro estado, como la de García-Garmendia y cols. (30), existe un amplio abanico de cifras de mortalidad en la bibliografía, dependiendo del tipo de paciente y la infección (28,32-34). Parece lógico pensar por tanto, que unas cifras de mortalidad tan variables puedan deberse a estas variables y a los métodos empleados para su análisis, sabiendo la dificultad que existe en ajustar los datos a los diversos factores de confusión.
Reconocemos, que una limitación del presente trabajo está, en no haber utilizado métodos de tipificación de clonas, tanto fenotípicos como genotípicos, a la hora de descartar una posible transmisión de los gérmenes multirresistentes entre enfermos aislados en diferentes salas del hospital. En general, la combinación de ambos métodos ayuda a confeccionar un calendario gráfico del origen y transmisión de los casos, además de identificar qué papel desempeña el uso previo de antimicrobianos en la persistencia de clonas multirresistentes (35). No obstante, creemos que el trabajo tiene el valor de ser una de las series que detalla la INGM en todo su conjunto dentro de un hospital, sin destacar simplemente un brote o una sala en particular.
En resumen, la vigilancia y análisis de las tasas de incidencia de INGM mediante técnicas epidemiológicas, ayudan a obtener una base de datos que describa la ocurrencia y distribución de la IN, con las que poner en marcha estrategias de control futuras.
Bibliografía
1. Mariano A, Alonso S, Gavrila D, et al. Niveles de evidencia en la prevención y control de la infección nosocomial. Enf Infec Microbiol Clin 1999; 17: 59-65. [ Links ]
2. Hrymiewicz W. Epidemiology of MRSA. Infection 1999: 27 (Supl. 2): 13-16. [ Links ]
3. Scheckler WE, Brimhall D, Buck AS, et al. Requirements for infrastructure and essential activities of infection control and epidemiology in hospitals: A consensus panel report. Am J Infect Control 1998; 26: 47-60. [ Links ]
4. Haley RW, Culver DH, White J, et al. The efficacy of infection surveillance and control programs in preventing nosocomial infections in US hospitals. Am J Epidemiol 1985; 121: 182-205. [ Links ]
5. Garner JS, Jarvis WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections, 1988. Am J Infect Control 1988; 16: 128-140. [ Links ]
6. Grupo de Estudio de Infección Hospitalaria de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Documento de consenso sobre recomendaciones y recursos necesarios para un programa de control de la infección nosocomial en los hospitales españoles 1999; http://www.seimc.org/geih/doc1.htm [ Links ]
7. Valls V, Gómez-Herruz P, González-Palacios R, Cuadros JA, Romanyk JP, Ena J. Long-term efficacy of a program to control methicillin-resistant Staphylococcus aureus. Eur J Clin Microbiol Infect Dis 1994; 13: 90-95. [ Links ]
8. Trilla A, Marco F, Moreno A, et al. Epidemiología clínica de un brote de infección nosocomial por Staphylococcus aureus resistente a meticilina y aminoglucósidos: eficacia de las medidas de control. Med Clin (Barc) 1993; 100: 205-209. [ Links ]
9. Layton MC, Hierholzer WJ, Patterson JE. The evolving epidemiology of methicillin-resistant Staphylococcus aureus at university hospital. Infect Control Hosp Epidemiol 1995; 16: 12-17. [ Links ]
10. Boyce JM. Increasing prevalence of methicillin-resistant Staphylococcus aureus in the United States. Infect Control Hosp Epidemiol 1990; 11: 639-642. [ Links ]
11. Quinn JP. Clinical problems posed by multiresistant nonfermenting gram-negative pathogens. Clin Infect Dis 1998; 27 (Supl. 1): 117-124. [ Links ]
12. Ayats J, Corbella X, Ardanuy C, et al. Epidemiological significance of cutaneus pharingeal, an digestive tract of colonization by multiresistant Acinetobacter baumannii in ICU patients. J Hosp Infect 1997; 37: 287-295. [ Links ]
13. Christie C, Mazon D, Hierholzer WJ, Patterson JE. Molecular heterogeneity of Acinetobacter baumanii isolates during seasonal increase in prevalence. Infect Control Hosp Epidemiol 1995; 16: 590-594. [ Links ]
14. Denton M, Kerr KG. Microbiological and clinical aspects of infection associated with Stenotrophomonas maltophilia. Clin Microbiol Rev 1998; 11: 57-80. [ Links ]
15. Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. Proyecto EPINE 1990-1999. Evolución de la prevalencia de las infecciones nosocomiales en los hospitales españoles. Grupo de trabajo EPINE. Vaqué. J , Roselló. J, editores. Madrid, 2001. [ Links ]
16. Generalitat de Catalunya. Departament de Sanitat i Seguretat Social. Pla de salut de Catalunya 1999-2001. Barcelona: Departament de Sanitat i Seguretat Social, 1999. [ Links ]
17. Koeleman JG, Parlevliet GA, Dijkshoorn L, Savelkoul PH. Nosocomial outbreak of multi-resistant Acinetobacter baumannii on a surgical ward: epidemiology and risk factors for acquisition. J Hosp Infect 1997; 37: 113-123. [ Links ]
18. Bergmans D, Bonten M, van Tiel F, et al. Cross-colonisation with Pseudomonas aeruginosa of patients in an intensive care unit. Thorax 1998; 53: 1053-1058. [ Links ]
19. Corbacho Malo MS, Sarria Amigot J, Hernández Navarrete MJ, Muniesa Cuenca P, Jiménez Buñuales T, Arribas Llorente JL. Cambios e los patrones epidemiológicos de la infección por Staphylococcus aureus resistente a la meticilina en un hospital de tercer nivel. Experiencia de 5 años. Med Clin (Barc) 2000; 114: 136-138. [ Links ]
20. Prentice W, Dunlop R, Armes PJ, Cunningham DE, Lucas C, Todd J. Methicillin-resistant Staphylococcus aureus infection in palliative care. Palliat Med 1998; 12: 443-449. [ Links ]
21. Clifford L, Banerjee SN, Jarvis WR. System. Seasonal variation of Acinetobacter infections: 1987-1996. Clin Infect Dis 1999; 29: 1133-1137. [ Links ]
22. Gales AC, Jones RN, Forward KR, Liñares J, Sader HS, Verhoel J. Emerging importance of multidrug-resistant Acinetobacter species and Stenotrophomonas maltophilia as pathogens in seriously ill patients: geographic patterns, epidemiological features, and trends in the SENTRY antimicrobial surveillance program (1997-1999). CID 2001; 32 (Supl. 2): 104- 113. [ Links ]
23. Roghmann MC. Predicting methicillin resistance and the effect of inadequate empiric therapy on survival in patients with Staphylococcus aureus bacteriemia. Arch Intern Med 2000; 160: 1001-1004. [ Links ]
24. Rello J, Torres A, Ricart M, et al. Ventilator-associated penumonia by Staphylococcus aureus: comparison of methicillin-resistant and methicillin-sensitive episodes. Am J Respir Crit Care Med 1994; 150: 1545-1549. [ Links ]
25. Maury E, Alzieu M, Baudel JL, et al. Availability of an alcohol solution can improve hand disinfection compliance in an intensive care unit. Am J Respir Crit Care Med 2000; 162: 324-327. [ Links ]
26. Crossley K, Loesch D, Landesman B, Mead K, Chern M, Strate R. An outbreak of infections caused by strains of Staphylococcus aureus resistant to methicillin and aminoglycosides. I. Clinical studies. J Infect Dis 1979; 139: 273-279. [ Links ]
27. Coello R, Glynn JR, Gaspar C, Picazo JJ, Fereres J. Risk factors for developing clinical infection with methicillin-resistant Staphylococcus aureus (MRSA) amongst hospital patients initially only colonized with MRSA. J Hosp Infect 1997; 37: 39-46. [ Links ]
28. Lortholary O, Fagon JY, Hoy AB, et al. Nosocomial acquisition of multiresistant Acinetobacter baumannii: risk factors and prognosis. Clin Infect Dis 1995; 20: 790-796. [ Links ]
29. Wenzel RP. The economics of nosocomial infections. J Hosp Infect 1995; 31: 79-87. [ Links ]
30. García-Garmendia JL, Ortiz-Leyba C, Garnacho-Montero J, Jiménez-Jiménez FJ, Monterrubio-Villar J, Gli-Miner M. Mortality and the increase in length of stay attributable to the acquisition of Acinetobacter in critically ill patients. Crit Care Med 1999; 27; 1794-1799. [ Links ]
31. Kaul R, Burt JA, Cork L, et al. Investigation of a multiyear multiple critical care unit outbreak due to relatively drug-sensitive Acinetobacter baumannii: risk factors and attributable mortality. J Infect Dis 1996; 174: 1279-1287. [ Links ]
32. Haddin AS, Fappiano SA, Lipsett PA. Methicillin resistant Staphylococcus aureus (MRSA) in the intensive care unit. Postgrad Med J 2002; 78: 385-392. [ Links ]
33. Fagon JY, Chastre J, Domart Y, Wenzel RP, Feinberg SE. Mortality due to ventilator-associated pneumonia or colonization with Pseudomonas or Acinetobacter species: assessment by quantitative culture of samples obtained by a protected specimen brush. Clin Infect Dis 1996: 23: 538-542. [ Links ]
34. Álvarez-Lerma F, Gasulla guillermo M, Abad Peruga V, Pueyo Pont MJ, Tarragó Eixarch E. Efectividad del aislamiento de contacto en el control de bacterias multirresistentes en un servicio de medicina intensiva. Enferm Infecc Microbiol Clin 2002; 20: 57-63. [ Links ]
35. Villers D, Espaze E, Coste-Dure M, Giauffret F, Ninin E, Nicolas F et al. Nosocomial Acinetobacter baumannii infections: microbiological and clinical epidemiology. Ann Intern Med 1998; 129: 182-189. [ Links ]