Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.87 no.8 ago. 2012
https://dx.doi.org/10.1016/j.oftal.2012.04.010
Agudeza visual a largo plazo en pacientes con degeneración macular asociada a la edad tratados con ranibizumab y persistencia de fluido subretiniano
Long-term visual acuity in patients with age-related macular degeneration and persistence of subretinal fluid after treatment with ranibizumab
C. Torrón, S. Fernández-Pérez, O. Ruiz, J. Leciñena y L. Pablo
Servicio de Oftalmología, Hospital Universitario Miguel Servet, Zaragoza, España
Dirección para correspondencia
RESUMEN
Objetivo: Analizar la agudeza visual (AV) a largo plazo en pacientes con DMAE tratados con ranibizumab con persistencia de líquido subretiniano después del tratamiento de inducción y/o en los controles sucesivos.
Método: Hemos revisado las historias clínicas, tomografías de coherencia óptica (OCT) y angiografías fluoresceínicas de los 216 pacientes tratados con ranibizumab entre enero de 2008 y abril del 2010, seleccionando aquellos que han presentado fluido subretiniano de forma persistente o recurrente a lo largo del seguimiento mínimo de un año.
Resultados: Hemos incluido 36 ojos de 34 pacientes; 19 ojos (52,7%) presentaban persistencia y 17 (47,2%) recurrencia de fluido subretiniano a lo largo del seguimiento (media 29,06±9,28 meses). La media de inyecciones fue de 7,89 ± 3,2. El espesor macular central (EMC) inicial fue de 330 ± 84µm, a los 3 meses de 265,2 ± 62µm y de 294,5 ± 37µm al final del seguimiento. La AV media inicial fue de 0,3±0,2, a los 3 meses 0,43±0,2 (p<0,05) y al final del seguimiento de 0,41±0,22 (p<0,05). La aparición de hemorragias en las recurrencias se asoció con peor visión final en comparación con los que no las presentaron (p=0,004). Al final del seguimiento18 ojos (50%) continúan en tratamiento con ranibizumab, 16 ojos (44%) se mantienen en observación y 2 pacientes han fallecido. No existen diferencias entre AV y EMC entre ambos grupos.
Conclusión: La persistencia o recurrencia de fluido macular subretiniano en pacientes tratados con ranibizumab no disminuye significativamente la ganancia visual obtenida después del tratamiento de inducción, a pesar de la interrupción del mismo durante el seguimiento. La aparición de hemorragias en las recurrencias se asoció con peor AV final.
Palabras clave: Degeneración macular asociada a la edad. Ranibizumab. Lucentis. Antiangiogénicos. Neovascularización.
ABSTRACT
Objective: To analyse the long-term visual acuity (VA) in patients with age-related macular degeneration (ARMD) treated with ranibizumab, and who had persistent subretinal fluid after the induction therapy and/or in the successive controls.
Materials and methods: We reviewed the medical records, optical coherence tomography (OCT) and fluorescein angiograms of 216 patients treated with ranibizumab between January 2008 and April 2010, selecting those who had persistent subretinal fluid or recurrent fluid for at least one year of follow-up.
Results: A total of 36 eyes from 34 patients were included, with 19 eyes (52.7%) having persistent, and 17 (47.2%) recurrent subretinal fluid throughout the follow-up (mean 29.06±9.28 months). The average number of injections was 7.89±3.2. The central macular thickness (CMT) at the start of follow-up was 330±84µm, at 3 months 265.2±62µm, and 294.5±37µm at the end of the follow-up. The initial mean VA was 0.3±0.2, at 3 months 0.43±0.2 (P<.05) and at the final review, 0.41±0.22 (P<.05). Haemorrhages in recurrences were associated with a worse final VA (P=.004). At the end of follow-up, 18 eyes (50%) continued with ranibizumab treatment, 16 eyes (44%) were kept under observation, and 2 patients died. There were no differences between VA and CMT between the groups.
Conclusions: The persistence or recurrence of macular subretinal fluid in patients treated with ranibizumab does not significantly reduce the visual gain obtained after induction therapy, despite discontinuation of treatment during follow-up. Haemorrhages in the recurrences were associated with a worse final VA.
Key words: Age-related macular degeneration. Ranibizumab. Lucentis. Antiangiogenic. Neovascularisation.
Introducción
El tratamiento con ranibizumab es en la actualidad de elección en la degeneración macular asociada a la edad (DMAE) de tipo exudativo. Los estudios multicéntricos, aleatorizados y doble ciego MARINA Y ANCHOR1,2 demostraron que la administración mensual de ranibizumab durante dos años no solo mantenía sino que conseguía mejorías significativas de visión, con una ganancia media de 7,2 y 11,3 letras respectivamente. Este patrón de tratamiento es inviable en la práctica clínica habitual, por razones organizativas, sociales y económicas, de manera que se han ido desarrollando estudios para alcanzar los objetivos de mejoría de agudeza visual (AV) con menor número de inyecciones. Los estudios en los que se ha usado un régimen de tres inyecciones mensuales al inicio y posteriormente inyecciones trimestrales (PIER, EXCITE) no han conseguido igualar los buenos resultados de AV3,4, pero aquellos basados en tres inyecciones mensuales iniciales y luego según las necesidades de cada paciente (PrONTO, SUSTAIN) obtuvieron ganancias de AV muy similares con una media de inyecciones muy inferior5-7. Pero además, con el régimen mensual probablemente se están sobretratando pacientes de forma innecesaria, provocando alteraciones en el epitelio pigmentario retinano (EPR) y daño en los fotorreceptores8.
En nuestro Hospital, la pauta habitual ha sido generalmente tres inyecciones mensuales consecutivas al inicio y posteriormente el tratamiento individualizado para cada paciente, teniendo en cuenta la AV, hallazgos en fondo de ojo por biomicroscopía y en la tomografía de coherencia óptica (OCT), según las recomendaciones del estudio PrONTO6. Durante los cinco años de experiencia con el tratamiento antiangiogénico, hemos observado que en algunos pacientes, las inyecciones de ranibizumab no conseguían eliminar por completo el fluido subretiniano en la OCT, mientras que en otros desaparecía y aparecía periódicamente independientemente de los retratamientos. Esto obligaba a un seguimiento atento para evitar pérdidas de visión. Por esta razón, nos planteamos realizar este estudio retrospectivo, cuyo principal objetivo era investigar la evolución de la AV a largo plazo en este grupo de enfermos y secundariamente, la influencia de las diversas variables como tipo o tamaño de membrana neovascular, presencia de DEP, hemorragia, así como el número de inyecciones de ranibizumab, en el resultado visual de este tipo de pacientes.
Material y métodos
Estudio retrospectivo y observacional de 216 pacientes con DMAE exudativa tratados con ranibizumab en nuestro Hospital entre enero de 2008 y abril del 2010. Se han incluido en el estudio aquellos que presentaron fluido subretiniano de forma persistente después de las tres inyecciones de carga o de forma recurrente a lo largo del seguimiento mínimo de un año.
Consideramos recurrencia de fluido subretiniano cuando este reaparece, independientemente de los retratamientos, después de desaparecer inicialmente con las 3 dosis de carga de ranibizumab.
Se excluyó a los pacientes con sospecha clínica de nueva neovascularización, proliferación angiomatosa retiniana (RAP) en estadios avanzados, vasculopatía coroidea polipoidal idiopática (VCPI) o enfermedad asociada que pudiera ser causante de exudación, así como los que tenían antecedentes de cirugía intraocular reciente o tratamiento previo con láser o terapia fotodinámica.
Todos los pacientes fueron revisados mensual o bimensualmente durante el primer año y cada 1-3 meses a partir del segundo año de tratamiento. En cada visita se realizaba una exploración oftalmológica completa que incluía: AV (optotipos tipo Snellen), biomicroscopía de polo anterior, tonometría por aplanación, exploración de fondo de ojo con oftalmoscopio binocular, biomicroscopía de polo posterior con lente de 78 dioptrías, angiografía con fluoresceína (AGF) y una OCT macular, estrategia «macular cube» 512×128 (Cirrus HD -OCT, Zeiss Meditec, Jena-Germany).
La angiografía fluoresceínica (AGF) se realizó antes de iniciar el tratamiento, excepto en 2 pacientes (3 ojos) y cuando se consideró necesario durante el seguimiento para descartar nueva neovascularización o cambio de estrategia terapéutica.
La variable principal del estudio fue la AV, como variables secundarias se consideraron los hallazgos biomicroscópicos, de la AGF y de la OCT macular.
Se realizó un análisis estadístico descriptivo calculando las frecuencias y proporciones de las variables cualitativas y, las medias (desviación típica) o medianas (rangos), en el caso de las variables cuantitativas. Para contrastar las variables cualitativas, se aplicó el test de Chi-cuadrado. Para las variables cuantitativas, se comprobó si seguían una distribución normal mediante el test de Kolmogorov-Smirnov, dado que los datos no se ajustaron a la normalidad, se compararon las medias utilizando el test no paramétrico U de Mann-Whitney para muestras independientes y la W de Wilcoxon para datos apareados. Se consideró el nivel de significación del 5%: p<0,05. El programa informático utilizado fue el SPSS Inc, Chicago, IL, EE. UU. versión 18.0.
Resultados
Se han incluido incluido 36 ojos de 34 pacientes, con una edad media de 76,1±5,67 años.
De ellos, 11 eran varones (32,3%) y 33 mujeres (67,6%); 19 ojos (52,7%) presentaban persistencia y 17 (47,2%) recurrencia de fluido subretiniano en las OCT a lo largo de los diferentes controles realizados (Figura 1 y Figura 2). El seguimiento medio ha sido de 29,06±9,28 meses (rango 12-48) y el número medio de inyecciones realizadas ha sido de 7,89±3,21 (rango 3-14). En 20 de los 34 pacientes estudiados (58,8%) existía una DMAE exudativa bilateral. Solamente se ha perdido el seguimiento de dos pacientes con enfermedad de Alzheimer, a los 30 y 18 meses, fallecidas a los 87 y 85 años.

Figura 1. A) Retinografía. B-D) Angiografía fluoresceínica de paciente de 64 años
con lesión mínimamente clásica, edema macular quístico y desprendimiento de
epitelio pigmentario retiniano. Agudeza visual inicial 0,1.
Agudeza visual final tras 11 inyecciones de ranibizumab (24 meses) 0,3.





Figura 2. A) Tomografia de coherencia óptica inicial. B-F) Tomografía de coherencia
óptica a los 3, 6, 9, 12 y 24 meses de la 1.a inyección de ranibizumab. Espesor macular
central inicial 658µm, final 323µm. Obsérvese la persistencia de fluido subretiniano
en todos los controles a pesar del tratamiento.
En el examen de fondo de ojo con biomicroscopía, en 9 de los 36 ojos (25%) se apreció hemorragia subretiniana y en 13 (36%) un desprendimiento de epitelio pigmentario (DEP) en el momento del diagnóstico.
Las características de la AGF y OCT basal se exponen en la Tabla 1.
La AV media inicial fue de 0,30±0,20 (rango 0,02-0,9), a los 3 meses de la 1.a inyección de 0,43±0,22 (p=0,00035; ratio 1,96; IC 95% 1,27-2,65), a los 12 meses de 0,39±0,2 (p=0,008; ratio 1,89; IC 95% 1,08-2,69), a los 24 meses (N=30) de 0,42±0,2 (p=0,006; ratio 2,03; IC 95% 1,22-2,84), y al final del seguimiento de 0,41±0,22 (p=0,02; ratio 2,0; IC 95% 1,27-2,73), observándose diferencias significativas entre la AV media inicial y todos los controles. En la comparación de la AV media a los 3 meses de la primera inyección con respecto a los controles de los 12, 24 meses y final, no se observaron diferencias significativas (p=0,247; p=0,818 y p=0,631, respectivamente).
En las figuras 3 y 4 se aprecia la evolución de la AV media y del espesor macular central (EMC) medio de todos los pacientes estudiados en los diferentes controles.
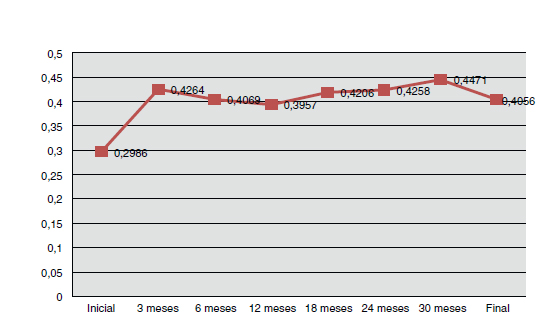
Figura 3. Evolución de la agudeza visual (AV) media en los diferentes controles.

Figura 4. Evolución en micras del espesor macular central medio en los diferentes controles.
Antes del tratamiento solo siete ojos (19,4%) tenían una AV > 0,5, mientras que al final del seguimiento eran 15 (41,6%) p=0,005; ratio 2,60; IC 95% 1,13-4,06.
En cuanto a la evolución del fluido subretiniano con relación a las inyecciones de ranibizumab, en 11 ojos (30,5%) se objetivó disminución del mismo en más del 50% de los retratamientos, en 9 (25%) no disminuyó en ninguno de los retratamientos y en 16 (44,4%) se apreció disminución en menos de la mitad de los retratamientos realizados.
No se observaron diferencias significativas en la AV final ni en el EMC comparando los pacientes que han seguido recibiendo inyecciones de ranibizumab durante todo el seguimiento (N=25, 69,4%), con los que en un momento determinado se han dejado de tratar y se han ido controlando sin tratamiento (N = 11, 30,5%) (Tabla 2).
No hubo diferencias significativas en la comparación de AV basal o EMC basal en la OCT, según el tipo angiográfico de membrana neovacular. Tampoco entre la existencia basal de DEP, quistes intrarretinianos o hemorragia intra- o subretiniana.
Analizando las diferentes variables entre los pacientes con fluido persistente y recurrente (AV inicial y final, tamaño de la lesión, n.o de inyecciones), solo se observaron diferencias significativas en el EMC tanto inicial (p=0,01; media 330,52; IC 95% 299,62-361,41) como final (p < 0,001; media 267,03; IC 95% 246,81-287,24), que es menor en los pacientes con fluido recurrente.
En los ojos con aparición de hemorragias en las recurrencias, la AV final fue significativamente peor que en los que no las tenían (p=0,004; media AV hemorragia en recurrencias 0,21; IC 95% 0,08-0,34 versus no hemorragia 0,47; IC 95% 0,40-0,55), en cambio la aparición de quistes en la OCT en dichas recurrencias no se asoció con peor AV final con respecto a los que no los presentaron (p=0,442), aunque fue significativamente peor en los ojos con quistes en el control de los 3 meses (Tabla 3).
Discusión
El tratamiento con ranibizumab ha conseguido un importante cambio en el manejo de los pacientes con DMAE, de manera que la mayoría de los pacientes van a estabilizar o mejorar su visión. Sin embargo, un 8-10% de los pacientes sufren pérdidas visuales importantes, aun en los casos de tratamientos mensuales como demostraron los ensayos clínicos MARINA y ANCHOR1,2. En un estudio retrospectivo reciente, Rosenfeld8 ha investigado las principales causas de pérdida visual en estos pacientes, comparando las diversas variables entre los pacientes con ganancia de > 15 letras y los que perdieron > 15 letras, partiendo de la hipótesis de que un aumento de la exudación procedente de la neovascularización explicaría la diferencia entre los grupos. Sin embargo, la comparación entre ambos grupos demostró que no había diferencias en el control basal, ni al mes, 3, 6, 12 o 24 meses. Tampoco encontraron asociación entre la pérdida visual y hemorragia, fibrosis o presencia de DEP. En cambio, sí se observaron diferencias significativas en la extensión de anomalías del EPR y aumento del área de atrofia, superiores en el grupo de pérdida visual. En su opinión, estos cambios podrían deberse a la propia terapia con ranibizumab.
En el estudio PrONTO3, la presencia de fluido subretiniano en la OCT era criterio de retratamiento, independientemente de la AV. Sin embargo, en el estudio SUSTAIN, después de las 3 inyecciones de carga, se trataba solo a aquellos pacientes que presentaban pérdida de más de 5 letras de AV o incremento superior a 100 mµ en el EMC.
En nuestro estudio, hemos comprobado como en un grupo de pacientes, la terapia con ranibizumab no conseguía eliminar por completo el fluido subretiniano en la OCT, de manera que en algunos casos la actitud terapéutica habitual era revisar al paciente sin tratamiento mientras no existiera disminución de AV, hemorragias o quistes intrarretinianos, indicando una reactivación de la lesión, mientras que otros se trataban por miedo a que su visión disminuyera al tratarse en muchos casos de ojos únicos. Sin embargo, el análisis de nuestros resultados parece indicar que solo la presencia de hemorragias asociadas a la aparición de fluido subretiniano se acompañó de un peor resultado visual. Asimismo, demuestra que los pacientes que se mantienen en observación sin tratamiento no tienen peor AV que los que se siguen tratando a lo largo de todo el seguimiento.
Consideramos que estos pacientes no son «no respondedores», puesto que la AV mejora con el tratamiento inicial y se mantiene estable después, sino que podríamos considerarlos «respondedores parciales»9. Además de la posible persistencia de exudación proveniente de la neovascularización, quizás por una posible taquifilaxia10,11, puede haber otros mecanismos implicados en la persistencia de fluido subretiniano, tales como la disfunción del epitelio pigmentario retiniano o la adherencia vitreomacular12.
Aunque el porcentaje de pacientes es de algo más de un 15%, supone una fuerte sobrecarga en las consultas ya que requieren controles indefinidos en periodos de tiempo cortos tanto si se retratan como si no, convirtiéndose en «crónicos» y creando una dependencia del hospital. Creemos que es importante reconocer este tipo de comportamiento, ocasionado probablemente por lesiones quiescentes o menos agresivas a consecuencia del tratamiento, o por factores desconocidos.
Estas especiales características hacen que en estos pacientes la presencia de fluido intra- o subretiniano no sea un criterio absoluto de retratamiento siempre que no se acompañe de pérdida visual.
En conclusión, hemos comprobado que un porcentaje de alrededor de un 15% de nuestros pacientes ha presentado una persistencia o recurrencia de fluido subretiniano acompañado o no de otras manifestaciones de exudación como DEP o quistes intrarretinianos. En estos pacientes, la ganancia media de AV obtenida después de las 3 inyecciones de carga se ha mantenido a largo plazo, a pesar de que en casi la mitad de los pacientes se haya abandonado el tratamiento. La presencia de hemorragias en las recidivas asoció peor AV final.
Nuestro estudio presenta algunas limitaciones como su carácter retrospectivo, el pequeño número de ojos y la exploración de la AV con optotipos de Snellen, pero creemos que aporta una información útil en el manejo de estos pacientes en la clínica diaria.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Bibliografía
1. Rosenfeld PJ, Brown DM, Heier JS, Boyer DS, Kaiser PK, Chung CY, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006; 355:1419-31. [ Links ]
2. Brown DM, Michels M, Kaiser PK, Heier JS, Sy JP, Lanchulev T. Ranibizumab versus verteporfin photodinamic therapy for neovascular age-related macular degeneration: two-year results of the ANCHOR study. Ophtalmology. 2009; 116:57-65. [ Links ]
3. Fung AE, Lalwani GA, Rosenfeld PJ, Dubovy SR, Michels S, Feuer WJ, et al. An optical coherence tomography-guided, variable dosing regimen with intravitreal ranibizumab (Lucentis) for neovascular age-related macular degeneration. Am J Ophthalmol. 2007; 143:566-83. [ Links ]
4. Regillo CD, Brown DM, Abraham P, Yue H, Ianchulev T, Schneider S, et al. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER Study year 1. Am J Ophthalmol. 2008; 145:239-48. [ Links ]
5. Spaide R. Ranibizumb according to need: a treatment for age-related macular degeneration. Am J Ophthalmol. 2007; 143:679-80. [ Links ]
6. Lalwani GA, Rosenfeld PJ, Fung AE, Dubovy SR, Michels S, Feuer W, et al. A variable-dosing regimen with intravitreal ranibizumab for neovascular age-related macular degeneration: year 2 of the PrONTO Study. Am J Ophthalmol. 2009; 148:43-58. [ Links ]
7. Holz FG, Amoaku W, Donate J, Guymer RH, Kellner U, Schlingemann RO, et al, SUSTAIN Study Group. Safety and efficacy of a flexible dosing regimen of ranibizumab in neovascular age-related macular degeneration: the SUSTAIN study. Ophthalmology. 2011; 118:663-71. [ Links ]
8. Rosenfeld PJ, Shapiro H, Tuomi L, Webster M, Elledge J, Blodi B. MARINA and ANCHOR Study Groups. Characteristics of patients losing vision after 2 years of monthly dosing in the phase III ranibizumab clinical trials. Ophthalmology. 2011; 118:523-30. [ Links ]
9. Torrón C. Pacientes no respondedores a anti-VEGF. En: Arias L., editors. Actualización de terapia anti-VEGF en enfermedades de retina y coroides. Ed. Barcelona: Elsevier; 2010. 80-93. [ Links ]
10. Eghøj MS, Sørensen TL. Tachyphylaxis during treatment of exudative age-related macular degeneration with ranibizumab. Br J Ophthalmol. 2012; 96:21-3. [ Links ]
11. Gasperini JL, Fawzi AA, Khondkaryan A, Lam L, Chong LP, Eliott D, et al. Bebacizumab and ranibizumab tachyphylaxis in the treatment of choroidal neovascularisation. Br J Ophthalmol. 2012; 96:14-20. [ Links ]
12. Lee SJ, Koh HJ. Effects of vitreomacular adhesion on anti-vascular endothelial growth factor treatment for exudative age-related macular degeneration. Ophthalmology. 2011; 118:101-10. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
ctorron@salud.aragon.es
(C. Torrón).
Recibido 23 Noviembre 2011
Aceptado 8 Abril 2012


















