Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.33 no.4 Madrid oct./dic. 2007
| Síndrome del shock tóxico estreptocócico tras fascitis necrotizante por estreptococo pyogenes Streptococcal toxic shock syndrome after necrotizing fascitis due to streptococcus pyogenes |
|
| Rodríguez Lorenzo, A.*, Midón Míguez, J.**, Martelo Villar, F.*** |
| Resumen La fascitis necrotizante por Estreptococo Pyogenes es una emergencia quirúrgica con una tasa de mortalidad elevada por la rápida progresión a shock y fallo multiorgánico. El reto supone realizar un diagnóstico precoz, ya que suele ser confundido con una infección leve de tejidos blandos. Presentamos dos casos clínicos de fascitis necrotizante que presentaron en 24 horas un Síndrome de Shock Tóxico Estreptocócico. Revisamos el mecanismo patogénico, diagnóstico y tratamiento descritos para este cuadro y discutimos las recomendaciones para su manejo establecidas en la literatura.
| Abstract Necrotizing fascitis by Streptococcus Pyogenes is a surgical emergency with a high mortality task due to a rapid progression of the illness to shock and organ failure. The challenge is to perform a prompt diagnosis because it is often confused with a minor soft-tissue infection. We present two cases of necrotizing fascitis by Streptococcus Pyogenes who in 24 hours developed a Streptococcal Toxic Shock Syndrome. In addition, we review the pathogenic mechanism, diagnosis and treatment of this syndrome and we discuss its management following literature recommendations. |
|
|
|
* Médico Interno Residente.
** Médico Adjunto.
*** Jefe de Servicio.
Servicio de Cirugía Plástica y Quemados. Complejo Hospitalario Universitario Juan Canalejo. La Coruña. España.
Introducción
El Estreptococo Pyogenes o Estreptococo BetaHemolítico del grupo A(EGA) es un coco Gram-positivo aeróbico facultativo que crece en cadenas y cuyo único reservorio conocido en la naturaleza es la piel ymucosa humanas.
Produce un amplio espectro de infecciones en humanos (1) incluyendo faringitis, amigdalitis, fiebre escarlatina, fiebre reumática, glomerulonefritis posestreptocócica y diferentes infecciones de tejidos blandos como pyoderma estreptocócico, erisipela y celulitis. Menos frecuentemente el EGA produce lo que se denominan infecciones invasivas definidas por la presencia de bacteriemia, neumonía o cualquier otra infección asociada con el aislamiento de EGA en un medio habitualmente estéril, incluyendo entre ellas la fascitis necrotizante y la miositis gangrenosa espontánea. La prevalencia de estas infecciones invasivas por EGA según estudios prospectivos poblacionales se establece entre 1-5 casos por cada 100.000 habitantes (2,3). En torno a un tercio de ellas se complican con el llamado Síndrome de Shock Tóxico Estreptocócico(SSTE) definido por la presencia de una infección invasiva por EGA asociada a shock y fallo multiorgánico, presentando una tasa de mortalidad que oscila entre el 30% y el 70% de los casos según las series publicadas (3,4).
El manejo óptimo del SSTE tras fascitis necrotizante por EGA incluye un desbridamiento quirúrgico agresivo, antibioterapia y soporte hemodinámico. No obstante, el diagnóstico precoz supone un reto para médicos y cirujanos, siendo frecuentemente confundido este cuadro con una infección leve como celulitis. Presentamos dos casos clínicos de fascitis necrotizante y fascitis necrotizante asociada a miositis necrotizante en la extremidad inferior producida por EGA que desarrollaron un cuadro de SSTE. Revisamos el mecanismo patogénico, diagnóstico y tratamiento descritos para este cuadro, así como discutimos las recomendaciones para su manejo establecidas en la literatura según su nivel de evidencia científica.
Pacientes y método
Caso 1
Varón de 38 años de edad alérgico a Penicilina, bebedor de 80 gramos de alcohol/día y obeso que acude al Servicio de Urgencias de nuestro Hospital por presentar un cuadro de edemas en las extremidades inferiores, distensión abdominal y febrícula de dos días de evolución. Refiere además astenia importante de varias semanas de evolución acompañada de náuseas, vómitos y diarrea en los últimos 7 días. A la exploración física destaca la presencia de 37,5º C de temperatura, datos de ascitis abdominal y edemas en ambas extremidades inferiores, principalmente en la derecha, asociados en este miembro a eritema, petequias y equímosis. No se aprecian otros datos patológicos a la exploración.
En la analítica de ingreso se obtuvieron los siguientes resultados: Hemoglobina 8,3 gr/dl ; Hematocrito:23,3%;Leucocitos 20.420 por µl (neutrófilos 91,5%); Plaquetas 119.000 por µl ; Dimeros D 14.080 ng/dl; Urea: 178 mg/dl; Creatinina 9 mg/dl; Na 124 mEq/l; K 3,9 mEq/l;Proteinas totales 5,6 gr/dl, LDH 559 UI/l; CPK 239 UI/l;GPT 35 UI/l; GOT 77 UI/l. Se realizó una radiografía de tórax que era normal y una Ecografía y TAC abdominales que reflejaban una ascitis masiva, datos de hepatopatía crónica y esplenomegalia. Con el juicio clínico de insuficiencia renal aguda, en el contexto de un hepatópata crónico de origen enólico y celulitis en extremidad inferior ingresa en el Servicio de Nefrología. Se instaura un tratamiento con diuréticos (Furosemida) y antibioterapia empírica con Ciprofloxacino (1gr/ 24 horas) tras extracción de hemocultivos. A las 24 horas del ingreso el paciente presenta fiebre (38,4º C) y empeoramiento de las lesiones en miembro inferior derecho (MID), con aumento del dolor, extensión de la celulitis y presencia de ampollas. En la analítica se objetiva un empeoramiento en la función renal con valores de creatinina plasmática de 10,60 mg/dl y urea 181 mg/dl, un aumento de la leucocitosis (35.340 por µl, neutrófilos 96,8 %) y alteraciones en la coagulación ( tiempo de protrombina de 28,8 segundos y tiempo de tromboplastina parcial activada de 61,4 segundos). En el hemocultivo realizado al ingreso se aísla Estreptococo Pyogenes, por lo que se inicia antibioterapia intravenosa con Clindamicina y Gentamicina y es ingresado en la Unidad de Cuidados Intensivos (UCI) por presentar inestabilidad hemodinámica y progresión rápida de las lesiones en extremidad inferior visible en pocas horas, con anestesia cutánea, grandes ampollas hasta el tercio medio de muslo y afectación escrotal ( Fig. 1) .Precisa ventilación mecánica invasiva, aminas vasoactivas y hemofiltración veno-venosa continua y se indica intervención quirúrgica urgente en la que se realiza desbridamiento escrotal, desbridamiento de fascia hasta raíz de muslo y amputación abierta supracondílea.

Fig. 1. Caso 1: Apariencia de las lesiones cutáneas a las 24 horas del ingreso con celulitis y
anestesia cutánea hasta tercio medio de muslo derecho y afectación escrotal.
Presenta una evolución desfavorable con fracaso multiorgánico (fracaso renal agudo, coagulopatia y síndrome de distrés respiratorio agudo) no respondiendo a medidas de soporte hemodinámico ni a antibioterapia y fallece finalmente a las 24h de la cirugía.
Caso 2
Varón de 62 años sin antecedentes de interés que es remitido a la Unidad de Quemados de nuestro Hospital desde su centro de referencia con el diagnóstico de quemadura química en el miembro inferior derecho de 24 horas de evolución. A la exploración se encuentra apirético, presentando dolor en la extremidad inferior derecha con eritema y áreas de necrosis en el dorso del pie y de la cara anterior de la pierna. No se aprecian otros datos patológicos a la exploración. En la analítica de ingreso se obtuvieron los siguientes resultados: Hemoglobina 13,1 gr/dl; Hematocrito: 37,9%; Leucocitos 3.370 por µl (neutrófilos 88,4%);Plaquetas 195.000 por µl ; Urea: 182 mg/dl; Creatinina 3,6 mg/dl; Na 132 mEq/l; K 5,2 mEq/l; Proteinas totales 5,6 gr/dl;CPK 317 UI/L.
Con el diagnóstico inicial de quemadura química de tercer grado en extremidad inferior se realizan bajo sedación escarotomías y reanimación con sueroterapia. A las 24 horas de ingreso se observa progresión de necrosis y eritema hasta el abdomen (Fig. 2) con leve mejoría de la función renal (Urea: 188 mg/dl;Creatinina 2,7 mg/dl) y con una CPK 9.782 UI/L, hipotensión y taquicardia.
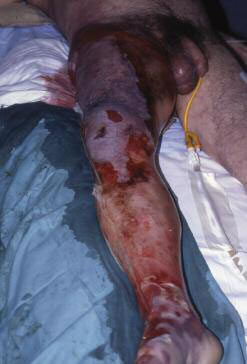
Fig. 2. Caso 2: Sufrimiento y necrosis cutánea hasta raíz del muslo.
La familia del paciente revela que cuatro días antes había tenido un pequeño traumatismo en la rodilla derecha que evolucionó a una celulitis con posterior aparición de un área eritemato-violácea; le realizaron una punción para descartar hematoma y le aplicaron el "agua de Burow", siendo diagnosticado de quemadura química al día siguiente y remitido a nuestro centro.
Con el diagnóstico de shock séptico tras fascitis necrotizante en extremidad inferior derecha se indica intervención quirúrgica urgente, realizándose desbridamiento facial; al comprobarse necrosis muscular a nivel del muslo se realiza desarticulación abierta a nivel coxofemoral y empíricamente se administra antibioterapia basada en Imipenem y Vancomicina. En el cultivo microbiológico de fascia y músculo se aisló Estreptococo Pyogenes y la histología objetivó necrosis dérmica, tejido celular subcutáneo, fascia y músculo con presencia de cocos Gram positivos. El paciente presentó una evolución clínica satisfactoria, realizándose secundariamente cobertura del muñón con un colgajo miocutáneo pediculado de recto anterior.
Discusión
Diferentes estudios revelan un aumento reciente de las infecciones graves por EGA (5,6). Afectan en general a individuos sanos, no inmunocomprometidos y de cualquier edad. Se han asociado diferentes factores de riesgo como la presencia de infecciones virales (varicela (7) o el uso de AINES (8), no obstante se desconoce exactamente su relación. Han sido descritos casos de transmisión horizontal de la infección en comunidades cerradas (9), siendo esto extremadamente raro, lo que ha hecho formular la hipótesis de la existencia de una predisposición individual a esta infección grave mediante la existencia de factores constitucionales como el HLA de clase II, aloantígenos de células B o regiones específicas Vβ de los linfocitos (10-12).
Los mecanismos patogénicos del SSTE no se conocen con exactitud ya que se basan en interacciones complejas entre los mecanismos de defensa del huésped y los factores específicos de virulencia del EGA (13) que son fundamentalmente dos: la proteína M y las exotoxinas. La proteína M es una proteína filamentosa de la membrana celular que presenta propiedades antifagocitarias siendo los subtipos de proteína M 1, 3, 12 y 28 los más frecuentemente asociados a infecciones graves en pacientes con shock y fallo multiorgánico.
Se han identificado tres tipos de exotoxinas estreptocócicas: A, B y C. La tipo A (más frecuente en Estados Unidos) y la B (más frecuente en Suecia y Reino Unido) se encuentran en la mayor parte de los casos de infecciones graves por EGA. In vitro, estas exotoxinas producen citotoxicidad, fiebre y aumentan los efectos de las endotoxinas, comportándose como superantígenos (al igual que en el Síndrome de Shock Tóxico Estafilocócico, de tal forma que interactúan simultáneamente con el complejo mayor de histocompatibilidad de clase II de las células presentadoras de antígenos y con la región específica Vβ de los receptores de los linfocitos T en ausencia del procesamiento clásico de antígenos. Como consecuencia de esta activación del sistema inmune se desencadena la liberación de grandes cantidades de citoquinas inflamatorias ( factor de necrosis tumoral α, interferón gamma, interleukina-1β, interleukina-6, interleukina-2, interferón γ, factor de necrosis tumoral β). Esta masiva liberación de citoquinas se establece como el posible mecanismo que explique el shock y el fallo multiorgánico que se produce en el SSTE, debido a un aumento de la permeabilidad capilar y daño tisular.
El diagnóstico de certeza de fascitis necrotizante se basa en criterios histológicos (14). Los hallazgos característicos son necrosis de la fascia superficial con infiltrados de polimorfonucleares y necrosis fibrinoide de las paredes arteriales y venosas con oclusión trombótica de los vasos. Los microorganismos están presentes en la fascia y en la dermis profunda. El uso de una biopsia en fresco para establecer el diagnóstico ha propiciado una pronta detección y un tratamiento quirúrgico precoz con buenos resultados en pequeñas series de pacientes (15). Sin embargo, la confirmación histológica no es posible a veces y puede llegar demasiado tarde en otras ocasiones, por el riesgo de desarrollar un SSTE, por lo que la clave es una alta sospecha clínica.
No existe ningún dato patognomónico de la fascitis necrotizante producida por EGA, no obstante diferentes datos locales y sistémicos nos orientan a su diagnóstico (6,16). Quizás el síntoma más precoz sea el dolor desproporcionado frente a la apariencia de la infección cutánea, habitualmente secundaria a una pequeña herida o traumatismo previo. La presencia de un edema indurado que se extiende más allá del área de eritema es otro signo local habitual, siendo infrecuente la presencia de linfangitis. La presencia de cambios cutáneos debidos a trombosis de vasos subcutáneos suele producirse posteriormente, produciendo una piel brillante y tensa inicialmente que evoluciona a purpúrea y grisácea y frecuentemente asociada a la formación de bullas rellenas de líquido serosanguinolento. Las pruebas de imagen pueden revelar un aumento de partes blandas y la presencia de gas en los tejidos sugieren una etiología diferente como infección por Clostridium, celulitis anaeróbica no-Clostridium o fascitis necrotizante tipo 1. Entre las manifestaciones sistémicas la fiebre es un hallazgo consistente, asociada a una elevada leucocitosis con desviación izquierda y la presencia de valores elevados de CPK que sugieren una infección profunda de tejidos blandos; no obstante en ocasiones puede existir leucopenia( como en el Caso 2 que presentamos). La progresión de la CPK es un dato orientativo correlacionado con la progresión de la infección.
Bisno y Stevens (1) establecen tres fases clínicas del SSTE. En la fase 1, se detectan síntomas precoces de SSTE que incluyen mialgia, escalofríos, fiebre, náuseas, vómitos y diarrea, acompañados por dolor en el sitio de trauma menor. En la fase 2, taquicardia, fiebre, taquipnea y aumento del dolor en el sitio de la infección. En la fase 3 la presencia de fiebre persistente, dolor incoercible en el lugar de la infección, evidencia de shock y fallo multiorgánico. Frecuentemente, la insuficiencia renal precede a la hipotensión, como se observa en los casos clínicos que presentamos. La hipotensión está presente en el 40-50% de los pacientes en el momento del ingreso hospitalario y el resto la desarrollan en las siguientes 4-8 horas de evolución.
El manejo óptimo del SSTE requiere el manejo local de la infección mediante cirugía, soporte hemodinámico y un tratamiento antibiótico específico (16). Es fundamental un revisión quirúrgica precoz y agresiva de la zona de sospecha de una infección profunda de tejidos blandos antes de que se desarrollen datos de toxicidad sistémica, cuando ya puede ser tarde. La cirugía abarca desde procedimientos diagnósticos mediante de revisión quirúrgica de la grasa, fascia y músculo a través de una pequeña incisión, obteniendo una muestra en fresco para análisis, hasta una cirugía de desbridamiento cuyo objetivo es eliminar tejido muerto, reducir el número de bacterias presentes en el cuerpo y parar la progresión de la infección. Como en el resto de las fascitis necrotizantes de otra etiología, este desbridamiento puede ir desde un desbridamiento facial (único o seriado) hasta la amputación de extremidades (17).
Habitualmente la fascitis necrotizante por EGA presenta una evolución tan rápida, que el desbridamiento ha de ser intenso eliminando en un solo acto quirúrgico la totalidad del tejido afecto, por lo que no existe un criterio claro de cuándo realizar una amputación de urgencia en casos de SSTE. Diferentes autores (18) han recomendado la amputación de entrada en casos de shock, para reducir la agresividad quirúrgica producida por la pérdida hemática en el desbridamiento, que puede inestabilizar aún más al paciente; no obstante, esta práctica no ha demostrado un aumento en la supervivencia frente al desbridamiento agresivo (19).
En los dos casos que presentamos se realizó una amputación de la extremidad; en ambos, los pacientes presentaban una importante inestabilidad hemodinámica y en el caso 2, se constató además la presencia de necrosis muscular unida a la de la fascia, por lo que no fue posible preservar la extremidad.
El soporte hemodinámico incluye el aporte de cantidades masivas de líquidos intravenosos (10-19 litros/día), así como el uso de aminas vasoactivas como Dopamina o Epinefrina debido la hipotensión intratable. La hemodiálisis puede ser necesaria en caso de disfunción renal, así como la ventilación mecánica invasiva en caso de distrés respiratorio.
La antibioterapia constituye un pilar fundamental para el control de infecciones graves por EGA (20). La Penicilina ha resultado ser eficaz en infecciones menores de partes blandas, como celulitis, erisipela o impétigo; no obstante en fascitis necrotizante por EGA presenta un grado de eficacia menor (21). La explicación a esta falta de respuesta a la Penicilina es que es ineficaz cuando existen grandes concentraciones de EGA o cuando están en una fase estacionaria de crecimiento, situación que sucede en fases avanzadas de la infección.
Por ello se ha buscado una alternativa terapéutica a los Beta-lactámicos, encontrándose la Clindamicina como antibiótico de primera línea frente a infecciones graves por EGA. Su eficacia se debe a varios factores: no se afecta por la cantidad de inóculo ni el estadío de crecimiento del germen, suprime la síntesis de toxina, facilita la fagocitosis del EGA al inhibir la síntesis de la proteína M antifagocítica, suprime el factor de necrosis tumoral, presenta un efecto postantibiótico más largo que los Betalactámicos e inhibe la síntesis de las PBP( penicilin binding proteins), que son enzimas encargados de la síntesis y degradación de la pared celular.
Otras modalidades terapéuticas en desarrollo incluyen el uso de Inmunoglobulina Antitoxina Intravenosa, Anticuerpos anti-TNF y oxígeno hiperbárico. La Inmunoglobulina Intravenosa Antitoxina Estreptocócica supone una modalidad terapéutica reciente cuyo fin es neutralizar las toxinas circulantes estreptocócicas; no obstante aún no está comercializada en Europa, y aunque los resultados en ensayos clínicos son esperanzadores (22-24), se necesitan estudios adicionales que confirmen su eficacia. Los Anticuerpos anti-TNF se encuentran en fase de experimentación animal (25) y el oxígeno hiperbárico (26) ha sido utilizado en muy pocos casos sin que por el momento existan estudios aleatorios prospectivos que verifiquen su beneficio clínico.
Conclusiones
El diagnóstico precoz es la clave para disminuir la tasa de mortalidad en la fascitis necrotizante por EGA, basándose en la sospecha clínica (antecedentes de traumatismo menor en paciente sano de cualquier edad, con dolor desproporcionado a la apariencia de la infección, asociados a fiebre y signos de sufrimiento cutáneo)
Frecuentemente la insuficiencia renal aguda precede a la hipotensión en el desarrollo de Síndrome de Shock Tóxico Estreptocócico.
Ante un cuadro clínico compatible con fascitis necrotizante por EGA, las medidas terapéuticas que presentan un alto grado de recomendación clínica (basadas en estudios con un nivel de evidencia científica 1b (17)) son: la exploración y desbridamiento quirúrgico precoz y agresivo asociado a un tratamiento antibiótico empírico de amplio espectro que debe incluir la Clindamicina, y una vez aislado el germen en cultivo, con Clindamicina (900 mg intravenosos cada 8 horas) asociada a Penicilina( 4 millones de unidades intravenosas cada 4 horas).
Dirección del autor
Dr. Andrés Rodríguez Lorenzo
Servicio de Cirugía Plástica
Complejo Hospitalario Universitario Juan Canalejo
C/ Xubias de Arriba, 84.15006, A Coruña
e-mail: a.rodriguez.ps@gmail.com
Bibliografía
1. Bisno AL, Stevens DL.: "Streptococcal infections of skin and soft tissues". New England Journal of Medicine 1996; 334:240. [ Links ]
2. O´Brien KL, Beall B, Barrett NL.: "Epidemiology of invasive group A streptococcus disease in the United States, 1995-1999". Clinical Infectious Disease 2002; 35:268 [ Links ]
3. Davies HD, McGeer A.,Schwartz B.: "Invasive group A streptococcal infections in Ontario, Canada". New England Journal of Medicine 1996; 335: 547. [ Links ]
4. Stevens DL, Tanner MH, Winship J.: "Reappearance of scarlet fever toxin A among streptococci in the Rocky Mountain West: severe group A streptococcal infections associated with a toxic shock-like syndrome". New England Journal of Medicine 1989;321:1. [ Links ]
5. Schwartz B, Facklam RR, Brieman RF.: "Changing epidemiology of group A streptococcal infection in the USA". Lancet 1990;336:1167. [ Links ]
6. Stevens DL.: "The Flesh-Eating Bacterium: What´s Next". New England Journal of Medicine 1999;179( Supplement 2):366. [ Links ]
7. Laupland KB, Davies HD, Low DE.: "Invasive group A streptococcal disease in children and association with varicella-zoster virus infection. Ontario Group A Streptococcal Study Group". Pediatrics 2000; 105:E60 [ Links ]
8. Stevens, DL.: "Could nonsteroidal anti-inflammatory drugs (NSAIDs) enhance the progression of bacterial infections to toxic shock syndrome?" Clinical Infectious Disease 1995;21:977. [ Links ]
9. Schwartz B, Elliot JA, Butler JC.: "Clusters of invasive group A streptococcal infections in family, hospital and nursing home settings". Clinical Infectious Disease 1992; 15:277. [ Links ]
10. Greenberg LJ, Gray ED, Yunis E.: "Association of HL-A5 and immune responsiveness in vitro to streptococcal antigens". Journal of Experimental Medicine 1975; 141:934. [ Links ]
11. Weintein L, Barza MA: "Gas gangrene". New England Journal of Medicine 1973;289:1129. [ Links ]
12. Zabriskie JB, Lavenchy D, Williams RC.: "Rheumatic-fever associated B-cell alloantigens as identified by monoclonal antibodies". Arthritis Rheum 1985;28:1047. [ Links ]
13. Stevens DL.: "Invasive group A streptococcus infections". Clinical Infectious Disease 1992;14:2. [ Links ]
14. Thibault GE.: "Clinical problem-solving". New England Journal of Medicine 1994; 330(9): 623. [ Links ]
15. Stamenkovic I, Lew PD.: "Early recognition of potentally fatal necrotizing fascitis: the use of frozen-section biopsy". New England Journal of Medicine 1984;310:1689. [ Links ]
16. Stevens DL.: "Epidemiology, clinical manifestations and diagnosis of streptococcal toxic shock syndrome". Uptodate 2006; Version 14.3: 1. [ Links ]
17. Lombardi CM, Silver LM, Lau KK, Silhanek AD, Connolly FG. "Necrotizing Fascitiis in the lower extremity: a review and case presentation." The Journal of foot and Ankle Surgery 2000;39(4):244. [ Links ]
18. Tang WM, HO PL, Fung KK, Yuen KY, Leong JCY.: "Necrotising fasciitis of a limb". The Journal of Bone and Joint Surgery 2001;83-B(5):709. [ Links ]
19. McHenry CR, Piotrowski, Petrinic D, Malangoni MA.: "Determinants of mortality for necrotizing soft-tissue infections". Annals of Surgery 1995;221(5):558. [ Links ]
20. Stevens DL, Bryant AE, Yan S.: "Invasive group A streptococcal infection: new concepts in antibiotic treatment". Int J Antimicrob Agents 1994; 4:297. [ Links ]
21. Eagle H.: "Experimental approach to the problem of treatment failure with penicillin. I. Group A streptococcal infection in mice". American Journal of Medicine 1952; 13:389. [ Links ]
22. Barry W, Hudgins L, Donta S, Pesanti E.: "Intravenous immunoglobulin therapy for toxic shock syndrome". JAMA 1992;267:3315. [ Links ]
23. Kaul R. MacGeer A, Norrby-Teglund A.: "Intravenous immunoglobulin therapy for streptococcal toxic shock syndrome-A comparative observational study". Clinical Infectious Disease 1999;28:800. [ Links ]
24. Darenberg J, Ihendyane N, Sjolin J.: "Intravenous immunoglobulin G therapy in streptococcal toxic shock syndrome: a European randomized, double-blind, placebo-controlled trial". Clinical Infectious Disease 2003;37:333. [ Links ]
25. Stevens DL, Bryant Ae, Hackett Sp.: "Group A streptococcal bacteriemia: the role of tumor necrosis factor in shock and organ failure". Journal of Infectious Disease 1996; 173:619 [ Links ]
26. Riseman JA, Zamboni WA, Curtis A, Graham DR, Konrad HR, Ross Ds.: "Hiperbaric oxygen therapy for necrotizing fasciitis reduces mortality and the need for debridements". Surgery 1990;108:847. [ Links ]















