Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.42 no.2 Madrid abr./jun. 2016
EXPERIMENTAL
ORIGINAL / Investigación
Efectividad de la simvastatina tópica e inyectable contra hidrocoloide en la epitelización de heridas de espesor parcial en un modelo animal
Topic and subdermic injection of simvastatin for wound reepithelialization versus hydrocolloid dressing in an animal model
Pablo D. Murakami-Morishige*; Mauricio A. Erazo-Franco*; Ximena Zozaya-Mininchini**; Felipe A. López-Silva***, Marco A. Barreda-Gaxiola ***; M. Teresa Bernal-Obana**** y Shoko Watanabe*****
* Cirujano Plástico, Mesa Directiva de la Práctica Médica Grupal (PMG), Centro Médico ABC, Observatorio of The American British Cowdry IAP, Campus Observatorio, Ciudad de México, México.
** Médico Residente, Servicio de Cirugía General, Hospital Ángeles Lomas, Ciudad de México, México.
*** Médico Adscrito, Servicio de Cirugía Plástica, Hospital Central Militar, Ciudad de México, México.
**** Médico Residente, Servicio de Anestesiología, Hospital Español, Ciudad de México, México.
***** Médico General, Universidad Anáhuac, Huixquilucan Estado de México, México.
Conflicto de intereses: los autores declaran no tener ningún interés financiero relacionado con el contenido de este artículo.
Dirección para correspondencia
RESUMEN
Introducción y Objetivos. En la actualidad existen una gran cantidad de apósitos y coberturas para el tratamiento de las heridas de espesor parcial; la elección depende de la experiencia del cirujano y sobre todo de la disponibilidad y recursos existentes. Las estatinas (inhibidores de la Hidroxi-Metil-CoA reductasa) se usan en el tratamiento de la hipercolesterolemia, aunque recientemente se han encontrado propiedades antinflamatorias, estimulantes de la angiogénesis y linfangiogénesis, antifibróticas, y especialmente estimuladoras de los queratinocitos.
Nos proponemos comparar la epitelización e inflamación de las heridas en un modelo animal con la aplicación de simvastatina tópica, inyectable y apósito de hidrocoloide.
Material y método. Empleamos 20 ratas Wistar en 4 grupos, cada uno con 5 ratas, a las que practicamos heridas de espesor parcial por dermoabrasión en el dorso. A cada grupo se le aplicó gasa de organza, apósito de hidrocoloide, simvastatina tópica y simvastatina inyectada, respectivamente. Descubrimos las heridas a los 7 días y sacrificamos a los animales. Tomamos biopsias de las heridas y comparamos el grado de epitelización de cada grupo.
Resultados. Al comparar la simvastatina en preparación tópica con el grupo de gasa de organza y el grupo de apósito de hidrocoloide, encontramos un mayor porcentaje de epitelización en el grupo tratado con simvastatina tópica, con una diferencia estadísticamente significativa (p < 0.05). Las heridas tratadas con simvastatina tópica demostraron menor inflamación, menor fibrosis, mayor epitelización (queratinocitos), mayor cantidad de fibroblastos y no presentaron costra, de forma estadísticamente significativa.
Conclusiones. La cobertura de heridas de espesor parcial con simvastatina tópica es más efectiva en epitelización y efecto antinflamatorio, en comparación con la simvastatina inyectable, los apósitos de hidrocoloide y las gasas de organza.
Palabras clave: Heridas espesor parcial, Epitelización, Simvastatina, Estatinas.
Nivel de evidencia científica: 5 Investigación básica.
ABSTRACT
Background and Objective. There are various alternatives and dressings for split thickness skin wounds, the choice depends on the experience and training of each surgeon. Statins, which are normally used for the treatment of hypercholesterolemia, have proven to induce and antinflammatory effect on wound keratinocytes, which provokes a faster re-epithelialization on in vitro studies.
Our aim was to compare epithelialization and anti-inflammatory properties in split thickness wounds of rats, using hydrocolloid dressings versus a simvastatin based emulsion or simvastatin injected.
Methods. We used 20 Wistar rats divided in 4 groups in which split thickness wounds were induced in the dorsum by dermoabrasion. Each group was treated with organza gauze, hydrolloid dressings, simvastatin cream and injectable simvastatin in the wound, respectively. Seven days later, the wounds were exposed and the animals where sacrificed. The wounds were analyzed with digital photographs and biopsies where taken in order to compare the epithelization percentage in each group.
Results. There was a statistically significant improvement (p < 0.05) in wound rate epithelialization in the rats treated with topic simvastatin. The wounds treated with topic simvastatin had less inflammation, less fibrosis, no evidence of crusting and a higher number of fibroblast.
Conclusions. Split thickness skin wounds coverage with topical simvastatin is most effective in epithelialization and antinflamatory effect compared with injectable simvastatin, organza gauze dressings and hydrocolloid dressings.
Key words: Split thickness wounds, Re-epithelialization, Simvastatin, Statins.
Level of evidence: 5 Bench Research.
Introducción
La epitelización de las heridas es una inquietud constante para los cirujanos plásticos, sobre todo en pacientes que presentan lesiones de espesor parcial, como heridas por abrasión, quemaduras superficiales y áreas donadoras de injertos. La respuesta del cuerpo durante la curación de las heridas comienza inmediatamente después de la lesión con la fase de hemostasia, que inicia la respuesta inflamatoria, la proliferación del tejido de granulación, la re-epitelización del defecto y la remodelación de la dermis por los factores de crecimiento y las citosinas.
De modo general, clasificamos las heridas de acuerdo a su espesor en: heridas de espesor parcial o superficiales, y de espesor total o profundas. Las heridas de espesor parcial son aquellas que involucran solo la epidermis y la dermis superficial (papilar), y generalmente tienen un grosor en la piel de los humanos de 0.5-0.8 mm (1-3). La epitelización de las heridas de espesor parcial se produce en 7-21 días (10 días como promedio). Si la epitelización no es espontánea, puede dejar alteraciones del contorno, de la textura cutánea y cambios de coloración, además de provocar dolor y limitación de la movilidad durante el proceso de epitelización (4).
La elección de un método húmedo para el tratamiento de estas heridas depende de la experiencia del cirujano y de la disponibilidad de materiales y recursos. Todos los apósitos tienen ventajas y desventajas. El objetivo de la cobertura con apósitos es promover un ambiente húmedo que facilite la migración celular y prevenga la sequedad de la herida (5). Winter en 1962 (6) introdujo el concepto de apósitos de poliuretano y está considerado como el precursor de la terapia húmeda. Los apósitos de láminas de poliuretano disminuían el dolor y prevenían la deshidratación de la herida, aunque provocaban trauma al despegarlos, no absorbían el líquido de la herida, y eran fuente de contaminación bacteriana.
En la actualidad existe gran cantidad de apósitos que están diseñados para mantener las heridas húmedas, y su manufacturación y consumo representan una industria que anualmente produce ingresos en torno a los de 70 billones de dólares americanos. Los apósitos más usados son:
• Hidrocoloides: creados a partir del material utilizado para la cobertura de los estomas; producen un ambiente húmedo por el contacto con el gel y el líquido de la herida, de manera que la capa externa queda protegida por una membrana o lámina semioclusiva.
• Esponjas: promueven una absorción fácil de retirar, con superficie de contacto adhesiva y no adhesiva.
• Alginatos: se transforman de una fibra a un gel suave en contacto con el líquido de las heridas, promoviendo una superficie de contacto poco adherente y un ambiente húmedo.
• Hidrogeles: promueven un ambiente rico en agua debido al gel que los hace no adherentes, disminuyendo así el dolor, rehidratando la herida y favoreciendo la autolisis (7).
El uso de hidrocoloides se ha asociado a una disminución del tiempo de epitelización del área donante de injertos de hasta un 33%, a menor dolor, mayor facilidad de colocación, y a alteraciones mínimas en el área sana alrededor de la zona donante. Está demostrada una mayor epitelización con el uso de alginatos y películas oclusivas, sin embargo, éstos tienen también algunas desventajas como por ejemplo: la apariencia y el olor que desprenden por el exudado que generan, la fuga de líquido sobre la zona donadora, su costo, la necesidad de cambio frecuente de los apósitos, la maceración de la piel y la aparición de dermatitis por contacto (8).
Las estatinas son medicamentos que inhiben de forma competitiva la enzima 3-hidroxi-3-metilglutaril coenzima A reductasa (HMG-CoA), la cual es el primer paso para la biosíntesis del colesterol. La simvastatina no existe en presentación líquida o tópica, solo existe en presentación oral en forma sólida cristalina que se puede disolver en solventes orgánicos como el etanol, el metanol y el dimetilsulfoxido. Si se disuelve en etanol al 100%, se debe disolver 1gr de simvastatina en 1.8 cc de etanol al 100% para obtener una solución de 25 mg/ml, la cual puede almacenarse durante 24 horas a una temperatura de -20o C. Su metabolismo es principalmente hepático y presenta unión a proteínas plasmáticas del 95%. Cuando se administra por vía oral, su principal efecto adverso es la rabdomiolisis. Además de sus funciones sobre el colesterol, tiene propiedades pleiotrópicas inhibiendo al ácido mevalónico en el endotelio, lo cual se traduce en cambios inmunomoduladores. Esta función induce acciones antinflamatorias, mejoramiento del endotelio y de la función microvascular y modulación de la óxido nítrico sintetasa endotelial (9).
Vukelic y col. demostraron, en modelos experimentales, el nuevo papel que pueden tener las estatinas, especialmente la simvastatina, que además de intervenir en la síntesis del colesterol por la inhibición de la HMG-CoA, inhibe la farnesil pirofosfato sintetasa, cuya acción inflamatoria retrasa la migración de los queratinocitos en la herida, retrasando a su vez la epitelización de las heridas (9).
Rego y col., utilizaron una preparación de simvastatina disuelta en solvente orgánico como vehículo para aplicación tópica en heridas infectadas. Encontraron que además de los cambios inmunomoduladores, ejerce acciones antibacterianas con una mayor proliferación de factores de crecimiento epidérmico y factor transformador de fibroblastos, acelerando la contracción de las heridas. Demostraron tanto la seguridad y eficacia de la dilución de simvastatina en un vehículo o recipiente basado en acetona, como utilizándola de forma directa o en conjunto con aceites (aceite de almendra) para su uso como pomada (10).
Aunque existe una gran cantidad de apósitos y fármacos tópicos para ayudar a la epitelización de las heridas. Sin embargo, la gran mayoría tienen precios muy elevados. Aunque la administración de apósitos de hidrocoloide es la terapia más utilizada, no hay un consenso sobre la mejor forma de cubrir las heridas de espesor parcial en cuanto a resultados, tiempo, calidad de epitelización y precio. La elección depende de la disponibilidad, experiencia y preferencia del cirujano.
El objetivo de este trabajo es comparar la epitelización e inflamación de las heridas en un modelo animal con la aplicación de gasa de organza, simvastatina tópica, simvastatina inyectable y apósitos de hidrocoloide.
Material y método
Diseñamos un estudio experimental sobre una población de 20 ratas de raza Wistar (n=20), machos, de 15 semanas de edad, con peso entre150 y 200 gr., a las que realizamos una herida de espesor parcial en el dorso mediante dermoabrasión mecánica. Dividimos el grupo total de animales en 4 subgrupos, de 5 ratas cada uno (n=5); cada rata se asignó a uno de los 4 grupos de manera aleatorizada y quedaron constituidos de la siguiente manera:
1. Grupo A (n=5): apósito de hidrocoloide (Duoderm ®, Skillman, Nueva Jersey, EE.UU.).
2. Grupo B (n=5): gasa de tela de organza.
3. Grupo C (n=5)= inyección subdérmica de solución de simvastatina.
4. Grupo D (n=5) = pomada de simvastatina.
Como criterios de no inclusión en el estudio consideramos las ratas que no sobrevivieron a inducción anestésica y/o a la cirugía. Y como criterios de exclusión, aquellas ratas que no cumplieron los criterios de edad y sexo predeterminados.
Llevamos a cabo el protocolo en el Servicio de Cirugía Plástica y Reconstructiva del Hospital Central Militar de la Ciudad de México (México), entre mayo y octubre del 2013. Realizamos tanto el estudio experimental como la preparación de la simvastatina en el Bioterio y Laboratorio de Biología Molecular de la Escuela Médico Militar, respectivamente. La revisión de las laminillas se realizó en el Servicio de Patología del Hospital Central Militar.
Las variables del estudio fueron:
a. Independientes:
1. Terapia experimental con aplicación de simvastatina inyectada, tópica y apósito de hidrocoloide en heridas de espesor parcial.
b. Dependientes:
1. Porcentaje de epitelización.
2. Grado de inflamación.
3. Grado de fibrosis.
4. Presencia o ausencia de costra.
5. Presencia o ausencia de fibroblastos.
Preparación de la simvastatina y procedimiento quirúrgico
Preparamos la solución de la simvastatina de la siguiente manera: solución de simvastatina 40 mg disuelta en 8 cc de etanol absoluto (100%), centrifugado y calentamiento a temperatura de 50o C, logrando una solución con simvastina de 5 mg/cc.
Para la preparación de la pomada de simvastatina seguimos el siguiente método: disolución de 5 mg de simvastina en 995 mg de petrolato de vaselina, centrifugación y calentamiento a temperatura de 65o C durante 15 minutos, y enfriamiento de la emulsión a temperatura de 20o C.
Para la intervención de los animales empleamos anestesia general controlada con ketamina 80 mg/Kg y xilacina 16 mg/kg en administración intraperitoneal. Realizamos marcaje con plumón y regla de una zona de 2 x 2 cm en el dorso de los animales. Previa antisepsia con solución de superoxidación con PH neutro (Estericide ®, Esteripharma- Pharma, Ciudad de México, México), practicamos una herida de espesor parcial mediante dermoabrasión mecánica con fresa de diamante de 17 x 6 mm, sosteniendo el dermoabrasor a 45o y en sentido horizontal de izquierda a derecha, sin presionar sobre la piel, con movimientos de la fresa en sentido de las manecillas del reloj, a una velocidad de 10.000 revoluciones por minuto (Fig. 1). Seguidamente tratamos las heridas de las ratas elegidas aleatoriamente de acorde al grupo asignado de la siguiente manera:
1. Grupo A (n=5): cobertura con apósito de hidrocoloide.
2. Grupo B (n=5): cobertura con gasa de tela de organza.
3. Grupo C (n=5)= inyección subdérmica de solución de simvastatina.
4. Grupo D (n=5) = cobertura con pomada de simvastatina.
Mantuvimos a las ratas aisladas, brindándoles cuidados postoperatorios, alimentación, y en caso de ser necesario, volvimos a cubrir las heridas. A los 7 días de postoperatorio, descubrimos las heridas de los 4 grupos, tomamos fotografías digitales y procedimos al sacrificio a las ratas. Tomamos biopsias del área epitelizada, de 1 cm en forma de huso, con profundidad de 4 mm (Fig. 2).
Las fotografías fueron digitales y las empleamos para medir en ellas el porcentaje de megapíxeles en las zonas epitelizadas y no epitelizadas por medio del análisis del programa Adobe Photoshop CSS 8.0 ®, obteniendo así el porcentaje de epitelización logrado en cada una (Fig. 3).
En cuanto a las piezas histológicas recolectadas, las enviamos a análisis anatomopatóligico, evaluando el grado de inflamación, el grado de fibrosis, y la presencia y ausencia de costra y fibroblastos.
Resultados
Evaluamos las variables cualitativas como presencia de fibroblastos, costra, fibrosis e inflamación mediante porcentajes y las analizamos mediante la prueba estadística no paramétrica Chi cuadrado (X¬2), al 95% de confianza.
Al obtener el porcentaje de epitelización de las muestras mediante fotografías tomadas a los 7 días de postoperatorio y comparadas por planimetría fotográfica midiendo el porcentaje inyectable, encontramos una epitelización un 88% mayor en las heridas tratadas con simvastatina tópica. El método estadístico de análisis de varianza de Kruskal Wallis indicó los porcentajes de epitelización de los 4 grupos, que presentaron una diferencia estadísticamente significativa (H = 11.83; 3 gl; p = 0.01) mayor en el grupo tratado con simvastatina tópica. Calculando el porcentaje de megapíxeles en las zonas epitelizadas y no epitelizadas con el software Adobe Photoshop®, fue posible establecer que las heridas del grupo de gasa de organza presentaron una media geométrica de 41.38%;en las heridas tratadas con Duoderm® la media fue de 57.6%; y asimismo observamos una media de epitelización del 61.89% en las heridas tratadas con simvastatina. (Gráfica 1).
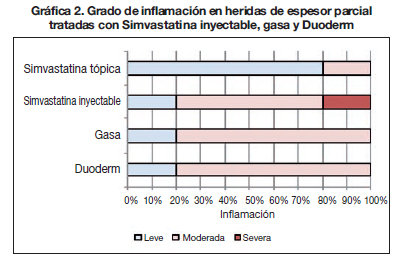
Con la finalidad de observar el grado de inflamación mediante la presencia de polimorfonucleares, encontramos que las heridas tratadas con Duoderm® y las del grupo tratado solo con gasa de organza fueron semejantes, con un 20% leve y 80% moderada.
En las heridas tratadas con simvastatina inyectable observamos 1 caso (20%) con inflamación severa. En las heridas tratadas con simvastatina tópica, la inflamación leve se presentó en un 80% y la moderada en un 20% (Gráfica 2).
En cuanto a la determinación de colágena mediante tinción de Masson para conocer el grado de fibrosis (Tabla I), pudimos observar que de las heridas tratadas con Duoderm ®, el 60% presentó fibrosis leve y el 40% fibrosis moderada. En el grupo tratado con gasa de organza se presentó fibrosis leve y moderada en un 40%, mientras que en un 20% se presentó fibrosis severa. Las heridas tratadas con simvastatina inyectable presentaron fibrosis leve en el 80% y fibrosis moderada en el 20%; en tanto que las tratadas con simvastatina tópica, en su totalidad presentaron fibrosis grado leve (Gráfica 3) (Fig. 4).
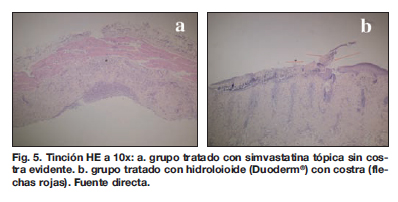
Valoramos mediante estudio histopatológico la presencia de costra en las heridas (Tabla II) y determinamos que en el 100 % de las tratadas con Duoderm® se desarrolló costra, en tanto que en el grupo tratado con gasa de organza la presencia de costra se produjo en el 80%. En las heridas tratadas con simvastatina inyectable solo encontramos costra en un 20%, y en el grupo tratado con simvastatina tópica no hubo costra en su totalidad.Pudimos establecer una asociación significativa de las heridas tratadas con simvastatina tópica y la ausencia de costra (X2 = 272.0; 3 gl; p < 0.05) (Gráfica 4) (Fig. 5).
Discusión
La epitelización de las heridas es una inquietud presente entre los cirujanos plásticos, sobre todo en pacientes con lesiones de espesor parcial por abrasiones, quemaduras superficiales y heridas de áreas donantes de injertos (1). Existe en la actualidad una gran cantidad de opciones terapéuticas para la cobertura y tratamiento de heridas de espesor parcial, aunque la mayoría utiliza apósitos que promueven un ambiente húmedo en la herida para acelerar la re-epitelización, si bien los precios de estos apósitos pueden ser muy elevados para la mayoría de la población (2).
Si bien no hemos encontrado en la literatura estudios que comparen la epitelización con el uso de gasas de organza, simvastatina tópica e inyectable, y apósitos de hidrocoloide, Vukelic y col. (9), sí que encontraron que la simvastatina tiene otras funciones además de su efecto sobre el colesterol, como son sus acciones inhibitorias sobre la HMG-CoA, inhibiendo la farnesil pirofosfato cuya acción inflamatoria retrasa la migración de los queratinocitos en la herida y retrasa por tanto la epitelización de las heridas.
La ausencia de costra y la mayor cantidad de fibroblastos con diferencia estadísticamente significativa en las heridas tratadas con simvastatina en comparación con aquellas tratadas con el apósito de hidrocoloide Duoderm ®, o el grupo tratado con gasa de organza, refleja una epitelización más rápida y de mejor calidad, tal y como comentan Baser y col. (11). Aunque la presencia de costra no es un factor contraproducente para la epitelización, denota un retraso en la epitelización y un mayor proceso inflamatorio (3). La presencia de fibroblastos se asocia a una formación más rápida de la membrana basal una vez que se ha terminado la epitelización y la migración de los queratinocitos (5). La mayor presencia de fibroblastos también se asocia a una mayor formación de colágena y a una mayor cicatrización. Pese a esto, encontramos resultados parecidos sobre los efectos de la simvastatina y una mayor presencia de fibroblastos respecto a otros autores como Ghaderi y col. (12). Encontramos también una semejanza entre nuestro estudio y el del grupo de Rego y col. (10) en cuanto al uso de simvastatina tópica asociado a una menor inflamación; también observamos una mayor presencia de fibroblastos en los grupos en los que utilizamos simvastatina respecto a aquellos en los que empleamos hidrocoloide y gasas de organza. Nosotros realizamos la preparación y dilución de las soluciones en base al estudio de estos autores, aunque ellos solo midieron la respuesta inflamatoria y encontraron además proliferación de factores de crecimiento epidérmico y de fibroblastos. También encontramos resultados parecidos con este estudio respecto al uso de simvastatina, en nuestro caso tópica e inyectable, y una menor presencia de fibrosis en las heridas, que junto a la menor cantidad de costra y la mayor cantidad de fibroblastos, pueden llevarnos a concluir que la herida tiene una mejor calidad respecto a los otros grupos.
En cuanto a la simvastatina inyectable, encontramos que las propiedades antinflamatorias no fueron estadísticamente significativas respecto al grupo tratado con Duoderm® y el grupo control, contrastando con lo encontrado por el grupo de Ko y col. (13). Una de las razones por las que puede haber mayor inflamación puede ser el trauma adicional provocado por la inyección, a pesar de que la realizamos por fuera del borde de la herida y no incluimos esta zona en la biopsia para análisis histopatológico. Empleamos la misma fórmula y técnica de preparación de la simvastatina inyectable que usaron estos autores para no tener alteraciones por los vehículos o sustancias disolventes. El mayor grado de epitelización es resultado del efecto antinflamatorio de la simvastatina, razón por la cual la diferencia fue notable en el grupo tópico e inyectable en comparación con el de Duoderm® y el de cobertura solo con gasas de organza. La dosis tópica se basó en estudios previos de pomadas preparadas con simvastatina, ya que no existe la vía tópica en forma comercial y no hay estudios sobre el comportamiento de este medicamento por esta vía. Aunque está demostrado que atraviesa la epidermis y la dermis de la rata, no se conoce la vida media del fármaco por vía tópica (6).
En nuestro estudio encontramos que la simvastatina tópica provoca mayor epitelización, menor inflamación respecto al grupo tratado con hidrocoloide y el grupo de gasa de organza. La vía tópica se asoció además a menor formación de costra y menor cantidad de fibrosis, aunque con mayor formación de fibroblastos respecto a los otros grupos.
Comparamos el uso de simvastatina inyectable diluida en etanol y una preparación de simvastatina tópica preparada como pomada a base de petrolato de vaselina. Utilizamos la simvastatina en forma sólida comercial que puede conseguirse en cualquier farmacia, basándonos en estudios previos donde no hay efectos adversos por los vehículos o sustancias que acompañan a la forma sólida de la simvastatina. Al comparar el grupo tratado con simvastatina en preparación tópica con el grupo tratado con gasa de organza y el grupo tratado con Duoderm ®, vimos un mayor porcentaje de epitelización con una diferencia estadísticamente significativa (p < 0.05) en el primero. Aunado a esto, las heridas tratadas con simvastatina tópica demostraron una menor inflamación, menor fibrosis, menor formación de costra y mayor cantidad de fibroblastos de forma estadísticamente significativa.
En cuanto a la metodología del trabajo utilizamos un sistema de medición digital similar al que mencionan Monton Echeverria y col. (14) con un análisis digital de superficies para poder obtener un cálculo en base a píxeles y porcentaje de área epitelizada y así hacer la comparativa, aunque nos basamos en la fórmula descrita por Sullivan de:
Porcentaje de epitelización =área total epitelizada /Tamaño total del defecto x 1000.
Decidimos utilizar un modelo animal basado en ratas siguiendo lo descrito por Dorsett- Marin y col. (15), quienes mencionan que las ratas son un modelo adecuado para vigilar las heridas ya que las capas de la piel de la rata presentan epidermis, dermis superficial, membrana basal y dermis. Las ratas tienen epitelización y contracción de las heridas; la contracción es mediada por los miofibroblastos y es muy importante para la cicatrización por la laxitud y falta de adhesiones de la piel. Su epitelización es similar a la de los humanos: los queratinocitos migran desde los bordes de la herida y los folículos pilosos, y se calcula una epitelización de 1 mm/día.
Para complementar la medición de resultados, además del análisis digital de las fotografías decidimos realizar biopsias de las áreas tratadas con las preparaciones de simvastatina tópica, inyectada e hidrocoloide y realizar mediciones ayudados por histopatología, tal y como se menciona en el trabajo de Esparza y col. (16), utilizando variables inflamatorias como el grado de inflamación, fibrosis, y la presencia o ausencia de costra y fibroblastos.
Encontramos similitud con las propiedades antinflamatorias, estimuladoras de la angiogénesis, linfangiogénesis, antifibróticas y estimuladoras de queratinocitos, como las descritas por Asai y col. (17).
Aunque por el momento no existen preparaciones comerciales que utilicen esta vía, se necesitan más estudios para conocer el comportamiento de esta nueva forma de aplicación, de manera que los resultados de este estudio sean equiparables al uso en seres humanos. La simvastatina tópica representa una nueva forma terapéutica, fácil de conseguir y de preparar, más económica y que podría ser una nueva opción efectiva para la epitelización de las heridas.
Conclusiones
Con base en los resultados obtenidos en el presente estudio, podemos concluir lo siguiente:
1. Se aceptó la hipótesis de investigación parcialmente ya que, aunque las heridas tratadas con simvastina tópica demostraron una menor respuesta inflamatoria, una mayor epitelización, ausencia de formación de costra y mayor cantidad de fibroblastos respecto al grupo tratado con Duoderm® y al tratado con gasas, observamos una mejoría antinflamatoria en el grupo de simvastatina inyectable, aunque sí hubo diferencia estadísticamente significativa en cuanto al porcentaje de epitelización, menor formación de costra y mayor cantidad de fibroblastos.
2. La simvastatina tópica produce un mayor porcentaje de epitelización y menor inflamación que la simvastatina inyectable, los apósitos de hidrocoloide y las gasas de organza para el tratamiento de heridas de espesor parcial.
3. Las heridas tratadas con simvastatina tópica e inyectable presentaron menor grado de fibrosis, menor formación de costra, mayor cantidad de fibroblastos y mayor porcentaje de epitelización respecto al grupo tratado con Duoderm® y al tratado con gasas, de manera estadísticamente significativa.
4. La cobertura de heridas de espersor parcial con simvastatina tópica tiene mayor efectividad en cuanto a la epitelización y al efecto antinflamatorio en comparación a la simvastatina inyectable, los apósitos de hidroloide (Duoderm® ) y las gasas de organza.
Bibliografía
1. Paletta C, Pokorny J, Rumbolo P. Skin Grafts. Plastic Surgery 2 ed. New York: Mathes 2002. I:14, Pp: 293-317. [ Links ]
2. Madeline Flanagan. Wound Healing and Skin Integrity. Principles and Practice. Chichester, West Sussex: Wiley-Blackwell 2013, 1st ed. Vol. 1. [ Links ]
3. Kleinbeck K, Faucher L, Kao W, et al. Biomaterial modulate interleukin-8 and other inflammatory proteins during reepithelization in cutaneous partial-thickness wounds in pigs. Wound Repair & Regeneration. 2010; 18:486-498. [ Links ]
4. Fatah MF, Ward M. The Morbidity of split skin graft donor sites in the elderly: the case for mesh grafting the donor site. Br J Plast Surg 1984;37,184-190. [ Links ]
5. Greenhalgh D. Wound Healing. Total Burn Care 3 ed. Philadelphia: Elsevier Inc. 2007, 46, Pp: 578-592. [ Links ]
6. Winter G. Formation of the scab and rate of epithelization of superficial wounds in the skin of the young domestic pig. Nature 1962:193;293-294. [ Links ]
7. Jones, V., Grey, J.E., Harding, K.G. ABC of Wound Healing. British Medical Journal, 2006;332:777-780. [ Links ]
8. Stojdanovic O, Gordon K, Lebrun E, et al. Stress Induced Hormones Cortisol and Epinefrine Impair Wound Epithelization. Advances in Wound Care. 2012;1:29-36. [ Links ]
9. Vukelic S, Stojadinovic O, Pastar I, Vouthonis C, et al. Farnesyl pyrophosphate inhibts epithelization and wound healing through the glucocortocoid receptor. J Biol Chem 2010; 285-290. [ Links ]
10. Rego AC, Araujo F, Damasceno B, et al. Simvastatin improves the healing of infected skin wounds of rats. Acta Cir Bras. 2007;22:57-63. [ Links ]
11. Baser TN, Baructu AY, Akbuga UB, Terzioglu A, Aslan G. High-valve vapor-permeable film dressing versus fine mesh gauze dressing on skin graft donor areas in diabetic patients: a prospective randomized controlled trial. Eur J Plast Surg (2008) 31:219-228. [ Links ]
12. Ghaderi R, Afshar M, Akhbarie H, et al. Comparison of the Efficay of Honey and Animal Oil in Accelerating Healing of Full Thickness Wound of mice skin. Int. J. Morphol. 2010; 28 (1):193-198. [ Links ]
13. Ko J, Kim P, Zhao Y, et al. HMG-CoA Reductase Inhibitors (Statins) Reduce Hypertophic Scar Formation in a rabbit Ear Wounding Model. Plast. Reconstr. Surg. 2012;129(2):252-261. [ Links ]
14. Montón Echeverría, J. Validación de un nuevo método de análisis digital de superficies. Cir plást Iberlatinam 2006, 32 (2): 71-82. [ Links ]
15. Dorsett-Martin W, Wysocki A. Rat Models of Skin Wound Healing. Sourcebook of Biomedical Research. Mississippi: Springer link. 2008:631-638. [ Links ]
16. Esparza Iturbide, R., et al. El trasplante autólogo de células mesoteliales como acelerador y modificador de la cicatrización cutánea en ratas. Cir plást iberolatinoam, 2013,39 (1): 47-51. [ Links ]
17. Asai J, Takenaka H, Hirakawa S, Sakabe J, Hagura A, et al. Topical simvastatin accelerates wound healing in diabetes by enchancing angiogenesis and lymphangiogenesis. Am J Pathol 2012;181:217-224. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Pablo D. Murakami Morishige
Centro Médico ABC Observatorio
Sur 136 116, Álvaro Obregón
01120 Ciudad de México, México
Correo electrónico: murakami_md@hotmail.com
Recibido (esta versión): 1 mayo/2016
Aceptado: 15 mayo/2016