Introducción
La realización de colgajos cutáneos locales con vascularización aleatoria es un procedimiento muy común y conveniente usado en Cirugía. Pero la necrosis parcial o completa del colgajo sigue siendo una de las principales complicaciones.(1) El aporte vascular es el factor más importante y determinante para la supervivencia de un colgajo, y se entiende por tanto que una de las complicaciones quirúrgicas más frecuentes en el área de la Cirugía Plástica se deba a problemas circulatorios.
Los colgajos cutáneos aleatorios son ampliamente utilizados en Cirugía Reconstructiva. Presentan la ventaja de no tener que identificar una arteria principal para su diseño puesto que su vitalidad está determinada por los plexos, y por ende, su complejidad quirúrgica es menor. Su desventaja radica principalmente en que solo permiten obtener una extensión máxima de tejido de 2:1, que es la proporción que el tejido tolera sin evolucionar a isquemia y necrosis..(2,3) Esta descripción puede ser de ayuda para diseñar un colgajo con vascularización aleatoria, pero no necesariamente un pedículo más ancho va a aumentar el área de vitalidad del colgajo. Esto se explica por una segunda variable que es la presión de perfusión. Existe una caída progresiva de la presión a medida que aumenta la distancia desde la base del colgajo. Si esta distancia es muy extensa y la caída de la presión es muy pronunciada, llega hasta un punto de no retorno que implica la oclusión de las arteriolas a nivel del plexo subdérmico y la necrosis subsecuente del tejido.(4) Una caída del índice de presión por debajo del 25% podría predecir necrosis.(2) Finalmente, la vitalidad del colgajo va a depender de la severidad de la isquemia, del estrés oxidativo durante el período de reperfusión, de los niveles de expresión de los distintos mediadores de la inflamación y de sustancias vasoactivas y de la tolerancia celular para evitar un daño celular irreversible, resultando en necrosis del colgajo.
Al séptimo día de realización, un colgajo cutáneo aleatorio extremadamente largo respecto a su anchura, es decir, con una proporción mayor a 1:2 respecto al pedículo, evolucionará a necrosis inevitablemente a menos que se realice un tratamiento específico para aumentar la vitalidad del colgajo. Es por ello que se han realizado numerosos estudios hasta el momento buscando diferentes formas y procedimientos con el fin de disminuir el área de necrosis; entre ellos encontramos métodos; farmacológicos (simpaticolíticos, vasodilatadores, bloqueadores de los canales de calcio, anticoagulantes, secuestro de radicales libres); la administración de agentes proangiogénicos como el VEGF (factor de crecimiento endotelial vascular); las terapias genéticas a través de vectores adenovirales; el retardo de colgajo y el tratamiento con células madre..(5,6)
El retardo del colgajo viene siendo uno de los procedimientos más ampliamente utilizados en Cirugía Reconstructiva y con más evidencia sobre sus beneficios y su superioridad respecto a otras variadas opciones farmacológicas..(7-9) Por su parte, el tratamiento con células madre ha resultado prometedor y llama la atención un efecto potencial global. A diferencia de los métodos farmacológicos que actúan frente a un factor específico (angiogénesis, vasodilatación, simpaticolíticos, secuestro de radicales libres, inhibición de prostaglandinas, etc.), estas células en teoría, por su capacidad de diferenciación en múltiples linajes celulares, tendrían una función que abarcaría en forma más global la fisiopatología del colgajo.(10) Existen distintas fuentes de obtención de células madre; últimamente la más atractiva tanto por su accesibilidad como por preservar sus características propias, son las células madre derivadas de tejido adiposo adultas (ASCs). Además, recientemente se han podido potenciar mediante un precondicionamiento con hipoxia. La exposición a hipoxia a un nivel no letal aumenta significativamente la tolerancia celular y presenta una mejora en las propiedades regenerativas de las células madre, a través de características de mejoramiento en la sobrevida, en los efectos paracrinos con una obtención de un mejor soporte trófico, mejor tolerancia en el sitio de lesión después de ser administradas, aumento de la proliferación y capacidad de migración a regiones isquémicas o alrededor de un tejido infartado..(11,12) Por ello, resultaría interesante comparar el retardo de colgajo, que es un proce- dimiento superior a muchos métodos farmacológicos, con el tratamiento con células madre con y sin precondicionamiento para aumentar la supervivencia en colgajo cutáneo aleatorio en ratas.
Este trabajo consiste en evaluar si existe más de un patrón de necrosis cutánea del colgajo al séptimo día de postoperatorio realizando una clasificación de necrosis basada en características macroscópicas e histopatológicas. Si presenta alguna utilidad clínica o si puede ser utilizada por otros autores como herramienta de estudio de vitalidad de colgajos, y comparar la efectividad de estos métodos en el aumento de la supervivencia del colgajo predispuesto a necrosis en su zona distal.
Material y método
El presente trabajo fue aprobado por el Comité de Bioética sobre investigación en animales de la Facultad de Medicina de la Universidad de Chile.
Diseño de estudio
Empleamos 40 ratas Sprague-Dawley machos, de peso entre 300-500 gr. intervenidas bajo las normas bioéticas del ICBM (Instituto de Ciencias Biomédicas) para la experimentación con animales de laboratorio. Las ratas fueron anestesiadas con ketamina 80 mg/kg y xilacina 8 mg/kg vía intramuscular. Preoperatoriamente se les administró penicilina benzatina 40.000 U/Kg intramuscular. Tras la anestesia los animales fueron intervenidos según el grupo perteneciente, aleatorizadas en 4 grupos: grupo control (n=10); grupo intervenido mediante retardo del colgajo (RTC) (n=10); grupo intervenido con células madre derivadas de tejido adiposo adultas (ASCs) (n=10); y grupo intervenido con células madre derivadas de tejido adiposo adultas precondicionadas con hipoxia (ASCs-H) (n=10) (Fig. 1).
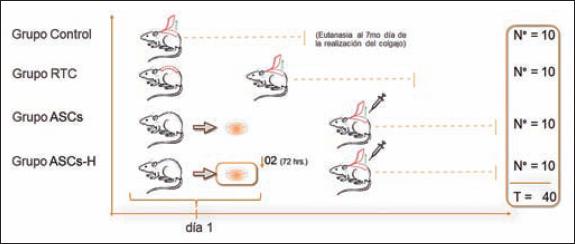
Fig. 1. Diseño de estudio experimental. En el grupo control se realiza el colgajo cutáneo aleatorio en el día 1. En el grupo RTC se realiza la incisión del colgajo sin elevación, en un segundo tiempo quirúrgico (al 5º día), se realiza elevación y reposición. En los grupos de ASCs y ASCs-H se obtiene ASCs de la región ínguino-abdominal. Las ASCs serán expandidas y cultivadas en una incubadora en condiciones de normoxia (21% O2 - 5% CO2), y el grupo ASCs-H 72 horas previo a su uso, serán sometidas a hipoxia (2% O2- 5% CO2). En un segundo tiempo quirúrgico tras la realización del colgajo y reposición de este, se inyectan a nivel subcutáneo las células en 10 zonas demarcadas específicamente. Se realiza eutanasia al 7º día de realizado el colgajo cutáneo aleatorio.
RTC: retardo del colgajo; ASCs: células madre derivadas de tejido adiposo; ASCs-H: células madre derivadas de tejido adiposo adultas precondicionadas con hipoxia.
Técnica quirúrgica
Rasuramos la región dorsal. En condiciones de asepsia y antisepsia, colocamos los animales en posición de decúbito ventral y dibujamos un rectángulo cuyo margen craneal está a nivel de la cintura escapular y el caudal a nivel de la cintura pélvica. Realizamos la incisión del colgajo con bisturí nº 23. Elevamos el colgajo con una anchura de 2 cm conservando su pedículo craneal y una longitud de 8 cm, de grosor que involucre piel y tejido celular subcutáneo. Luego colocamos en el lecho una lámina de silicona (Parafilm M®) previamente sumergida en alcohol de 70º y luego sometida a luz ultravioleta durante 15 minutos, de 1 mm de grosor, con una anchura y longitud que cubra totalmente el lecho; la fijamos utilizando sutura de catgut 4-0 en sus 4 esquinas. Posteriormente, reposicionamos el colgajo suturándolo cuidadosamente con nylon 4-0 (Fig. 2).

Fig. 2. A. Rata en decúbito ventral con región dorsal rasurada. Mediante un molde con el diseño de 2 x 8 cm, se realiza el diseño inicial del colgajo. B. Unión de los puntos para lograr el diseño final del colgajo cutáneo aleatorio de 2 x 8 cm manteniendo su pedículo en proximidad a la región escapular. C. Incisión de bordes del colgajo, elevación y colocación de lámina de silicona en el lecho. D. Reposición del colgajo y sutura.
Grupo retardo del colgajo
En este grupo de animales, tras incidir el colgajo, lo suturamos inmediatamente en su posición sin realizar elevación del mismo. Posteriormente, al quinto día de post-operatorio, realizamos el procedimiento detallado en el apartado de técnica quirúrgica.
Grupo ASCs y ASCs-H
Tras la obtención de ASCs de la misma rata según apartado que detallamos más adelante, inyectamos 0.1 ml de concentrado de ASCs o ASCs-H, según corresponda, en 10 zonas igualmente distribuidas desde la zona craneal hacia caudal y de forma subcutánea.
Obtención de ASCs
Fraccionamos el tejido adiposo del área abdominal de la rata y lo lavamos con solución buffer-fosfato 1x (DPBS, GIBCO®, Cod: 14190144), digerido con colagenasa tipo II al 0.15% (Sigma-Aldrich®, Cod: C6885) durante 60 minutos a 37 ºC y neutralizado con medio de cultivo (DMEM, GIBCO®, Cod:11995) 10% de suero bovino fetal (FBS, GIBC®O, Cod: 10270), 1% antibióticos y antimicóticos (Antibiotic-Antimycotic 100X, GIBCO®, Cod: 15240). Posteriormente lo centrifugamos durante 10 minutos a 1200 G. El pellet obtenido se resuspende en medio de cultivo y se analiza. Mantenemos las ASCs en condiciones de normoxia (21%O2 - 5%CO2), mientras que a las ASCs-H, en la mitad del proceso de expansión, se les realiza tripsinización (0.25% Trypsin-EDTA (1X), GIBCO®, Cod:25200) para luego colocarlas en DMEM preparado que ha sido sometido a hipoxia durante 24 horas en una cámara de hipoxia (modular incubator chamber). Tras 72 horas en estas condiciones (2% O2-5% CO2) se tripsinizan nuevamente para realizar el conteo celular con hemocitómetro. Posteriormente se colocan en un volumen total de 1 ml para su administración en el colgajo.
Método de cuantificación de isquemia y necrosis del colgajo aleatorio
A la semana de la intervención quirúrgica llevamos a cabo la eutanasia de los animales con solución de eutanasia 0.1 ml administrada a nivel intratorácico. Tomamos imágenes digitales del colgajo a una distancia estandarizada para su posterior análisis en computadora mediante el programa ImageJ 1.45s. Categorizamos las zonas en áreas necróticas y área total, manteniendo como bordes los límites del colgajo. Expresamos los resultados en áreas de necrosis en relación al área total del colgajo. Además, identificamos distintos grados de necrosis en el colgajo cutáneo aleatorio al séptimo día de postoperatorio tomando en cuenta características al examen físico y cambios histopatológicos. Realizamos una clasificación de necrosis otorgando una puntuación del 0 al 3 desde piel sana hasta colgajo con necrosis de mayor grado. Por último, obtuvimos una puntuación de necrosis multiplicando el área de necrosis y la puntuación según la clasificación.
Estudio microscópico
Obtuvimos secciones de tejido de 4 zonas de proximal a distal, a 1, 3, 5 y 7 cm aproximadamente desde la base del colgajo, y categorizados en zonas 1, 2, 3 y 4 respectivamente (Fig. 3). Se fijaron en Duboscq Brasil durante 6 horas y luego se mantuvieron en alcohol de 70º. Posteriormente fueron embebidas en parafina y cortadas transversalmente con micrótomo. Realizamos tinciones de hematoxilina/eosina (HE), Tricrómico de Masson y Picro-Sirius para la observación de colágeno tipo I y III con luz polarizada y análisis computacional con el programa Image-Pro® Plus Version 6.0 para evaluación de la proporcionalidad de colágeno I/III. Con la tinción Picro-Sirius con luz polarizada, las fibras de colágeno gruesas y organizadas presentan birrefringencia intensa en color rojo correspondiente al colágeno tipo I, mientras que en verde claro se observa el colágeno tipo III con birrefringencia más débil.(13,14) (Fig. 4). Para el estudio cualitativo de células endoteliales y revascularización realizamos tinción inmunohistoquímica con anti-VEGF (factor de crecimiento endotelial vascular) 1:500 (Santa Cruz Biotechnology®, Santa Cruz, CA).

Fig. 3. Izquierda: colgajo cutáneo aleatorio al séptimo día de postoperatorio. Se divide en 4 zonas de proximal a distal. En este caso las zonas 1 y 2 corresponden al área de colgajo vital, zona 3 de transición y zona 4 de necrosis. Derecha: imagen macroscópica del colgajo cutáneo en sección transversal de espesor completo, con piel sana vecina a ambos lados.

Fig. 4. Método para cuantificación de colágeno I y III. A. Imagen directa de corte histológico con tinción Picro-Sirius con luz polarizada, aumento 400x. B. Optimización automática de contraste de la imagen en A, (aplicación Best Fit del software Image-Pro® Plus Versión 6.0). C. Descomposición de colores dejando en azul el fondo. D. Rojo colágeno I. E. Blanco colágeno III. F. Agrupación de los colores y cuantificación del porcentaje de área de cada uno (Tabla).
RESULTADOS
Clasificación de necrosis del colgajo cutáneo aleatorio
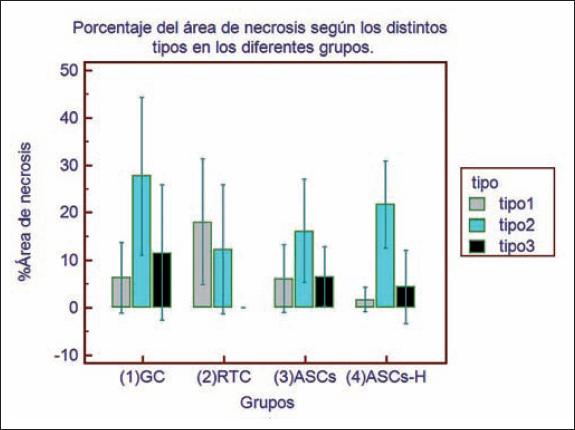
Durante el desarrollo del trabajo, al séptimo día de postoperatorio observamos grados variables de necrosis en el colgajo cutáneo aleatorio en los distintos grupos. Clasificamos esos grados de necrosis tomando en cuenta características al examen físico como la coloración y textura y correlacionamos con los cambios histopatológicos. De esta forma clasificamos distintos grados de necrosis que especificamos en la Tabla I. De esta forma, consideramos el tipo 0 como piel normal, mientras que el tipo 3 correspondió a la necrosis en su grado máximo. El examen físico de la piel sana mantiene la coloración y textura elástica y blanda. A medida que va progresando la necrosis, comienza a cambiar hacia un tono más oscuro a la vez que la textura y consistencia van aumentando hasta tornarse acartonada y delgada. Correlacionamos esto directamente con un adelgazamiento progresivo de la dermis, atrofia del epitelio asociada a focos de desprendimiento, atrofia y necrosis de los anexos cutáneos, presencia de células fantasmas (células sin su núcleo), homogenización e hipereosinofilia del tejido conectivo,(15) presencia de infiltrado inflamatorio superficial y profundo y disminución del número de vasos sanguíneos (Fig. 5). De esta manera, aparte de realizar la medición correspondiente al área de necrosis, le otorgamos una puntuación del 0 al 3 (tipo 0=0 / tipo 0+=0 / tipo 1=1 / tipo 2=2 y tipo 3=3) para analizar de mejor forma los cambios isquémicos/necróticos mediante tinción de HE y Tricrómico de Masson (Fig. 6 Fig. 7-Fig. 8) y análisis de la proporcionalidad de colágeno tipo I y III mediante el programa Image-Pro Plus 6 (Fig, 9 y 10). Por último, realizamos la tinción de VEGF para evaluar la presencia de vasos de neoformación (Fig. 11).
Tabla I. Clasificación de necrosis tomando características macroscópicas de coloración de piel, textura y cambios histopatológicos. La puntuación asignada es mayor a medida que aumenta la necrosis.


Fig. 5. Distintos tipos de necrosis según la clasificación de la Tabla I, utilizando como referencia el examen macroscópico junto con su correlación histopatológica. Las muestras se obtuvieron de la zona 3 marcada en rectángulo. Se analizó utilizando las tinciones de Hematoxilina y Eosina (HE), Tricrómico de Masson y Picro-Sirius con luz polarizada. En la última columna a la derecha se observa la transición de piel no intervenida al colgajo. Análisis histopatológico con aumento 40X.

Fig. 6. Muestra histológica obtenida en zona del colgajo cutáneo aleatorio sin necrosis (tipo 0) y con cambios adaptativos reversible (tipo 0+). Se comparan distintas estructuras (epitelio, glándula sebácea, colágeno y músculo estriado) con distintas tinciones. En el tipo 0+ se observa el epitelio y las glándulas sebáceas atróficas, sin zonas de desprendimiento epitelial ni de necrosis glandular. A nivel de la dermis se observan aún fibras de colágeno gruesas y parcialmente organizadas. No se observa variación histopatológica en la capa muscular. Hematoxilina y Eosina (HE), Tricrómico de Masson. Aumento 400X.

Fig. 7. Muestra histopatológica obtenida en zona de necrosis tipo 1 y 2 del colgajo cutáneo aleatorio. En el tipo 1 el epitelio se observa atrófico con focos aislados de desprendimiento. Glándulas atróficas y necróticas en menor medida. Característicamente se observa un infiltrado inflamatorio superficial que delimita a superior un tejido conectivo homogéneo e hipereosinofílico, mientras que bajo esta, presenta fibras de colágeno organizadas. Es evidente esta diferencia con la tinción de Tricrómico de Masson. En el tipo 2 el epitelio se observa atrófico y con zonas de desprendimiento. Glándulas sebáceas atróficas y necróticas en mayor medida. Presenta homogenización e hipereosinofilia en la totalidad de la dermis. Infiltrado inflamatorio profundo a nivel de la dermis reticular y capa de musculatura estriada a expensas de un infiltrado inflamatorio superior en disminución. Hematoxilina y Eosina (HE), Tricrómico de Masson. Aumento 400X.
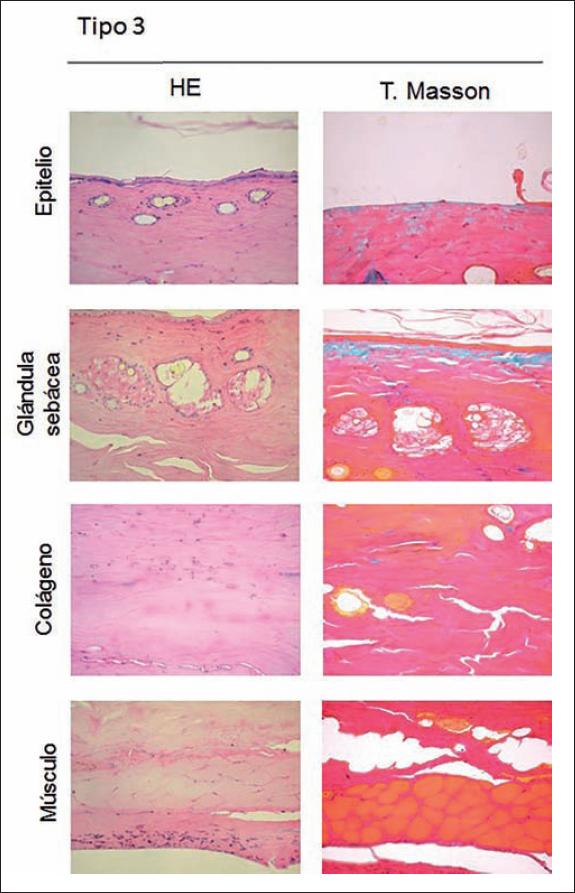
Fig. 8. Muestra histopatológica obtenida en zona de necrosis tipo 3 del colgajo cutáneo aleatorio. El epitelio se encuentra atrófico con focos de desprendimiento. Extensa necrosis glandular. Tejido conectivo homogéneo e hipereosinofílico que abarca todo el espesor de la dermis. Atrofia dérmica y de la capa muscular, escasa presencia de infiltrado inflamatorio a nivel de la hipodermis. Hematoxilina y Eosina (HE), Tricrómico de Masson. Aumento 400X.

Fig. 9. Cuantificación de colágeno I y III en los distintos tipos de necrosis. A medida que va progresando la necrosis se aprecia un aumento en la proporcionalidad de colágeno tipo III observado como birrefringencia débil en verde claro mediante luz polarizada, asociado a atrofia marcada de la dermis. Hematoxilina y Eosina (HE) y Picro-Sirius con luz polarizada.

Fig. 10. Evaluación de la proporcionalidad de colágeno I/III en los distintos tipos de necrosis. (* = p ≤ 0.05, **= p ≤ 0.01)

Fig. 11. Cortes histopatológicos de los distintos tipos de necrosis según la clasificación y tinción con VEGF. Se observa en el corte de piel normal (tipo 0), la presencia de vasos sanguíneos maduros (a, b y c). El tipo 0+ presenta un aumento de vasos de neoformación en la zona de transición (d). En el tipo 1 se observa un aumento de vasos sanguíneos en (g) y (h) bajo la zona de hipereosinofilia y homogenización de la dermis en la superficie. En la necrosis tipo 2 existe una disminución considerable de vasos sanguíneos mientras que en el tipo 3 es prácticamente un territorio avascular (k). Flechas negras indican vasos sanguíneos. Tinción VEGF. Aumento 400X.
Al realizar el análisis de la proporcionalidad de los colágenos I y III, observamos en condiciones normales y en el colgajo con cambios atróficos sin necrosis, un aumento en la proporcionalidad del colágeno I. También una disminución del colágeno I a expensas de un aumento del colágeno III a medida que progresa la necrosis, siendo estadísticamente significativo en los tipos 2 y 3 respecto al tipo 0 (Fig. 10).
Tomando en cuenta la puntuación descrita en la clasificación de necrosis, el área de necrosis obtenida se multiplicó según el tipo de necrosis. En la Fig. 12 ilustramos cómo obtuvimos la puntuación total tomando en cuenta características macroscópicas mediante inspección y palpación que corroboramos con el análisis histopatológico.

Fig. 12. Método utilizado par obtener la puntuación de necrosis según los tipos de necrosis del 0 al 3 descritos en la Tabla I.
Obtuvimos una puntuación total en el grupo control de 96.5 +/- 56.93; grupo retardo de colgajo de 47.39 +/- 43.88 (p ≤ 0.05) respecto al control; grupo ASCs 57.92 +/- 34.66; y por último grupo ASCs-H con una puntuación total de 58.34 +/- 23.86 (Fig. 13).
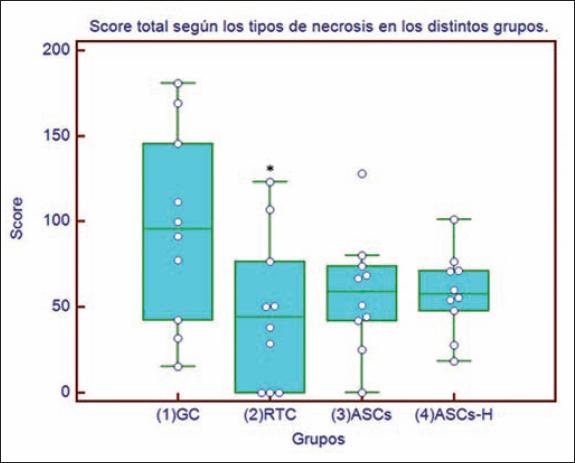
Fig. 13. Diagrama de caja (Box-Plot) en el que se analiza la puntuación total según el área y tipo de necrosis en los distintos grupos intervenidos. GC: grupo control, RTC: retardo del colgajo, ASCs: células madre derivadas de tejido adiposo, ASCs-H: células madre derivadas de tejido adiposo adultas precondicionadas con hipoxia. (* = p ≤ 0.05).
Separando los datos según el tipo de necrosis, encontramos que existe un patrón similar de porcentaje de necrosis en los grupos control y en los grupos tratados con células madre, encontrando un porcentaje mayor de necrosis tipo 2 seguido de necrosis tipo 3 y en menor cuantía necrosis tipo 1. Por otra parte, en el grupo de retardo de colgajo observamos en mayor porcentaje necrosis tipo 1, seguida de necrosis tipo 2 con ausencia de necrosis tipo 3 (Fig. 14). En el grupo de retardo de colgajo pudimos constatar en algunos casos, al séptimo día, reepitelización completa tras haber presentado necrosis tipo 1. En los tipos 0+ y 1 observamos focos de reepitelización temprana al séptimo día, mientras que en estadios más avanzados la necrosis fue completa, por lo que es de esperar cierre por segunda intención (Fig. 15).
Supervivencia y necrosis del colgajo cutáneo aleatorio
Medimos el área de necrosis considerando los tipos del 1 al 3 respectivamente en la totalidad de los grupos. En el grupo control obtuvimos un porcentaje de necrosis en promedio de 45.63% +/- 18.27. En el grupo de retardo del colgajo al quinto día de postoperatorio de la primera intervención pudimos constatar que ninguno de los colgajos presentó signos de isquemia ni de necrosis. Tras su elevación y reposición en el segundo tiempo quirúrgico, al séptimo día de postoperatorio constatamos un porcentaje de necrosis en promedio de 32.72% +/- 24.75. En el grupo ASCs administramos en promedio 9.95 x 106+/- 7.3 x106 células/ml, con 8.80 +/-1.81 días de cultivo, al séptimo día constatamos en promedio 28.73% de necrosis con una desviación estándar de 16.31, siendo este valor estadísticamente significativo respecto al grupo control (p = 0.04). Por último, en el grupo ASCs-H administramos en promedio 1.5 x107 +/- 1.5 x 107 células/ml, con 9.8 +/-1.93 días de cultivo al séptimo día constatando en promedio 27.99% de necrosis con una desviación estándar de 10.08 (p= 0.01 respecto al grupo control) (Fig. 16).

Fig. 16. Diagrama de caja (Box-Plot) del área de necrosis medida en porcentaje en los distintos grupos intervenidos. GC: grupo control, RTC: retardo del colgajo, ASCs: células madre derivadas de tejido adiposo, ASCs-H: células madre derivadas de tejido adiposo adultas precondicionadas con hipoxia. (* = p ≤ 0.05, ** = p = 0.01, respecto al GC).
Discusión
En la práctica clínica, los colgajos cutáneos aleatorios se pueden realizar sin inconvenientes cuando su proporción largo y ancho es de 1.5:1 a 2:1. Pero cuando es necesario utilizar colgajos de una extensión mayor, la necrosis distal es una de las complicaciones esperables.(16) Hasta donde hemos podido conocer, no existe en la literatura una clasificación de necrosis en los colgajos cutáneos aleatorios. Nuestra clasificación identificó 5 tipos, desde piel de colgajo sin alteraciones hasta necrosis en su máxima expresión. Pudimos observar cambios en las distintas estructuras, como en el epitelio, glándulas sebáceas, dermis, composición y organización del colágeno, presencia de vasos sanguíneos, infiltrado inflamatorio y trofismo de la capa muscular estriada. En la piel normal se reconocen 2 tipos de colágeno predominantes: el tipo I de fibras gruesas y organizadas, de gran fuerza tensil y resistencia elástica, y el tipo III de fibras delgadas y no organizadas en menor cantidad que el tipo I.(17) La proporción de colágeno tipo I/III en adulto en el trabajo de Cheng y col.(18) es de 2.46+/- 0.15, similar a lo encontrado en piel de colgajo sin necrosis y con cambio adaptativo reversible, 2.11 +/- 2.78 y 2.48 +/- 2.13 respectivamente. Esta proporción cambia especialmente durante la fase temprana de cicatrización de las heridas debido a que los fibroblastos comienzan a producir activamente colágeno tipo III. Ya para la segunda semana, el colágeno tipo I nuevamente comienza a ser producido principalmente por los fibroblastos.(19) Respecto a la proporción del colágeno tipo I y III en la porción distal del colgajo, observamos una disminución significativa en la necrosis tipo 1 respecto a la 2; esto concuerda considerando que en este último tipo existe una necrosis mayor de los anexos cutáneos asociada a homogenización del colágeno en la totalidad de la dermis atrófica. En comparación al tipo 1 que presenta esta homogenización e hipereosinofilia del colágeno solo en forma superficial, presentando inmediatamente bajo esta vasos de neoformación e infiltrado inflamatorio superficial y una dermis que no presenta alteración en el colágeno ni en su proporción. Por lo tanto, es de esperar que en algunas zonas sea posible evidenciar desprendimiento de esta capa necrótica y reepitelización temprana al séptimo día, lo cual no es esperable si la necrosis abarca todo el espesor de la dermis, con escasa presencia de vasos sanguíneos a nivel de la dermis y presencia de infiltrado inflamatorio profundo a nivel de la hipodermis, como ocurre en la necrosis menor con infiltrado inflamatorio profundo (tipo 2). Por lo tanto, es esperable que del tipo 2 evolucione al tipo 3 y consecuentemente a desprendimiento total de la dermis para posterior cierre por segunda intención, siendo este proceso considerablemente más lento que el anterior. De otra forma, en la práctica, la presencia de necrosis tipo 1 permite un manejo más conservador y de expectación a diferencia del manejo más agresivo necesario en la necrosis de mayor grado.
Tomando en consideración lo anterior, pudimos confeccionar una puntuación de necrosis que considera aspectos macroscópicos, histopatológicos y el área de necrosis. Este nuevo método parece ser adecuado para analizar de forma complementaria la efectividad de distintos tratamientos, ya que presenta la ventaja de poder analizar de forma global el colgajo.
Esta clasificación parece ser un método adecuado para entender la evolución de la necrosis del colgajo cutáneo y como método complementario para analizar la efectividad de distintos tratamientos, ya que considera los aspectos histopatológicos además del área de necrosis en forma global.
Respecto a la técnica de retardo de colgajo, es uno de los procedimientos más utilizados en Cirugía Reconstructiva y con más evidencia sobre sus beneficios, así como sobre su superioridad respecto a varias opciones farmacológicas..(7-9) Aun es controvertido el tiempo necesario de espera desde la primera intervención quirúrgica a la elevación del colgajo. Comúnmente se ha utilizado un intervalo que va desde los 7 a los 14 días.(20) Holzbach y col.(21) concluyen que el quinto día posterior a la realización del retardo de colgajo es el tiempo óptimo para ser elevado y transferido por mostrar mejores resultados de supervivencia en comparación a retardos de colgajo de 3 a 7 días respectivamente, explicado por un aumento en la expresión de VEGF y de la densidad microvascular; es por ello que en este trabajo utilizamos 5 días de retardo. En el presente trabajo presentamos una mayor disminución de la puntuación de necrosis dada una mayor proporción de necrosis tipo 1 respecto a la necrosis tipo 2 con ausencia de necrosis tipo 3. Este dato es interesante ya que no hemos encontrado literatura respecto a esta modalidad de clasificación de necrosis, y por lo tanto, probablemente de mayor utilidad en comparación al análisis del área de necrosis en forma global. Además, precisamente este grupo fue el que presentó mayores casos de ausencia de necrosis al séptimo día por presentar mayor capacidad de reepitelización completa; por lo tanto, podría traducirse en un manejo más expectante. Por el contrario, tomando en consideración solamente el área de necrosis en forma global, el tratamiento con células madre resulta ser superior en forma no significativa al grupo de retardo del colgajo.
En relación a las células madre, resulta una opción terapéutica prometedora para el tratamiento de reparación y regeneración de tejidos. En la actualidad se pueden obtener de distintos tejidos con características similares a las originalmente aisladas de médula ósea. Así es como las células madre derivadas de tejido adiposo adultas cobran importancia, ya que se encuentran en forma abundante, son de fácil acceso y es posible lograr diferen-
ciación celular de distintos linajes mesodérmicos como tejido adiposo, osteogénico, condrogénico y miogénico.(22) En este trabajo logramos obtener células madre derivadas de tejido adiposo adultas de la zona ínguino-abdominal de ratas.
Uno de los mayores problemas del tratamiento con células madre es que una gran proporción de estas células mueren en el sitio trasplantado isquémico, situación que podría reducir su eficacia.(16) Es por ello que optamos por potenciar estas células en hipoxia al (2% O2 y 5% CO2). La expresión del factor inducible a hipoxia (HIF-1α) contribuiría a la activación de genes proangiogénicos, genes promotores de la migración celular, genes antioxidantes y protectores de la apoptosis con mayor tolerancia al trasplante en zonas isquémicas.(23)
Administramos estas células a nivel subcutáneo inmediatamente después de la reposición del colgajo. Observamos una disminución significativa del área de necrosis en los grupos ASCs y ASCs-H (28.73%+/- 16.31 y 27.99% +/- 10.08 respectivamente) respecto al grupo control, sin diferencia estadística entre ellos; por lo tanto, serían superiores al método de retardo de colgajo de 5 días tomando en consideración solamente el área de necrosis en forma global. Estos datos son distintos a los publicados por Wang y col.,(16) quienes realizan el mismo diseño de colgajo para la administración subcutánea de células madre mesenquimales de médula ósea (BM-MSCs) y BM-MSCs precondicionadas con hipoxia (BM-MSCs-H) (1% 02 y 5% CO2) a concentraciones de 4 x 106 células en 0.5 ml DMEM_LG (bajo en glucosa) obteniendo un porcentaje de área de necrosis en el control de 75.5%, ASCs 54.3% y ASCs-H 35.6%, presentando en estos 2 últimos grupos diferencia significativa. Cabe destacar que en el presente trabajo administramos el doble de células en el grupo ASCs, lo cual podría explicar su menor porcentaje de necrosis pero no explicaría la similitud en los resultados en relación al ASCs-H.
Por otra parte, en ambos grupos tratados con células madre no hubo diferencias de proporcionalidad de los tipos de necrosis respecto al control, presentando mayor proporción de necrosis tipo 2 seguida de necrosis tipo 3, contrario a lo encontrado en el grupo de retardo de colgajo con un aumento significativo de necrosis tipo 1 y con ausencia de necrosis tipo 3.
Conclusiones
Por lo tanto, las ASCs y en mayor medida las ASCs-H, disminuyen significativamente el área de necrosis del colgajo cutáneo aleatorio pero sin encontrar diferencia estadística entre ellas. La técnica de retardo de colgajo de 5 días, a pesar de no presentar disminución significativa en el área de necrosis, muestra un colgajo de menor grado de necrosis al séptimo día con mayor capacidad de reepitelización respecto al resto de los grupos. Estos hallazgos permiten un enfoque distinto frente al colgajo de retardo en la práctica clínica, ya que utilizando la clasificación de necrosis, permiten optar por un enfrentamiento más conservador y de expectación al estar frente a una necrosis de menor grado (tipo 1). La administración de estas células en colgajos cutáneos aleatorios en humanos podría ser una opción terapéutica para disminuir el área de necrosis, pero al ser predominantemente de mayor grado (tipo 2 y 3), no poseen capacidad de reepitelización temprana, sino por el contrario, esta zona requeriría ser manejada mediante desbridamientos, curaciones para cierre por segunda intención, colgajos o injertos. Finalmente, la clasificación de necrosis de colgajo cutáneo aleatorio permite entender la evolución de la necrosis de manera más global en los colgajos cutáneos aleatorios y podría ser utilizada por otros autores como herramienta para estudios futuros.