Introducción
El tratamiento del paciente quemado experimentó una verdadera revolución durante el siglo XX; se desarrollaron los antibióticos, las unidades de quemados, el cuidado intensivo, el soporte nutricional y las terapias físicas tanto la ocupacional como la psicológica. Janzecovich publicó el primer trabajo sobre escisión tangencial de la piel quemada bajo la premisa de tener cobertura inmediata, autóloga o de otro ser viviente.1
Al iniciar la Residencia de la especialidad de Cirugía Plástica, en 1982, el primer Servicio por el que roté fue el de la Unidad de Quemados del Hospital Infantil Lorencita Villegas de Santos, en Bogotá (Colombia). El manejo local de la quemadura era conservador con diferentes agentes tópicos; se buscaba controlar la infección mientras se producía la autolisis del tejido necrótico y se delimitaban las áreas a injertar. Más pronto o más tarde el paciente extensamente quemado quedaba con grandes áreas cruentas que no podían ser injertadas por la falta de áreas donantes. Desde ese primer contacto con el paciente quemado, fue evidente para mí la necesidad de poder contar con algún sustituto cutáneo que permitiera, aunque fuera provisionalmente, disminuir el dolor, evitar pérdidas de líquidos y electrolitos y disminuir la infección; en ese momento, en nuestro país, sólo existía la posibilidad de aplicar membrana amniótica fresca.
En Colombia, fueron utilizadas frescas por primera vez por Coiffman y Sastoque en 1970 en las Unidades de Quemados de los Hospitales San Juan de Dios y la Misericordia de Bogotá; posteriormente se aplicaron en el Hospital Infantil Lorencita Villegas de Santos en 1982 y por última vez en el Hospital Simón Bolívar, también de Bogotá, en 1989. El único criterio de inclusión era que se pudieran tomar de cesárea y el único criterio de exclusión el que hubiera líquido amniótico meconiado. No se solicitaba consentimiento de la madre y no se tomaban pruebas de laboratorio. La membrana se desprendía de placenta, se lavaba, se colocaba en un frasco de suero con penicilina y un aminoglucósido y se guardaba fresca en alguna nevera del hospital. El riesgo de trasmisión de enfermedades infecciosas, principalmente con el surgimiento del VIH (virus de inmunodeficiencia humana) condujo a la suspensión de su uso hasta el surgimiento de los bancos de tejidos.
En 1997 logré la capacitación en el Euroskin Bank de Beverwijck, en Holanda, y en 1998 la Fundación del Quemado creó el primer banco de piel en Colombia, en Bogotá, que cerró en 2008 para abrir el primer banco público multitejidos, fundado en 2010 y que en el momento actual pertenece al Instituto Distrital de Ciencia Biotecnología e Innovación en Salud (IDCBIS). Durante estos 20 años se ha presentado la experiencia con los tejidos procesados con glicerol, piel y membrana amniótica.2,3
He participado por Colombia en proyectos regionales e interregionales del OIEA (Organismo Internacional de Energía Atómica) mediante acuerdos ARCAL (Acuerdo Regional de Cooperación para la Promoción de la Ciencia en América Latina) con bancos de 9 países de América Latina (Argentina, Perú, Brasil, Chile, Cuba, Uruguay, Ecuador, Venezuela y Colombia) (Fig. 1) y en 2010 en un IAEA-CPR (Proyecto de Cooperación Regional) también apoyado por la OIEA en el cual se realizaron proyectos de investigación en Gran Bretaña, Eslovaquia, India, Malasia, Argentina, Perú, Brasil, Chile, Uruguay, Alemania, Singapur, Polonia y Colombia: CPR: “Safety and optimisation of radiation sterilization in tissue banking: studies on functional properties of irradiated tissue grafts (E3.10.06)”4(Fig. 2).

Figura 1. Finalización del Proyecto ARCAL en Ciudad de México, año 2012. De izq. a dcha.: Mónica Mathor (Brasil), Linda Guerrero (Colombia), Miguel Rojas (Costa Rica), Isabel Otero (Cuba), Jan Wondergem (OEIA), Eulogia Kariyama (Argentina), Elizabeth Merentes (Venezuela), María Candela (Ecuador), Paulina Aguirre y Teresa Obronick (Chile), Emma Castro (Perú) y María Esther Martínez (México)

Figura 2. En la sede de Naciones Unidas en Viena (Austria) cuando se presentaron los resultados de investigación en 2012. De izda. a dcha.: Astrid Lobo Gajiwala Ann (India), Linda Guerrero (Colombia), Mónica Mathor (Brasil), Eulogia Kariyama (Argentina), Emma Castro (Perú), Carmen Saldías (Uruguay), Peter Myint (Gran Bretaña), Mark Forwood (Australia), Suzina Sheikh Ab. Hamid (Malasia) en el frente y Jan Wondergem (OEIA coordinador del CPR), Jan Koller (Eslovaquia), Menkher Manjas (Singapur) y Mark Schaflert (Alemania)
Cada vez son más importantes los bancos de tejidos tanto en sus países de origen como en el contexto internacional; su principal objetivo es entregar tejidos seguros y de buena calidad para la cobertura de las heridas, principalmente las de los pacientes con quemaduras profundas y extensas. Por ello es de interés revisar la historia, la evolución y el desarrollo de los bancos de tejidos en el mundo, su estado actual y sus perspectivas a futuro en este siglo XXI, que es precisamente el siglo de la ingeniería de tejidos.
El objetivo del presente estudio es revisar brevemente la historia de las coberturas cutáneas y la creación de los bancos de piel, principalmente en Latinoamérica y Colombia, su importancia y su futuro.
Material y método
Realizamos una revisión bibliográfica de coberturas cutáneas, de la creación y actual existencia de los bancos de tejidos en el mundo, principalmente en Latinoamérica y Colombia y llevamos a cabo una encuesta a los directores de los bancos de tejidos laminares de América Latina para recabar datos sobre el tema.
Con toda la información obtenida, redactamos una breve historia del conocimiento y desarrollo de las coberturas cutáneas, y un relato de la historia de los bancos cutáneos, narrando su aparición y desarrollo en el mundo, para acabar centrándonos en la situación en el entorno Latinoaméricano y aportar nuestra perspectiva de conocimiento desde Colombia.
Resultados
Breve historia de las coberturas cutáneas
La necesidad de dar cobertura a las heridas ha existido desde siempre. El uso de tejido humano en el tratamiento de pacientes con diversos trastornos tiene una larga historia y podemos remontarlo hasta 3000-2500 años a.C. en textos sánscritos que documentan trasplantes de piel hechos en la India (Herman 2002). También están documentadas pinturas rupestres que insinúan estos intereses. En el siglo III d.C. se menciona el milagro de Cosme y Damián, dos médicos del medio oriente que trasplantaron por primera vez una extremidad a un amputado. Alexis Carrel, quien recibió el Premio Nobel en 1912, está acreditado por los primeros estudios sobre almacenamiento de tejidos, y fue profético en sus predicciones del uso de cadáveres para la toma de órganos y tejidos.
En el siglo XIX se empezaron a utilizar diferentes alternativas. Así, en 1870 Pollock utilizó aloinjertos combinados con autoinjertos y en 1880 ya se menciona la utilización de piel de oveja y de cerdo para cubrir quemaduras. En 1910 Davis fue el primero en proponer el uso terapéutico de membrana amniótica para trasplante de piel.5
En 1943, Gibson y Medawar reportaron el rechazo inmunológico de los aloinjertos que habían empezado a utilizarse con regularidad en la II Guerra Mundial, tomados de extremidades amputadas o de cadáveres como una medida desesperada para cubrir las grandes heridas sufridas por los soldados y las víctimas del conflicto. Por su facilidad de obtención y disponibilidad Stern y Sabella usaron la membrana amniótica para cubrir a los pacientes quemados. Vladimir Petrovich Filatov, ruso, la utilizó en los países del este. En la postguerra, los escritos e ideas de Filatov atravesaron el telón de acero político-militar de la guerra fría y penetraron en los países occidentales, extendiéndose su uso como “tisuoterapia feto-placentaria”.6 En esta época no encontré referencias a la utilización de piel, únicamente de membrana amniótica que se aplicaba fresca, sin ninguna seguridad para la no trasmisión de infecciones al huésped. Como he mencionado antes, con el surgimiento del VIH se suspendió su utilización hasta la constitución de los bancos de tejidos
Historia de los bancos de tejidos
Los primeros bancos de tejidos se fundaron para procesar tejido ósteo-muscular. El primer banco de aloinjertos en América fue fundado por la Naval de Estados Unidos en 1949 y en 1957 se construyó un banco de tejidos en el Complejo Internacional de Ortopedia Científica Frank País (ORTOP) de La Habana (Cuba), que desde 1961 tiene radiación gamma aplicada para esterilizar los aloinjertos producidos. Este fue por tanto el primer banco de tejidos en América Latina que utilizó esta tecnología.
El Organismo Internacional de Energía Atómica (OIEA) jugó un papel muy importante en el fortalecimiento y desarrollo de los bancos de tejidos. Durante la década de 1970, alentó a los investigadores internacionales a estudiar este aspecto y resultado del programa fue presentado y discutido en las reuniones del Grupo Asesor celebradas en 1976 (Grecia), 1978 (República de Corea) y 1981 (Checoslovaquia). En la década de 1980 el uso de radiaciones ionizantes para esterilización de tejidos para trasplante se implementó dentro del marco de un programa coordinado de investigación (CPR-Proyecto de Cooperación Regional) en Asia, el Pacífico y Europa del Este y en la década de 1990, en América Latina. Con el apoyo de los gobiernos y profesionales de cada región, se logró que los bancos de tejidos operaran bajo sistemas de calidad, mejoraran la legislación regional y establecieran mejores criterios para la selección, rescate, procesamiento, preservación, almacenamiento y distribución de los tejidos para trasplante humano.7
En Beverwijk, Holanda, se fundó el primer banco de piel, el Euroskin Bank; los alonjertos allí producidos fueron aplicados en la Unidad de Quemados del Red Cross Hospital de la misma ciudad.8
En América Latina, el primer banco de piel oficialmente reconocido fue el de la Fundación Benaím, en Buenos Aires (Argentina), al que siguieron el Banco de Tejidos Rosa Guerzoni Chambergo del Instituto de Salud del Niño en Lima (Perú) en 1996, el Banco de Piel de la Fundación del Quemado en Bogotá (Colombia) en 1998, el Banco de Tejidos Radio-esterilizados de la Ciudad de México (México) en 1999 y el Banco de Tejidos del Hospital de Clínicas de Sao Paulo (Brasil) en 2001.9 Algunos se cerraron por un tiempo, otros definitivamente y otros reabrieron.
Una barrera política y física dividió a los países de Europa hasta el final de la guerra fría en 1991. La caída de este denominado Telón de Acero fue probablemente el factor más importante para el desarrollo de los bancos de tejidos como una ciencia. Es significativo que fuera en Berlín (Alemania) donde se realizó la I Conferencia Internacional sobre el tema en 1991, inmediatamente después de la caída del muro. A raíz de dicha conferencia se creó en Marsella (Francia) la Asociación Europea de Bancos de Tejidos (EATB), que cambió su nombre en 2016 al de Asociación Europea de Tejidos y Células (EATCB).10
Desde 1993, el OIEA apoyó el establecimiento o la consolidación de 7 bancos de tejidos en Latinoamérica y el Caribe. Se capacitó a 90 operadores de bancos de tejidos y a personal médico en el centro de capacitación de Buenos Aires. Otros 6 (Argentina, Brasil, Chile, Cuba, México y Perú) fueron capacitados en el Centro Internacional de Capacitación de Singapur, bajo los estándares internacionales del OIEA, su código de práctica y control de calidad. En el marco de la cooperación PCT (Cooperación en Materia de Patentes) entre el OIEA y la Transplant Procurement Management (TPM) de la Universidad de Barcelona (España), se formaron instructores mediante un curso impartido en 2003. Se constituyeron los organismos de control y se determinaron las autoridades que los regulan, y se organizaron entidades nacionales e internacionales de trasplantes de órganos y de tejidos.11
En el año 2000 se creó en Sao Paulo (Brasil), la Asociación Latino-Americana de Bancos de Tejidos (ALABAT) con la estrecha colaboración de la OIEA.
En 2012, el OIEA / ARCAL realizó 2 cursos en Buenos Aires (Argentina) con el apoyo del Comité Nacional de Energía Atómica, CNEA en el INCUCAI (Instituto Nacional Único Coordinador de Ablación e Implante) que impulsa, normaliza coordina y fiscaliza las actividades de donación y trasplantes de órganos, tejidos y células en Argentina; el primero sobre la versión en español actualizada del código de prácticas para la esterilización por radiación de los aloinjertos; y el segundo sobre inspección de instalaciones y centros de bancos de tejidos para la ablación y el implante, con la asistencia de 19 participantes de Argentina, Brasil, Chile, Colombia, Costa Rica, Cuba, Ecuador, México, Perú, Uruguay y Venezuela (Fig. 1 y 2).
Varios países de la región han organizado cursos de capacitación nacionales y regionales para operación de bancos de tejidos: Argentina, Brasil, Colombia, Cuba, México, entre otros. En Argentina, el Curso Básico de Ablación, Preservación y Trasplante de Tejidos Humanos se imparte anualmente por el Multibanco de Tejidos del Hospital Garrahan de Buenos Aires y el INCUCAI, con el auspicio de la Oficina de Coordinación de Trasplantes de Galicia (OCT) y la Asociación Latinoamericana de Bancos de Tejidos (ALABAT).12 En general en toda la región existe una muy baja cultura de donación, por lo cual los tejidos que más se procesan son el amnion y los xenoinjertos (cerdo, sapo)13 y en la actualidad se está procesando la piel de tilapia en Fortaleza (Brasil) (Tabla I).
Tabla I. Principales bancos de tejidos laminares transitorios en Latinoamérica
| PAÍS | HOSPITAL o INSTITUCIÓN | Piel | Xeno | Otro | PROCESAMIENTO | INICIO |
|---|---|---|---|---|---|---|
| Argentina | Hospital de Córdoba | Piel | Glicerolizado | |||
| Hospital Garraham. Buenos Aires | Piel | Glicerolizado/radioesterilizado | 2003 | |||
| Hospital Británico Buenos Aires | Piel | ND | ND | |||
| Brasil | Centro Tejidos Biológicos | Piel | 2010 | |||
| Hospital San Marcos | ND | ND | ||||
| Fortaleza | Tilapia | Glicerolizado/irradiado | 2018 | |||
| Hospital Clínica Sao Paulo | 2010 | |||||
| Chile | H. Concepción | Piel | Liofilizado/radioesterilizado | |||
| Colombia | IDCBIS. Bogotá | Piel | Dermis acelular glicerolizada | Glicerolizado | 2009 | |
| H San Vicente de Paúl Medellín | Piel | Glicerolizado | ||||
| Costa Rica | Piel | Glicerolizado | ||||
| Cuba | Cerdo | Radioesterilizado | ||||
| Ecuador | H. Eugenio Espejo Quito | Piel | Frescas | |||
| Guayaquil | Piel | Glicerolizado | ||||
| México | I. Nacional de Rehabilitación Ciudad de México | Piel | Radioesterilizado | 2009 | ||
| México | BTR-ININ | Piel | Cerdo | Radioesterilizado | 1999 | |
| México | BTEM Estado de México | Piel | Radioesterilizado | 2008 | ||
| Paraguay | Centro Nal. Quemaduras | Glicerolizado | 2010 | |||
| H. Arzobispo Loaiza Lima | Cerdo | Glicerolizado | ||||
| Perú | I. Nacional del Niño Lima | Radioesterilizado | ||||
| Rep. Dominicana | U. Niños Quemados Dra Thelma Rosario Santiago de los Caballeros |
Glicerolizado | 2017 | |||
| Uruguay | INDT. Montevideo | Piel | Radioesterilizado | 1978 |
En Colombia ha ido mejorando la tasa de donación; el Banco de Piel de la Fundación del Quemado de Bogotá (1998-2008) tardó 7 meses en obtener el primer donante y en los 10 años sólo obtuvo 74 donantes, ni siquiera 1 por mes;14 el segundo banco inició su funcionamiento en 2010, esta vez como servicio público multitejidos y pertenece al Instituto Distrital de Ciencia Biotecnología e Innovación en Salud (IDCBIS). La donación ha mejorado, pues en 8 años y medio de funcionamiento ha contabilizado 229 donantes y se han distribuido 379.920 cm² de tejido (Tablas II y III), con una tasa de 14 donantes por millón de habitantes, inferior a la de México que tiene 20.5 donantes por millón de habitantes y muy inferior a la de España y Holanda, que tienen más de 40 donantes por millón de habitantes.
Estos sustitutos cutáneos transitorios contribuyeron significativamente a aumentar la supervivencia de pacientes con quemaduras profundas y muy extensas, que sobreviven pero quedan con secuelas mayores, con un nuevo reto para la ciencia y la bioingeniería: producir sustitutos definitivos disponibles de forma inmediata, que sean permanentes y que mejoren la calidad de las cicatrices, tanto funcionales como estéticas, y que se han clasificado en 3 grupos:
- Clase I: cultivos epidérmicos autólogos (CEA).15
- Clase II: sustitutos cutáneos con componente dérmico derivado de piel procesada o fabricados de colágeno u otras matrices proteicas. La ingeniería tisular restaura el tejido dérmico, promoviendo el crecimiento de un nuevo tejido y optimizando las condiciones de curación de la herida. Requieren cobertura con una capa epidérmica permanente o sustituta.16
- Clase III: sustitutos cutáneos compuestos por materiales sintéticos
Discusión
Los apósitos biológicos juegan, y siguen jugando, un papel muy importante en el tratamiento de pacientes cuya extensión de quemaduras deja muy poca área donante disponible para autoinjertar, reemplazando provisionalmente la epidermis. Son derivados de diferentes tejidos naturales y algunos con combinación de colágeno, elastina y lípidos y resultan muy superiores a los apósitos sintéticos. Reducen el tiempo de curación de las heridas, disminuyen el dolor, preparan para la cobertura definitiva y mejoran la cicatrización, pero finalmente requieren de autoinjertos.17
Naoum y col., de Galveston (EE.UU.), realizaron un estudio comparativo en quemaduras extensas, superiores al 40% de superficie corporal quemada y de espesor parcial, tratadas en dos períodos diferentes: con agentes antimicrobianos hasta 1978 y con desbridamiento quirúrgico temprano y cobertura cutánea inmediata con homoinjertos después de ese año. Encontraron una disminución de la estancia hospitalaria de 32 a 16 días y de la sepsis a partir de la herida del 6 al 1%; la mortalidad general disminuyó, pero no significativamente; la mortalidad por infección a partir de la herida descendió de un 40% en 1978 a un 18%.18
Se ha demostrado su superioridad frente a apósitos sintéticos como el poliuretano (Tegaderm®).19
Sus principales ventajas son:
Restaurar la barrera para disminuir la evaporación y prevenir la deshidratación de la herida.
Disminuir las pérdidas calóricas por evaporación.
Disminuir las pérdidas de proteínas y electrolitos en el exudado de la herida.
Prevenir o disminuir la contaminación de la herida.
Requerir cambios de curación menos frecuentes y menos dolorosos.
Permitir la movilización de articulaciones sin dolor.
Facilitar el desbridamiento de la herida.
Crear buen tejido de granulación.
Servir de prueba para la integración del autoinjerto.
Disminuir el tiempo de epitelización en heridas de espesor intermedio.
Mejorar la calidad de la cicatrización, inhibiendo el exceso de fibroblastos y decreciendo la contracción de la herida.20
Cada avance plantea un nuevo reto; los transitorios contribuyeron a aumentar la sobrevida de los pacientes con quemaduras profundas y extensas. El reto ahora es que estos supervivientes tengan mejor calidad de vida y esto va ligado a la dermis: a la presencia de colágeno, fibras elásticas, glucosaminoglucanos, etc. En el siglo XXI se inicia una nueva etapa con la Bioingeniería de Tejidos. La industria está invirtiendo millones en la producción de sustitutos dérmicos; por razones de espacio en este artículo no discutiremos cada uno y sólo mencionaré algunos aspectos de su estado actual.
Los cultivos de queratinocitos generaron mucha expectativa. Sin embargo, estudios posteriores demostraron que sólo el 50% de los casos tenían una integración de más del 70% y los que se integraban eran tan frágiles que se esfacelaban con gran facilidad, por lo que a largo plazo terminaban reemplazándose por autoinjertos. Carecen de membrana basal, una estructura esencial para interacción epidermis-dermis que requiere de integrinas como los hemidesmosomas para su anclaje celular. Además, el alto costo de los sustitutos de la piel cultivada sigue siendo un factor práctico para su uso clínico. Las estimaciones del costo de las láminas de queratinocitos varían de 1000 a 13.000 $ por tanto por ciento de superficie corporal cubierta. Esos costos pueden llegar casi al doble si también se usa un sustituto dérmico.21
Los requisitos biológicos y clínicos son complejos y se relacionan con la composición, estructura física, propiedades inmunológicas e interacciones célula-matriz de los diversos materiales. Deben tener propiedades importantes como el tamaño de poro, los sitios de adhesión celular, la reticulación, la degradabilidad y la presencia de una membrana basal para cada una de las diferentes clases de materiales.22
Dentro de los clase II, los más conocidos son Alloderm® y Glyaderm® que son dermis acelulares alogénicas cuyas principales ventajas son que la composición y organización del andamio es muy similar a la de la dermis original y que partes de la membrana basal pueden conservarse. Matridem® e Integra® son las llamadas pieles artificiales, lo que permite un mayor control sobre la composición del andamio; la adición de componentes de la matriz extracelular, como los glicosaminoglucanos, facilitan al producto influir en el comportamiento de las células que migran e invaden la matriz. Todos requieren autoinjertos, ya sea en uno o en dos tiempos quirúrgicos.23 La reticulación del andamio puede provocar citotoxicidad o respuestas a cuerpo extraño que aún deben ser investigadas más a fondo para evitar tales problemas. Por ahora Matriderm®, la nueva monocapa de Integra® y Glyaderm® puede aplicarse en un tiempo quirúrgico. En Colombia contamos con los dos últimos; como el sustituto no se encuentra revascularizado, es recomendable fijar el autoinjerto a la dermis y al tejido celular subcutáneo con puntos separados o continuos para facilitar su integración. También se recomienda aplicar los autoinjertos en forma transversa para un mejor resultado estético y funcional, según un trabajo realizado por Madiedo24 (Fig. 3 y 4).

Figura 3. A. Autoinjertos aplicados en forma transversa y fijados con puntos separados de sutura reabsorbible. B. Autoinjertos y dermis acelular glicerolizada integrados. C. Fijación del tejido con puntos continuos
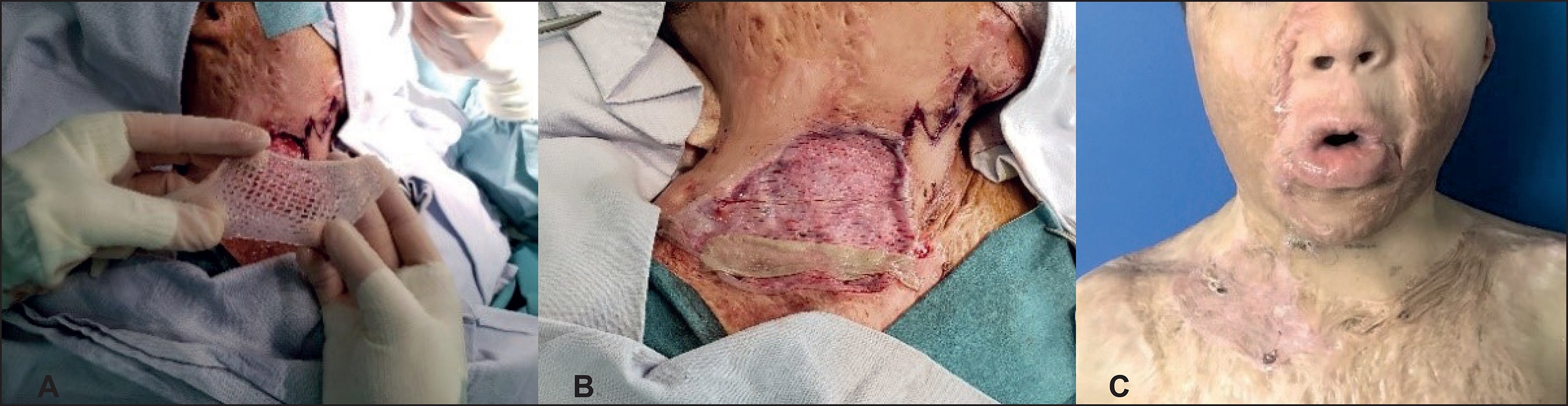
Figura 4. A. Dermis acelular glicerolizada antes de aplicarse. B. Dermis aplicada e inicio de aplicación de autoinjertos C. Integración de dermis y autoinjerto a los 15 días de postoperatorio
Se ha propuesto la utilización de la terapia de presión negativa para acelerar la revascularización e integración de los sustitutos y de los injertos aplicados sobre ellos, pero hoy por hoy es necesario mayor respaldo científico que confirme este método. Tampoco existen resultados a largo plazo que comparen la flexibilidad, tensión y elasticidad de los sustitutos con la piel normal o con la de un colgajo; estas características son las que aseguran los buenos resultados estéticos y funcionales. Numerosas publicaciones corresponden a casos clínicos; las pocas que intentan comparar son tan disímiles en sus variables que no permiten sacar conclusiones válidas. En una revisión de la literatura de diversas publicaciones sólo lograron incluir 20 ensayos controlados aleatorios. Los análisis de subgrupos y la diversidad de sustitutos de la piel limitaron la capacidad de extraer conclusiones de todo ello. Sí se pudo evidenciar que los sustitutos de la piel con Bioingeniería, a saber, Biobrane®, TransCyte®, Dermagraft®, Apligraf®, piel autóloga cultivada y piel cultivada alogénica, son tan seguros como los sustitutos biológicos de la piel o los agentes tópicos en heridas. No pudieron determinar la seguridad de Integra®.25
Conclusiones
Los bancos de tejidos continúan siendo vigentes, pues por diferentes variables como el estado general del paciente, las condiciones propias de la herida o la falta de disponibilidad de tejidos autólogos, las heridas por trauma no se pueden cubrir en forma inmediata y definitiva y deben ser diferidas para un cierre final. Significa esto que todavía los apósitos transitorios, sintéticos y biológicos son necesarios para preparar los lechos o permitir que el paciente mejore y se encuentre en condiciones de ser llevado a cirugía. De igual forma, la cobertura final puede ser realizada con sustitutos dérmicos definitivos. Es el reto de los bancos y de la industria continuar la investigación y producción de diferentes productos.
Son necesarios también estudios multicéntricos que evalúen los diferentes sustitutos que existen; las publicaciones son tan disímiles que no permiten una adecuada comparación para obtener conclusiones con verdadera evidencia. Lo que sí es evidente es que se requiere un lecho adecuado que permita la adherencia del implante, al igual que son de importancia la composición química del dispositivo, su adhesividad, elasticidad y capacidad de hemostasia.

















