Introducción
Los pabellones auriculares son un componente anatómico muy importante cuya función es proteger el oído medio, amplificar y dirigir el sonido hacia el oído medio como parte de la vía auditiva.(1) Además, dada su localización sobresaliente en la región lateral de la cabeza, tienen una gran connotación estética dado que se prestan para ser exhibidos y adornados mediante la perforación y el uso de gran variedad de joyería que realza su belleza natural.(2) Por esto, cuando se presenta una deformidad auricular, hay interferencia con las actividades de la vida diaria del individuo como el uso de gafas o de audífonos, y puede haber alteración en la conducción del sonido hacia la cóclea, entre otros problemas, así como también efectos psicológicos derivados del defecto estético que puede provocar complejos e inseguridades y llevar a la persona que los padece a tener una baja autoestima.(3)
Por otro lado, las quemaduras son un problema de salud pública ya que según la Organización Mundial de Salud (OMS) ocasionan en el mundo 300.000 muertes al año y son la tercera causa de muerte accidental. Este tipo de trauma es considerado de alto costo dada la larga estancia hospitalaria que representa, a lo que se asocia además una alta mortalidad y morbilidad, lo cual, se traduce en discapacidad física y periodos prolongados de incapacidad laboral.(4)
En el caso particular de las quemaduras en cabeza y cuello, estas representan aproximadamente el 50% de todas las lesiones por trauma térmico. El 95%presentan cierto grado de compromiso auricular, siendo la mitad de los casos la cara anterior de la oreja la más afectada,(5) principalmente en el antihélix y el borde del hélix.(6) Las quemaduras del pabellón auricular son lesiones de difícil manejo y suponen todo un reto ya que requieren un abordaje multidisciplinar con el fin de lograr un resultado adecuado. Además, este componente anatómico es particularmente vulnerable al daño debido a la poca protección del cartílago auricular, pues desde el punto de vista fisiopatológico, tras la quemadura, se destruyen las capas superficiales de la oreja generando daño vascular y edema, lo que junto con la pobre vascularización de la zona y la isquemia, conlleva la inflamación persistente del pericondrio cuyo desenlace es la deformidad del pabellón auricular que se conoce como oreja en coliflor.(4) También se pueden presentar complicaciones tempranas, como infección y condritis y complicaciones tardías como hiperpigmentación, deformidad, cicatrización anormal y hasta pérdida completa del pabellón auricular.(7)
La condritis, como proceso inflamatorio del pabellón auricular, puede tener un origen no infeccioso o infeccioso; en el primer caso la etiología puede ser neoplásica o autoinmune y en el segundo, puede estar asociada a hematoma, herida quirúrgica o trauma, como es el caso de las quemaduras. Cuando la etiología es infecciosa, los microorganismos aislados con mayor frecuencia son, por orden, Staphylococcus aureus, Pseudomonas aeruginosa y algunas especies de Proteus.(8)
La condritis secundaria a quemadura puede ocurrir a partir de una quemadura de espesor parcial o total; el debut de los síntomas es habitualmente insidioso y tiene una presentación tardía, de 2 a 5 semanas tras la quemadura.(9) Las manifestaciones clínicas de esta patología son la aparición de dolor sordo que aumenta gradualmente y se acentúa con la presión o el contacto con el pabellón auricular, asociado a rubor, eritema, edema, puede o no haber drenaje de secreción purulenta y presencia del signo de salto positivo (springing sign), en el cual hay sensibilidad con la movilización del pabellón auricular.(8, 9, 10, 11) También está descrito un incremento en el ángulo auriculocefálico, que es la protrusión del pabellón auricular desde la cabeza y que se observa al ubicarse detrás del paciente. En condiciones normales este ángulo es de entre 25 a 30 grados.(8, 12)
Cuando la condritis no es tratada de forma oportuna ocurre la peor complicación que recibe el nombre de oreja en coliflor y corresponde a la necrosis y contactura del marco cartilaginoso del pabellón auricular con distorsión del ángulo auriculocefálico, cuya incidencia aumenta de manera significativa si la quemadura es de espesor total.(5)
Aunque el diagnóstico de la condritis es netamente clínico, también podría encontrarse leucocitosis y fiebre, sin embargo, estos son hallazgos típicos de la evolución de la quemadura, por lo que no hay alguna imagen o laboratorio clínico que confirme su existencia.(11, 13)
En la revisión de la literatura referente al tatamiento de las quemaduras de los pabellones auriculares, la prevención de sus complicaciones y el manejo de las secuelas, este se divide en 2 grupos. Por un lado, el tratamiento conservador en el cual se realizan curaciones periódicas que emplean apósitos con soluciones antisépticas, antibióticos tópicos o sistémicos en caso de signos de infección, junto con drenaje local y especial énfasis en evitar hacer presión en la zona afectada con los vendajes o el uso de diferentes dispositivos.(9, 11, 13, 14, 15, 16) Por su parte, el tatamiento quirúrgico está basado en la escisión del tejido necrótico y desvitalizado y el drenaje de la secreción purulenta con el objetivo de mantener un marco cartilaginoso viable por medio de diferentes técnicas quirúrgicas para su posterior cobertura definitiva empleando injertos autólogos o colgajos de diferentes tipos.(3, 6, 9, 13, 14, 15, 17, 18)
La membrana amniótica humana (MAH) ha sido ampliamente utilizada durante el último siglo de manera exitosa en diferentes especialidades quirúrgicas como alternativa de tratamiento para diversas patologías. El primer reporte de su aplicación como trasplante de tejido fue en 1910 por Davis y hacia 1913 se describió su uso en pacientes con quemaduras, úlceras de piel, para extensas pérdidas de tejido como en el síndrome de Stevens Johnson, para la reconstrucción del piso pélvico, de la cavidad oral, el reemplazo de mucosa nasal en el síndrome de Rendu-Osler-Weber, así como en el tratamiento para defectos durales, adhesiones intraabdominales, reconstrucción peritoneal, reparación tendinosa y cirugía ótica para la reconstrucción de la membrana timpánica, entre muchas otras aplicaciones.(19)
Esta membrana se deriva del ectodermo, es delgada, se localiza en la parte interna de la placenta, envuelve al feto, y a su vez delimita la cavidad amniótica, la cual está llena de líquido amniótico. Su grosor puede variar de 0.02 a 0.5 mm y se compone de 3 tipos de capas histológicas: la capa epitelial, la membrana basal gruesa y el tejido avascular mesenquimal, que contienen colágeno tipo I al VII, elastina, laminina, fibronectina, vitronectina, fibroblastos, y producen múltiples péptidos vasoactivos y factores de crecimiento como EGF, KGF, bFGF, TGF, entre otros, citoquinas y proteínas de la matriz extracelular que actúan una vez que se ha trasplantado esta membrana.(19, 20) Asimismo, es importante resaltar que el epitelio amniótico y las células mesenquimales carecen de moléculas HLA de clase A, B, DR y sus moléculas coestimuladoras que son CD40, CD80 y CD86, por lo que no tiene actividad inmunogénica debido a que las células mesenquimales tienen la capacidad de inhibir la maduración de monocitos periféricos en células presentadoras de antígenos.(19, 20) Sus principales efectos terapéuticos consisten en reducir el dolor, favorecen la preparación del lecho para cobertura definitiva debido a su alta adherencia a las quemaduras, disminuye la pérdida excesiva de fluidos, de agua y por tanto, disminuye los trastornos hidroelectrolíticos asociados a la quemadura; promueve la cicatrización de la herida y la neovascularización, tiene propiedades antibacterianas, con la consecuente disminución de la frecuencia de necesidad de curaciones. Finalmente, gracias a que es delgada, ligera y transparente, permite hacer seguimiento de la quemadura y promueve una cicatrización más estética.(20)
En el presente estudio nos planteamos hacer una búsqueda comparativa de la literatura acerca de los métodos más empleados a lo largo del tiempo para el tratamiento de las quemaduras auriculares y la prevención de la condritis auricular y además, valorar en un grupo de pacientes la utilidad de la membrana amniótica con esta misma finalidad.
Material y método
Para la primera parte de nuestro trabajo, realizamos una búsqueda bibliográfica en las principales bases de datos médicas como PubMed, ScienceDirect, Clinical Key y SciELO, utilizando las palabras clave “Ear”, “Burns”, “Amnios”, “Chondritis”, “Cauliflower ear”, con los conectores (Ear) AND (Burns) OR (Chondritis) AND (Burns), seleccionando así los títulos, resúmenes de artículos de casos clínicos y revisiones bibliográficas escritas en inglés y español desde el año 1963 hasta 2017, tomando los escritos más relevantes relacionados con el tratamiento de las quemaduras auriculares.
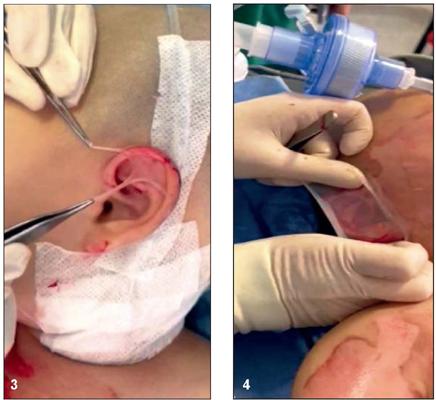
Para la segunda parte seleccionamos un grupo de pacientes de nuestra propia experiencia clínica con los siguientes criterios de inclusión: pacientes hospitalizados en la Unidad de Quemados de la Subred Integrada de Servicios de Salud Norte E.S.E (UHMES) Simón Bolívar, Bogotá D.C., Colombia, entre el 1 de enero de 2020 y el 31 de diciembre de 2021, de edad mayor a 18 años, con quemaduras de espesor parcial superficial y/o profunda en uno o ambos pabellones auriculares, cuyo ingreso a la Unidad no fuera superior a 48 horas desde la quemadura. Excluimos todos los pacientes menores de edad, con quemaduras de espesor total, con lesiones previas del pabellón auricular o condritis ya establecida y aquellos a quienes se les hubiera practicado otro procedimiento quirúrgico diferente a la aplicación de membrana amniótica. Recopilamos la información en una base de datos diseñada por el grupo investigador que incluía los ítems: nombre, identificación, edad, porcentaje de quemadura, etiología, oreja comprometida, fecha de la quemadura, fecha de ingreso a la unidad de quemados, fecha de la primera cirugía, si se aplicó membrana amniótica o se empleó cura oclusiva y si hubo o no desarrollo de condritis (Fig. 1,2,3,4).
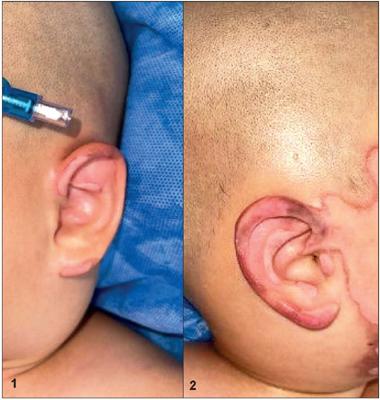
Figuras 1 y 2. Varón de 1 año de edad con quemadura por llama de ambos pabellones auriculares, de espesor parcial.
La membrana amniótica empleada para el tratamiento de los pacientes del presente estudio fue obtenida del Banco de Tejidos del Instituto Distrital de Ciencia, Biotecnología e Innovación en Salud (IDCBIS) de la Secretaría de Salud de Bogotá, Colombia, la cual ha sido empleada previamente en nuestro país como apósito biológico temporal para el manejo de quemaduras faciales de espesor parcial superficial y profundo, demostrando ser un recurso económico y de fácil acceso que favorece la epitelización en menor tiempo, permite disminuir el número de curaciones, así como el dolor y las secuelas cicatriciales graves.(21)
Resultados
De nuestra búsqueda bibliográfica extrajimos un total de 23 artículos, en su mayoría revisiones de la literatura y otros descriptivos, observacionales. La revisión comparativa de los artículos analizados nos hizo distinguir 2 grandes grupos de tratamientos para las quemaduras auriculares, los tratamientos conservadores y los tratamientos quirúrgicos, que presentamos de forma resumida en la Tabla I.
Tabla I. Revisión de literatura: tratamiento por épocas de las quemaduras auriculares.
| MANEJO CONSERVADOR | MANEJO QUIRÚRGICO |
|---|---|
| 1963: Vendaje compresivo firme sobre pabellones auriculares. Si aparece secreción, drenaje con aguja calibre 15 o 16 gz., si no funciona, incisión para drenaje y cobertura con vendaje compresivo.(14) | 1963: En infección activa, retirar tejido necrótico y drenar secreción con compresas húmedas hasta mejoría del dolor, dejando conformador de acrílico para evitar estenosis cicatricial del conducto auditivo externo.(14). |
| 1972: No recomendado vendaje compresivo como factor importante en la prevención de condritis, ni uso de almohada. Curaciones 2/día con antibióticos tópicos para control de infección local.(4) | 1972: Escisión temprana de tejido desvitalizado en quemaduras de espesor parcial superficial o profundo y espesor total, y cobertura con injertos autólogos de espesor parcial para su integración.(4) |
| 1973: Instilación local de solución antibiótica determinada por cultivos de secreción. Aguja de 25 gz. con hialuronidasa y xilocaina al 1% para dolor Irrigar 2 a 5 cc 2 a 5/día y compresas tibias 7 a 10 días.(13) | |
| 2004: Orejeras para proteger pabellones auriculares sujetas con correas con velcro y correderas.(11) | 2004: Tallaje de cartílago auricular e inserción del mismo bajo la piel quemada que esté conservada.(11) |
| 2005: Curaciones con clorhexidina (antibacteriana contra Pseudomonas y Staphylococcus, mantiene seca la quemadura, y disminuye edema y dolor). Cobertura sin presión.(5) | 2005: Escisión temprana de tejido y cobertura con injertos autólogos o colgajos en heridas más profundas y de menor extensión.(5) |
| 2008: Evitar presión sobre orejas quemadas con vendaje abultado, lavado generoso con jabón antibacterial, agua y antibiótico tópico 2/día.(12) | 2008: Técnica Nagata: retirar escara, tejido sin elasticidad y cartílago necrótico. Construcción del marco cartilaginoso auricular en 3D y cobertura con colgajo de fascia témporoparietal o temporal profundo; en zona donante cobertura con injertos autólogos de cuero cabelludo. Dos etapas con 2 a 3 meses de diferencia.(12) |
| 2009: Rasurar cabello perilesional, lavar orejas con solución salina, cobrir con gasa en yodopovidona y antibiótico 2/día.(8) | 2009: Técnica bivalva: escisión cartílago necrótico con incisión por borde del hélix, disección bivalva de la oreja exponiendo colección y cartílago; cefalos-porinas de 3ª generación sistémicas / 8 horas y cierre por segunda intención.(8) |
| 2012: Prevención de condritis evitando presión en orejas quemadas, uso de almohada y vendaje compresivo. Cobertura solo en caso de necesidad de antibióticos tópicos y, para evitar edema, ajustar líquidos endovenosos y elevar cabeza.(10) | 2012: Escisión radical de cartílago no viable para evitar recurrencia de condritis.(10) |
| 2016: Implantes sintéticos como Medpor® (polietileno poroso) para recrear marco cartilaginoso y expansores cutáneos periauriculares para aumentar área de superficie para cubrirlos, retroauriculares o en área mastoidea.(16). | |
| 2017: Lavado con jabón antibacterial y ungüentos lubricantes. Ante riesgo de infección, sulfadiazina de plata o acetato de mafenide para cubrir bacilos gram negativos, gram positivos y ligera actividad antifúngica, vigilando acidosis metabólica hiperclorémica. Recomendado hipoclorito por su efecto antimicrobiano sin toxicidad.(7) | 2017: Desde colgajos locales, compuestos, cartílago costal cubierto con colgajo de avance retroauricular y expansores tisulares, implantes sintéticos, sustitutos dérmicos (Transcyte®, Alloderm®, Integra®) hasta ingeniería tisular e impresión 3D de cartílago auricular con menor morbilidad de zona donante; requiere tiempo (6 meses) y es muy costosa.(7) |
De nuestra recogida de casos extrajimos los siguientes resultados. El total de pacientes seleccionados fue de 52, que se adaptaron a los criterios de inclusión, de los cuales al 40.4% (n=21) se le aplicó membrana amniótica y al 59.6% (n=31) solo se le trató con curaciones oclusivas.
La selección de pacientes a tratar mediante membrana amniótica frente a curación oclusiva se determinó de manera aleatorizada, según la disponibilidad de la primera y teniendo en cuenta el compromiso hemodinámico del paciente derivado de la extensión de su quemadura corporal total, que impedía el traslado a salas de cirugía, siendo un 7.69% de los pacientes (n=4); finalmente, se aplicó la membrana amniótica independientemente de si era quemadura de espesor parcial superficial y/o profundo.
Entre los agentes etiológicos que provocaron las quemaduras en nuestro grupo de pacientes, el 61.5% (n=32) de las quemaduras fue por llama, seguido del 15.38% (n=8) por electricidad, 13.46% (n=7) por líquido hirviente, 5.76% (n= 3) por pólvora y 3.84% (n= 2) por sustancia química (Tabla II).
Tabla II. Agentes etiológicos de la quemadura de los pabellones auriculares en los pacientes de nuestro grupo de estudio.
| AGENTE | TOTAL DE PACIENTES | PORCENTAJE |
|---|---|---|
| Llama | 32 | 61.5% |
| Electricidad | 8 | 15.38% |
| Líquido hirviente | 7 | 13.46% |
| Pólvora | 3 | 5.76% |
| Sustancia química | 2 | 3.84% |
En cuanto al compromiso de los pabellones auriculares, el 57.69% (n=30) se presentó en ambos y el 42.30% (n=22) comprometió uno de ellos (Tabla III), sin especificarse cuales fueron de espesor parcial superficial y/o profundo.
Tabla III. Compromiso auricular en los pacientes de nuestro grupo de estudio.
| PABELLÓN AURICULAR COMPROMETIDO | TOTAL DE PACIENTES | PORCENTAJE |
|---|---|---|
| Uno | 22 | 42.30% |
| Ambos | 30 | 57.69% |
Otro parámetro analizado fue el tiempo comprendido entre la quemadura y el primer procedimiento quirúrgico, encontrando que el 28.8% (n=15) de los pacientes fué llevado a aplicación de membrana amniótica dentro de los 5 primeros días tras la quemadura y el 11.53% (n= 6) después de 5 días de ocurrida la quemadura.
Dentro del 40.4% de los pacientes (n= 21) a los que se les aplicó membrana amniótica, solamente el 1.9% (n=1) presentó condritis y el 38.5% (n= 20) evolucionó de forma satisfactoria en su proceso de cicatrización. Por otro lado, del 59.6% (n= 31) de los pacientes que solo fue manejado con curaciones, el 19.2% (n=10) desarrolló condritis y el 40.4% (n=21) no la desarrolló (Tabla IV).
Discusión
Con respecto a la revisión bibliográfica realizada, encontramos una descripción del abordaje de las quemaduras del pabellón auricular en la que se diferencian 2 categorías que son, el manejo conservador, en el cual se describe el uso de diferentes soluciones antisépticas, antibióticas, antifúngicas, bactericidas, entre otras, sin lograr evitar la instauración de la condritis;(11, 14, 15, 18) y por otro lado el manejo quirúrgico, en el que se describen diferentes técnicas que emplean la resección de tejido necrótico con cierre por segunda intención, y otras donde se da tratamiento a las deformidades secundarias a la quemadura por medio de diferentes materiales para reconstruir el pabellón auricular,(3, 6, 9, 13, 14, 16) sin embargo, en su mayoría requieren diferentes tiempos quirúrgicos para su planeamiento y ejecución, lo que se traduce en mayor tiempo de estancia hospitalaria y por lo tanto, mayor inversión de recursos económicos, sin que pueda evidenciarse una verdadera prevención en la aparición de la condritis. Por esta razón, consideramos que con los resultados del presente estudio contribuimos a conocer mejor el uso de la membrana amniótica y sus múltiples beneficios en la cobertura de las quemaduras de espesor parcial de los pabellones auriculares, que además es una herramienta de fácil acceso en nuestro país gracias al Banco de Tejidos del Instituto Distrital de Ciencia, Biotecnología e Innovación en Salud (IDCBIS), y es costo-efectiva, ya que al ser un apósito biológico es de fácil aplicación, presenta propiedades bioquímicas e inmunológicas y al dejarse expuesta, permite hacer seguimiento a la evolución de la quemadura, requiere menor cantidad de curaciones lo que beneficia al paciente porque reduce el dolor, ayuda a la preparación del lecho de la quemadura para una cobertura definitiva con injertos, disminuye la pérdida excesiva de fluidos y agua, promueve la cicatrización de la herida, y como tiene propiedades antibacterianas disminuye la frecuencia de las infecciones,(20) que se traduce en una menor morbilidad e incapacidad funcional del paciente.
Por otra parte, de la revisión de nuestra casuística analizando un grupo de 52 pacientes que presentaron quemaduras de espesor parcial en los pabellones auriculares y haciendo una comparación entre su manejo quirúrgico y aplicación aleatoria de membrana amniótica frente al empleo de curaciones oclusivas, independientemente de si eran quemaduras de espesor parcial superficial o profundo, encontramos que al 40.4% (n=21) del total de los pacientes les fue aplicada membrana amniótica y de ellos, solamente el 1.9% (n=1) desarrolló condritis, en contra del 59.6% (n=31) que fueron tratados con curaciones oclusivas y en los que el 19.2% (n=10) desarrolló condritis.
Teniendo en cuenta que esta patología tiene una forma de presentación clínica insidiosa(3) y que requiere una intervención oportuna, nuestro estudio analizó el tiempo en el que los pacientes fueron llevados al primer tiempo quirúrgico, encontrando que al 28.8% (n=15) se les aplicó la membrana amniótica en los primeros 5 días de ingreso a la unidad de quemados a partir de la fecha de la quemadura y, solamente el 11.53% (n=6), fueron intervenidos después de estos 5 días; sin embargo, no encontramos que el tiempo de intervención quirúrgica fuera un factor determinante en el desarrollo de condritis.
Solamente el 1.9% (n=1) desarrolló condritis, contrario al 59.6% (n=31) que fueron manejados con curaciones oclusivas, donde el 19.2% (n=10) de estos desarrollaron condritis y también se encontró que los pacientes que presentaron quemaduras de espesor parcial profundo fueron los que en mayor parte evolucionaron a dicha complicación.
Por lo que respecta a la disponibilidad y uso de la membrana amniótica en nuestro país, se obtiene del banco de tejidos del Instituto Distrital de Ciencia Biotecnología e Innovación en Salud (IDCBIS) de La Secretaría de Salud de Bogotá, Colombia, la cual se recibe doblemente empaquetada al vacío y se almacena en nevera conservando temperatura de 2°C para favorecer su viabilidad. Dado que la membrana amniótica viene preservada en glicerol al 85%, cuando se dispone para su uso en salas de cirugía debe ser sumergida en solución salina en 3 tiempos con el fin de retirar completamente este producto. Este apósito biológico se puede separar en sus capas y usar de manera independiente, a saber, el corion, el amnios o ambos según la necesidad.(21, 22)
Para su aplicación, se lleva a cabo previamente la dermoabrasión con lija n° 100 a 150 hasta obtener sangrado en capa, conocido como rocío sangrante, luego se aplica sobre las zonas comprometidas, se extiende completamente y se fija con un dispositivo de aire a temperatura ambiente durante 15 minutos para promover el secado y adherencia de la misma a las quemaduras.
Conclusiones
Las quemaduras en los pabellones auriculares son de tratamiento complejo y requieren un abordaje oportuno para evitar el desarrollo de complicaciones tales como infección, condritis, hiperpigmentación, deformidad, cicatrización anormal e incluso la pérdida completa del pabellón auricular.
De nuestro estudio en dos partes podemos concluir que, por un lado, la revisión bibliográfica realizada contribuye a actualizar el conocimiento de la evolución en el tiempo y el uso de los diferentes procedimientos descritos para el tratamiento de este tipo de lesiones, y por otro lado, analizamos nuestra propia experiencia en el uso concreto de un material, la membrana amniótica, intentando valorar su relevancia en la prevención de condritis y deformidades del pabellón auricular como secuelas.
Si bien entre nuestros pacientes no encontramos una relación directa entre el agente etiológico de la quemadura y el desarrollo de condritis del pabellón auricular, si pudimos determinar que la primera causa de quemadura de este segmento anatómico fue la llama.
En nuestra experiencia, la aplicación de membrana amniótica en el tratamiento de las quemaduras del pabellón auricular, independientemente de si eran superficiales y/o profundas, gracias a su disponibilidad, costo efectividad y sus múltiples propiedades, favoreció la evolución de la herida hacia la mejoría y por tanto hacia una mejor cicatrización de dicho segmento anatómico, lo que se tradujo en una menor estancia hospitalaria en aquellos pacientes que no presentaban un compromiso sistémico adicional.