Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Oncología (Barcelona)
versión impresa ISSN 0378-4835
Oncología (Barc.) vol.28 no.1 ene. 2005
ORIGINAL
Glutamina sérica como factor predictivo de insuficiencia renal en pacientes oncológicos tratados con quimioterapia basada en cisplatino
M. Cobo Dols; S. Gil Calle; A. Montesa Pino; I. Ales Díaz; J. Alcaide García; V. Gutiérrez Calderón; M. Benavides Orgaz;
F. Carabante Ocón; J. J. Bretón García
Servicio de Oncología Médica
Hospital Regional Universitario Carlos Haya
Málaga
Dirección para correspondencia
RESUMEN
PROPÓSITO: La glutamina es el vehículo del nitrógeno para poder ser transportados de forma no tóxica por la sangre. En insuficiencia renal se elevan sus niveles. Se pretende encontrar factores predictivos de riesgo de desarrollar insuficiencia renal secundaria al cisplatino.
MATERIAL Y MÉTODOS: 54 pacientes con diversos tumores sometidos a tratamiento quimioterápico basado en cisplatino. Se determinaban aminoácidos plasmáticos el tercer día tras cada infusión.
RESULTADOS: el nivel de glutamina a lo largo de los ciclos es mayor en pacientes con insuficiencia renal. la glutamina > 1000 µMol/L recogida tras el cisplatino es altamente predictiva de desarrollar insuficiencia renal.
CONCLUSIONES: La elevación de la glutamina plasmática tiene un alto valor predictivo de desarrollar insuficiencia renal secundaria al cisplatino.
Palabras clave: Glutamina. Insuficiencia renal. Cisplatino
SUMMARY
PURPOSE: Glutamine is a vehicle transporting non-toxic nitrogen in the blood. High levels of glutamine are present in renal failure. We studied glutamine searching possible predictive factors associated to the development of renal failure secondary to cisplatin.
MATERIAL AND METHODS: We studied 34 patients with different tumors treated with cisplatin-based chemotherapy. We determined the serum amino acid three days after each infusion.
RESULTS: Glutamine concentration along the chemotherapy cycles was higher in the patients with renal failure. Glutamine level >1000 µM/L determined after cisplatin administration was strongly predictive of developing renal failure.
CONCLUSIONS: The elevation of serum glutamine has a significant predictive value of developing renal failure secondary to cisplatin.
Key words: Glutamine. Renal failure. Cisplatin.
Introducción
Los aminoácidos son subunidades monoméricas sencillas que proporcionan la clave de la estructura de millares de proteínas diferentes, están compuestos por un grupo carboxilo y un grupo amino, unidos al mismo átomo de carbono1. La glutamina forma parte del grupo de los aminoácidos con grupos "R" polares sin carga, que son más solubles2.
Dos aminoácidos, el glutamato y la glutamina representan el paso crítico en la incorporación del nitrógeno a los aminoácidos. Los grupos amina que precisan los aminoácidos y otros productos son donados por glutamato y glutamina a través de las reacciones de transaminación3. Los grupos amino de los 20 aminoácidos de las proteínas se eliminan durante la degradación de éstos. Si no se reutilizan, se canalizan en el hígado hacia un producto excretorio final, el amoniaco, que es tóxico para el organismo, por lo que debe ser transformado en un producto no tóxico. Este compuesto es la glutamina, y se forma gracias a la glutamina sintetasa, que combina el glutamato con el amoniaco4. La glutamina es la principal forma de transporte del amoniaco, hallándose en la sangre a concentraciones mucho más elevada que otros aminoácidos. Una vez llega al hígado o riñón, la glutaminasa la convierte en glutamato y amoniaco. En la producción de urea en el hígado a partir del amoniaco, el primer grupo amino que entra en el ciclo proviene del amoniaco procedente de la glutamina5.
En pacientes con fallo renal agudo o crónico se producen importantes disturbios en el metabolismo de las proteínas y de los aminoácidos6. En diversos estudios se ha evidenciado en el contexto del fallo renal alteraciones en la utilización de aminoácidos 7,8, además de en su tiempo medio de eliminación9,10. Además, en la insuficiencia renal, se altera el consumo hepatoesplácnico de diversos aminoácidos, que tiene especial repercusión en los niveles plasmáticos de la glutamina, la prolina y la tirosina11. La hiperaminoaciduria se relaciona con el efecto tubular precoz que tienen numerosos nefrotóxicos, incluyendo antibióticos y citostáticos12.
Por otra parte, Laidlaw13 y otros autores demostraron que hay una correlación lineal entre la progresiva pérdida de la función renal y el incremento de las anormalidades de aminoácidos plasmáticos14-21. Debemos considerar de forma independiente a la glutamina por sus especiales características respecto a su papel como transportador de nitrógeno. Hay estudios en pacientes con insuficiencia renal, sobre todo en fases iniciales, en los que se detecta elevación de la glutamina, y disminución de su aclaramiento plasmático. Además, incluso dipéptidos formados con glutamina como la alanina-glutamina o la glicina-glutamina, también reducen su aclaramiento en el fallo renal, mientras que la insuficiencia hepática no influye en el aclaramiento de estos dipéptidos22. Concordando con esos resultados, si se analizan las diferencias arteriovenosas de la vascularización del hígado para determinar alteraciones en la utilización hepática de los aminoácidos en insuficiencia renal, se evidencia una disminución de la captación y gasto de la glutamina por parte del hígado para formar amoniaco, y posteriormente urea11, con lo cual aumenta el nivel plasmático de la glutamina.
El cisplatino es un fármaco clave en el tratamiento quimioterápico de una gran cantidad de tumores sólidos. Una de los efectos colaterales más frecuentes es la nefrotoxicidad, básicamente ocasionada por daño tubular23, cambios no apreciados en las primeras horas tras infusión de CDDP, sino que, al ser fenómenos secundarios, se iniciarían 2 a 3 días después24.
En nuestro estudio analizamos los cambios en el perfil de aminoácidos en sangre en pacientes tratados con cisplatino para intentar encontrar factores predictivos precoces de insuficiencia renal.
Material y método
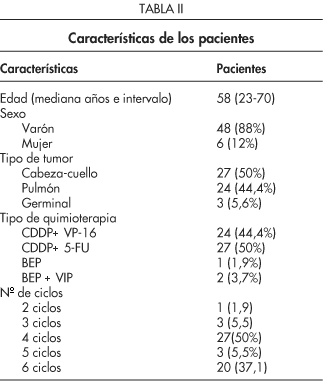
Se incluyeron en este estudio prospectivo 54 pacientes neoplásicos con cáncer de pulmón o de cabeza y cuello fuera de tiempo quirúrgico y tumores testiculares, tratados en la Sección de Oncología Médica del Hospital Regional Carlos Haya de Málaga con un esquema de quimioterapia basado en cisplatino. Los criterios de inclusión: edad entre 18-70 años, E.C.O.G. <2, pérdida de peso inferior al 5%, no haber recibido quimioterapia previa, no ser portadores de alteraciones endocrino-metabólicas, hipertensión arterial no controlada ni infecciones. Función hepática y cardiaca normales, adecuada reserva medular. Adecuada función renal: creatinina sérica inferior a 1,5 mg/100 ml, aclaramiento de creatinina mayor a 60 ml/minuto, así como ausencia de alimentación supletoria tanto enteral como intravenosa.
En todos los casos se empleó cisplatino a la misma dosis de 100 mgr/m2 en ciclos repetidos cada 21 días. El protocolo de quimioterapia se aplicó en régimen de hospitalización según se expone en la Tabla I. Previamente a la administración de cada ciclo de quimioterapia, se procedía a la realización de una analítica de sangre (hemograma, glucemia, creatinina, ionograma), y valoración del aclaramiento de creatinina a través de la recogida de orina de 24 horas. La dosis de los fármacos se reducía al 75% si aparecía un efecto tóxico limitante de la dosis según la escala de la OMS. Se suspendía el tratamiento si se evidenciaba progresión o toxicidad inaceptable. En cuanto a la nefrotoxicidad, si a los 21 días del ciclo previo el nivel sérico de creatinina era superior a 1,5 mgr/dl, hacíamos una hidratación y diuresis forzada hasta un máximo de 7 días. Si entonces la cifra de creatinina oscilaba entre 1,5-2 mgr/dl, o el aclaramiento de creatinina presentaba un valor entre 45-60 ml/min, reducíamos la dosis del cisplatino al 50%; pero si la creatinina sérica era superior a 2 mgr/dl o el aclaramiento de creatinina estaba por debajo de 45 ml/min, el paciente salía del estudio. Finalizábamos la recogida de muestras cuando terminó el tratamiento, o se suspendía precozmente por progresión o toxicidad; o bien, cuando aparecían factores que podían alterar la calidad de las muestras.

Las determinaciones de laboratorio consistieron en el análisis en suero de 27 tipos de aminoácidos diferentes. La extracción de las muestras se hacía a las 72 horas después de la administración del cisplatino. Los aminoácidos determinados fueron: Ácido aspártico, Taurina, Treonina, Serina, Asparagina, Ácido glutámico, Glutamina, Prolina, Glicina, Alanina, Citrulina, Ácido aminobutírico, Valina, Cistina, Metionina, Isoleucina, Leucina, Tirosina, Fenilalanina, Triptófano, Ornitina, Lisina, Histidina, Arginina, Hidroxiprolina, 3-metil-histidina, 1-metil-histidina.
La determinación de los aminoácidos se hizo con el analizador cromatográfico BecKman, sistema 6300/7300. La preparación de las muestras se hizo con la siguiente metodología: Para la determinación en sangre: Se recoge 1 ml de sangre total en tubo heparinizado. Se transfieren 20 µL a un tubo de microfuga de 400 µL. Y se añade 200 µL de una solución buffer a pH 2,2 consistente en una mezcla de ácido clorhídrico y ácido cítrico; se mezcla y se congela. Posteriormente la solución se descongela y se centrifuga a 13000 revoluciones por minuto (r.p.m.) durante 10 minutos. Para desproteinizar, se toman 200 µL del sobrenadante con una micropipeta, se transfiere a un tubo de microfuga de 400 µL y se añaden 20 µL de ácido sulfosalicílico y se centrifuga a 13000 r.p.m. durante 5 minutos. Se toma 5 µL del sobrenadante y se mezcla con Li-A al 50%, y se pasa por un filtro.
Respecto al análisis estadístico. El estudio comparativo para detectar diferencias en los cambios del perfil de aminoácidos a través de los ciclos entre pacientes con insuficiencia renal y sin ella, con el modelo ANOVA de medidas repetidas. Para los parámetros que no cumplían criterios para poder aplica el test de ANOVA, se realizaron los cambios en el tiempo a través de los ciclos con el test no paramétrico de Friedman. Los factores definidos como posibles predictores de toxicidad renal por el cisplatino (comparación de variables cualitativas), se analizaron por el test de la Ji cuadrado.
Resultados
Las características se exponen en la Tabla II. Se realizaron un total de 308 determinaciones. Además de determinar los niveles de cada uno de los 27 aminoácidos en condiciones basales (1 ó 2 días previos al comienzo del tratamiento), se hizo una determinación de estos mismos parámetros 72 horas después de la administración del cisplatino en cada uno de los ciclos. A los 21 días después de la infusión del cisplatino, y previo a la administración del siguiente ciclo, se determinó de forma sistemática la concentración de creatinina plasmática y el aclaramiento de creatinina en orina de 24 horas.
De los 54 pacientes incluidos en el estudio, un total de 13 pacientes (24%) desarrollaron en alguno de los ciclos algún defecto de la función renal manifestado por una elevación de la creatinina plasmática >1,5 mgr/dl y/o disminución del aclaramiento de creatinina < 50 ml/min. Cuando se detectó esa nefrotoxicidad, se procedió a hiperhidratación intravenosa con suero salino al 0,9% y diuresis forzada, un máximo de 7 días para intentar la recuperación. En 3 (23%) de los 13 pacientes, la toxicidad renal fue progresiva e irreversible, llegando hasta cifras de creatinina plasmática de 2.55; 3.1 y 8.1 mg/dl (con aclaramiento de creatinina 32.21; 23.55 y 8.16, respectivamente), precisando éste último caso entrar en programa de diálisis.
De los 10 pacientes restantes que desarrollaron nefrotoxicidad (77%), se pudieron recuperar o mejorar todos ellos, posibilitando reanudar el tratamiento, aunque con un retraso de 3 días de media (rango 2-6), y hubo que reducir la dosis del cisplatino en 3 pacientes. No obstante, el haber desarrollado alteración en la función renal, a pesar de normalizarse con hiperhidratación, incrementó la posibilidad de desarrollar un nuevo episodio de nefrotoxicidad en los ciclos sucesivos, lo que sucedió en 9 de los 10 pacientes (90%).
De los 27 aminoácidos estudiados, prácticamente en casi todos apreciamos una variabilidad sustancial en sus niveles plasmáticos al comparar los pacientes que habían desarrollado algún grado de insuficiencia renal y los que no la desarrollaron. Sin embargo, sólo la glutamina fue significativa (Fig. 1). De forma global, las modificaciones de los niveles plasmáticos de glutamina muestran una significación estadística a través de los ciclos (p = 0,0001), pero estos cambios son muy relevantes en aquellos pacientes con nefrotoxicidad (p=0,0002), mientras que en pacientes sin insuficiencia renal, la variabilidad de la glutamina a través de los ciclos no fue significativa. Detectamos diferencias estadísticamente significativas (p = 0,004) en la variación de glutamina a través de los ciclos entre estos dos grupos de pacientes.

Analizando la gráfica del valor medio de la glutamina (Fig. 1) en sujetos que en algún ciclo desarrollaron elevación de la creatinina > 1,5 mg/dl o disminución del aclaramiento de creatinina < 50 ml/min, se evidencia que, prácticamente, en la totalidad de los ciclos, el nivel medio de glutamina estaba por encima de 1000 µMol/L.
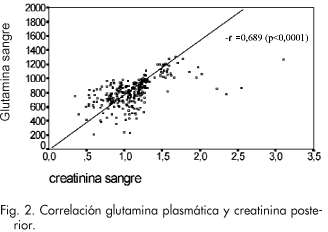
Hubo una correlación positiva entre las variables: concentración de creatinina plasmática previa a la administración del ciclo, y la concentración de glutamina plasmática recogida en el ciclo anterior (r -0,689, p < 0,0001) (Fig. 2) así como entre el aclaramiento de creatinina previo a la administración del ciclo, y la concentración de glutamina plasmática recogida en el ciclo anterior (r -0,563, p < 0,0001) (Fig. 3).

Estudiando cada uno de los ciclos de los pacientes con nefrotoxicidad, clarificamos que en los ciclos donde hubo algún tipo de anomalía de la función renal, en el control previo a la administración de la quimioterapia, la glutamina plasmática recogida 3 días después de la administración del cisplatino del ciclo anterior, evidenciaba niveles > 1000 µM/L, es decir, que niveles por encima de esta cifra podían ser un predictor de pacientes con riesgo de desarrollar toxicidad renal.
De los 254 ciclos de quimioterapia administrados, en 42 (16,5%) detectamos algún grado de insuficiencia renal, y en 41 ciclos (16,1%), comprobamos elevación de la glutamina plasmática > 1000 µM/L. En 36 ciclos coincidió el desarrollar anomalía en la función renal con haberse elevado en el ciclo previo la glutamina a niveles > 1000 µM/L , de tal forma que la relación entre ciclos con elevación de la glutamina por encima de estas cifras, y el desarrollar algún grado de insuficiencia renal previa a la administración del ciclo siguiente fue muy significativa ( p < 0,000001).

Al considerar la correlación entre elevarse la glutamina > 1000 µMol/L y el desarrollar insuficiencia renal, teniendo en cuenta los pacientes, observamos que de los 54 pacientes, 13 (24%) desarrollaron algún grado de insuficiencia renal en alguno de los ciclos, y 16 pacientes (29,6%) habían elevado la glutamina en alguno de los ciclos. Los 13 pacientes con nefrotoxicidad, elevaron previamente la glutamina, y sólo 3 pacientes que incrementaron este aminoácido en alguno de los ciclos, no desarrollaron posteriormente nefrotoxicidad. De esta forma, la relación entre los pacientes que han desarrollado toxicidad renal con el haber elevado previamente la glutamina > 1000 µMol/L sigue siendo muy significativa (p < 0,000001).

Discusión
Son pocos los estudios que analizan las modificaciones del perfil de los aminoácidos plasmáticos en la fase inicial de la insuficiencia renal. En estos estudios se han obtenido resultados discordantes, probablemente por el escaso número de casos estudiados y por la heterogeneidad de los enfermos incluidos: patologías diversas, edad no uniforme, diverso grado de disfunción renal, distinto estadio evolutivo y tratamiento diferente hasta el momento de analizarlos14, 15.
El interés de estudiar los aminoácidos en pacientes oncológicos que desarrollan insuficiencia renal, reside en la posibilidad de encontrar factores predictores de esta complicación, ya que uno de los fármacos antineoplásicos más utilizado y que es esencial en tumores curables es el cisplatino. Esta droga, además de una serie de efectos tóxicos de fácil manejo, posee también el de la nefrotoxicidad, y más específicamente la toxicidad tubular tanto aguda como acumulativa, que restringió su utilización cuando se hicieron los primeros ensayos.
La hiperhidratación y el uso de diuréticos son los medios más usados para disminuir la nefrotoxicidad del cisplatino, lo que se consigue aumentando su dilución, disminuyendo el tránsito, así como previniendo la caída de la filtración glomerular. Regímenes de hidratación convencional que deparen al menos un volumen urinario de 3 litros en 24 horas, como el usado en nuestro estudio, suelen proteger contra la nefrotoxicidad, que se detecta en el 5-10% de los casos. La elección de soluciones donde diluir el CDDP también es importante. La de suero salino hipertónico (3-4,5% de ClNa), que hemos usado en nuestras pautas de administración ha demostrado este efecto protector, posiblemente porque la alta concentración de cloro puede disminuir la unión del cisplatino a los grupos sulfidrilo de las proteínas25.
En nuestro estudio, 13 pacientes (24%) tuvieron alteraciones de la función renal en alguno de los ciclos, y aunque esta cifra parecería alta en comparación con la mayoría de la series publicadas, hay que tener en cuenta que sólo en 3 casos (5,5%), la toxicidad fue irreversible (de grado superior a 1 en la escala de la OMS), siendo ésta la que suelen recoger los registros de toxicidad de los estudios que emplearon el cisplatino como droga antitumoral, y que coincide con el porcentaje observado en nuestra serie.
Detectar factores que puedan ser predictores de alto riesgo de toxicidad renal secundaria al cisplatino, aunque sea bajo el porcentaje de eventos graves, es de interés porque: 1) Es un suceso idiosincrásico e imprevisible hasta ahora que podríamos evitar, si ante el menor indicio de alteración renal procediéramos a una nueva hiperhidratación intravenosa, que es la actuación terapéutica más eficaz cuando se ha establecido el daño tubular; 2) Pese a su escasa frecuencia, puede llevar a un sujeto a situaciones graves e incluso al fallecimiento (uno de los pacientes de nuestro estudio entró en programa de diálisis por un fallo renal agudo con creatinina de alrededor de 8 mg/dl). 3) Los eventos nefrotóxicos menores, aunque no suelen comprometer la vida ni la calidad de vida del paciente, sí interfieren la intensidad de dosis, lo que interfiere la supervivencia e incluso la curabilidad.
Actualmente se sabe que la lesión tubular es la primera en aparecer en esta nefropatía farmacológica, 2-3 días después de la administración del cisplatino, y que posteriormente se inician los cambios hemodinámicos (reducción del flujo plasmático renal y de la tasa de filtración glomerular)23. Esto fue lo que nos indujo a recoger las muestras de sangre y orina de 24 horas cuando habían pasado 72 horas de la administración del cisplatino. Por otro lado, aunque los cambios histopatológicos del daño renal por CDDP parece que siguen una sucesión cronológica, las lesiones histopatológicas más prominentes se han descrito exactamente 3 días después de la administración del fármaco25.
No encontramos modificaciones significativas del perfil de aminoácidos plasmáticos correlacionables con la alteración o no de la función renal, excepto para la glutamina, resultados que difieren de otros estudios en los que sí existieron alteraciones de ciertos aminoácidos en la presencia de tal complicación19, 20. Tal es el caso de los aminoácidos ramificados valina, leucina e isoleucina19, 20, la citrulina sérica, los aminoácidos aromáticos, especialmente la tirosina21, y de otros aminoácidos cuyas elevaciones en el fallo renal agudo, se detectaron de forma esporádica y variable de unos estudios a otros15-18. Al orientar nuestro estudio hacia la búsqueda de alteraciones bioquímicas que sirviesen como predictores de alto riesgo de nefrotoxicidad secundaria al cisplatino, hicimos las determinaciones de los aminoácidos séricos al tercer día de su administración y no en el momento de detectar la elevación del valor de la creatinina plasmática o la disminución del aclaramiento de creatinina, que es cuando posiblemente más evidente serían las modificaciones del perfil de aminoácidos.
La glutamina plasmática, junto con la citrulina y los aminoácidos aromáticos, se consideraron posibles parámetros predictores de la nefrotoxicidad por cisplatino. La glutamina tiene la especial función del transporte nitrogenado. Se sintetiza primariamente en el músculo esquelético, pulmones, tejido adiposo, etc, y transporta el nitrógeno desde los tejidos periféricos hacia el hígado y el riñón porque, a diferencia del amoniaco, es un compuesto nitrogenado no tóxico. Cuando llega al hígado o al riñón, actúa la glutaminasa que fracciona la glutamina en glutamato y amoniaco, y el amoniaco a su vez se transforma en urea. En el riñón el último paso no ocurre, y el amoniaco se expulsa directamente por la excreción urinaria, jugando un papel importante en el mantenimiento del pH orgánico26.
Con nuestro estudio, demostramos diferencias estadísticamente significativas de los niveles de glutamina al comparar la curvas de evolución de los niveles plasmáticos a través de los ciclos entre los pacientes que desarrollaron algún grado de insuficiencia renal frente a los que no la desarrollaron. Cuando analizamos ciclo a ciclo, hubo una clara tendencia de la glutamina a elevarse en el mismo ciclo en el que se observaba la alteración renal, aunque detectamos que dicha elevación era mayor en la muestra previa, como si el incremento de este aminoácido pudiera predecir una elevación de la creatinina plasmática y/o disminución del aclaramiento de creatinina antes de tener que administrar el siguiente ciclo. Estos datos fueron corroborados cuando comprobamos una correlación positiva entre la concentración de glutamina recogida tras el cisplatino, con la creatinina y el aclaramiento de creatinina previo a la administración del siguiente ciclo.
Analizando los niveles de la glutamina a través de los ciclos en pacientes con nefrotoxidad, los valores medios en cada uno de los ciclos sobrepasaban los 1000 µMol/L, por lo que decidimos que éste fuese el punto de corte para sospechar la posibilidad de desarrollar toxicidad renal a posteriori, haciéndose tanto por ciclos como por pacientes. En ambos casos, los resultados fueron similares, y la relación fue muy significativa, detectando valores muy aceptables de sensibilidad, especificidad y valor predictivo positivo del test.
No hemos encontrado estudios de diseño similar con los que poder contrastar nuestros resultados. No obstante, hay estudios que han detectado elevaciones de la glutamina, y disminución de su aclaramiento plasmático, en la insuficiencia renal, sobre todo en fases iniciales. Incluso dipéptidos formados con glutamina como la alanina-glutamina o la glicina-glutamina, también muestran una disminución de su aclaramiento en el fallo renal22. Otros estudios también apoyan fisiopatológicamnete nuestros resultados al comprobar que, en la insuficiencia renal, hay una disminución de la captación y gasto de la glutamina por parte del hígado para formar amoniaco y posteriormente urea11. Existen dos fracciones de glutaminasa: la hepática y la renal. La glutamina da lugar a glutamato y amoniaco, que posteriormente se transormará en urea. La fracción de glutaminasa renal, puede encontrarse no sólo en riñón, sino también en cerebro, intestino, hígado fetal, linfocitos y células transformadas27. El glutamato, como producto final de la acción de la glutaminasa, inhibe a esta enzima por mecanismos de retroalimentación28, 29. El otro producto de la glutamina, el amoniaco, así como situaciones que conllevan a una hiperamonemia como es la insuficiencia renal, inhiben también la acción de la glutaminasa30, 31.
La gentamicina es el fármaco utilizado para inducir insuficiencia renal por nefrotoxicidad en modelos murinos. Se ha observado una disminución en la producción de amonio y glucosa con defectos en la utilización de glutamina. Tales hallazgos pueden explicarse, bien por un incremento en la tendencia anabólica a consecuencia de la insuficiencia renal, que tiende a no catabolizar la glutamina, o por un efecto tóxico directo de la gentamicina sobre las enzimas de decarboxilación, es decir la glutaminasa entre otras32. Pero la alteración de la glutaminasa no es permanente mientras dure la insuficiencia renal, sino que acontece en etapas muy iniciales, y la actividad enzimática retorna a la normalidad en pocos días, con los cual sus efectos sobre la glutamina sólo se apreciarán precozmente33. Esta sería la base para fundamentar que en nuestro estudio la elevación de la glutamina fue más evidente en los momentos precedentes al desarrollo de la insuficiencia renal manifiesta, cuando el daño tubular ya existía previamente, y sin embargo cuando el fallo renal ya se ha establecido, la glutamina disminuía su concentración. Corroborando lo anterior, hay estudios experimentales en ratas cuyos riñones se les sometió a una isquemia, lo que deparó una inhibición del sistema enzimático de la glutaminasa para evitar el acúmulo de amonio, que también tiene efectos tóxicos para el riñón34.
Bibliografía
1. Scriver CR, Lamm P, Clow CL. Plasma amino acids. Screening, quantitation, and interpretation. American Journal of Clinical Nutrition 1971;24(7):876-890. [ Links ]
2. Frommel C. The apolar surface area of amino acids and its empirical correlation with hydrophobic free energy. Journal of Theoretical Biology 1984; 111(2):247-260. [ Links ]
3. O'Donovan DJ, Lotspeich WD. The role of the amide group of glutamine in renal biosynthesis of amino acids. Enzymologia 1969;36:301-312. [ Links ]
4. Lund P. Control of glutamine synthesis in rat liver. Biochemical Journal 1971;124:653-660. [ Links ]
5. Ratner S. Enzymes of arginine and urea synthesis. Advances in Enzymology & Related Areas of Molecular Biology 1973;39:1-90 [ Links ]
6. Greiber S, Mitch WE. Mechanims of protein catabolism in uremia: metabolic acidosis and activation of proteolytic pathways. Mineral and eletrolite metabolism 1992;18:233-236. [ Links ]
7. Jones MR, Kopple JD, Swendseid ME. Phenylalanine metabolism in uremic patients and normal man. Kidney international 1978;14:169-179. [ Links ]
8. Jones MR, Kopple JD. Valine metabolism in normal and chronically uremic man. Am J clin Nutr 1978;31:1660-164. [ Links ]
9. Druml W. Protein metabolism in acute renal failure. Mineral and Electrolyte Metabolism 1998;24(1):47-54. [ Links ]
10. Druml W, Fischer M, Liebisch B, lenz K, Roth E. Elimination of amino acids in renal failure. American Journal of Clinical Nutrition 1994;60(3):418-423. [ Links ]
11. Takala J. Total plasma clearance of intravenous essential amino acids: evidence of abnormal metabolism of amino acids in chronic renal failure. J Parentent Nutr 1983;146-150. [ Links ]
12. Goren MP, Wright RK, Pratt CB, et al. Potentiation of ifosfamide neutoxicity, and tubular neephrotoxicity by prior cis-diamminedichloroplatinum(II) therapy. Cancer research 1987;47:1457-1460. [ Links ]
13. Laidlaw SA, Berg RL, Kopple JD, Naito H, Walker WG, Walser M. Patterns of fasting plasma amino acid levels in chronic renal insufficiency: results from the feasibility phase of the modification of diet in renal disease study. American Journal of Kidney Diseases 1994;23(4):504-513. [ Links ]
14. Bazilinski N, Shaykh M, Ahmed S, et al. Amino acid composition of uremic middle and low molecular weight retention products. Advances in Experimental Medicine and Biology 1987;223:197-204. [ Links ]
15. Abel RM, Shih UE, Abott WM, Beck CH, Fischer JE. Amino acid metabolism in acute renal failure. Ann Surg 1974;180:350-355. [ Links ]
16. Feinstein EI, Blumenkrantz MS, Healy M, et al. Clinical and metabolic respoenses to parenteral nutrition in acute renal failure 1981;60:124-137. [ Links ]
17. Druml W, Burguer U, Kleinberger G, Lenz K, Laggner A. Elimination of amino acids in acute renal failure. Nephron 1986; 42(1):62-67. [ Links ]
18. Ceballos I, Chauveau, P, Guerin V, et al. Early alterations of plasma free amino acis in chronic renal failure. Clinica Chimica Acta 1990;188(2):101-108. [ Links ]
19. DeFronzo RA, Felig P. Amino acid metabolism in uremia: insights gained from normal and diabetic man. American Journal of Clinical nutrition 1980;33(7):1378-1386. [ Links ]
20. Tizianello A, De Ferrari, G, Garibotto G, et al. Branched-chain amino acid metabolism in chronic renal failure. Kidney International 1983;16:S17-22. [ Links ]
21. Druml W, Roth E, Lenz K, Lochs H, Kopsa H. Phenylalanine and tyrosine metabolism in renal failure: dipeptides as tyrosine source. Kidney international . [ Links ]
22. Hubl W, Druml W, Roth E, Lochs H. Importance of liver and kidney for the utilization of glutamine-containing dipeptides in man. Metabolism:clinical and experimental 1994;43(9);1104-1107. [ Links ]
23. Daugaard G, Abildgaard U, Holstein-Rathlou NH, Leyssac PP, Amtorp O, Dikhoff TG. Acute effect of cisplatin on renal hemodynamics and tubular function in dog kidneys. Renal Physiol 1986;9:308. [ Links ]
24. Daugaard G, Abildgaard U, Holstein-Rathlou NH, Bruunshuus I, Bucher D, Leyssac PP. Renal tubular function in patients treated with high doses cisplatin. Clin Pharmacol Ther 1988;44:164. [ Links ]
25. Pinzani V, Bresolle F, Johanne Haug I, Galtier M, Blayac JP, Balmes P. Cisplatin-induced renal toxicity and toxicity-modulating strategies: a review. Cancer Chemother Pharmacol 1994;35:1-9. [ Links ]
26. Watford M. Hepatic glutaminase expression: relationship to kidney-type glutaminase and the urea cycle. FASEB Journal 1993;7(15):1468-1474 [ Links ]
27. Curthoys NP, Watford M. Regulation of glutaminase activity and glutamine metabolism. Annual Review of Nutrition 1995;15:133-159 [ Links ]
28. Carter P, Welbourne T. Glutamate transport regulation of renal glutaminase flux in vivo. American Journal of Phyysiology 1997:273:521-527 [ Links ]
29. Welbourne TC, Mu X. Extracelular glutamate flux regulates intracelular glutaminase activity in LLC-PK1-F+ cells. American Journal of physiology 1995;268:1418-1424 [ Links ]
30. Curi TC, De Melo MP, De Avezaedo RB, Zorn TM, Curi R. Glutamine utilization by rat neutrophils: presence of phophate-dependent glutaminase. American Journal of Physiology 1997;273:1124-1129) [ Links ]
31. Petrun NM, Migal LA, Drannik GN. Activity of glutamine deamination enzymes in the kidneys, liver and serum dogs with renal failure and under normal conditions. Voprosy Meditsinskoi Hhimii 1977;23(4):485-489. [ Links ]
32. Rivas L, Garcia JL, Arevalo M, Rodríguez A, Lopez JM. Effect of gentamicine treatment on glutamine and lactate metabolism by the renal cortex of the rat. Archives Internationales de Pfysiologie, de Biochimie et de Biophysique 1993;101(3):193-196 [ Links ]
33. Anderson NM, Hortelano P, Alleyne GA. Renal metabolism of glutamine in rats with acute renal failure. Kidney International 1982;22(6):640-642. [ Links ]
34. Fitzpatrick JM, Monson JR, Gunter PA, Watkinson, LE, Wickman JE. Renal accumulation of ammonia: the cause of post-ischaemic functional loss and the "blue line". British Journal of Urology 1982;54(6):608-612. [ Links ]
 Dirección para correspondencia
Dirección para correspondencia
Dr. M. Cobo Dols
Secretaría del Servicio Oncología Médica
Pabellón A - 3ª planta
Hospital Regional Universitario Carlos Haya
Avda. Carlos Haya, s/n
E-29010 Málaga
E-mail: mangel.cobo.sspa@juntadeandalucia.es
Recibido: 13.12.04
Aceptado: 01.02.05














