Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.29 no.2 Madrid mar./abr. 2007
¿Cuál es su diagnóstico y tratamiento?
What is your diagnosis and treatment plan?
Paciente varón de 64 años de edad y trabajador en una fundición de acero durante 42 años, actualmente jubilado. Historia clínica de quistes hepáticos no tratados quirúrgicamente, pólipos intestinales en seguimiento por parte del Servicio de Digestivo de nuestro hospital y EPOC en tratamiento con corticosteroides inhalados.
Derivado a nuestra consulta por parte del Servicio de Otorrinolaringología por presentar historia actual de epistaxis de repetición y obstrucción nasal de 8 meses de evolución, compatible inicialmente con presencia de pólipos nasales.
A la exploración, el paciente presenta una masa excrecente en fosa nasal izquierda de aspecto lobulado, coloración parduzca y consistencia friable, que ocluye prácticamente por completo la luz de dicha fosa nasal (Fig. 1). La exploración cervicofacial es rigurosamente normal, sin detectarse adenopatías cervicales ni otras lesiones asociadas; asimismo la exploración por órganos y aparatos es anodina.
Se solicita estudio preoperatorio, estudios de imagen (Tomografía Axial Computerizada y Resonancia Magnética Nuclear) y biopsia de la lesión.
Los resultados de las pruebas preoperatorias son normales, sin detectarse ningún tipo de anomalía en la analítica sanguínea, en el estudio de parámetros de coagulación, ni en el resto de estudios solicitados.
En la RM (Fig. 2) se aprecia la existencia de una masa que ocupa de manera completa la fosa nasal izquierda y que desestructura toda la región de los cornetes. La lesión se expande hacia la porción más anterior de la fosa nasal así como hacia el cavum nasofaríngeo. Se evidencia abombamiento del tabique nasal sin poder descartarse infiltración del mismo por parte de la lesión. Existe desestructuración parcial de la porción más caudal de las celdillas etmoidales sin apreciarse infiltración de la cribosa etmoidal ni de la transición frontoetmoidal. Se observa una distensión mínima de la pared medial de la órbita izquierda así como del suelo de dicha órbita sin llegarse a apreciar infiltración de las mismas.
La biopsia de la lesión se corresponde con un tejido parcialmente necrótico que presenta células inflamatorias junto a células de aspecto neoplásico maligno con hábito plasmocitoide. Se comprueba asimismo la existencia de positividad para HMB45, vimentina y S100. El Ki 67 muestra una tasa proliferativa positiva del 40%.
Finalmente se solicita estudio con Tomografía por Emisión de Positrones (PET), donde se aprecia foco hipermetabólico en la porción más anterior de las fosas nasales así como a la altura de las coanas. No se evidencian otras lesiones hipermetabólicas en el resto de la exploración.
Tras el estudio diagnóstico de la lesión, se procede al tratamiento quirúrgico de la misma.
Melanoma mucoso de senos paranasales
Mucosal melanoma of the paranasal sinuses
L.M. Capitán Cañadas1, I.L. Labrot Moleón1, D.J. Durán Moreno1, A. Cabello Serrano1, E. Valencia Laseca2
1 Médico Residente.
2 Jefe de Servicio.
Servicio de Cirugía Oral y Maxilofacial. Hospital Universitario Virgen de las Nieves. Granada, España
Dirección para correspondencia
Con la sospecha diagnóstica histopatológica de melanoma, se decide realizar tumorectomía (Fig. 3) que incluye hemimaxilectomía segmentaria mediante abordaje combinado transfacial y coronal junto a cirugía endoscópica asistida para la resección completa de la mucosa del seno etmoidal y de la mucosa de ambos senos maxilares. Para la reconstrucción del defecto se decide emplear colgajo pediculado de gálea-pericráneo. La exéresis tumoral corresponde a una masa polipoidea friable de 4x4x2,7 cm de diámetro y a varios fragmentos irregulares obtenidos mediante el abordaje endoscópico (Fig. 4).
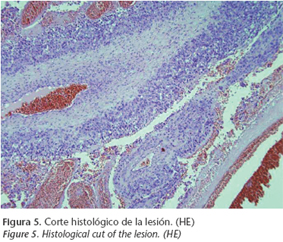
El estudio histológico del espécimen quirúrgico confirma el diagnóstico de melanoma mucoso epitelioide y de células redondas con amplias áreas de hemorragia y necrosis (Fig. 5). Tanto los pólipos como la mucosa de los senos etmoidales y maxilares se encuentran libres de enfermedad.
El postoperatorio inmediato del paciente es satisfactorio sin evidenciarse complicación alguna durante el desarrollo del mismo.
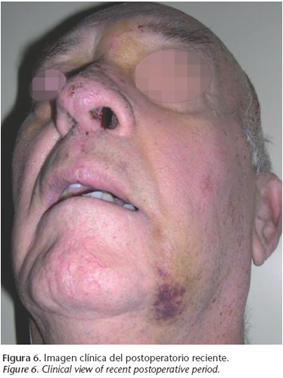
El paciente recibe radioterapia postoperatoria conformada tridimensionalmente sobre al área quirúrgica. Se emplea una dosis de 30 Gy en esquema hipofraccionado, con una dosis por fracción y día de 3 Gy por cinco días a la semana, utilizando una energía de fotones de 6 MV. El control postoperatorio a los 12 meses de la cirugía demuestra ausencia de enfermedad clínica y radiológica (Figs. 6 y 7).
Discusión
El melanoma mucoso de senos paranasales (MMSPN) es considerado como una patología de extremada agresividad,1 que supone alrededor del 1% del total de melanomas y entre un 3 y 4% del total de tumores de los senos paranasales.2, 3 Su incidencia estimada es de 1 por 500.000 habitantes por año.3 Presenta una mayor propensión a afectar a mujeres y a pacientes por encima de 60 años.4 Hasta en un 80% de pacientes la enfermedad se presenta de manera localizada con afectación principalmente de la cavidad nasal.2 Los principales síntomas clínicos relacionados con los MMSPN son epístaxis, presencia o sensación de masa y síntomas obstructivos,5 además se han descrito otro síntomas menores asociados como dificultad respiratoria, congestión, pólipos y dolor.6 La aparición de melanorrea, secreción nasal de coloración marrón, sugiere la presencia de pigmentación melánica.5 Al contrario que ocurre en los melanomas cutáneos, es rara la degeneración desde lesiones precursoras.2 Las principales dianas metastásicas de los MMSPN son cerebro y pulmón,7 siendo infrecuente la presencia de metástasis locales a nivel cervical. Alrededor de un tercio de estas lesiones se presentan con escasa o nula pigmentación, lo que puede dificultar su diagnóstico.8
El manejo diagnóstico de los MMSPN incluye la realización de estudios de imagen, principalmente TC y RM, despistaje tumoral sistémico que puede estar apoyado en el empleo de PET y filiación tumoral histopatológica.3
A nivel histológico puede plantear dudas diagnósticas con carcinomas pobremente diferenciados, linfomas, plasmocitomas, rabdomiosarcomas y neuroblastomas del tracto olfatorio.5 El perfil inmunohistoquímico de los MMSPN es idéntico al de los melanomas cutáneos, presentando positividad para la proteína S100, tirosinasa y HMB45.9
A pesar de que se han propuesto gran variedad de sistemas de estadiaje para los melanomas en general, no existe uniformidad en cuanto a la clasificación de los MMSPN. Esto es debido a la dificultad para aplicar los principales criterios de estadificación propuestos por diferentes autores para los melanomas cutáneos (identificación de límites histológicos como dermis papilar o reticular, espesor de penetración de la lesión) a los MMSPN. El reciente trabajo de Thompson y cols.5 apoyado en el estudio de 115 pacientes con MMSPN, propone un sistema de estadiaje basado en el clásico sistema TNM con determinadas modificaciones que permite un fácil manejo de este tipo de lesiones.
No hay duda de que el tratamiento de elección para los MMSPN pasa por la exéresis quirúrgica tumoral.2,3,5,10 Pese a que el abordaje abierto es el más frecuentemente empleado,11 se propugna el uso de cirugía endoscópica para facilitar la exéresis en zonas de difícil acceso o como abordaje primario para tumores previamente seleccionados.12 Debido a que el índice de metástasis ganglionares cervicales no supera el 5% no se recomienda la realización de vaciamiento cervical sistemático.2 Aunque existe consenso para la aplicación de radioterapia postoperatoria,13 numerosas publicaciones afirman que la misma no incrementa los índices de supervivencia de los pacientes con MMSPN.5 Una reciente publicación al respecto de Temam y cols.14 sugiere el incremento de control local de la enfermedad tras la aplicación de radioterapia postoperatoria. No se ha demostrado la eficacia del empleo de quimioterapia en pacientes con MMSPN, ni en combinación con tratamiento quirúrgico o radioterápico ni de manera aislada, estando su uso limitado a estadios avanzados con invasión tumoral sistémica.13 Pese a que se ha propuesto el empleo de inmunoterapia para el tratamiento de determinados melanomas cutáneos,15 son necesarios ensayos randomizados que demuestren la efectividad de este tipo de terapia en pacientes con MMSPN.3
La recidiva local es el principal factor asociado al fracaso terapéutico. La aparición de recidiva, se asocia principalmente con la exéresis incompleta del tumor secundaria a las relaciones anatómicas complejas y anfractuosas de la región paranasal, a la presencia de tumores multifocales, a la eventual proliferación tumoral submucosa y a siembras tumorales durante la cirugía.5
En líneas generales el pronóstico de los MMSPN es pobre y se asocia principalmente al tamaño tumoral, al retraso en el diagnóstico secundario a la naturaleza inespecífica de la sintomatología y a la inaccesibilidad técnica para la exéresis completa del tumor.5 El índice de supervivencia a los cinco años de los pacientes con MMSPN oscila entre un 20 y un 40%.2,5
Conclusiones
Los MMSPN son tumores extremadamente agresivos, con un índice de supervivencia que no supera el 40%. Su tratamiento de elección es la exéresis quirúrgica tumoral, siendo la resección completa del tumor con márgenes quirúrgicos libres, el único medio demostrado para conseguir un adecuado control de la enfermedad. Aunque no hay evidencias en cuanto a la mejora en los índices de supervivencia, la mayoría de autores propugnan la administración de radioterapia postoperatoria.
Bibliografía
1. Hoyt DJ, Jordan T, Fisher SR. Mucosal melanoma of the head and neck. Arch Otolaryngol. Head Neck Surg 1989;78:5-20. [ Links ]
2. Bridger AG, Smee D, Baldwin MA, Kwok B, Bridger GP. Experience with mucosal melanoma of the nose and paranasal sinuses. ANZ J Surg 2005;75:192-7. [ Links ]
3. Martin JM, Porceddu S, Weih L, Peters LJ. Outcomes in sinonasal mucosal melanoma. ANZ J Surg 2004;74:838-42. [ Links ]
4. Regauer S, Anderhuber W, Richtig E, Schachenreiter J, Ott A, Beham A. Primary mucosal melanomas of the nasal cavity and paranasal sinuses. APMIS 1998; 106:403-10. [ Links ]
5. Thompson LD, Wieneke JA, Miettinen MM. Sinonasal tract and nasopharyngeal melanomas. A clinicopathologic study of 115 cases with a proposed staging system. Am J Surg Pathol 2003;27:594-611. [ Links ]
6. Kingdom TT, Kaplan MJ. Mucosal melanoma of the nasal cavity and paranasal sinuses. Head Neck 1995;17:184-9. [ Links ]
7. Rinaldo A, Shaha AR, Patel SG, Ferlito A. Primary mucosal melanoma of the nasal cavity and paranasal sinuses. Arch Otolaryngol 2001;121:979-82. [ Links ]
8. Mills SE, Gaffey MJ, Frierson HF, Rosai J (ed.) Sobin LH (assoc. ed.). Atlas of tumor Pathology, 3rd series, fascicle 26. Washington DC: Armed forces Institute of Pathology 2000:127-141. [ Links ]
9. Prasad ML, Patel SG, Busam KJ. Primary mucosal desmoplastic melanoma of the head and neck. Head Neck 2004;26(4):373-7. [ Links ]
10. Medina JE, Ferlito A, Pellitteri PK, Shaha AR, Khafif A, Devaney KO, y cols. Current management of mucosal melanoma of the head and neck. J Surg Oncol 2003;83: 116-22. [ Links ]
11. Osguthorpe JD, Patel S. Cranifacial approaches to sinus malignancy. Otolaryngol Clin North Am 1995;28:1239-57. [ Links ]
12. Goffart Y, Jorissen M, Daele J, y cols. Minimally invasive endoscopic management of malignant sinonasal tumours. Acta Otorhinolaryngol Belg 2000;54:221-32. [ Links ]
13. Day TA, Beas RA, Schlosser RJ, Woodworth BA, Barredo J, Sharma AK, Gillespie MB. Management of paranasal sinus malignancy. Curr Treat Opt Oncol 2005;6:3-18. [ Links ]
14. Temam S, Mamelle G, Marandas P, Wibault P, Avril M-F, Janot F, y cols. Postoperative radiotherapy for primary mucosal melanoma of the head and neck. Cancer 2005;13:313-9. [ Links ]
15. Kirwood JM, Strawderman MH, Ersntoff MS, Smith TJ, Borden EC, Blum RH. Interferon alfa-2b adjuvant therapy of high risk resected cutaneous melanoma. The Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 1996;14:7-17. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Luis Miguel Capitán Cañadas
Servicio de Cirugía Oral y Maxilofacial
Hospital Universitario Virgen de las Nieves CRT.
Carretera de Jaén s/n Granada, España
E-mail: luismxf@hotmail.com











 texto en
texto en