Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.33 no.4 Madrid oct./dic. 2011
https://dx.doi.org/10.4321/S1130-05582011000400003
Diagnóstico diferencial inmunomorfológico de las lesiones quísticas maxilares con queratinización
Immunomorphological differential diagnosis of maxillary cystic lesions with keratinization
Beatriz Vera-Sireraa, Julia Guarínb, Cecilia López-Valdiviab, Enrique Jiménezb, Ma Carmen Baquero Ruíz de la Hermosac y Francisco Vera-Sempereb,d
aDepartamento de Estomatología, Universidad de Valencia, Valencia, España
bServicio de Anatomía Patológica, Hospital Universitario La Fe, Valencia, España
cServicio de Cirugía Maxilofacial, Hospital Universitario La Fe, Valencia, España
dDepartamento de Patología, Universidad de Valencia, España
Dirección para correspondencia
RESUMEN
Objetivos: Los quistes maxilares con queratinización son formas lesionales de carácter controvertido y de relevancia clínica, dada la implicación clínico-evolutiva del llamado tumor odontogénico queratoquístico (TOQ). En el presente estudio nos planteamos valorar la utilidad de las técnicas inmunohistoquímicas en la identificación de estas lesiones.
Material y métodos: Se analizan de forma retrospectiva las lesiones quísticas maxilares dotadas de fenómenos de queratinización interna, diagnosticadas en un mismo centro hospitalario, a lo largo de un periodo de 4 años, realizando un estudio inmunohistoquímico mediante la aplicación de un panel de cinco anticuerpos (Ki67, Bcl-2, p53, CK19, D2-40).
Resultados: De un total de 410 lesiones quísticas maxilares, se seleccionaron 22 casos (5,36%) en los que existían rasgos morfológicos de queratinización interna. Aplicando los criterios morfológicos de la clasificación histológica de la OMS (2005) se diagnosticaron 15 TOQ y 4 quistes odontogénicos ortoqueratósicos (QOO), existiendo 3 observaciones con rasgos morfológicos híbridos de TOQ y de QOO. El estudio inmunohistoquímico llevado a cabo permitió realizar un certero diagnóstico diferencial entre el TOQ y el QOO, y además su empleo posibilitó adscribir de forma correcta las formas híbridas a cada uno de estos dos tipos lesionales.
Conclusiones: El análisis inmunohistoquímico, con la aplicación de un panel de cinco anticuerpos, permite un diagnóstico certero de las lesiones quisticas maxilares con queratinización, permitiendo la diferenciación del TOQ frente al QOO, así como la correcta identificación de las lesiones de carácter morfológico híbrido.
Palabras clave: Quistes maxilares. Tumor odontogénico queratoquístico. Quiste odontogénico ortoqueratósico. Inmunohistoquímia. Diagnóstico diferencial.
ABSTRACT
Objectives: Maxillary cystic lesions with keratinization are controversial lesions that are clinically relevant due to the prognostic implication of the so-called keratocystic odontogenic tumor (KOT). The aim of this study was to assess the usefulness of immunohistochemistry in the identification of KOTs.
Material and methods: Retrospective study of all maxillary cystic lesions exhibiting keratinization diagnosed over a 4-year period in one hospital center. Immunohistochemical study using a panel of five antibodies (Ki67, Bcl-2, p53, CK19, D2-40) was performed.
Results: Of a total of 410 maxillary cystic lesions, 22 cases (5.36%) showing morphological features of internal keratinization were selected. Using WHO-2005 histological criteria, 15 KOTs and 4 orthokeratotic odontogenic cysts (OOC) were diagnosed, as well as 3 cases with hybrid morphological characteristics. Immunohistochemical results accurately differentiated between KOT and OOC and allowed the hybrid forms to be correctly identified.
Conclusions: Immunohistochemical analysis with a panel of five antibodies allows an accurate diagnosis of maxillary cystic lesions with keratinization, enabling the differentiation between KOT and OOC and the correct identification of cases of hybrid morphological characteristics.
Key words: Maxillary cysts. Keratocystic odontogenic tumor. Orthokeratotic odontogenic cyst. Immunohistochemistry. Differential diagnosis.
Introducción
Dentro de los quistes maxilares las lesiones con rasgos de queratinización son sin duda las formas de carácter más controvertido. La primera de ellas es el llamado queratoquiste odontogénico (QO) descrito por Philipsen1 y que la OMS, en su clasificación histológica de los tumores de cabeza y cuello2, ha propuesto se denominara tumor odontogénico queratoquístico (TOQ), significando que se trata realmente de una lesión tumoral, que frecuentemente cursa con destrucción ósea y con una alta tasa de recurrencias2. El TOQ se establece sobre todo en pacientes varones entre la 2.a y la 4.a década de la vida, afectando más a la porción posterior mandibular3, con una elevada tasa de recurrencias, comparada con otras lesiones quísticas odontogénicas 4,5.
El TOQ, sin embargo, no comprende la totalidad de lesiones quísticas maxilares con queratinización interna. La segunda entidad por orden de frecuencia es el llamado quiste odontogénico ortoqueratósico (QOO), a menudo confundido con el TOQ, siendo descrito por Wright6, quien lo consideró una variante del TOQ, dotada de ortoqueratinización, señalando una menor agresividad clínica.
Hoy sabemos que el QOO representa de un 5 a un 16% de las lesiones calificadas como QO7. De este modo, bajo la denominación de queratoquistes se han incluido entidades diversas, de diferente significado y evolución, hecho que sin duda ha llevado a un cierto descrédito del termino queratoquístico, que en principio es siempre un diagnóstico anatomopatológico indicativo de agresividad lesional y de opcional recidiva 8,9.
En la última década ha surgido un renovado interés acerca de los TOQ, al conocer su implicación en el síndrome névico-basocelular (SNB) o síndrome de Gorlin-Goltz10. Este síndrome hereditario autosómico dominante se caracteriza por anomalías esqueléticas asociadas a una predisposición carcinogenética, con aparición de diversas neoplasias (carcinomas basocelulares, meduloblastomas, fibromas ováricos, etc.). Los TOQ están presentes en el 75-90% de los SNB, siendo a menudo la aparición de TOQ (generalmente con carácter múltiple) el primer signo de sospecha de la existencia de un síndrome de Gorlin-Goltz 11. Los TOQ, únicos o múltiples, pueden tener por lo tanto un carácter esporádico o ser TOQ sindrómicos en el contexto de un síndrome de Gorlin-Goltz. La patología de los quistes maxilares con queratinización precisa por lo tanto de un diagnóstico preciso, que informe de su posible agresividad y de la posible identificación de las formas esporádicas y sindrómicas.
En el presente estudio nos planteamos estudiar morfológicamente y de forma retrospectiva una casuística de lesiones quísticas maxilares con queratinización, analizando el valor del análisis inmunohistoquímico en su caracterización y diagnóstico diferencial.
Material y métodos
Se ha llevado un análisis retrospectivo de las lesiones quísticas maxilares diagnosticadas en un mismo centro hospitalario (Hospital Universitario La Fe, Valencia) durante un periodo de 4 años (2006-2010), procedentes todas ellas de una misma área sanitaria (departamento sanitario 7), utilizando la aplicación informática PAT-Win® v.3.4.1 del Servicio de Anatomía Patológica. Se seleccionaron todas las observaciones en las que en aparecieran datos, bien el diagnóstico anatomopatológico o en la descripción microscópica, que orientaran a la presencia de fenómenos de queratinización en el interior del quiste.
En todos los casos seleccionados se dispuso de los datos clínicos de los pacientes y del seguimiento llevado a cabo (entre 3 y 20 años), obteniendo estos datos a través de la aplicación informática MIZAR 2.0. En cada caso se constató la edad y sexo de los pacientes, localización lesional, tipo de cirugía, lesiones adicionales detectadas en el seguimiento y presencia de patologías asociadas, constatándose si los pacientes reunían los criterios establecidos por Kimonis et al.12 para el diagnóstico de síndrome de Gorlin-Goltz.
En cada una de las observaciones se dispuso de las preparaciones histológicas así como los bloques de parafina de cada estudio biópsico. Todos los casos fueron reclasificados microscópicamente, aplicando los criterios establecidos en la clasificación de la OMS2, constatando la presencia de quistes hijos así como de cambios inflamatorios asociados (agudos / crónicos), calificando su intensidad de forma semicuantitativa de 1+ a 3+.
Posteriormente se seleccionó un bloque de parafina representativo de la lesión, sobre el que se realizaron las siguientes técnicas inmunohistoquímicas: CK-19, bcl-2, p53, Ki67 y podoplanina (D2-40). En la Tabla 1 se muestran las caractrísticas de los anticuerpos empleados, tipo de anticuerpo, clon y dilución empleada.
Todas las técnicas fueron realizadas empleando el sistema de detección y visualización Envision-PlusTM de Dako®. La recuperación antigénica se realizó mediante tratamiento térmico con el uso del EnVision Flex Target Retrieval solution, High pH (n.o cat. K8000/K8004) (Dako®). En todas las técnicas inmunohistoquímicas se introdujeron controles positivos y negativos. Como controles positivos se emplearon los siguientes especímenes: carcinoma ductal de mama como control de CK19 y secciones histológicas de piel como control para p53, Bcl-2, Ki67, D2-40 - podoplanina. Como control negativo se realizó la técnica sustituyendo el anticuerpo primario por tampón salino fosfato. Los resultados inmunomorfológicos obtenidos fueron valorados por dos observadores en un microscopio de doble observación Nikon Eclipse-50i, valorando la localización de la tinción (nuclear o citoplasmática), la intensidad de la inmunotinción (calificada de + a +++), así como el porcentaje de células marcadas, obteniéndose microfotografías mediante un fotomicroscopio Olimpus Vanox AHBT-3 con cámara digital DS-5Mc y unidad de control DS-L2 (Nikon).
Resultados
Datos clinicopatológicos
Se recopilaron 410 lesiones quísticas maxilares, diagnosticadas en un periodo de 4 años, procedentes todas ellas de una misma área sanitaria, y de ellas se seleccionaron 22 casos (5,36%) en cuyos diagnósticos anatomopatológicos se señalaban rasgos de queratinización, con diagnósticos tales como queratoquiste, quiste odontogénico queratoquístico, quiste odontogénico con queratinización, quiste maxilar paraqueratósico, etc. En la Tabla 2 aparecen los datos de estas 22 observaciones motivo del estudio. Se trataba de 10 varones y 12 mujeres, de edades entre 18 y 85 años, con una edad media de 50,72 años. La lesión quística afectó en 18 observaciones (81,80% de los casos) al hueso mandibular, y en 3 observaciones al maxilar superior, encontrando un único paciente con coexistencia de lesiones maxilares y mandibulares.
En 14 pacientes (63,6%) la lesión quística era única, mientras que en 8 pacientes (36,3%) existían antecedentes de lesiones quísticas o bien se detectaron nuevas lesiones quísticas en el seguimiento clínico. En estos ocho pacientes con lesiones quísticas múltiples, el número de lesiones osciló entre 2 y 5 lesiones quisticas, existiendo dos pacientes con 4 y 5 lesiones, respectivamente. La edad media de los pacientes con lesiones quísticas solitarias fue de 49,35 años y la de los pacientes con lesiones múltiples de 53,25 años, si bien los pacientes con quistes múltiples mostraron a menudo lesiones iniciales a edades muy tempranas, así una paciente en la que se constataron cinco episodios quirúrgicos, por lesiones quísticas de carácter osteolítico, presentó la primera manifestación lesional a los 14 años de edad.
Analizando la patología asociada se comprobó que dos pacientes (observaciones n.o 5 y 9) reunían criterios de síndrome de Gorlin-Goltz. El primer paciente era una mujer de 18 años que a los 14 años de edad presentó una primera lesión quístíca maxilar diagnosticada de queratoquiste; la lesión recidivó posteriormente apareciendo hasta cinco nuevas lesiones afectando a mandíbula y maxilar en un periodo de 5-6 años y como lesiones asociadas presentaba un escoliosis dorsolumbar, con deformidad de Sprengel (elevación escapular) izquierda y una calcificación del falx. El segundo correspondía a una mujer con síndrome de Down, que a los 38 años de edad se le diagnosticó de queratoquiste mandibular y que en un periodo de 7 años presentó tres nuevas lesiones quísticas mandibulares asociadas a tres carcinomas basocelulares, en el torso y espalda, siendo el primero de ellos diagnosticado a los 19 años.
Estudio morfológico e inmunohistoquímico
El estudio morfológico de las 22 observaciones, aplicando los criterios de la OMS, permitió clasificarlas (Tabla 3) en 15 (68,18%) TOQ y 4 (18,18%) QOO (Figura 1-A y B). Tres lesiones quísticas (13,63%) mostraron rasgos histológicos híbridos, con queratinización orto y paraqueratósica, de forma que no pudo adscribirse estas tres lesiones a un TOQ ni a un QOO, dada la presencia de una heterogeneidad lesional.
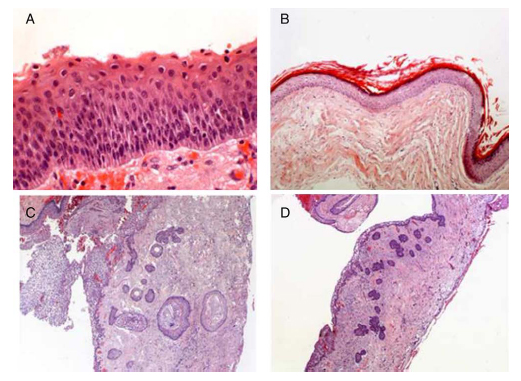
Figura 1. Detalle de revestimiento del TOQ mostrando una interfase epitelio/estromal plana,
células basales hipercromáticas y paraqueratosis (A) en comparación con el revestimiento
del QOO (B) que muestra laminas de queratinización ortoqueratósica. En C) se aprecia visión
panorámica del TOQ con quistes hijos satélites en la pared quística, así como la existencia de
yemas epiteliales proliferantes en la pared (D) (HE, 400, 250, 25 y 100x).
En todos los TOQ (15 observaciones) se observó una interfase epitelio/ estromal plana, con capa de células basales y parabasales de carácter columnar, con hipercromatismo nuclear e imágenes mitóticas, apreciando en superficie un contorno sinuoso con paraqueratinización (Figura 1-A). La presencia de material laminar queratínico paraqueratósico en el interior de los TOQ fue relativamente escasa y curiosamente la cantidad de láminas de queratina fue mayor en el caso de los QOO (Figura 1-B). De otra parte, en 4 casos calificados como 3 TOQ y una lesión híbrida se comprobó la existencia de numerosos quistes hijos, con yemas proliferativas basales (Figura 1-C y D). Dos de estas observaciones (observaciones 5 y 9) reunían criterios clínicos de síndrome névico basocelular (SNB).
En las tres observaciones con caracteres híbridos de TOQ y de QOO, se comprobó un patrón arquitectural propio de TOQ (interfase epitelio/estromal plana, hipercromatismo basal, frecuentes mitosis), pero se constataron zonas con ortoqueratinización junto a zonas de paraqueratosis, faltando a menudo el contorno ondulado del borde apical superficial, propio de los TOQ, no siendo posible adscribir la lesión a ninguna de las dos entidades. En 8 de las 22 (36,36%) observaciones se apreciaron cambios inflamatorios crónicos asociados con infiltrados inflamatorios (++/+++) de carácter mononuclear en la pared de los quistes (Tabla 3). Estos cambios inflamatorios fueron más prevalentes en los casos calificados como TOQ que en QOO.
Tras realizar el estudio inmunohistoquímico, constatamos que el perfil inmunohistoquímico de los casos calificados como TOQ era constante y claramente diferenciado del perfil de expresión proteica del QOO (Figura 2). Al analizar las tres observaciones (n.o 1, 5 y 18) consideradas como casos de morfología híbrida, estas tres observaciones fueron reclasificadas en 2 TOQ y un QOO, de forma que finalmente la distribución de casos de las 22 observaciones fue la siguiente: 17 casos (77,27%) correspondientes a TOQ y 5 casos (22,72%) correspondientes a QOO (Tabla 3). Señalar que la observación n.o 5 finalmente calificada de TOQ se comprobó además que reunía criterios de SNB.

Figura 2. Análisis comparativo inmunomorfológico del quiste
odontogénico ortoqueratósico (QOO) y del tumor odontogénico
queratoquístico (TOQ) referido a los cinco marcadores estudiados
(p53, Bcl-2, D2-40, CK19 y Ki67), permitiendo un claro diagnóstico
diferencial entre ambas lesiones (400x).
En relación a los marcadores empleados, se comprobó en los TOQ una constante expresión de Bcl-2, marcando estratos basales/suprabasales e incluso algunas capas intermedias; en los TOQ con presencia de «quistes hijos» también se apreció una marcada expresión de Bcl-2. Por el contrario, en los QOO la expresión de Bcl-2 fue limitada a algunas células basales, con un carácter discontinuo (Figura 2). Algo similar ocurría con p53, en los TOQ se apreció marcaje nuclear en células basales y parabasales, de forma que de un 20 a un 40% del espesor epitelial mostraba marcas por p53. Por el contrario, en los QOO tan solo estaban marcadas por p53 algunas células basales y a menudo con un patrón discontinuo (Figura 2).
La CK19 mostró intensa reactividad en las capas intermedias y superficiales de los TOQ, existiendo algunas observaciones con marcaje casi completo de todo el espesor epitelial. La expresión de la CK19 en los QOO fue, sin embargo, muy reducida, observándose solo expresión a nivel del citoplasma de las células básales del QOO (Figura 2). En los tres casos de morfología híbrida, la CK19 mostró igualmente un carácter híbrido con zonas marcando solo el espesor de las capas basales y zonas con inmunotinción completa de todo el epitelio. La CK19, por lo tanto, en estos casos de morfología híbrida no permitió adscribir a estos quistes híbridos a las formas de TOQ o QOO.
D2-40 mostró un perfil completamente distinto en los TOQ y en los QOO. En los QOO el marcaje era muy escaso y débil, limitado siempre al nivel basal, con marcaje exclusivo de membrana. En los TOQ, sin embargo, la expresión de D2-40 es muy intensa afectando a menudo a las capas parabasales, con una expresión que a veces afectaba al 50% del espesor epitelial (Figura 2). Los TOQ con «quistes hijos» mostraron una marcada reactividad de D2-40 en los quistes satélites, a menudo incluso más intensa que en lesión quística principal. D2-40 fue de gran utilidad en los casos con rasgos híbridos, identificando cuál era el componente lesional que predominaba en estos casos de morfología híbrida.
En relación a Ki67, señalar que la actividad proliferativa de los TOQ fue mucho más marcada que la del TOQ. Así en los QOO el porcentaje de células con marca nuclear se establecía en un rango entre el 2 y el 10% (valor medio: 4% de células marcadas) con marcas exclusivamente en el estrato basal. En los TOQ, sin embargo, la actividad proliferativa fue más acusada comprobándose reactividad nuclear entre el 10 y el 40% (valor medio: 29%) del total de células epiteliales, con actividad proliferativa en la capas basales y parabasales y en ocasiones también en los estratos intermedios (Figura 2). Los cuatro TOQ con presencia de quistes hijos mostraban índices de proliferación elevados, cercanos al 40% de la población celular.
Discusión
En el presente estudio se ha llevado a cabo un análisis inmunohistoquímico de 22 lesiones quísticas maxilares con queratinización. Dentro de ellas y tras realizar un estudio morfológico e inmunohistoquímico se calificaron 17 casos (77,27%) como tumores odontogénicos queratoquísticos (TOQ) o antiguos queratoquistes y 5 casos (22,72%) como quistes odontogénicos ortoqueratósicos (QOO).
En nuestro estudio empleamos un panel de cinco anticuerpos mononoclonales. Dentro de los anticuerpos empleados, se utilizó la citoqueratina CK19, una queratina de bajo peso molecular, expresada en los epitelios simples y en células basales de los epitelios no queratinizados, expresándose en las células de la lámina dental, referidas como supuesto origen de los TOQ 13. Por su parte, Bcl-2 es el producto proteico de un protooncogen, localizado en el cromosoma 18q21, que es capaz de producir un stop en la muerte celular programada (apoptosis), produciendo aumento en la supervivencia celular14. Por otro lado, p53 es el producto del gen supresor p53, que se expresa en la fase G1 del ciclo, permitiendo la reparación del ADN, impidiendo la progresión a la fase S, o de forma alternativa induciendo apoptosis en el caso de no poderse producir la reparación 15, aumentando su expresión en el curso de las mutaciones de p53, dado que la proteína mutada es más estable que la forma salvaje.
El marcador Ki 67 utilizado está presente en todas las partes activas del ciclo celular -fases G1, S, G2 y M-, estando solo ausente en la fase G0. La expresión de Ki 67 se incrementa con la progresión del ciclo celular, alcanzando su mayor expresión en las fases G2 y M 16. Este marcador de proliferación se ha referido como muy útil en la diferenciación entre el TOQ y el QOO7. El anticuerpo D2-40 o anti-podoplanina es inmunorreactivo frente a una glicoproteína de membrana expresada en los podocitos y en los neumocitos tipo I, siendo un marcador específico endotelial linfático17, describiéndose su reactividad asimismo a nivel del germen dentario 18.
La aplicación de este panel de cinco anticuerpos permitió diferenciar con certeza todas los casos estudiados, diferenciando las formas lesionales TOQ y QOO. Esta distinción no es un aspecto banal dada la agresividad y el carácter neoplásico del TOQ, que está actual y plenamente establecido en base a estudios moleculares que demuestran la existencia de una pérdida de la heterozigosidad en esta lesión y que puede afectar a diversos genes supresores de tumores, que incluyen p16, p53 y PTCH 19.
Estudios previos20 señalan que la incidencia del TOQ representa entre un 4 a un 12% de todos los quistes odontogénicos maxilares, con una incidencia media del 10%13. En nuestra serie los TOQ representan tan solo el 4,14% de los quistes odontogénicos, situándose nuestras cifras en el extremo inferior del rango antes señalado en la literatura20, si bien es posible que el número de TOQ esté sobrestimado, sobre todo en series donde no se ha contemplado un análisis inmunohistoquímico, de forma que bajo el término «queratoquístico» es probable que se hayan incluido lesiones que realmente no corresponden a TOQ. En nuestra serie los 17 TOQ afectaron a 10 varones y a 8 mujeres, con un ligero predominio masculino, aunque menor al referido previamente 20.
La incidencia encontrada en nuestro estudio para los QOO fue de un 22,72% de todas las lesiones quísticas con queratinización, incidencia superior a la señalada por otros 7-9, si bien cabe señalar que morfológicamente solo 4 de nuestras observaciones se consideraron inicialmente QOO en el examen morfológico y tras realizar el estudio inmunohistoquímico se reconoció una observación adicional, lo que hace pensar que las incidencias referidas de QOO en la literatura probablemente se verían aumentadas tras llevar a cabo una tipificación inmunohistoquímica. De otra parte, en nuestras observaciones de QOO no comprobamos el claro predominio lesional en varones indicado en otros estudios 7-9.
La localización lesional en nuestra serie de TOQ mostró un claro predominio por la afectación mandibular, sobre todo en la porción posterior del cuerpo, rama ascendente y angulo mandibular, siendo esto concordante con lo referido de forma constante por otros autores 2,20.
La lesión quística en el TOQ tuvo un carácter múltiple en 6 de 18 pacientes, con aparición de recidivas o nuevas lesiones quísticas en el 33,3% de los pacientes tras el seguimiento clínico. El carácter lesional múltiple de nuestras observaciones es superior al referido por Aragaki et al.13 que indican solo un 5% de casos con lesiones quísticas recidivadas o múltiples, situándose sin embargo nuestros datos en el rango señalado por Grasmuck y Nelson20, quienes señalan que el 17 al 56% de los casos presentan fenómenos de recurrencia o carácter lesional múltiple, si bien estas cifras pueden verse influenciadas por el número de años del seguimiento clínico y la modalidad de tratamiento realizado. En cualquier caso es evidente que un diagnóstico de TOQ, seguido de una confirmación inmunohistoquímica, obliga a realizar un seguimiento clínico y radiológico prolongado dado que las recurrencias pueden ocurrir pasados muchos años 21. Con respecto al QOO, solo una de las observaciones presentó dos lesiones quísticas independientes en el tiempo, mostrando por lo tanto una mucha menor tasa de recurrencia, tal como se refiere en la literatura 6,13.
La diferente tasa de lesiones múltiples y el muy distinto comportamiento clínico de los TOQ y QOO hace que el diagnóstico diferencial de estas dos entidades sea un aspecto crucial en el manejo de esta patología. Es importante realizar siempre una adecuada valoración clínico-radiológica preoperatoria de esta patología quística y tal como se demuestra en nuestro estudio, la aplicación de un panel de cinco anticuerpos permite establecer un diagnóstico diferencial de certeza entre ambas entidades, al mismo tiempo que posibilita el interpretar la exacta filiación de los casos con rasgos híbridos, siendo finalmente los datos anatomopatológicos, con un adecuado soporte inmunohistoquímico, lo que permite un exacto diagnóstico lesional.
El análisis inmunohistoquímico en las lesiones quísticas maxilares ha sido motivo de estudio previo por distintos autores. Así, Tsuneki et al.22 recientemente han propuesto un panel de 6 anticuerpos que a juicio de estos autores permitirían el diagnóstico diferencial de las lesiones quísticas maxilares. En nuestro análisis los cinco marcadores empleados presentaron un carácter claramente diferenciador, siendo probablemente los más resolutivos la CK19 y el índice de proliferación detectado con Ki67. La CK19 se expresa de forma característica en el TOQ a nivel de los estratos intermedios y superficiales 13,23, permitiendo en las formas lesionales híbridas el reconocimiento de los dos componentes, orto y paraqueratósico de la lesión pero sin permitir la adscripción definitiva a una forma lesional. El inmunomarcaje con Ki67da una idea exacta de la capacidad proliferativa y de la potencial agresividad de estas lesiones. En nuestras observaciones de TOQ Ki 67 mostró índices proliferativos entre el 10 y el 40% a diferencia del QOO que presentó índices entre el 2 y el 10%. Nuestros resultados aparecen en concordancia con estudios previos 7,24, que resaltan la utilidad diagnóstica de evaluar la capacidad proliferativa de estas lesiones quísticas.
De otra parte del total de 22 observaciones estudiadas en nuestra serie, con un total de 17 TOQ, dos casos reunieron criterios mayores o menores 12 de síndrome névico basocelular (SNB). Ambas observaciones presentaron TOQ a edades muy tempranas, una de ellas a los 14 años de edad, seguidas de cinco y tres recidivas lesionales, respectivamente. Ambos datos están en concordancia con lo referido en la literatura, donde se señala que en el 75 al 90% de los SNB aparecen TOQ de forma muy temprana11.
Las dos observaciones de TOQ en el contexto de un SNB mostraron un alto índice de actividad proliferativa (Ki67) y en varios de las lesiones extirpadas existían quistes hijos, aspectos estos sin duda relacionados con la alta tasa de recurrencias descrita en la forma sindrómica del TOQ2 y que algunos autores plantean incluso pueda modular la actuación quirúrgica a realizar21. De otra parte y desde una perspectiva inmunomorfológica, D2-40 y Bcl-2 se expresan de forma intensa en las lesiones con quistes hijos, aspecto asimismo referidos en la literatura de forma reciente25, como expresión de la capacidad invasiva de la lesión y de su carácter verdaderamente neoplásico.
Conclusiones
A pesar de la distinta morfología del TOQ y el QOO, existen formas quisticas maxilares con queratinización, que presentan características morfológicas híbridas, no siendo posible en estos casos realizar una adscripción a un tipo lesional tan solo a través de un estudio morfológico. La aplicación del panel de cinco anticuerpos propuestos en el presente estudio (p53, Bcl-2, Ki-67, CK-19 y D2-40) permite realizar un certero diagnóstico diferencial entre TOQ y QOO, posibilitando además adscribir de forma correcta las formas híbridas a cada uno de estos tipos lesionales.
Las formas de TOQ síndrómico (en el contexto de un SNB) presentan un carácter clinicopatológico distintivo: precoz aparición, carácter lesional múltiple, frecuente presencia de quistes hijos, mostrando una elevada expresión de D2-40 y de Bcl-2, con un índice de proliferación Ki67 muy elevado. Por todo ello, es importante en esta patología quística maxilar el realizar una adecuada aproximación clínico-radiológica, seguida de un minucioso estudio anatomopatológico, que incluya un análisis inmunohistoquímico, de especial relevancia en los casos de morfología híbrida así como en las observaciones en las que se sospeche una presentación sindrómica.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Philipsen HP. Om keratocystedr (Kolesteratomer) and kaeberne. Tandlaegebladet. 1956; 60:963-71. [ Links ]
2. Barnes L., Eveson J.W., Reichart P.A., Sidransky D., editors. World Health Organization classification of tumours. Pathology and genetics of head and neck tumours. Lyon: IARC Press; 2005. 306-7. [ Links ]
3. Gomes CC, Diniz MG, Gomez RS. Review of the molecular patogénesis of the odontogenic keratocyst. Oral Oncol. 2009; 45:1011-4. [ Links ]
4. Li TJ, Browne RM, Matthews JB. Quantification of PCNA positive cells within odontogenic jaw cyst epithelium. J Oral Pathol Med. 1994; 23:184-9. [ Links ]
5. El Murtadi AE, Grehan D, Toner M, MacCartan BE. Proliferating cell nuclear antigen staining in syndrome and nonsyndrome odontogenic keratocysts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1996; 81:217-20. [ Links ]
6. Wright JM. The odontogenic keratocyst: orthokeratinized variant. Oral Surg Oral Med Oral Pathol. 1981; 51:609-18. [ Links ]
7. Dong Q, Pan S, Sun LS, Li TJ. Orthokeratinized odontogenic cyst. A clinicopathologic study of 61 cases. Arch Pathol Lab Med. 2010; 134:271-5. [ Links ]
8. Crowley TE, Kaugars GE, Gunsolley JC. Odontogenic keratocysts: a clinical and histologic comparison of the parakeratin and orthokeratin varians. J Oral Maxilofac Surg. 1992; 50:22-6. [ Links ]
9. Li TJ, Kitano M, Chen XM, Itoh T, Kawashima K, Sugihara K, et al. Orthokeratinized odontogenic cyst: a clinicopathological and immunocytochemical study of 15 cases. Histopathology. 1998; 32:242-51. [ Links ]
10. Gorlin RJ, Goltz RW. Multiple nevoid basal-cell epithelioma, jaw cysts and bifid rib. A syndrome. N Eng J Med. 1960; 262:908-12. [ Links ]
11. Sasaki R, Miyashita T, Matsumoto N, Fujii K, Saito K, Ando Y. Multiple keratocystic odontogenic tumors associated with nevoid basal cell carcinoma syndrome having distinc PTCH I mutations: a case report. Oral Surg Oral Med Oral Pathol Radiol Endod. 2010; 110:e41-6. [ Links ]
12. Kimonis VE, Goldstein AM, Pastakia B, Yang ML, Kase R, DiGiovanna JJ, et al. Clinical manifestation in 105 persons with nevoid basal cell carcinoma syndrome. Am J Med Genet. 1997; 69:299-308. [ Links ]
13. Aragaki T, Michi Y, Katsube K, Uzawa N, Okada N, Akashi T, et al. Comprehensive keratin profiling reveals different histopathogenesis of keratocystic odontogenic tumor and orthokeratinized odontogenic cyst. Hum Pathol. 2010; 41:1718-25. [ Links ]
14. Lu QL, Abel P, Foster CS, Lalani EN. Bcl-2: role in epithelial differentiation and oncogenesis. Hum Pathol. 1996; 27:102-10. [ Links ]
15. Levine AJ. P53, the cellular gatekeeper for growth and division. Cell. 1997; 88:323-31. [ Links ]
16. Brown DC, Gatter KC. Ki67 protein: the immaculate deception?. Histopathology. 2002; 40:2-11. [ Links ]
17. Breiteneder-Geleff S, Matsui K, Soleiman A, Meraner P, Poczewski H, Kalt R, et al. Podoplanin, novel 43-kd membrane protein of glomerular epithelial cells, is down-regulated in puromicin nephrosis. Am J Pathol. 1997; 151:1141-52. [ Links ]
18. Sawa Y, Iwasawa K, Isikawa H. Expression of podoplanin in the mouse germ and apical bud cells. Acta Histochem Cytochem. 2008; 41:121-6. [ Links ]
19. Henley J, Summerlin D-J, Tomich C, Zhang S, Cheng L. Molecular evidence supporting the neoplastic nature of odontogenic keratocyst: a laser capture microdissection study of 15 cases. Histopathology. 2005; 47:582-6. [ Links ]
20. Grasmuck EA, Nelson BL. Keratocystic odontogenic tumor. Head Neck Pathol. 2010; 4:94-6. [ Links ]
21. Mendes RA, Carvalho JFC, van der Waal I. Characterization and management of the keratocystic odontogenic tumor in relation to its histopathological and biological features. Oral Oncol. 2010; 46:219-25. [ Links ]
22. Tsuneki M, Yamazaki M, Cheng J, Maruyama S, Kobayashi T, Saku T. Combined immunohistochemistry for the differential diagnosis of cystic jaw lesions: its practical use in surgical pathology. Histopathology. 2010; 57:806-13. [ Links ]
23. Dos Santos JN, Oliveira GQV, Gurgel CAS, Souza RO, Sales CBS, Neto AAPV, et al. Altered expresión of cytokeratins in primary, recurrent and syndrome keratocystic odontogenic tumors. J Mol Histol. 2009; 40:269-75. [ Links ]
24. Gadbail AR, Chaudhary M, Patil S, Gawande M. Actual proliferating index and p53 protein expression as prognostic marker in odontogenic cysts. Oral Diseases. 2009; 15:490-8. [ Links ]
25. Okamoto E, Kikuchi K, Miyazaki Y, Gonzalez-Alva P, Oku Y, Tanaka A, et al. Significance of podoplanin expression in keratocystic odontogenic tumor. J Oral Pathol Med. 2010; 39:110-4. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
fco.jose.vera@uv.es
(F. Vera-Sempere)
Recibido 16 Marzo 2011
Aceptado 5 Agosto 2011














