Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.36 no.1 Madrid ene./mar. 2014
https://dx.doi.org/10.1016/j.maxilo.2012.04.002
CASO CLÍNICO
Displasia fibrosa craneofacial avanzada: a propósito de un caso
Advanced craniofacial fibrous dysplasia: case report
Natalia Ventura–Martínez, Raquel Guijarro–Martínez, Juan Diego Morales–Navarro, Ignacio Solís–García, Miguel Puche–Torres y Gonzalo Pérez–Herrezuelo Hermosa
Servicio de Cirugía Oral y Maxilofacial, Hospital Clínico Universitario de Valencia, Valencia, España
Dirección para correspondencia
RESUMEN
La displasia fibrosa (DF) es una enfermedad fibroósea benigna que consiste en el reemplazamiento de hueso normal con excesiva proliferación de tejido conectivo fibroso con estructuras óseas afuncionales. La forma de DF craneofacial es poco frecuente y no está bien definida. La afectación más frecuente en el área craneofacial se da en el cuerpo de la mandíbula y zona posterior del maxilar. Los autores describen el manejo completo y la rehabilitación funcional de un caso de displasia fibrosa de mandíbula avanzado y revisan las opciones terapéuticas de esta condición.
Palabras clave: Displasia fibrosa. Craneofacial. Mandíbula. Microcirugía. Cirugía reconstructiva.
ABSTRACT
Fibrous dysplasia (FD) is a benign fibro-osseous disease where normal bone is replaced by an excessive proliferation of fibrous connective tissue with irregular trabecular bone. Craniofacial involvement is uncommon and is not well defined. The most commonly involved bones in the craniofacial area are the mandible body and the posterior maxilla. The authors describe the complete management and functional rehabilitation of a case of advanced fibrous dysplasia of the mandible, and provide an updated review of the therapeutic options for this condition.
Key words: Fibrous dysplasia. Craniofacial. Mandible. Microsurgery. Reconstructive surgery.
Introducción
La displasia fibrosa (DF) es una enfermedad fibroósea benigna que consiste en el reemplazo de hueso normal por excesiva proliferación de tejido conectivo fibroso con estructuras óseas anormales. En 1891 la enfermedad fue descrita por Von Reklinhausen1, y fue definida como DF por Lichtenstein2 en 1938.
Histológicamente muestra trabéculas de hueso inmaduro en el seno de un estroma fibrocelular en el cual se pueden encontrar osteoclastos dispersos. Las trabéculas son delgadas y gráciles, no estando conectadas unas con otras y muestran una morfología curvilínea, con patrón de "letras chinas", "puzzle" o en "C&S"3.
La forma más frecuentemente observada es la monostótica (afectación de un solo hueso, sin alteración sistémica), que conlleva el 70-85% de los casos. Otra de las formas, menos frecuente, es la poliostótica, en la que se afectan 2 o más huesos, no contiguos, y se añade afectación endocrina (en los síndromes de McCune-Albright y de Jaffe-Lichtenstein). La DF craneofacial es una forma muy poco frecuente, que se identifica por lesiones confinadas a huesos contiguos del esqueleto craneofacial, sin afectación de huesos extracraneales y sin alteraciones endocrinas, por lo que no se puede incluir en el resto de formas y queda como una entidad aparte. Si bien es cierto que entre el 50 y el 100% de las formas poliostóticas tiene afectación craneofacial y hasta un 10% de las formas monostóticas la presentan. En el área craneofacial los huesos más frecuentemente afectos son el cuerpo de la mandíbula y la parte posterior del maxilar.
La etiología de la DF es, muy probablemente, una mutación en el gen Gsa (GNAS1) del cromosoma 20q11. Esta mutación puede ocurrir durante el desarrollo embrionario, o la vida posnatal. La mutación del gen Gsa produce un aumento de la adenilato ciclasa, que aumenta el AMPc intracelular. La alta concentración del AMPc intracelular genera un aumento en la proliferación y diferenciación inapropiada de las células mutadas, causando la formación de una matriz fibrosa inmadura y desorganizada, generando el tejido fibroso de la displasia4.
Tiene una ligera predilección femenina y se presenta en las primeras 3 décadas de la vida. Aunque algunos autores postulan que suele remitir en la adolescencia, hay casos en los que la enfermedad no remite o incluso progresa. En nuestro caso, la paciente comenzó con la clínica en la segunda década de la vida, y tuvo una progresión rápida durante 2 años. Postulamos que, de no haber sido intervenida, la lesión habría seguido creciendo.
Se produce transformación maligna a sarcoma en un porcentaje muy bajo de pacientes (0,4% en DF monostótica y hasta un 4% en McCune Albright). La región craneofacial es el lugar de malignización más frecuente, con 35,6% de conversión (vs. en el fémur que tiene una frecuencia del 24,7% o en la tibia con frecuencia del 12,8%)5. A pesar de la creencia de que factor de riesgo más importante para que ocurra es la radiación previa, no es estrictamente necesaria, como demostraron Schwartz y Alpert6 en 1964.
La clínica más frecuentemente observada es la derivada del agrandamiento gradual sin dolor del hueso implicado, en este caso, la asimetría facial, con su correspondiente deformidad estética.
Otros síntomas son resultado de la constricción de agujeros craneales o de la obliteración de cavidades óseas: anosmia, diplopia, proptosis, epífora, estrabismo, parálisis facial, tinnitus, obstrucción nasal, maloclusión e interferencia con la masticación y el habla.
A pesar de que el patrón anatomopatológico es característico, se debe realizar el diagnóstico diferencial con múltiples entidades. El fibroma osificante es una verdadera neoplasia consistente en una proliferación de un tejido fibroso celular, que aparece bien delimitada o raramente encapsulada, que incluye hueso neoformado o calcificaciones esféricas. El tumor solo se presenta en los maxilares y huesos craneofaciales y tiene su inicio en tercera y cuarta década de la vida. Histológicamente, el componente fibroso muestra fibroblastos que no presentan atipia, escasas células multinucleadas gigantes, y ocasionales macrófagos espumosos. Las trabéculas óseas son finas, curvilíneas y aparecen inconexas, no hallándose bordeadas por un ribete de osteoblastos. Las características histológicas son similares a las de la DF por lo que la distinción hay que hacerla en base a los criterios clínicos, radiológicos, hallazgos quirúrgicos y características.
El querubismo es una enfermedad benigna, autosómica dominante, que consiste en una lesión de células gigantes de la mandíbula/maxilar que se presenta en niños entre 2-5 años como una tumefacción bilateral indolora, con progresión hasta la pubertad, cuando regresa de manera espontánea.
Otras entidades que pueden confundirse clínicamente con la DF son el granuloma de células gigantes, el quiste óseo aneurismático, el cementoma gigante, el ameloblastoma o la displasia ósea, entre otros.
Por ello es necesario un diagnóstico, además de clínico, basado en la imagen radiográfica (ya casi no utilizada) y más frecuentemente de TC, donde se describen varias formas (Schumberger, 1946):
- Pagetoide: expansión ósea con islas dispersas de formación ósea en campo de baja atenuación
- Esclerótica: apariencia homogénea con patrón en "vidrio esmerilado"
- Cística: lesión bien definida de baja atenuación con borde esclerótico en patrón de "cáscara de huevo"
El objetivo de este trabajo es comunicar un caso extremo de afectación craneofacial y en base a él, realizar una revisión de la literatura científica acerca del manejo de formas avanzadas de DF.
Caso clínico
Una mujer de 24 años consultó por asimetría facial y crecimiento progresivo del mentón a lo largo de 2 años. Además de la repercusión estética, la paciente presentaba dificultad para la masticación e incluso deglución. Había sido evaluada en varios centros especializados, siendo desestimada para tratamiento, dadas las dimensiones y localización de la lesión.
A la exploración clínica extraoral, la paciente mostraba una gran tumoración mentoniana con graves repercusiones estéticas (Figura 1A). Esta tumoración protruía de forma muy llamativa a suelo de la boca anterior y asociaba movilidad de incisivos inferiores (Figura 1B), sin dolor a la palpación.

Figura 1. Exploración clínica inicial: 1A Extraoral; 1B Intraoral.
La ortopantomografía mostró una lesión geográfica, mal definida, en vidrio esmerilado en cuerpo mandibular desde 4,6 a 3,7 (Figura 2). La TC con reconstrucción 3D confirmó la presencia de una lesión de 6,5 x 4,5 x 4,5 cm que afectaba prácticamente todo el cuerpo mandibular, con crecimiento expansivo hacia suelo de la boca (Figura 3, Figura 4). Las muestras para biopsia fueron compatibles con displasia fibrosa. La evaluación sistémica mediante SPECT craneal, con rastreo óseo y gammagrafía ósea vascular, descartó afectación extracraneal.

Figura 2. Ortopantomografía inicial.
Las dimensiones de la lesión, la edad de la paciente y la naturaleza progresiva de la enfermedad, desestimaron la remodelación por improcedente y contraindicada, justificándose la adopción de una actitud radical. A partir del TC 3D se obtuvo un modelo estereolitográfico de la mandíbula mediante el cual planificar la resección y preformar la placa de reconstrucción. Se realizó una mandibulectomía de ángulo a ángulo, con incisión cervical baja por motivo estético. La reconstrucción se realizó mediante injerto microvascularizado de peroné, fijado sobre placa de reconstrucción preformada (Figura 5).

Figura 5. Imagen intraoperatoria.
La lesión se describió anatomopatológicamente como una tumoración nodular sólida, aparentemente bien delimitada, de 6,8 x 5,7 x 5,1 cm, que a la sección presentaba consistencia indurada, coloración blanquecina homogénea y destruía por completo el hueso maxilar que englobaba, no objetivándose macroscópicamente estructuras óseas, afirmando con ello el diagnóstico de DF.
Se colocaron implantes "Nobelactive Internal RP", y 6 meses después se realizó la segunda cirugía (Figura 6).
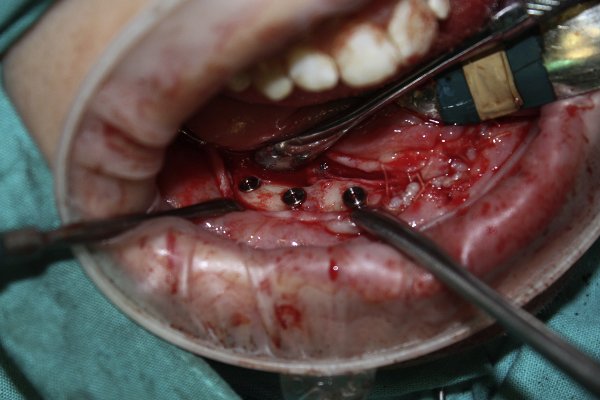
Figura 6. Colocación implantes.
Los controles radiológicos a los 12 meses de la inserción de los implantes mostraron una osteointegración adecuada (Figura 8).

Figura 7. Ortopantomografía. Inicio de inserción de implantes.

Figura 8. Prótesis implantosoportada.
Dos años después de la cirugía, la función masticatoria ha sido rehabilitada con prótesis implantosoportada (Figura 7). La paciente mantiene una apariencia estética muy satisfactoria, con recuperación completa de la función deglutoria y fonatoria (Figura 9).

Figura 9. Exploración clínica a los 2 años de la cirugía.
Discusión
Ante una lesión diagnosticada de DF por biopsia, será necesario un estudio analítico para descartar alteración endocrina y un TC full body/gammagrafía para descartar una extensión extracraneal. Hay autores que consideran que la medición de la fosfatasa alcalina sérica (FAS), junto con la edad del paciente, pueden ser un buen marcador para detectar la progresión de enfermedad en la cirugía incompleta de la DF craneofacial7.
El tratamiento de la DF está en continua revisión y no existen pautas de actuación bien establecidas. En nuestra opinión, el tratamiento de las lesiones del área craneofacial debe basarse en la clínica, excepto en lesiones de cono orbitario, que dado el alto riesgo de compresión del nervio orbitario la indicación está fuera de toda duda.
Es aceptable hacer observación cuando las lesiones son pequeñas, asintomáticas y cosméticamente aceptables.
Respecto al tratamiento médico, históricamente la radioterapia (RT) ha sido una de las opciones a considerar, pero actualmente ha sido abandonada por el riesgo de transformación maligna posterior (sarcoma post RT). La quimioterapia (QT) ha demostrado no ser efectiva5.
Actualmente se plantea la terapia con bisfosfonatos8 (como pamidronato o alendronato), con la coadyuvancia del calcio, la vitamina D y el fósforo; sin embargo, existen contradicciones respecto a esta opción terapéutica: por una parte, esta terapia estabiliza la enfermedad, disminuye el riesgo de fracturas óseas y mejora el dolor del paciente. Además, se ha observado un incremento de la actividad de los osteoclastos, muy disminuida en la DF y una mejoría radiológica; sin embargo y a pesar de estos resultados, autores como Plotkin et al.9 no han demostrado evidencia de mejoría radiológica en sus estudios, a pesar de obtener resultados estadísticamente significativos respecto a los niveles de los marcadores óseos del turnover.
Además, el tratamiento con bisfosfonatos no esta claramente indicado en pacientes sin dolor óseo ni con lesiones osteolíticas significativas.
Sin embargo, en estos artículos se concluye que la terapia intravenosa con pamidronato es segura, incluso en pacientes con tratamientos a largo plazo.
Los pacientes no respondedores a la terapia con bisfosfonatos, tampoco se ha demostrado buena respuesta al ácido zoledrónico (a pesar de ser una de las opciones para el tratamiento de primera línea).
A pesar de todos los esfuerzos, los bisfosfonatos no son la cura de la DF, porque no influyen en la mutación de las células osteoblásticas, aunque sí son una potencial alternativa no quirúrgica al tratamiento de la DF, porque inducen mejoría radiológica y bioquímica, además de actuar sobre el dolor óseo. Sin embargo, son necesarios estudios de doble ciego para establecer plenamente la eficacia del pamidronato en la DF
Así pues, la ambigüedad que rodea a las indicaciones y los criterios de valoración terapéuticos, junto con un riesgo bien definido para el desarrollo de osteonecrosis del maxilar, no hace recomendable hoy en día el tratamiento con bisfosfonatos, puesto que los beneficios no han demostrado superar los riesgos.
Alternativamente, la existencia de un incremento en la reabsorción ósea y en la remodelación, ha alentado el desarrollo de algunos ensayos clínicos con calcitonina, para inhibir la resorción osteoclástica.
En algunos estudios se observó una disminución de la excreción urinaria de hidroxiprolina y otros encontraron cambios en los niveles de fosfatasa alcalina sérica tras la administración de calcitonina en pacientes con DF. Sin embargo, otros estudios no encontraron cambios en los niveles de fosfatasa alcalina sérica y no se mencionan cambios en la clínica ni radiológicos8.
Algunos autores realizan remodelado quirúrgico (citorreducción o reducción del tejido lesionado). Sin embargo, en esta opción de tratamiento puede quedar enfermedad residual que siga creciendo y requiera nuevamente cirugía; además, a pesar de ser menos invasivo, el tejido remanente no es adecuado para colocación de implantes dentales5. En nuestro caso, las dimensiones y localización de la lesión hacían inviable esta opción terapéutica.
La escisión radical y reconstrucción (propuesta por primera vez en 1990 por Chen y Noorhoff10), es el tratamiento más utilizado en la actualidad. Sus indicaciones son: compresión del nervio óptico, deformidad cosmética, dolor, fractura patológica, disminución de la audición y obstrucción nasal o sinusal. El injerto libre de peroné fue la cirugía propuesta por Taylor et al. en 197511, y posteriormente introducido el método por Hidalgo en 198912, es, actualmente, la técnica de elección para reconstrucción microvascular de mandíbula, debido a su facilidad de recogida, a la longitud aceptable de hueso disponible, a la calidad del pedículo, a un excelente riego vascular perióstico que permite múltiples osteotomías y a la posibilidad del abordaje en 2 tiempos debido a la lejanía de la zona donante.
Conclusiones
La DF mandibular es una enfermedad poco frecuente. Se presenta de manera ligeramente más frecuente en mujeres. Suele remitir en la adolescencia aunque no siempre es así. El diagnóstico se realiza normalmente con la clínica (asimetría facial), apoyándose en la TC y la biopsia. La terapéutica actual consiste, en nuestra opinión, en la individualización del tratamiento en función de la edad, perspectivas de curación del paciente, evolución de la clínica, entre otros, considerándose de elección la cirugía radical y reconstrucción con injerto microvascular de peroné.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Financiación
Este trabajo no ha recibido ayuda económica de ningún tipo.
Bibliografía
1. Von Recklinghausen F. Die fibrose oder deformierende ostitis, die osteomalacie und die osteoplastische carcinose in ihren gegenseitigen beziehungen. Berlin: Festschr, Rudolf Virchow; 1891. [ Links ]
2. Lictenstein L. Polyostotic fibrous dysplasia. Arch Surg. 1938; 36:874. [ Links ]
3. Reed RJ. Observations of bone maturation and fibrous dysplasia of bone. Bull Tulane Med Fac. 1959; 19:45-53. [ Links ]
4. Perdigao PF, Pimenta FJ, Castro WH, De Marco L, Gomez RS. Investigation of the Gsa gen in the diagnostic of fibrous displasia. Int J Oral Maxillofac Surg. 2004; 33:498-501. [ Links ]
5. Kim D, Ghali GE, Wright JM. Surgical treatment of giant fibrous dysplasia of the mandible with concomitant craniofacial involvement. J Oral Maxillofac Surg. 2012; 70:102-18. [ Links ]
6. Schwartz DT, Alpert M. The malignant transformation of fibrous dysplasia. Am J Med Sci. 1964; 247:1. [ Links ]
7. Park BY, Cheon YW, Kim YO. Prognosis for craniofacial dysplasia after incomplete resection: age and serum alkaline phosphatise. Int J Oral Maxillofac Surg. 2010; 39:221-6. [ Links ]
8. Chapurlat RD. Medical therapy in adults with fibrous dysplasia of bone. J Bone Miner Res. 2007; 21:114-9. [ Links ]
9. Plotkin H, Rauch F, Zeitlin L. Effect of pamidronate treatment in children with polyostotic fibrous dysplasia of bone. J Clin Endocrinol Metab. 2003; 88:4569-75. [ Links ]
10. Chen YR, Noordhoff MS. Treatment of craniomaxillofacial fibrous dysplasia: how early and how extensive?. Plast Reconstr Surg. 1990; 86:835. [ Links ]
11. Taylor GI, Miller GDH, Ham FJ. The free vascularised bone graft: a clinical extension of microvascular techniques. Plast Resconstr Surg. 1975; 55:533. [ Links ]
12. Hidalgo D. Fibular free flap: a new method of mandible reconstruction. Plast Reconstr Surg. 1989; 84:71. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
natalia.ventura@gmail.com (N. Ventura-Martínez)
Recibido 15 Febrero 2012
Aceptado 9 Abril 2012
















