La PAAF realizada informaba de citología positiva para malignidad, carcinoma de parótida.
El paciente fue sometido a intervención quirúrgica, se realiza parotidectomía radical incluyendo tronco y ramas del VII par craneal, con hemimandibulectomía derecha y reconstrucción microquirúrgica con colgajo libre de peroné derecho, además se realiza exéresis de 4 ganglios uno laterocervical derecho en área III y 3 ganglios cervicales derechos (figs. 1A-D).
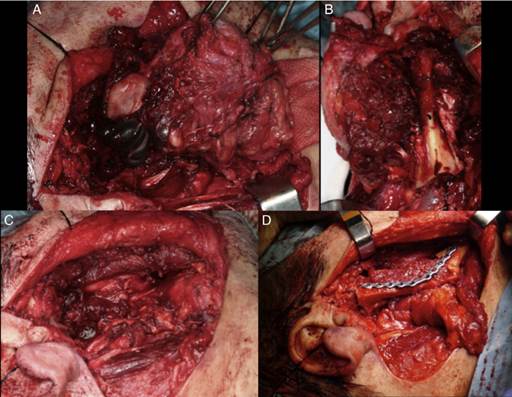
Figura 1 A) Parotidectomía radical incluyendo tronco y ramas del VII par craneal. B) Hemimandibulectomía derecha. C) Defecto quirúrgico posresección. D) Reconstrucción con colgajo microvascularizado de peroné.
El estudio anatomopatológico definitivo mostraba un carcinoma ductal infiltrante de glándula salival de 6 cm de diámetro, aproximadamente, con infiltración perineural, infiltración vascular e infiltración ósea. Margen superointerno muy próximo, ganglios linfáticos intraoperatorios libres de metástasis estadio IVA T4aN0Mx.
Se realiza estudio de amplificación del gen (FISH) HER-2: negativo.
Se presenta el caso en el comité de tumores de cabeza y cuello, donde se decide tratamiento coadyuvante con quimio y radioterapia concomitantes, 5 días semanales durante 6 semanas consecutivas; el paciente presentó buena tolerancia, sin necesidad de interrupción.
El paciente realizó controles periódicos, según protocolo con examen físico, pruebas de imagen (TAC y RMN) (fig. 2), sin signos de recidiva hasta agosto de 2014, cuando el paciente fallece a causa de un IAM.
Discusión
El carcinoma ductal de glándula salival (CDS) es un tumor poco frecuente, y es el tumor más agresivo que puede afectar a la glándula parótida, representa entre un 6-10% de los cánceres de parótida1,2, afecta a pacientes con una edad media de 60 años3,4, con predominio en varones1,3-5. La incidencia de este carcinoma en otras glándulas como la submaxilar, la sublingual y las glándulas salivares menores es mayor, aproximadamente el 50%2.
Histopatológicamente los tumores malignos de la glándula parótida están compuestos por un amplia variedad de subtipos morfológicos, con un comportamiento clínico variado; en general se dividen en cánceres de los conductos intercalados (adenoide cístico, células acinares, adenocarcinoma polimorfo de bajo grado y carcinoma mioepitelial) que son de bajo grado y biológicamente indolentes, comparados con los cánceres del conducto secretor (carcinoma ductal, mucoepidermoide y escamosos)2.
En un 20% de los casos, de los CDS, de parótida derivan de una lesión benigna, generalmente una transformación de un adenoma pleomorfo1,4,5. Es un tumor localmente agresivo, con mal pronóstico y con patrón de infiltración neural y linfático4-6, puede presentar metástasis a distancia, entre un 20-48% según algunos estudios5, pudiendo afectar el pulmón, hueso, hígado, cerebro y piel4. Este carcinoma, de alto grado, presenta una elevada mortalidad, cerca del 50% de los pacientes han muerto a los 4-5 años4,6 (tabla 1).
Tabla 1 CDS de parótida reportados en la literatura en inglés
| Autor | Edad/sexo | Estadio | Tratamiento | Seguimiento |
|---|---|---|---|---|
| Anderson et al. (1992) | 59/M | T2N0M0 | Parotidectomía + VC | No evidencia de enfermedad 3 años |
| Anderson et al. (1992) | 91/M | T2N0M0 | Parotidectomía parcial | Recurrencia la año después de parotidectomía total NOD 3 meses |
| Butterworth et al. (1992) | 59/V | T2N0M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 3 meses |
| Delgado et al. (1993) | 72/V | T2N1M0 | Parotidectomía + RT | No evidencia de enfermedad a los 5 años |
| Dee et al. (1993) | 74/V | T2N0M0 | Parotidectomía + RT | No evidencia de enfermedad a los 6 meses |
| Minamiguchi et al. (1996) | 60/V | T2N0M0 | Parotidectomía + VC + RT | Metástasis pulmonar al mes, muere de enfermedad a los 9 meses |
| Minamiguchi et al. (1996) | 66/V | T2N0M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 27 meses |
| Minamiguchi et al. (1996) | 57/M | T3N1M0 | Parotidectomía + VC + RT | Metástasis ósea a los 1,5 meses Metástasis pulmonar a los 7 meses |
| Kruslin et al. (1996) | 47/M | T3N1M1 | Parotidectomía + VC + RT | Metástasis a intestino delgado, muere de enfermedad a los 5 meses |
| Ikeda et al. (1997) | 65/V | T2N1M1 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 25 meses |
| Colecchia et al. (1997) | 63/V | T1N0M0 | Parotidectomía + VC | No evidencia de enfermedad a los 15 meses |
| Madrigal et al. (1999) | 78/V | T2N0M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 11 meses |
| Vinette-Leduc (1999) | 61/M | T2N1M1 | No tratado | Metástasis a útero, muere de enfermedad a los 10 meses |
| Milanesi et al. (1999) | 68/V | T1N0M0 | Parotidectomía + VC+ RT +QT | No evidencia de enfermedad a los 24 meses |
| Henley et al. (2000) | 56/V | T1N0M0 | Parotidectomía superficial + VC +RT | No evidencia de enfermedad a los 12 meses |
| Henley et al. (2000) | 68/V | T2N0M0 | Parotidectomía + VC | Muere de enfermedad a los 3 años |
| Henley et al. (2000) | 70/V | T1N0M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 7 meses |
| Laforga (2004) | 75/V | T2N1M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 5 años |
| Aygit et al. (2005) | 40/V | T3N0M0 | Parotidectomía + RT | Recurrencia a los 16 meses y metástasis a piel |
| Valery et al. (2005) | 56/V | T3N0M0 | Parotidectomía + VC | No disponible |
| Bhalla et al. (2006) | 53/V | T3N1M0 | Parotidectomía + VC + mastoidectomía + tarsorrafia + RT | Recurrencia a los 10 meses y metástasis a ganglios linfáticos inguinales |
| Alsharif et al. (2008) | 22/V | T1N0M0 | Parotidectomía + VC + RT+ reconstrucción del nervio facial | No evidencia de enfermedad a los 10 años |
| Rajni et al. (2016) | 35/M | T4N2M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 96 meses |
| Rajni et al. (2016) | 50/V | T4N2M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 6 meses |
| Rajni et al. (2016) | 40/M | T3N0M0 | Parotidectomía + VC + RT | No evidencia de enfermedad a los 7 meses |
| Caso actual | 62/V | T4N0M0 | Parotidectomía radical + RT + QT | No evidencia de enfermedad a los 24 meses que fallece por otra causa |
Delgado et al.7 han clasificado el CDS de parótida en 3 subtipos dependiendo de si el carcinoma es intraductal o infiltrativo: 1) predominantemente intraductal, donde el 90% del tumor es intraductal; 2) predominantemente infiltrativo, donde menos del 20% del tumor es intraductal; o 3) infiltrativo, donde el tumor es completamente infiltrativo.
El CDS de parótida es histológicamente muy similar a ciertos tipos de cánceres de mama. El uso de agentes anti-HER2 está actualmente aceptado como tratamiento en los cánceres de mama que sobreexpresan el gen8,9; diferentes estudios han estudiado la correlación entre HER2/neu y el comportamiento clínico con los carcinomas de las glándulas salivares, encontrándose una asociación de mal pronóstico y agresividad9. En la mayoría de los estudios esta sobrexpresión se ha reportado con mayor frecuencia en el CDS de parótida que en otros carcinomas de la glándula parótida, reportándose hasta un 83%, según algunos estudios8,9. La sobreexpresión del HER2/neu nos ha proporcionado datos esperanzadores en diferentes estudios donde se ha utilizado el trastuzumab, un anticuerpo monoclonal dirigido contra el HER2 combinado con quimioterapia, donde se ha mostrado no progresión de la enfermedad y en algunos casos remisión completa8,9. Simpson4 basado en la similaridad que comparte con el carcinoma ductal de mama y con la expresión de receptores de andrógenos, propone una clasificación molecular en 3 grupos: 1) receptores de andrógenos positivos; 2) HER2 positivo, y 3) fenotipo basal. De esta forma se orientaría a un pronóstico clínico y a nuevas posibilidades terapéuticas4.
Aunque la gran mayoría de CDS de parótida se parecen a carcinoma ductal de la mama de alto grado y es relativamente sencillo de reconocer, otros casos pueden ser más problemáticos4. El diagnóstico histopatológico diferencial se debe realizar con el carcinoma mucoepidermoide, oncocítico y mioepiteliales, además con metástasis de melanoma, carcinoma escamoso de mama y próstata, en casos de duda se deben realizar pruebas de inmunohistoquímica, ya que este tumor suele ser positivo para RA receptores de andrógenos (67-83%), GCDFP-15 un marcador de diferenciación apocrina en cáncer de mama (>80%) y negativo para la proteína S-100, además de buscar de la sobreexpresión del receptor HER2/neu3,4,10.
Dadas las características de agresividad, el tratamiento de elección es la parotidectomía radical con vaciamiento cervical ipsilateral4,11 más radioterapia postoperatoria4,5,10; esta última está indicada según las característica anatomopatológicas como los casos de extensión extraparotídea, márgenes quirúrgicos positivos, invasión linfática de ganglios cervicales o invasión perineural10. La quimioterapia se reserva para la presencia de metástasis3, y se debe de considerar como parte del tratamiento el uso de trastuzumab en los casos que sobreexpresen HER2/neu4,9.















