Introducción
El trasplante hepático es un procedimiento de gran complejidad. A pesar de los continuos e importantes avances en las técnicas quirúrgicas anestésicas y en los recursos farmacológicos, la morbimortalidad en el postoperatorio temprano (primer mes tras el trasplante) continúa siendo un problema importante. Las complicaciones médicas más frecuentes en el periodo postoperatorio precoz engloban las pulmonares, renales, cardiovasculares, neurológicas, infecciosas y hepáticas, relacionadas con el aloinjerto. Se podrían añadir, además, complicaciones relacionadas con fármacos como inmunosupresores, antibióticos, antivirales, antifúngicos. Reconocer, diagnosticar de forma precoz y tratar adecuadamente estas complicaciones es un aspecto fundamental que permite en ocasiones salvar la vida del paciente.
Presentamos el caso de un paciente en el postoperatorio inmediato de un trasplante hepático con numerosas complicaciones en relación a su farmacoterapia. Desarrolla una reacción adversa muy grave y rara a micafungina, una anemia hemolítica que representa el primer caso descrito en la población caucásica. Además, presenta neurotoxicidad con estatus convulsivo, presuntamente relacionado con tacrolimus, y complicaciones infecciosas. El farmacéutico, integrado en el equipo multidisciplinar con presencia diaria en la Unidad de Cuidados Intensivos (UCI), es clave en la optimización de la efectividad y seguridad del tratamiento.
Descripción del caso
Mujer de 61 años sin alergias medicamentosas conocidas. Entre los antecedentes destaca una cirrosis hepática descompensada secundaria a infección por el VHC genotipo 3, resistente al tratamiento con PEG-interferón + ribavirina.
Presenta una respuesta viral sostenida tras el tratamiento con sofosbuvir, daclatasvir y ribavirina.
Indicación de trasplante hepático: cirrosis por VHC descompensada y hepatocarcinoma. Situación clínica previa al trasplante: Child-Pugh B9, MELD score 16, MELD-Na 37, sin datos de encefalopatía ni varices esofágicas, función renal normal.
Enfermedad actual
Paciente que ingresa en UCI en el postoperatorio inmediato de trasplante hepático ortotópico. Recibe tratamiento inmunosupresor y profilaxis antibiótica según protocolo del centro (ver posologías en tabla), con buena función del injerto y evolución favorable.
El día 5 postrasplante presenta un episodio de hemorragia pulmonar aislado y de causa desconocida. Ante la sospecha de infección respiratoria, se amplía el espectro antibiótico, añadiendo, entre otros fármacos, micafungina, que tras una única dosis de 100 mg, es sustituida por caspofungina, sin ninguna razón que justifique el cambio, a preferencia del hepatólogo. Todas las muestras extraídas para cultivo resultan negativas, por lo que tras completar 10 días de tratamiento, y sin evidencia de infección activa, se decide suspender la antibioterapia.
El día 19 postrasplante, ante los signos sugestivos de infección y el empeoramiento radiológico, se reintroducen meropenem, linezolid y micafungina. Tras el comienzo de la infusión de micafungina, tiene lugar un cuadro de bradicardia e hipotensión extremas y exantema generalizado, deteniéndose su administración y administrándose corticoides y noradrenalina. Se registra una caída de hemoglobina y hematocrito, sin evidencia de foco de sangrado activo, hemoglobinuria, hemólisis y fallo renal, que requiere la introducción de técnicas continuas de reemplazo renal (TCRR).
El Servicio de Hematología realiza una prueba de antiglobulina indirecta (PAI) que resulta positiva, en la que el suero del paciente hemoliza la muestra solo en presencia de micafungina y no se produce hemólisis en presencia de caspofungina ni en los controles con suero de un donante sano, lo que confirma la hemólisis intravascular mediada por inmunocomplejos por micafungina.
Además, teniendo en cuenta la nefrotoxicidad de los anticalcineurínicos, se reduce la dosis de tacrolimus y se complementa la inmunosupresión con micofenolato mofetilo, basiliximab y corticoides. Ello permite una recuperación progresiva de la diuresis, pudiéndose retirar la TCRR.
Dado que la paciente se encuentra consciente, orientada, colaboradora, afebril y estable, se decide su traslado a la planta de hospitalización en el día 36 postrasplante (Figura 1).
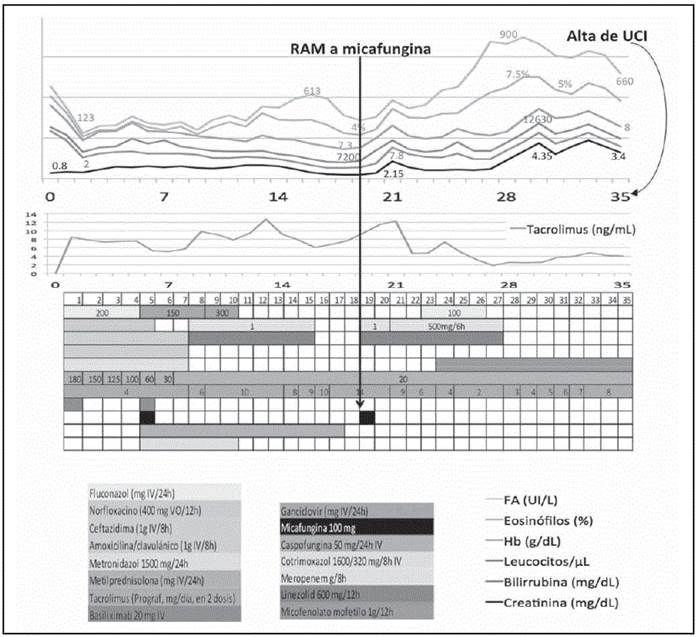
Figura 1 Evolución de parámetros analíticos, niveles de tacrolimus y dosis de antibióticos e inmunosupresores hasta el día 36 postrasplante (traslado de UCI a planta).
El día 42 postrasplante reingresa en la UCI tras presentar un estatus convulsivo focal, secundariamente generalizado, con disminución del nivel de conciencia. A su llegada, se administran diversos anticomiciales (clo nazepam, ácido valproico y midazolam), manteniéndose el estatus bioeléctrico en electroencefalograma (EEG), que requiere sedación con propofol e inicio de tiopental en perfusión continua. Para filiar el origen del cuadro se realiza una resonancia magnética nuclear (RMN) que muestra imágenes de hiperseñal a nivel del sistema límbico y cortical, cuyo diagnóstico diferencial es amplio, incluyendo neurotoxicidad por tacrolimus, que se mantiene como principal hipótesis diagnóstica. Se suspende el tratamiento, sustituyéndose inicialmente por ciclosporina, que ante la ausencia de mejoría de la clínica neurológica se cambia por everolimus. El farmacéutico informa al personal de enfermería de la administración de everolimus por songa nasogástrica (SNG). Tras 4 días en coma barbitúrico y desaparición del estatus, se suspende el tiopental y se introduce fenobarbital, recuperando progresivamente el nivel de conciencia. Se repite la RMN el día 58 postrasplante (16 días tras la aparición del estatus), que muestra una significativa reducción de las lesiones, contribuyendo a afianzar la sospecha de iatrogenia (Figura 2).

Figura 2 En las imágenes se puede observar una reducción de las lesiones (zonas blancas brillantes).
En este segundo ingreso en UCI presenta una infección urinaria por Enterobacter cloacae y traqueobronquitis purulenta por Proteus mirabilis tratadas con linezolid y piperacilina-tazobactam, respectivamente, según antibiograma. Además se aísla Eschericia coli productor de betalactamasas de espectro extendido en urocultivo, que se decide tratar inicialmente con carbapenem. Informamos de la interacción meropenem-valproico, por lo que se propone y acepta el cambio de antibiótico por cotrimoxazol según antibiograma, con buena evolución clínica.
En cuanto a la función del injerto, la paciente presenta datos compatibles con rechazo. Los niveles de everolimus se mantienen permanentemente por debajo del intervalo terapéutico (siempre inferiores a 1 µg/mL). El farmacéutico informa de la interacción everolimusfeno-barbital, por lo que se decide incrementar la dosis. Dada la buena evolución, en el día 67 postrasplante, se decide de nuevo el traslado a planta (Figura 3).

Figura 3 Evolución de parámetros analíticos, niveles de anticomiciales y dosis de antibióticos e inmunosupresores hasta el día 66 postrasplante.
En el día +80 postrasplante se detecta una nueva línea de prescripción de micafungina, además de meropenem (continuaba en este momento con valproico). Gracias a la pronta actuación farmacéutica no llegan a administrarse los fármacos y se sustituyen por piperacilina-tazobactam y fluconazol.
Discusión y aportación farmacéutica
Postoperatorio de trasplante hepático con evolución tórpida que presenta las siguientes complicaciones: extrahepáticas (anemia hemolítica intravascular por micafungina, probable leucoencefalopatía posterior reversible relacionada con tacrolimus e infecciones) y relacionadas con el injerto hepático (rechazo celular agudo).
El farmacéutico integrado en el equipo multidisciplinar aborda los siguientes problemas: interacciones, administración y optimización de la administración de inmunosupresores por sonda nasogástrica, detección y comunicación de reacciones adversas a medicamentos:
Anemia hemolítica intravascular por micafungina: la ficha técnica de Mycamine® recoge la anemia hemolítica como una reacción adversa rara (frecuencia ≥ 1/10.000 a < 1/1.000). En este caso el Servicio de Banco de Sangre alerta de la presencia de hemólisis, se realiza una búsqueda bibliográfica y, debido a la secuencia temporal, se relaciona con la administración de micafungina. Con el objetivo de filiar la causa de la hemólisis el banco de sangre realiza una PAI. Para ello se prepararon las muestras según los pocos datos publicados en la bibliografía. Inicialmente, la prueba no fue concluyente (aparición de hemólisis en la muestra del paciente y en los controles), ya que se realizó la PAI con una concentración de micafungina muy superior a la concentración terapéutica (50 mg/ml en lugar de 50 mcg/ml). Revisamos la farmacocinética de micafungina (concentraciones plasmáticas máximas del orden de 10 mcg/ml) y los artículos publicados y se detecta una errata en uno de los artículos. Se repitió la prueba con la concentración recomendada por el farmacéutico que, finalmente, resultó positiva para micafungina y negativa para caspofungina y los controles, confirmando una hemólisis intravascular mediada por inmunocomplejos.
Comunicamos la reacción adversa a través del formulario electrónico del Sistema Español de Farmacovigilancia de Medicamentos de uso Humano.
El farmacéutico interviene para que se proceda al registro de la alergia a micafungina en la historia clínica electrónica en el lugar reservado para ello, en la sección de “Alergias y reacciones adversas”.
Un mes después de la resolución del cuadro, en la planta de hospitalización se intensifica el tratamiento antifúngico y se pauta de nuevo micafungina. El farmacéutico interviene evitando la administración por parte de enfermería e informa al médico, que suspende el tratamiento.
2. Probable leucoencefalopatía posterior reversible relacionada con tacrolimus: las complicaciones neurológicas son una causa frecuente de morbimortalidad en los pacientes sometidos a trasplante hepático. El tacrolimus es un fármaco inmunosupresor que ha demostrado su eficacia en la prevención del rechazo agudo en el trasplante de órgano sólido; sin embargo, la neuro y nefrotoxicidad son sus principales efectos adversos. La leucoencefalopatía posterior reversible es una de las formas más graves de neurotoxicidad (alteración del estado mental, cefalea, déficits neurológicos focales, trastornos visuales y convulsiones), que puede ser reversible reduciendo la dosis o suspendiendo el tratamiento. Se comunica la reacción adversa a través del formulario electrónico del Sistema Español de Farmacovigilancia de Medicamentos de uso Humano.
Administración de micofenolato mofetilo: después de la aparición del estatus convulsivo, la paciente requiere intubación orotraqueal, por lo que se coloca una sonda nasogástrica. Inicialmente se pauta micofenolato mofetilo por SNG, pero por recomendación farmacéutica se cambia a la vía intravenosa para evitar problemas relacionados con la absorción. Las mezclas intravenosas de micofenolato mofetilo se preparan en el Servicio de Farmacia en cabina de flujo laminar vertical, por ser considerado un fármaco biopeligroso por el National Institute for Occupational Safety and Health (NIOSH) del Departamento de Salud de Estados Unidos.
Interacciones entre anticomiciales y antiinfecciosos: el paciente presenta una infección urinaria por E. coli productor de BLEE. En este caso, el tratamiento de elección es un carbapenem; se prescribe tratamiento con meropenem. El farmacéutico informa de la interacción meropenem-ácido valproico (día 55: la paciente con tratamiento anticomicial no lograba las tasas de supresión deseadas en el EEG). La interacción entre el carbapenem y el ácido valproico es conocida mediante estudios publicados, casos notificados y la información procedente de un estudio en voluntarios sanos (no publicado). Se ha comunicado una reducción del 60-100% en los niveles plasmáticos de valproato en un periodo de dos días, por lo que su efecto terapéutico puede verse reducido, considerándose una interacción clínicamente relevante.
Desde un punto de vista farmacocinético, la interacción es muy compleja y no se conoce con certeza su mecanismo, ya que parece que intervienen numerosos factores que disminuyen las concentraciones del antiepiléptico: disminución en la absorción del valproato, disminución de su reciclado enterohepático, cambio en su volumen de distribución disminuyendo la proporción de fármaco libre y aumento en su glucuronidación. Dada la magnitud de la reducción de los niveles plasmáticos y el tiempo reducido en el que parece producirse esta disminución, la monitorización de los niveles plasmáticos o los ajustes de dosis no se consideran de utilidad para manejar adecuadamente esta interacción.
Se propone como alternativa cotrimoxazol, que sin presentar interacciones farmacológicas supone una correcta cobertura antibiótica. Se acepta el cambio y se completan 10 días de tratamiento, con curación clínica y microbiológica de la infección.
Interacciones entre inmunosupresores y anticomiciales: everolimus se metaboliza principalmente en el hígado por el CYP3A4 y es un sustrato de la bomba de flujo multifármaco glicoproteína P. Por lo tanto, su absorción y eliminación puede estar influenciada por fármacos que afectan al CYP3A4 y/o glicoproteína P. El fenobarbital, que es un potente inductor enzimático, disminuye la exposición a everolimus por los dos mecanismos. Se advierte desde la instauración del tratamiento, pero debido a la limitación de uso de los anticalcineurínicos, se valora el balance beneficio-riesgo y se decide administrar ambos fármacos. La ficha técnica del everolimus recoge que la Cmax y el AUC se reducen en un 60% y un 16% cuando se administra con una comida rica en grasas. Para minimizar la variabilidad, la ficha técnica recomienda tomar Certican®, con o sin alimentos, pero siempre del mismo modo. El farmacéutico recomienda administrar everolimus separadamente de la nutrición enteral para optimizar la absorción y monitorizar estrechamente los resultados de laboratorio de los niveles sanguíneos del everolimus para evitar un repunte de sus valores en las reducciones de dosis del fenobarbital.
6. Administración de everolimus: everolimus solo está disponible en forma farmacéutica oral y, ya que el paciente está intubado y es portador de SNG, se administra la dosis en forma de comprimidos dispersables (solo disponibles en dosis de 0,25 mg y 0,1 mg). Se recuerda a enfermería la técnica más adecuada de dispersión de comprimidos (usando una jeringa) y se deja información por escrito recomendando medidas de protección personal, ya que el everolimus está considerado un fármaco biopeligroso por el NIOSH. Debido a la interacción con el fenobarbital, se incrementa la dosis de everolimus hasta 6 mg cada 12 horas, lo que supone la administración de 48 comprimidos dispersables diarios de Certican® 0,25 mg. El farmacéutico comprueba la correcta dispersión de un número tan alto de comprimidos y revisa diariamente la correcta administración por parte de enfermería que, al tener que administrar dosis tan elevadas, con frecuencia utilizaba la presentación de Certican® 1 mg, que no son comprimidos dispersables y no es la forma farmacéutica adecuada para administración por SNG. En conclusión, se ha informado acerca de las vías de administración e interacciones, se ha participado en la filiación de una reacción adversa muy grave y extremadamente infrecuente, se ha evitado una peligrosa segunda reexposición a ese fármaco y se ha colaborado diariamente con el equipo médico en la evaluación y búsqueda de alternativas terapéuticas seguras y efectivas, que con una alta probabilidad, han contribuido a la progresiva mejoría del paciente.














